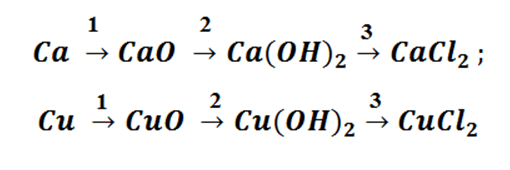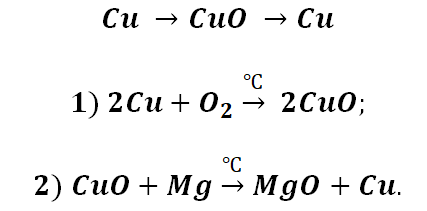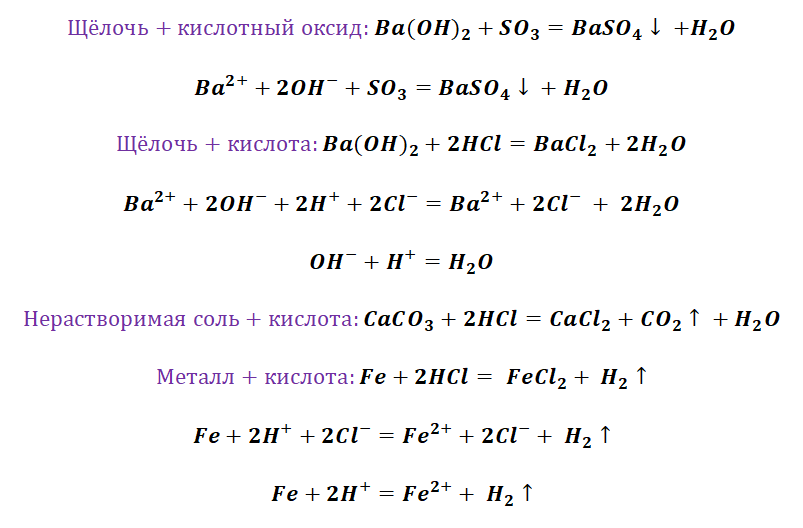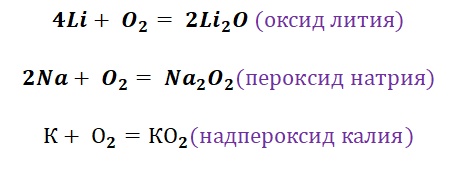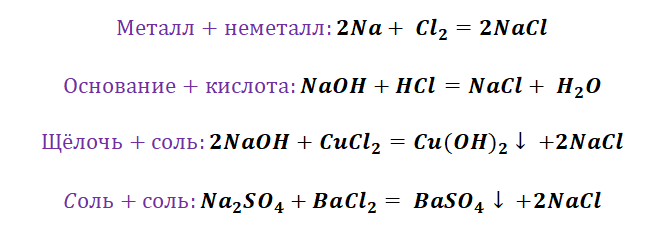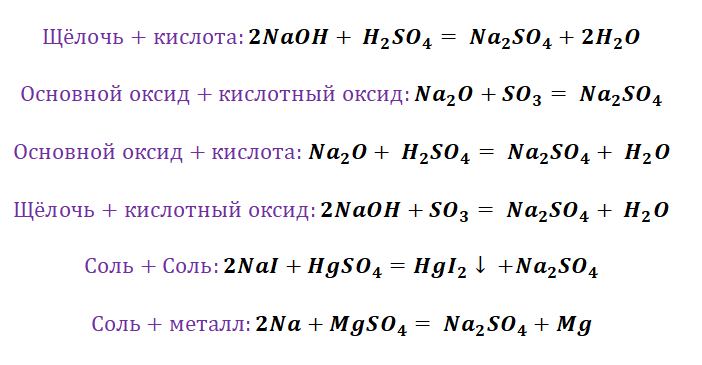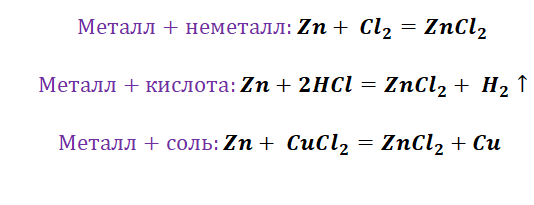Химия металлы и неметаллы
Обновлено: 18.05.2024
Простые веществаа — химические вещества, состоящие исключительно из атомов одного химического элемента, в отличие от сложных веществ. Являются формой существования химических элементов в свободном виде; или, иначе говоря, химические элементы, не связанные химически ни с каким другим элементом, образуют простые вещества. Известно свыше 400 разновидностей простых веществ.
Химические вещества, состоящие исключительно из атомов одного химического элемента, в отличие от сложных веществ. Являются формой существования химических элементов в свободном виде; или, иначе говоря, химические элементы, не связанные химически ни с каким другим элементом, образуют простые вещества. Известно свыше 400 разновидностей простых веществ.
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Простые вещества
Прежде чем приступить к рассмотрению свойств простых веществ, необходимо вспомнить некоторые закономерности, характеризующие способность свободных атомов к перестройке электронной конфигурации. Так, у свободных атомов элементов III периода наблюдаются следующие тенденции:

Результатом реализации отмеченных тенденций, присущих свободным атомам, является образование соответствующих связей в простых веществах. Как известно, в периодах наблюдается постепенный переход от активных металлов (щелочные металлы) к типичным неметаллам (галогены).
При рассмотрении тех же тенденций у свободных атомов в группах периодической системы наблюдаем следующие изменения:

С указанными характеристиками свободных атомов можно связать усиление металлических свойств и ослабление неметаллических с ростом зарядов ядер у элементов одной и той же группы.
Металлы и неметаллы. Относительность деления простых веществ на металлы и неметаллы
Простые вещества, характеризующиеся атомным (ионным) строением и наличием свободных электронов, являются металлами. Эти вещества обладают металлическим блеском, электро- и теплопроводностью. По химическим свойствам металлы являются типичными восстановителями (т. е. легко отдают валентные электроны).
Все простые вещества, образованные атомами элементов дополнительных подгрупп, являются металлами.
Типичными неметаллами являются такие простые вещества^ которые, как правило, состоят из молекул с атомной и ковалентной связью. Не имея свободных электронов, неметаллы по физическим свойствам характеризуются отсутствием электронной проводимости, металлического блеска и т. п. По химическим свойствам многие из них являются энергичными окислителями, так как их атомы обладают сильной склонностью к присоединению электронов.
Рассмотрим фрагмент периодической системы, составленный из элементов главных подгрупп:

Как видно из этой схемы, типичные неметаллы располагаются в правом верхнем углу системы, а металлы — в ее левом нижнем углу.
Валентность перехода, или относительность деления на металлы и неметаллы, выражается в наличии ряда простых веществ, являющихся как бы полуметаллами. При обычных условиях простые вещества, образованные этими элементами, имеют незначительную электропроводность . Поэтому их нельзя отнести ни к неметаллам, ни к металлам. Иногда их называют металлоидами (т. е. неполными металлам). Атомы этих элементов в простом веществе соединяются ковалентными связями. При этом нередко образуются прямые кристаллические структуры, подобные структуре алмаза, в которых каждый атом связан с несколькими другими.
Следовательно, одна из причин относительности деления простых веществ на металлы и неметаллы тесно связана со знанием атомов элементов.
Другая причина относительности такого деления заключается в состоянии внешних условий. Так, при обычных условиях металлы, как известно, характеризуются наличием свободных электронов. Металлическая связь осуществляется и в твёрдом и в жидком состоянии. Но если перевести в пар при определённых условиях (высокие температуры и низкие давления), то он теряет свое характерное свойство — электропроводность. У неметаллов в условии высокого давления наоборот возникает электронная проводимость, что является результатом глубоких изменений в структуре вещества.
Таким образом, структура вещества, тип химической связи, простого вещества могут изменяться под воздействием соответствующих внешних условий. Хорошо известным примером такого рода изменений являются различия физических свойств у различных аллотропных модификаций одного и того же элемента.
Аллотропия
Способность одного и того же элемента существовать в виде нескольких простых веществ называется аллотропией. В настоящее время известно около 400 простых веществ. Причина образования различных аллотропных видоизменений одного элемента кроется в возможности образования новых связей между атомами при изменении внешних условий. В результате образуются молекулы нового состава или новые кристаллические вещества, отличающиеся пространственным расположением атомов.
Так, например, существуют обыкновенный кислород и озон, отличающиеся друг от друга числом атомов в молекуле: кислород О2, и озон О3. Озон образуется при прохождении через воздух электрических разрядов.
Для серы известны два аллотропных видоизменения: ромбическая и призматическая сера. Выше температуры 95,6° С существует призматическая сера, ниже — ромбическая. Изменяется кристаллическая форма (ясно из названия) — изменяются и физические свойства.
Для олова переход одной модификации (серое олово) в другую (белое олово) совершается при температуре 18° С. Здесь также происходит изменение типа кристаллической решетки.
Наличие нескольких аллотропных видоизменений характерно для всех элементов четвертой группы. Рассмотрим, как влияет изменение структуры на физические свойства простых веществ элементов этой группы. Как известно, углерод и кремний принято относить к неметаллам, германий — к полупроводникам, олово и свинец — к металлам. Однако такое деление условно. В этом можно убедиться, рассмотрев, например, аллотропные видоизменения углерода.
В алмазе каждый атом углерода находится в центре правильной треугольной пирамиды (тетраэдр) и соединен ковалентными связями с четырьмя соседними атомами углерода (рис. 6). Таким образом, в таком кристаллическом веществе нет отдельных молекул (это понятие здесь теряет свой смысл). Связи между атомами углерода весьма прочны. Этим объясняется исключительно высокая твердость алмаза, высокая температура плавления и кипения.
В структуре графита плоские слои из атомов углерода расположены шестиугольниками. При этом расстояние между слоями больше расстояния между соседними атомами углерода, находящимися в одном слое (рис. 7). Для образования связей в шестиугольниках от каждого атома углерода требуется три электрона, четвертый же остается «свободным». Этим объясняется электропроводность графита. Поэтому графит используется для изготовления электродов.
Точно так же отличаются физическими свойствами кристаллические модификации олова: белое олово обладает электронной проводимостью, серое является полупроводником.
Выше мы отмечали, что переход одного аллотропного видоизменения в другое происходит при соответствующих условиях. Однако дело в том, что скорость указанного превращения, как правило, незначительна, различные простые вещества одного элемента могут сосуществовать.

рис. 6. Структура алмаза

Если различия между физическими свойствами аллотропных модификаций одного элемента нередко велико, то по химическим свойствам они чаще всего близки. Отличия касаются, главным образом, окислителей (озон — более активный окислитель), скорости реакции с участием простого вещества.
Понятие об окислительно-восстановительных процессах
При первоначальном знакомстве с химией рассматриваются четыре вида химических реакций: реакции соединения, разложения, замещения и двойного обмена.

Цифры над символами элементов означают окислительное число. Мы видим, что одни реакции (1, 3, 5, 6) идут с изменением окислительного числа элементов, другие (2, 4, 7) — без его изменения. На этой основе все химические реакции условно делят на два типа: реакции, идущие с изменением окислительного числа элементов — окислительно-восстановительные реакции — и реакции, течение которых не сопровождается изменением окислительного числа. Первые реакции играют огромную роль в жизни человека, в окружающем нас мире. Окислительно-восстановительные процессы имеют место при горении, дыхании, при получении серной кислоты из серы или сульфидов металлов, при выплавке металлов из руд, при коррозии металлов и сплавов, при работе химических источников электрической энергии.
Что же лежит в основе перечисленных выше процессов? Почему одни простые вещества легко вступают в реакцию друг с другом, тогда как другие нет.
В основе рассматриваемых процессов лежит такая перестройка электронной структуры атомов, составляющих соединение, которая ведет к изменению окислительного числа элементов. Таким образом, в этом случае, как правило, имеет место переход электронов от одних атомов, ионов, молекул к другим. Правда, иногда изменение окислительного числа сопровождается не передачей электронов от одного атома (иона) к другому, а смещением электронных пар:

(вертикальной линией условно обозначена середина межатомного расстояния в рассматриваемых молекулах).
В первом случае из двух простых веществ образуется ионное соединение, во втором — ковалентное полярное. Окислительное число элементов в простых веществах принимается равным нулю.
Окислительное число хлора и в поваренной соли, и в хлористом водороде равно -1, хотя указанные соединения различаются типом химической связи (что и представлено на схеме).
Окислителями называются вещества (атомы, ионы, молекулы), которые в ходе химической реакции присоединяют электроны или оттягивают их от других атомов. В только что рассмотренных примерах в качестве окислителя выступал хлор (С12). В результате реакции окислительное число хлора понизилось.
Восстановителями называются вещества (атомы, ионы, молекулы), вторые в ходе химической реакции отдают электроны для образования ионной или ковалентной связи. В тех же примерах в качестве восстановителей выступали соответственно натрий и водород. В результате реакции окислительное число восстановителей повысилось.
Принципиальная возможность электронной перестройки, наличие потенциального окислителя или восстановителя определяются строением атомов, строением вещества в целом.
Реализация этой возможности в общем случае находится в зависимости от многих факторов: наличия соответствующего партнера, концентрации окислителя и восстановителя, температуры, среды, в котоорой осуществляется реакция, и т. п.
Рассмотрим это на примере реакции взаимодействия двух простых веществ натрия и хлора:
2Na + С12 = 2NaCI
Как известно, для атомов натрия характерно «стремление» к отдаче электрона, для атомов хлора — к присоединению. Следовательно, в данном случае имеет место взаимодействие активного окислителя и активного восстановителя. Реакция осуществляется довольно легко: попаренная соль образуется с большим выделением тепла, в чём легко убедиться на практике. Процессы взаимодействия многих металлов с хлором идут самопроизвольно или при незначительном нагревании (для увеличения скорости реакции). Образовавшиеся при реакции ионы натрия (Na + ) и хлора (СI - ) обладают завершёнными электронными конфигурациями и поэтому, представляет себе возможность течения обратной реакции, мы понимаем, что Na + будет очень плохим окислителем, а СI - — плохим восстановителем. Для осуществления такой реакции потребуется значительная затрата энергии (высокие температуры). При обычных условиях натрий и хлор из поваренной соли получают электролизом расплава поваренной соли.
Ранее, рассматривая вопрос о положении водорода в периодической системы, мы указывали на сходство водорода как со щелочными металлами, так и с галогенами. Это сходство проявляется, в частности в том, что подобно щелочным металлам, водород может выступать в качестве восстановителя, но с другой стороны, подобно галогенам, способен быть и окислителем. Причина двух способов изменения электронной конфигурации нейтрального атома водорода заключается в особенности строения атомов I периода (первый энергетический уровень заполняется двумя электронами). Изменение
окислительного числа водорода можно представить следующим образом:
В первом случае водород выступает как восстановитель, во втором — как окислитель. Например:

Таким образом, мы прежде всего должны учитывать принципиальные возможности присоединять или отдавать электроны, т. е. возможности, прямо вытекающие из строения атомов и окислительного числа элемента в соединении. В нашем примере водород (Н2) может выступать и в роли окислителя и в роли восстановителя. Какая из этих двух возможностей будет реализована, зависит от партнера по реакции, от того, с каким веществом (окислителем или восстановителем) будет взаимодействовать водород.
Как же связать окислительные и восстановительные свойства простых веществ с положением элементов в периодической системе? Рассмотрим конкретные примеры. Например, окислительная способность в ряду галогенов убывает от хлора к йоду:
Восстановительную способность металлов отражает ряд активности (напряжения) металлов который составлен с учетом последовательности вытеснения металлов из растворов их солей.
По-иному будет выглядеть ряд, иллюстрирующий способность металлов образовывать соединения с кислородом или азотом, водородом или фтором и т. д.
В группах периодической системы восстановительные свойства простых веществ, как правило, усиливаются, а окислительные — падают. Однако это общее положение нуждается в уточнении, когда мы приступаем к изучению некоторых конкретных примеров. Число реакций, в которых данный элемент может выступать, скажем, в качестве восстановителя, достаточно велико, а процесс окисления— восстановления зависит от многих факторов, которые мы пока еще не рассматривали.
Услуги по химии:
Лекции по химии:
Лекции по неорганической химии:
Лекции по органической химии:
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
Периодическая система химических элементов
В этом разделе Вы познакомитесь подробно с периодической системой химических элементов (ПСХЭ). Рассмотрим: почему она носит такое название, почему её называют универсальной шпаргалкой, какие сведения можно получить, используя её на уроках не только химии, но и физики.
План урока:
Классификация химических элементов
Начнём с истории создания ПСХЭ. В определённый момент XIX века, когда наука значительно шагнула вперёд и достаточно быстрыми темпами открывались новые химические элементы, возникла необходимость рассортировать их. Несмотря на то, чтои все они отличались по своим свойствам, в процессе изучения можно было выделить общие их свойства.
Год открытия периодической системы считается 1869. Она была колоссальным успехом того времени, а так же не теряет актуальность и на данный момент.
Но давайте всё рассмотрим по порядку, ведь над проблемой систематизации на протяжении многих лет работало много учёных, которые внесли большой вклад в развитие науки. В силу разных причин, они не смогли в полной мере классифицировать элементы.
Так, самая первая попытка была разделить на металлы и неметаллы, автором которой был шведский учёный Йёнс Якоб Берцелиус.
Что характерно для металлов?
Представим перед собой, предметы с железа, золота, алюминия. Что первое мы можем сказать о свойствах этих металлов? Все они имеют металлический блеск.
Также они (за исключением ртути) при нормальных условиях находятся в твёрдом виде. Имеют хорошую электропроводность и теплопроводность, высокую плотность. Эти признаки объединяют группу металлов.
Как мы можем описать неметаллические вещества?
Какие они будут иметь общие характеристики? В простых соединениях неметаллы могут быть как газы (кислород О2, хлор Cl2, азот N2), жидкости (бром Br2), так и твёрдые вещества (алмаз – самоё твёрдое вещество, образован Углеродом С, также сера S, кремний Si, фосфор Р, йод I2).Они могут быть не только разного агрегатного состояния, но и иметь разнообразную окраску.
Но, не смотря на такие резкие отличия между ними, возможно выделить общие черты: они диэлектрики и не пластичны. Большинство неметаллов имеют молекулярное строение. Данная классификация актуальна и в наше время.
Над классификацией элементов трудилось много учёных разных стран. Работая независимо друг от друга, они обнаружили интересный факт, что свойства элементов зависят от их атомной массы.
Немецкий химик И.В. Деберейнер отметил, что некоторые элементы сходны свойствами, и их можно объединить в группы, название которым дал – триады. Масса одного из элементов является средним арифметическим элементов с максимальной и минимальной массой в группе.
Недостатком данной систематизации является то, что данным способом удалось получить всего 5 триад. Не трудно подсчитать, что систематизировано было всего 15 элементов, а остальные 56 элементов не вписывались в его классификацию. Однако Деберейнер один из немногих заметил связь между свойствами и атомной массой элемента.
Ещё один необычный способ предложил французский химик А.Э. Шанкартуа. За основу он взял спираль и на её витках разместил элементы в порядке возрастания их атомных масс. Другое название она получила «Теллуровый винт», потому что заканчивалась Теллуром. Заслугой «спирали-винта» было обращение внимания на подобные свойства Водорода и галогенов (Cl, Br, I). Таким образом удалось систематизировать 50 элементов.
Как совершенству нет предела, так и фантазиям учёных. Так английский учёный Джон Ньюлендс связал элементы с музыкой, он предоставил их в виде нот и заострил своё внимание на том, что каждый восьмой повторяет свойства первого.
Как оказалось, и эта классификация имеет недочёты, во-первых, она не располагала местом для новых элементов, а, во-вторых, в одно семейство попадали элементы с разными свойствами, которые не имели ничего общего: Cl и Pt, S, Fe и Au. Однако данная систематизация имела и положительные моменты, учёные заметили, что периодичность возникает на 8 элементе по счёту, также появилось понятие порядковый номер.
Отдельно хочется выделить немецкого учёного Лотара Мейера. Он разместил 28 элементов в виде таблицы. В принцип создания таблицы он заложил атомную массу, её увеличение, а также выделил столбцы элементов с одинаковой валентностью.
Ему понадобилось почти шесть лет, чтобы усовершенствовать свою таблицу и расположить остальные элементы, которые он не учёл в версии таблицы, выданной в 1864 году. Ошибка Мейера заключалась в том, что не было никаких обобщений и выводов, но как видно, он был близок к открытию не только периодической системы, но и закона.
Схема показывает, что учёные не одно десятилетие работали над созданием упорядоченной таблицы для элементов. Необходим был фундаментальный закон, который будет применим в естествознании.
В 1869 году русский учёный Дмитрий Менделеев создаёт периодическую систему. Об истории написания таблицы существует множество легенд, как и самом учёном. Менделеев был достаточно многогранной личностью, он трудился в разных сферах науки. Открыл секрет изготовления бездымного пороха, придумал способ передачи нефти, используя трубопровод. К нефти он особенно относился, считая сжигание нефти кощунством, так как она служит источником для получения множества вещества. «Человек-чемодан» можно также услышать о нём, потому что любимым его делом было изготавливать чемоданы. Но самой значимой его заслугой было создание периодической системы, которую, поговаривают, создал он во сне.
Строение периодической системы
Для начала рассмотрим понятия таблица и система. Вы не один раз видели таблицу, она состоит из строк и столбцов. Но почему творение Менделеева имеет названия как таблица, так система да еще и с добавлением периодическая.
В таблице содержится упорядоченная информация в определённом порядке. Система указывает, что сведения связаны между собой. Периодичность означает, что через какой-то промежуток или отрезок происходит повторение свойств.
Как уже известно, в периодической системе находятся элементы. Принцип их расположения - это увеличение их атомной массы.
В таблице имеются строки – это периоды, и столбцы – группы.
Существует несколько вариантов ПСХЭ, так называемый короткий и длинный вариант.
Короткий вариант имеет 8 групп, номера которых указаны римскими цифрами I, II…VIII, содержит главную (А) и побочную (В) группы. Длинный формат вмещает 18 групп, нумерация осуществляется арабскими цифрами I, II…XVIII,
Если посмотреть на таблицу, то видим закономерность, так как абсолютно каждый период будет начинаться активным металлом и заканчиваться инертным газом. Такая периодичность сохраняется 7 раз.
Как видно из таблицы, I период включает 2 элемента, II и III состоят из 8, IV и V содержат 18, самые большие – это VI и VII вмещают 32 элемента (VII период незаконченный).
В периоде с ростом атомной массы металлические свойства уменьшаются, неметаллические – увеличиваются.
Вертикальные столбцы образуют группы. Это условно компании, где собираются единомышленники. Точнее, располагаются элементы, подобные по своим свойствам.
Обратите внимание, что подобие характерно только в пределах подгруппы. Так, натрий и медь принадлежат одной I группе, но располагаются в разных подгруппах. Натрий – элемент главной подгруппы, медь – побочной. Именно по этой причине они будут иметь разные физические и химические свойства.
В пределах группы с ростом атомной массы металлические свойства увеличиваются, неметаллические – уменьшаются.
Таким образом, периодическую систему можно условно назвать домом химических элементов, где каждый из них занимает своё определённое место (порядковый номер) согласно его свойствам.
Рассмотрим подробнее на примере 2 и 3 периода. Что показывает сравнение: оба периода начинаются с активных металлов Li и Na, для которых характерно существование в виде соединений, в свободном виде могут находиться только под слоем керосина. Они относятся к группе щелочных металлов. Анализируя схему, мы видим, что первые три группы образованны металлами. С IV – VII находятся неметаллы. «Закрывают период» инертные газы.
Особое внимание располагают к себе элементы VI и VII периоды, которые образуют «семейство» лантаноидов (Лантан № 57) и актиноидов (Актиний 89), они формально близки к скандию. Но из-за их количества они вынесены за пределы системы.
Периодический закон Д. И. Менделеева
Проанализировав изменения свойств элементов II и III периода, можно сделать выводы, которые Д. И. Менделеев записал в виде периодического закона.
Благодаря периодическому закону, зная расположение элемента в периодической системе, мы можем прогнозировать свойства веществ. Элементы входят в состав как простых, так и сложных веществ, влияя при этом на их свойства. Обобщить данные тезисы можно в виде таблицы.
Таблица 1. Изменение свойств химических элементов в ПСХЭ
Рассмотрим на примере I группы. Li, Na, K, Cs, Fr собрались в компанию одновалентных металлов, которые образуют основные оксиды состава Ме2О. При взаимодействии с водой образуют щёлочь. Эти характеристики их объединяют. Теперь рассмотрим отличия. Вам уже известно, что в пределах группы с ростом атомной массы металлические свойства увеличиваются.
Как это сказывается на реакционной способности данных металлов?
Интенсивность и скорость реакции калия и лития с водой будет отличаться. Реакция калия будет сопровождаться бурным выделением водорода, в то время как литий будет спокойно реагировать с водой.
Зная формулу и состав высшего оксида, можем предположить его характер. Например, марганец образует оксиды MnO, MnO2, Mn2O7. Таблица поможет нам предположить их свойства.
MnO – будет основным оксидом (ищем аналогию со II группой), ему будет отвечать основание Mn(OH)2. Не трудно догадаться, что MnO2 и Mn2O7 будут кислотными (подобно IV и VII группе), они образуют кислоты H2MnO3 и HMnO4.
Свинец образует два оксида PbO и PbO2. Оксид свинца (II) PbO будет основной, оксид свинца (IV)PbO2– кислотный.
Характеристика элемента по его положению в периодической системе
Зная «прописку» элементов в таблице, мы можем прогнозировать их свойства. Составим план, согласно которому сможем описать свойства элементов, рассматривать будем на примере серы.
Первое, что нам необходимо знать - это какой символ имеет сера, чтобы по нему найти её в ПСХЭ. Обозначение S занимает ячейку 16. (порядковый номер).
Уточняем «прописку». III период, VI группа, главная подгруппа. Зная эти элементарные сведения, мы предполагаем, что это неметалл (принадлежность к VI группе и нахождение в малом ряду даёт нам основание для предположения).
Формула высшего оксида и его свойства. Поскольку сера элемент VI группы, высшая валентность будет равна VI. Формула оксида SO3. Пользуясь таблицей-шпаргалкой, определяем характер – кислотный. С курса физики известно, что противоположности притягиваются. Как плюс притягивает минус, так и кислотные оксиды взаимодействуют с основными, которые образованы элементами-металлами с валентностью I или II. Возьмём, например, барий, который образует оксид и гидроксид, соответственно ВаO и Вa(OH)2.
Формула высшего гидроксида и его свойства. Снова обратимся к нашей шпаргалке, высшие гидроксиды VI группы имеют формулу H2ЭO4, а именно H2SO4. Образованный гидроксид имеет кислотные свойства, для которого свойственны реакции с основными оксидами и основаниями. К примеру, возьмём двухвалентный стронций, формула оксида и гидроксида соответственно SrO и Sr(OH)2.
Как элемент-неметалл образует летучее водородное соединение состава H2S.
На данном примере убеждаемся, что зная расположение элемента в ПСХЭ, можно прогнозировать его свойства, а также свойства веществ, в состав которых он входит.
Металлы и неметаллы
Наш мир наполняют различные простые вещества – металлы или неметаллы. При существовании 120 химических элементов, Вселенную наполняют более 400 простых веществ. Этот парадокс связан с понятием аллотропии – явлением образования одним химическим элементом двух и более простых веществ. Например, атом кислорода может формировать молекулярный кислород О2 и озон О3.
Физические свойства металлов
Металлы – химические элементы, атомы которых в процессе реакции стремятся отдавать электроны. Они обладают металлической кристаллической решеткой и общими физическими свойствами. На данный момент известно более 87 металлов.
Для металлов характерен ряд свойств:
- твердость (кроме ртути, которая представляет собой жидкость);
- металлический блеск;
- проводимость электрического тока и тепла;
- пластичность.
Металлы при ударах не разрушаются, а меняют форму. С этой особенностью связано то, что из них производят проволоку, металлические листы и др. Развитие бронзового и железного века связано с производством товаров из металлов.
Физические свойства неметаллов
Неметаллы – химические элементы, атомы которых стремятся принять чужие электроны. Для них характерны атомные и молекулярные кристаллические решетки. Для атомов неметаллов не характерны общие физические свойства. На данный момент существует 22 неметалла.
Для неметаллов характерен ряд свойств:
- хрупкость (неметаллы нельзя ковать);
- отсутствие блеска;
- непроводимость электрического тока и тепла.
Расположение металлов и неметаллов в периодической таблице Д.И. Менделеева
Определить, является простое вещество металлом или неметаллом, можно с помощью периодической таблицы Менделеева. Металлы располагаются ниже диагонали «водород-бор- кремний-мышьяк-теллур-астат», а неметаллы выше.
Красные ячейки – неметаллы, синие – металлы
Элементы, расположенные вблизи диагонали, обладают смешанными свойствами: проявляют как металлические, так и неметаллические свойства. Они называются полуметаллами.
Красные ячейки – полуметаллы
Полуметаллы имеют ковалентную кристаллическую решетку при наличии металлической проводимости (электропроводности). Валентных электронов у них либо недостаточно для образования полноценной ковалентной связи, либо они не удерживаются достаточно прочно из-за больших размеров атома. Поэтому связь в ковалентных кристаллах этих элементов имеет частично металлический характер.
Закономерности в таблице Д.И. Менделеева
Каждый атом состоит из протонов, нейтронов и электронов. Протоны и нейтроны находятся в ядре, который несет положительный заряд. Вокруг ядра движутся отрицательно заряженные электроны. Атомный номер указывает на количество протонов.
Чем больше заряд ядра, тем сильнее к нему притягиваются электроны. Т.о., атому сложнее отдавать электроны. Поэтому в периоде слева направо, с увеличением порядкового номера металлические свойства ослабевают, а неметаллические – усиливаются.
Неметаллы стремятся принять электроны от других атомов. Период в таблице указывает на количество электронных уровней. По мере увеличения числа орбиталей электроны отдаляются от ядра и атому сложнее удерживать электроны на последних уровнях. Т.о., в группе сверху вниз количество орбиталей возрастает, поэтому металлические свойства усиливаются, а неметаллические – уменьшаются.
Способы получения металлов
Большую часть металлов получают из оксидов при нагревании.
Металлы, имеющие на внешнем уровне один-два электрона, получают с помощью электролиза расплавов.
Химические свойства металлов
Все металлы проявляют восстановительные свойства. Легкость в отдачи внешнего электрона применяется в фотоэлементах. Степень активности определяется рядом активности. У самых активных на внешнем уровне располагается по одному электрону.
Общие химические свойства металлов выражаются в реакциях со следующими соединениями.
Активные металлы реагируют с галогенами и кислородом. С азотом взаимодействуют только литий, кальций и магний. Большинство металлов при взаимодействии с кислородом образуют оксиды, а наиболее активные металлы – пероксиды (N2O2).
2 Ca + MnO2 → 2 CaO + Mn(нагревание)
Водород в кислотах вытесняют только те металлы, которые в ряду напряжений стоят до водорода.
Более активные металлы вытесняют из соединений менее активные.
- Химические свойства щелочных и щелочно-земельных металлов (реакции с водой)
2 Na + 2 H2O → 2 NaOH + H2
Способы получения неметаллов
Неметаллы синтезируют из природных соединений с помощью электролиза.
2 KCl → 2 K + Cl2
Также неметаллы получают в результате окислительно-восстановительных реакций.
SiO2 + 2 Mg → 2 MgO + Si
Химические свойства неметаллов
Неметаллы проявляют окислительные свойства. Самый активный неметалл – фтор. Он бурно реагирует со всеми веществами, а некоторые реакции сопровождаются горением и взрывом. В атмосфере фтора горят даже вода и платина. Фтор окисляет кислород и образует фторид кислорода OF2.
Неметаллы вступают в реакции со следующими веществами.
3 F + 2 Al → 2 AlF3 (нагревание)
S + Fe →FeS (нагревание)
Меньшей активностью обладают такие неметаллы как бор, графит, алмаз. Они могут проявлять восстановительные свойства.
2 C + MnO2 → Mn + 2 CO
Коррозия металла
Коррозия – это процесс разрушения металлов или металлических конструкций под действием кислорода, воды и вредных примесей. Не все металлы подвергаются коррозии. Их стойкость зависит от ряда факторов.
- На благородных металлах не образуется коррозия.
- На поверхности алюминия, титана, цинке, хрома и никеля есть оксидная пленка, которая предотвращает процессы коррозии.
Различают несколько видов коррозии – химическую и электрохимическую.
Химическая коррозия
Химическая коррозия сопровождается химическими реакциями. Она образуется под действием газов.
Электрохимическая коррозия
Электрохимическая коррозия – процесс разрушения металлов или металлических конструкций, который сопровождается электрохимическими реакциями. В большинстве металлов находятся примеси. В процессе коррозии электродами могут служить не только металлы, но и его примеси.
Например, в железе могут находиться примеси олова. В этом случае на аноде электроны переносятся от олова к железу и металлы растворяются, т.е. железо подвергаются коррозии. На катоде восстанавливается водород из воды или растворенного кислорода. Электрохимическая коррозия может сопровождаться следующими процессами.
Анод: Fe 2+ - 2e → Fe 0
Катод: 2H + + 2e → H2
Способы защиты от коррозии
В промышленности популярны различные методы защиты металлов от коррозии.
Покрытия защищают поверхности от действия окислителей. Ими служат различные вещества:
- покрытие менее активным металлом (железо покрывают оловом);
- краски, лаки, смазки.
- Создание специальных сплавов
Физические свойства сплавов и чистых металлов отличаются. Поэтому для повышения стойкости в сплав необходимо добавить дополнительные металлы.
Биологическая роль металлов и неметаллов
В организмах содержится множество различных металлов и неметаллов. Различных химических элементов в организме может не хватать, поэтому приходится потреблять их извне.Химические элементы можно разделить на две большие группы – макроэлементы и микроэлементы.
К макроэлементам относятся вещества, содержание которых в организме превышает 0,005 %. Эта группа включает водород, углерод, кислород, азот, натрий, магний, фосфор, сера, хлор, калий, кальций.Микроэлементы – элементы, содержание которых не превышает 0,005%. К ним относятся железо, медь, селен, йод, хром, цинк, фтор, марганец, кобальт, молибден, кремний, бром, ванадий, бор. Каждый макро- и микроэлемент в организме выполняет определенную функцию.
Применение металлов и неметаллов
В синтезе химических препаратов и лекарств применяются чистые металлы и неметаллы. В органической химии металлы используются в качестве катализаторов, а также при получении металлорганических соединений. Неметаллы служат исходным сырьем для получения чистых кислот и других химических соединений.
Взаимопревращения между классами веществ
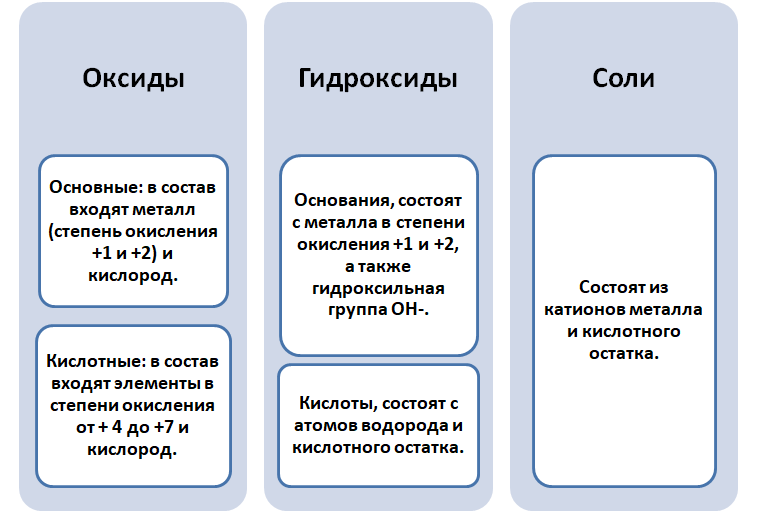
Наверняка у каждого из Вас есть семейный альбом, где есть фото родителей, бабушек, дедушек, прабабушек. А возможно у кого-то есть сведения о предках не одного поколения, и это всё отображается в виде генетического дерева. Правомерный вопрос, к чему эти сведения и химия? Однако и в химии есть, так называемые, прародители (металлы и неметаллы), с которых путём химических превращений, были получены новые классы соединений и между ними существует генетическая связь.
Почему связь между классами веществ считается генетической
Чтобы разобраться в этом вопросе. Вспомним состав классов веществ, с которыми Вы познакомились на предыдущих занятиях.
Обратите внимание, что соли содержат в себе частицы как оснований (атомы металла), так и кислот (кислотных остатков). Если соль рассматривать как «венец» превращений, то давайте, попытаемся прийти к истокам. Всё начинается с простого, точнее металла и неметалла, как простых веществ.
Попробуем построить генетический ряд металлов, переходя от одного класса к другому.
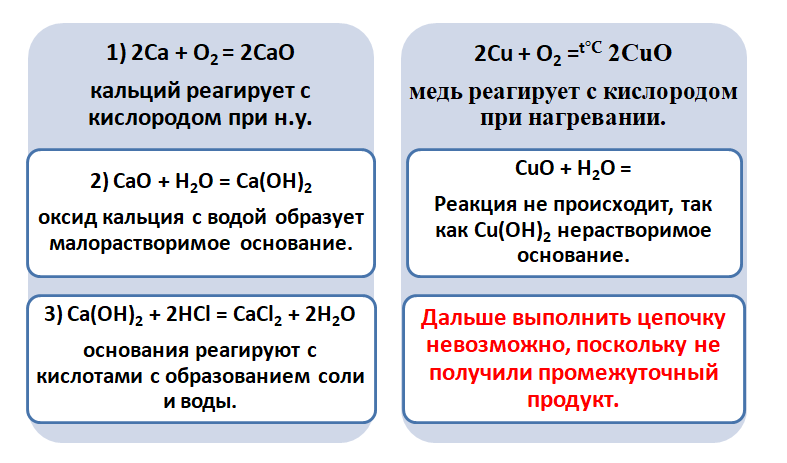
Возьмём, к примеру, металлы кальций и медь, подставив их в цепочку уравнений.
Обратите внимание, что данные металлы отличаются своей реакционной способностью.
Получается, эта генетическая связь соединений присуща только для активных металлов, оксиды которых, реагируя с водой, дают продукт в виде щёлочи.
Для металлов, которые отличаются малой активностью, переход от вещества, находящегося в простом состоянии, к соли, происходит путём превращений.
Поскольку основные оксиды реагируют с металлами (более активными, чем металлы, которые входят в состав оксида), то эту схему можно сократить.
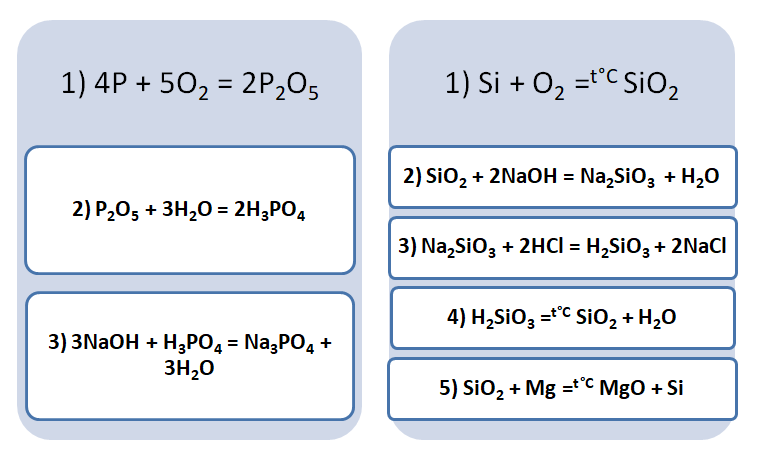
Аналогичным способом можно составить генетический ряд неметаллов, начиная от неметалла заканчивая солью или неметаллом.
Подставим в цепочку уравнений фосфор и кремний.
А возможны иные пути решения данных цепочек уравнений. Способы получения кислотных оксидов реализуются путём взаимодействия простых веществ с кислородом. А вот не с каждого оксида можно получить ему соответствующую кислоту, путём прибавления воды. Поскольку кремниевая кислота нерастворима в воде, то необходимо получить сначала соль, а потом уже и кислоту.
В данном решении предлагается добыть соль Na3PO4, взаимодействием основания и кислоты. Однако можно использовать и другие варианты, которые также будут верны.
Если объединить генетические ряды металлов и неметаллов, получим дружную семью неорганических соединений, где каждое вещество связано неразрывной нитью с другими классами. Таблица 1.
Данная таблица отображает, как реагируют между собой вещества и какие продукты возможны, вследствие реакции.
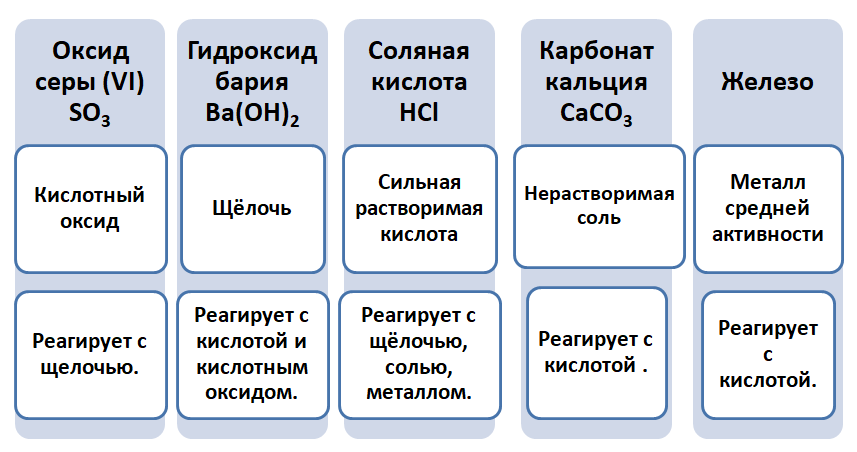
Промоделируем на примере: В вашем распоряжении имеются следующие вещества: оксид серы (VI), гидроксид бария, соляная кислота, карбонат кальция и железо. Ваша задача спрогнозировать, между какими соединениями возможна реакция и, записать, соответствующие уравнения реакций.
Подтвердив свои прогнозы молекулярно-ионными уравнениями в сокращённом и полном виде.
Родственные связи между металлами и неметаллами
Кислород является типичным представителем неметаллов. Он является достаточно сильным окислителем, перед которым может устоять только фтор. Получение основных оксидов происходит путём взаимодействия кислорода и металлов. Однако не все металлы охотно с ним реагируют. Щелочные реагируют бурно, именно поэтому их хранение осуществляется под слоем керосина. Необходимо заметить, что щелочные металлы не образуют оксиды во время взаимодействия с О2. Их чрезвычайная активность позволяет получать только для их характерные продукты, это будут пероксиды и надпероксиды (за исключением лития, продукт Li2O).
А вот, чтобы менее активные металлы – железо или медь прореагировали, необходимо нагревание.
Получение кислотных оксидов происходит аналогично взаимодействием неметаллов с О2.
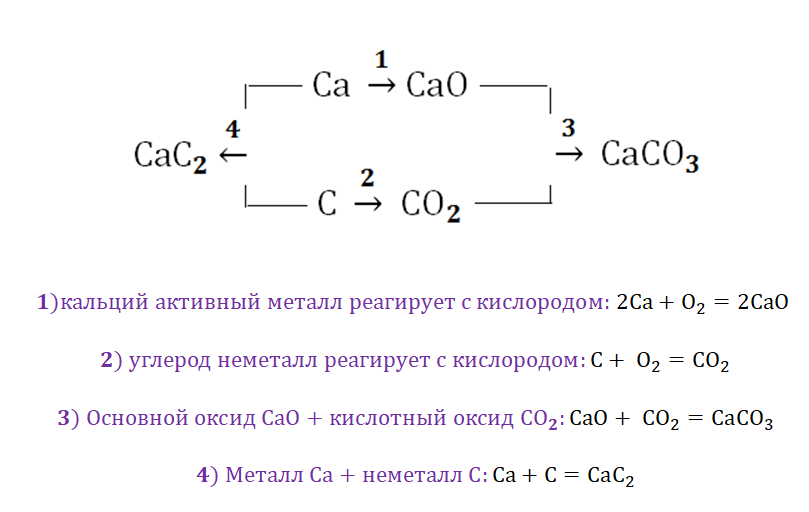
Металлы и неметаллы в химии рассматриваются как противоположности, которые, как заряды (положительные и отрицательные) имеют свойства притягиваться. Рассмотрим на примере металла кальций и неметалла углерод.
Соль СаСО3 имеет истоки от простых веществ Са и С, промежуточным звеном являются оксиды этих веществ, для которых свойственно реагировать между собой.
Вспомним с Вами один с основных постулатов химии, а именно, закон постоянства состава вещества.
Представим, что мы с Вами химики-первооткрыватели и нам предстоит сложная задача получить азотную кислоту, которая имеет важную роль в химической промышленности. Получение кислот возможно несколькими способами. Обращаясь к таблице 1, делаем вывод, что нам доступно несколько способов, а именно.
Взаимодействие кислот с солями приведёт нас к желаемому результату, однако не забывайте, что в продукте должны увидеть газ, осадок либо окрашивание.
Способы получения средних солей доказательно показывают связь между веществами. Снова выручалочкой нам послужит таблица 1. Наша задача получить вещество, без которого, полагаем, Вы не представляете своё существование, это соль NaCl. Используя данные, видим, что доступно для её получения 4 способа (Вы ищете, где продуктом является соль и применяете данные на свой пример).
Рассмотрим подробно каждый с них.
Способы получения солей отличаются, причиной этому является то, какую именно соль мы хотим получить, кислородсодержащей,сильной или слабой кислоты. К примеру, получение Na2SO4 будет отличаться от предыдущего примера с NaCl. Количество способов будет больше, так как это соль кислородсодержащей кислоты.
Здесь следуют отметить особенность щелочных, а также щелочно-земельных металлов, для которых свойственно взаимодействие с водой. По сути, идёт два параллельных процесса.
Полученная щёлочь реагирует с кислотой.
Способы получения солей аммония несколько отличаются, от солей металлов, тем, что аммиак непосредственно реагирует с кислотами (смотри урок химическая связь) с образованием донорно-акцепторных связей.
Гидроксид аммония имеет способность взаимодействовать с кислотами, с образованием необходимого продукта, не иначе как солей аммония.
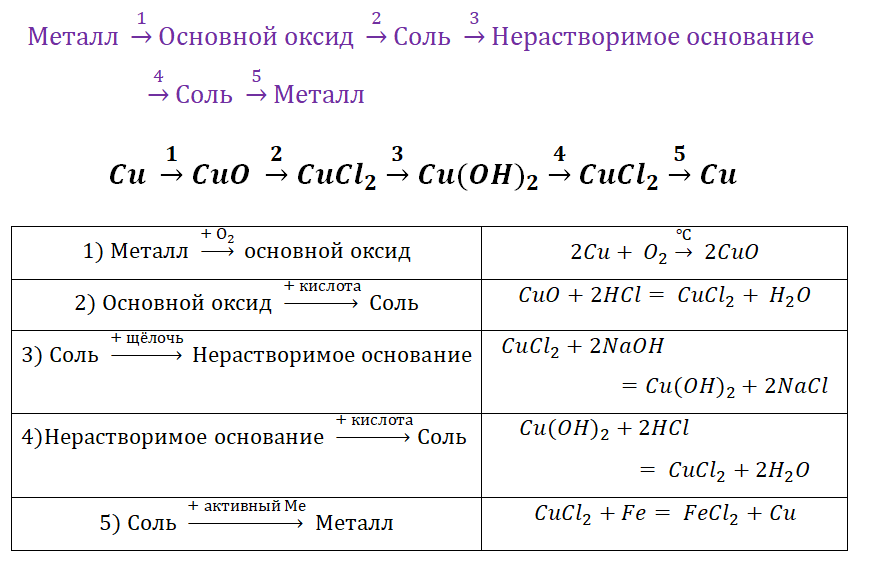
Наверняка некоторые из Вас пугал вид заданий, который был цепочек уравнений. Обобщая всё выше сказанное, рассмотрим несколько примеров.
Чтобы справится с данной задачей, проанализируем условие. Первое, что необходимо выделить – это количество уравнений (смотрим по стрелочкам, их 5). Второе определим исходное вещество – цинк, металл средней силы. Чтобы получить с него соль (не забываем о таблице 1), можно использовать 3 способа:
Выбор за Вами, одного из трёх уравнений. Переходим к следующей части цепочки ZnCl2 → Zn(OH)2. Здесь решением будет один вариант, это прибавление щёлочи.
Zn(OH)2 относится к нерастворимым основанием, поэтому при нагревании распадаются.
И наконец, итоговый продукт, металл. Его необходимо выделить из соли. Для этого необходимо взять металл, сила которого будет больше. Если эту информацию забыли, то освежить эти данные сможете с помощью урока Соли и их свойства.
Решение цепочек химических уравнений на первый взгляд кажется не посильной задачей, но если внимательно изучить свойства веществ, то они кажутся не такими уж и сложными.
Взаимопревращение между классами веществ
Обобщая сведения о свойствах неорганических соединений, составим схему 1. Взаимосвязь между классами неорганических веществ.
Эта схема и таблица 1 будут служить Вам волшебной палочкой в изучении неорганической химии.
Металлы и неметаллы – в чем разница и как понять, когда металлические свойства усиливаются, а когда ослабевают

Металлы – это такие элементы, которые стараются отдавать свои электроны. Неметаллы – наоборот, стараются их принимать. Вам надо понять, почему это происходит, и что значат фразы типа «металлические свойства усиливаются, а неметаллические ослабевают». Сейчас я вам это объясню.
Почему металлические свойства слабеют «слева направо»
Итак. В атоме есть три частицы: протоны, нейтроны и электроны. У протонов заряд +1, у электронов -1. У нейтронов заряда нет.
Протоны и нейтроны находятся в ядре. Поэтому заряд ядра всегда плюсовой. А электроны крутятся вокруг ядра и притягиваются к нему, потому что у них заряд минусовой.
Электроны крутятся по электронным уровням – как планеты по орбитам вокруг Солнца.
Атомный номер показывает, сколько в атоме протонов. Как видите, это количество постоянно увеличивается.

Чем больше протонов, тем сильнее они «тянут» к себе электроны. Сравните:

Вывод – чем больше становится протонов, тем сильнее они удерживают электроны. Тем сложнее становится эти электроны отдавать. Поэтому слева направо, с увеличением порядкового номера (и, соответственно, числа протонов) металлические свойства слабеют, а неметаллические усиливаются.
На заметку – про радиус атома
Чем сильнее протоны притягивают электроны, тем ближе эти электроны становятся к протонам. Поэтому радиус атома уменьшается, атом как бы сжимается из-за увеличения заряда.
Почему неметаллические свойства слабеют «сверху вниз»
Идем дальше. Период в таблице показывает количество уровней (тех самых орбит), по которым летают электроны.
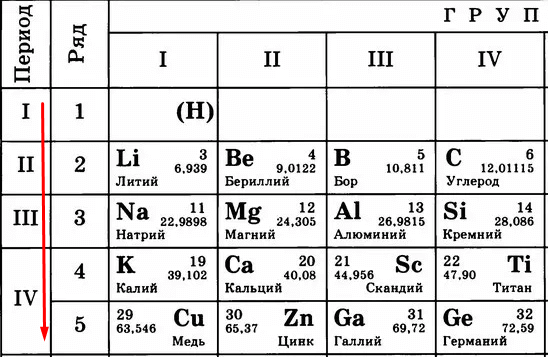
Чем больше период, тем больше этих орбит и тем дальше оказываются электроны от ядра. Сравните:
Кому сложнее удерживать электроны на последнем уровне? Меди, конечно, потому что эти электроны в два раза дальше от ядра, чем, например, у лития. Их проще становится отдать, чем пытаться удерживать.
Следовательно, «сверху вниз» количество уровней, по которым движутся электроны, растет, удерживать их становится сложнее, поэтому металлические свойства усиливаются, а неметаллические – слабеют.
Еще про радиус
Если смотреть на таблицу «сверху вниз» радиус ядра растет, потому что уровней становится больше.
Да, заряд атома тоже растет, но все-таки расстояние перевешивает. Чем больше уровней, тем труднее становится держать электроны, даже несмотря на то, что заряд увеличивается.
- Слева направо в таблице металлические свойства слабеют, неметаллические усиливаются из-за того, что ядро сильнее тянет к себе электроны.
- Сверху вниз металлические свойства усиливаются, неметаллические слабеют, потому что уровней становится больше, и удерживать электроны на последних уровнях становится труднее.
Из этих двух положений следует, что в правом углу таблицы Менделеева будут сосредоточены неметаллы, а в левом – металлы.
Я нашел вам вот такую картинку, на ней показаны все неметаллы. То, что выделено курсивом – это так называемые металлоиды – вроде и не совсем металлы, и в то же время не неметаллы. Нечто среднее.
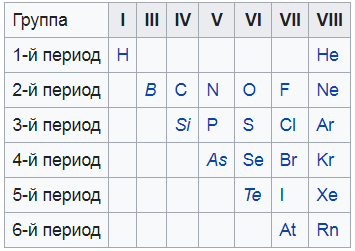
Это основа основ. Надеюсь, я объяснил понятно и вы разобрались. Если нет – перечитайте еще раз, задайте вопросы мне в комментариях. Только когда разберетесь – читайте дальше.
Свойства металлов
Эти свойства проявляются в разной мере, но все-таки присущи всем металлам:
- Плавятся.
- Их можно ковать.
- Обладают металлическим блеском.
- Проводят электрический ток. Это происходит благодаря металлической связи, которая соединяет их атомы.
- Проводят тепло.
- Твердые – это касается всех, кроме ртути.
На сегодняшний день металлов известно 87.
Свойства неметаллов
У них почти все наоборот:
- Ковать нельзя, потому что они хрупкие.
- Не обладают металлическим блеском.
- Не проводят электрический ток (за редким исключением – кремний и графит могут быть проводниками).
- Очень плохо проводят тепло.
- Есть твердые, газообразные, жидкие.
Неметаллов на данный момент 22.
Это первая статья по химии на нашем сайте. Напишите, что не так, что нравится и не нравится. Я буду думать, как сделать материал лучше.
И еще – есть идея записывать видеоролики с объяснениями. Лично вам удобнее разбираться в чем-то, читая текст, или просматривая видео?
Читайте также: