Химия металлы презентация 9 класс химия
Обновлено: 30.06.2024
Загрузить презентацию (550 кБ)
Цели урока: познакомить учащихся с основными понятиями темы, со значением металлов в практической жизни человека
Планируемые результаты обучения:
- понятие металлической связи и металлической решетки;
- физические свойства металлов;
- роль металлов в уральском регионе, нахождение металлов в природе и значимость металлов в жизни человека;
- Давать общую характеристику металлов как элемента по положению в периодической системе и строению атома;
- Объяснять физические свойства металлов исходя из строения металлической кристаллической решетки.
Оборудование: презентация, наборы металлов (цинк, медь, алюминий), атласы с картой Свердловской области.
Ход урока
Сегодня мы приступаем к изучению нового раздела неорганической химии – химии металлов. (слайд 1)
М.В. Ломоносов также посвятил металлам вдохновенные строки:
«Металлы подают укрепление и красоту важнейшим вещам, в обществе потребным. Ими защищаемся от нападения неприятеля, ими утверждаются корабли и силою их связаны. Металлы отверзают недро земное к плодородию, служат нам в ловлении земных и морских животных для пропитания нашего…. И кратко сказать, ни едино художество, ни едино ремесло простое употребление металлов миновать не может». (слайд 2)
I. Актуализация знаний
- Что вы знаете о металлах?
- Что вы хотите узнать? (какими свойствами физическими обладают и от чего они зависят? Как на практике используются металлы?)
- Для чего вам это нужно знать? (слайд 3)
Ребята отвечают на вопросы учителя, формируются цели урока
Цели: (слайд 4)
- Выяснить особенности строения металлов
- Познакомиться с физическими свойствами металлов
- Выяснить, от чего зависят физические свойства
- Познакомиться, как связаны физические свойства и использование металлов
Чтобы ответить на эти вопросы мы должны с вами выполнить большую работу по изучению нового материала и приобретению знаний.
II. Изучение нового материала
О каких металлах идет речь:
К группе черных отношусь,
В тяжелой металлургии – главный.
Своею ролью я горжусь –
и в эритроцитах содержусь.
(железо)
Царем металлов меня считают
И благородным называют,
Пленяю я блестящей желтизной,
Ничто не сравнится с моей красотой
(золото)
Свободный – я красный,
В растворах солей – голубой,
В сельском хозяйстве я встречусь с тобой,
Мягко и быстро коваться могу.
Чтобы меня угадать,
Состав малахита и бронзы надо знать.
(медь)
С древних времён по средние века были известны только 7 металлов, которые соотносились с известными тогда планетами: Солнце – золото (Au), Юпитер – олово (Sn), луна – серебро (Ag), Марс – железо (Fe), Меркурий – ртуть (Hg), Сатурн – свинец (Pb), Венера – медь (Cu). (слайд 5)
Древние алхимики говорили: «Семь металлов создал свет по числу семи планет», – и полагали, что под влиянием лучей планет в недрах Земли и рождаются металлы. Само слово «металл», по-видимому, происходит от греческого «металлон», что означает «шахта», «копи».
Не зря в истории человечества выделяют века: медный, бронзовый, железный (слайд 6)
- почему именно в таком порядке?
- в каком веке мы живем?
- какие металлы добываются и перерабатываются на Урале? (слайд 7)
- по карте определите основные месторождения металлических руд и покажите их на карте
На Урале известны многочисленные месторождения высококачественных железных руд (горы Магнитная, Высокая, Благодать, Качканар), медных руд (Медногорск, Карабаш, Сибай, Гай), редких цветных металлов, золота, серебра, платины, лучших в стране бокситов, каменных и калийных солей (Соликамск, Березники, Берёзовское, Важенское, Ильецкое) (слайд 8)
Но металлы есть не только на нашей планете. Так на Луне обнаружено большое количество самородного железа. А где расположены металлы в периодической системе?
Пользуясь ПСХЭ, ответьте на вопрос:
Каких элементов больше: металлов или неметаллов?
Изобразите строение атома:
- группа – литий
- группа – магний
- группа – алюминий
Каковы особенности строения атомов металлов? (слайд 9)
- На внешнем уровне 1–3 электрона – но почему полоний, висмут тоже металлы?
- Большие атомные радиусы. Какой способностью восстановительной или окислительной обладают атомы металлов?
- Легко отдают валентные электроны (восстановительная способность)
Как располагаются металлы в периодической системе? (слайд 10)
1 группа – щелочные металлы(слайд 11)
2 группа – щелочноземельные металлы, (слайд 12)
Как изменяются свойства металлов в ПС?
От чего зависят свойства металлов?
Металлическими называют решётки, в узлах которых находятся атомы и ионы металла, между ними свободные электроны. (Слайд 13)
Учитель: Итак, металл – это вид атомов, способных легко отдавать при химических реакциях электроны, входить в состав химических соединений в виде положительно заряженных ионов, а также образовывать простые вещества с характерными для металлов физическими свойствами. Рассмотрите образцы металлов (на столах пластинки трех металлов – медь, алюминий и цинк)
- в каком агрегатном состоянии находятся металлы?
1. Твердые (исключение ртуть – жидкий металл при комнатной температуре)
- найдите среди предложенных металлов медь. Считается, что металлический цвет – это серебристо – белый или серый. Но все ли металлы такого цвета? Назовите «цветные» металлы.
А алюминий и цинк можно отличить по цвету? А как отличим?
Пластичность – способность изменять свою форму при ударе, прокатываться в тонкие листы, вытягиваться в проволоку.
В чем причина пластичности металлов? В этом нам поможет разобраться следующий опыт: две стеклянные пластинки смачиваем водой и прижимаем друг к другу. Они легко скользят друг по другу, но их трудно разъединить. Прослойка воды имитирует свободные электроны, а значит причина пластичности – также особое строение кристаллической решетки.
Какие еще свойства присущи металлам? электропроводность, теплопроводность, металлический блеск, твердость.
Учитель: Как можно объяснить наличие общих физических свойств у такого большого числа разнообразных простых веществ?
Учащиеся делают вывод: причина в особенностях металлической связи, структуре кристаллов металлического типа.
Учитель: Действительно, электрическая проводимость металлов объясняется движением свободных электронов. Почему при нагревании электрическая проводимость металлов уменьшается? (стр. 30 учебника Габриеляна, 9 класс)
- в чем причина электропроводности металлов, какие металлы самые лучшие проводники тока, что такое сверхпроводимость? – отвечают на вопросы)
Чем обусловлена теплопроводность, и как она изменяется при нагревании? (стр30).
металлический блеск (из-за отражения света от их поверхности). (слайд 14)
Как блеск может применяться на практике?
Высокая отражающая способность позволяет использовать металлы при производстве зеркал, оптических линз, кровельных изделий. Алюминий используется для создания помех в радиолокации, для производства теплостойкой защитной одежды для пожарных.
Другие свойства (слайд 15)
плотность:
Как это свойство применяется на практике?
Многие лёгкие металлы используются для производства лёгких сплавов в машиностроении, авиа – и судостроении. Снижение массы машины даёт преимущества в скорости, дальности, высоте. Тяжёлые металлы для производства гирь, монет, решёток, цепей, тяжёлых машин.
температура плавления:
Тугоплавкие металлы используются для изготовления нитей накаливания электроламп, при производстве жаропрочных сталей.
Твердость
Твердые и мягкие
Ковкость (слайд 16), где используется?
Итак, какими физическими свойствами обладают металлы? (слайд 17) Почему?
III. Закрепление
– Поясните, почему металлы использованы именно таким образом, а не наоборот (слайд 18)
- какие металлы относят к черным, цветным, драгоценным?
- какие металлы самые распространенные на земле? (алюминий, железо, кальций)
IV. Подведение итогов
Презентация "Металлы".
презентация к уроку по химии (9 класс) по теме
Презентация по теме "Металлы" для 9 класса. Если вставить видеоопыты в презентацию, то получится красочный рассказ о металлах и их свойствах.
| Вложение | Размер |
|---|---|
| metally.ppt | 2.62 МБ |
Подтяните оценки и знания с репетитором Учи.ру
За лето ребенок растерял знания и нахватал плохих оценок? Не беда! Опытные педагоги помогут вспомнить забытое и лучше понять школьную программу. Переходите на сайт и записывайтесь на бесплатный вводный урок с репетитором.
Вводный урок бесплатно, онлайн, 30 минут
Предварительный просмотр:
Подписи к слайдам:
МЕТАЛЛЫ Химические и физические свойства металлов
Физические свойства металлов Очень важным свойством металлов является их сравнительно легкая механическая деформируемость. Металлы пластичны, они хорошо куются, вытягиваются в проволоку, прокатываются в листы и т.п.
Все металлы имеют характерный металлический блеск.
Частицы металлов, находящихся в твердом и жидком состоянии, связаны особым типом химической связи — так называемой металлической связью. Она определяется одновременным наличием обычных ковалентных связей между нейтральными атомами и кулоновским притяжением между ионами и свободными электронами. Таким образом, металлическая связь является свойством не отдельных частиц, а их агрегатов.
Металлическая связь и металлическая кристаллическая решетка атомы
Металлы черные цветные
Плотность и температура плавления некоторых металлов. Название Атомный вес Плотность, г/см3 Температура плавления, C Легкие металлы Литий 6,939 0,534 179 Калий 39,102 0,86 63,6 Натрий 22,9898 0,97 97,8 Тяжелые металлы Цинк 65,37 7,14 419 Хром 51,996 7,16 1875 Олово 118,69 7,28 231,9 Железо 55,847 7,86 1539 Медь 63,546 8,92 1083 Серебро 107,868 10,5 960,8 Ртуть 200,59 13,546 -38,87 Вольфрам 183,85 19,3 3380
Металлы легкие тяжелые ( плотность не более 5 г/см 3 ) ( плотность больше 5 г/см 3 )
Металлы мягкие твердые
Металлы легкоплавкие тугоплавкие ( t пл 1539 0 С )
Химические свойства металлов Основным химическим свойством металлов является способность их атомов легко отдавать свои валентные электроны и переходить в положительно заряженные ионы. Типичные металлы никогда не присоединяют электронов; их ионы всегда заряжены положительно.
1. Взаимодействие с неметаллами. Закончите уравнения химических реакций. Дайте названия образующимся веществам: Mg + O 2 Al + O 2 Cu + S K + CL 2 Ca + P Взаимодействие алюминия с бромом Разберите данную реакцию с т. з. окисления-восстановления
Взаимодействие железа с серой Разберите данную реакцию с т. з. окисления-восстановления.
А) . С активными металлами. Ме + Н 2 О щелочь+ Н 2 Б). С менее активными металлами при нагревании. Ме + Н 2 О оксид Ме + Н 2 t 0 2. Взаимодействие с водой. Взаимодействие калия с водой Zn + O 2 Разберите данную реакцию с т. з. окисления-восстановления.
3. Взаимодействие с кислотами. Металлы, стоящие в ряду активности до водорода, вытесняют его из кислот (исключение - азотная кислота и концентрированная серная кислота). Взаимодействие железа с разбавленной серной кислотой Запишите уравнение реакции и разберите её с т. з. окисления-восстановления.
4. Взаимодействие с солями. Взаимодействие железа с медным купоросом. Взаимодействие меди с нитратом ртути ( II ). Запишите уравнения реакций и разберите одну из них с т. з. окисления-восстановления.
Выводы: 1. Химические свойства металлов определяются строением их атомов и строением простого вещества металл. 2. При химических реакциях атомы металлов являются восстановителями, окисляясь при этом. 3. Активность металлов зависит: А) от числа валентных электронов – чем их меньше, тем металл активнее; Б) от удаленности валентных электронов от ядра – чем дальше, тем металл активнее.
Презентация по теме "Металлы" 9 класс
презентация к уроку по химии (9 класс)
Презентация по теме "Металлы". Данный материал использую на первых четырех уроках, при изучении следующих вопросов: Положение металлов в ПСХЭ, строение их атомов и физические свойства; Химические свойства и электрохимический ряд напряжения; Способы получения металлов, сплавы; Коррозия металлов
| Вложение | Размер |
|---|---|
| Презентация по теме "Металлы" | 158.5 КБ |
Металлы 9 класс
Проверка знаний Особенности строения атомов Ме. Где расположены Ме в ПС? Какие электроны называются свободными? Что такое Ме химическая связь? Назвать самый легкий и самый тяжелый Ме; самый легкоплавкий и тугоплавкий; самый мягкий и самый твердый Ме
Положение Ме в ПС ЭО r ат r ат е на внешнем уровне ЭО Ме неМе r ат r ат Ме – пе = Ме +п восстановители - число е на внешнем уровне от 1- 3 (у d элементов s и d электроны предвнешнего уровня) - значение ЭО от 0,7 – 1,9 Как в группе и периоде изменяются Ме свойства, а значит и восстановительные?
Физические свойства Общность свойств объясняется общим строением кристаллической решетки р.38, 39 - электро- и теплопроводность - ковкость и пластичность - плотность - твердость (мягкие – щелочные металлы) - t пл металлов (Н g – 38,9 W – 3390С) - металлический блеск - магнитные свойства ферромагнетики парамагнетики диамагнетики Fe Ni Co ЩМ ЩЗМ Cu Au Ag Bi
Классификация металлов по плотности по t плавления по основному Ме легкие тяжелые легкоплавкие тугоплавкие черные цветные P 5г/см 3 Li 5г/см 3 P 5г/см 3 Os =22.6 по химическим свойствам Благородные Ag Au Pt Os Химически активные ЩМ ЩЗМ Ca Sr Ba Редкоземельные Sc Y La Ac
Химические свойства С простыми веществами Ме 0 + неМе 0 = Ме +п неМе -п О 2 На l S N P активность уменьшается наиболее активные реагируют с Н гидриды 2.Со сложными веществами Взаимодействие с веществами Li K - - Mg - - Pb (H) Cu Hg Pt Au + H 2 O без нагревания Н 2 + МеОН при нагревании Н 2 + МеО не взаимодействуют + кислота При комнатной температуре Кислота +Ме = соль (раствор) +Н 2 Кислота +Ме = соль +Н 2 С концентрированными Не взаимодействуют + соли Ме стоящие левее вытесняют из солей Ме стоящие правее
Лабораторный опыт 12 С.72 Запишите в тетради название опыта Цель: познакомиться с химическими свойствами металлов Записать уравнение в молекулярном, ионном виде. Указать окислитель и восстановитель Написать вывод
Получение металлов Металлургия – отрасль занимающаяся производством Ме. Приводит природные соединения в форму доступную для обработки. - обжиг руд (Ме МеО) - растворение нерастворимых соединений(кислоты, сода) . Восстановителями являются: С Н 2 СО А l Mg ЩМ эл.ток
Пирометаллургия PbS + 3O 2 =2PbO + 3SO 2 PbO + H 2 = Pb + H 2 O (или С, СО) 3 TiCl 4 + 4Al = 3Ti + 4 AlCl 3 Гидрометаллургия CuO + H 2 SO 4 =CuSO 4 + H 2 O CuSO 4 + Fe = FeSO 4 + Cu ( для получения Cu Au Zn) Электрометаллургия 2 KCl 2 K + Cl 2 ( ЩМ, ЩЗМ, Al ) Микробиологический метод (бактерии переводят нерастворимые руды в растворимые) CuS CuSO 4
Лабораторный опыт 13 С.75 Запишите в тетради название опыта Цель: познакомиться с рудами металлов Записать наблюдение в таблицу из трех граф Написать вывод
Классификация сплавов по основному Ме по числу компонентов по структуре двойные (латунь, бронза) Тройные (серый чугун, мельхиор) Гомо- генные Гетеро- генные Черные (чугун, сталь) Цветные (бронза, дюралюминий) по физическим свойствам Коррозийно- устойчивые (сталь хромированная , никелевая) Тугоплавкие (никелин, констан) Жаропрочные (титан, вольфрам, молибден в сталях) Высоко- прочные Твердые (Мп сталь)
Проверка знаний Написать уравнения возможных реакций Ca + S = Al + O 2 = Na + H 2 O = Zn + O 2 = Cu + AgNO 3 = Na + Zn(NO 3 ) 2 = Fe + HCl = Ag + H 2 O = Cu + FeSO 4 = Zn + Pb(NO 3 ) 2 = Al + H 3 PO 4 = H 2 S + Mg =
Коррозия металлов ОВП при котором Ме выступают в качестве восстановителя, компоненты окружающей среды в качестве окислителя Виды химическая электрическая 2 Zn +O 2 =2ZnO оцинкованное Fe луженое Fe 2 Fe +3 Cl 2 =2 Fe Cl 3 Fe + Zn Fe + Sn Fe + O 2 + H 2 O= Fe(OH) 3 более активные Ме портятся быстрее Zn 0 -2e = Zn 2+ Fe 0 -2e = Fe 2+ 2H + + 2e = H 2 2H + + 2e = H 2 Fe 0 + 2H + = Fe 2+ + H 2
Домашнее задание П.10 зад.2,4 п.11 зад.2,5 п.12 в.3,4 новый уч. П.29 зад.4-6 п.36 зад.3-6
По теме: методические разработки, презентации и конспекты

Презентация к мастер-классу по теме «Продукты питания» в 3-м классе (УМК “Forward”)
Эта презентация была подготовлена для мастер-класса по объединённой теме «Продукты питания», которая изучалась в I полугодии 3-го класса, обучающегося по УМК “Forward”. Тема «Давайте напечём блины!» о.

Презентация к мастер-классу "Создание учебной презентации"
Наглядное сопровождение мастер-класса: типичные ошибки при создании презентаций. .

Презентация по теме "Класс Головоногие моллюски."7 класс
Презентация включает основные пункты изучения по данной теме .

Презентация по теме "Класс Млекопитающие" 7 класс
Презентация по теме "Класс Млекопитающие" 7 класс.
Презентация к мастер-классу по теме: Применение технологий развития критического мышления как способ реализации системно-деятельностного подхода на уроках литературы в старших классах. Прием «Фишбоун»
Презентация является методическим оснащение к мастер-классу, проводимому среди учителей литературы в рамках обмена педагогическим опытом.

Презентация к мастер-классу на тему "Метод визуализации, Постерная презентация"
Данная презентация является сопровождением к мастер-классу об одном из методов, который позволяет упростить процесс обучения на уроках русского языка и литературы.
Презентация к уроку "Класс Земноводные" 7 класс
Презентация посвещена теме "Класс Земноводные" 7 класс по учебнику "Биология. Животные" В.В. Латюшин, В.А. Шапкин.
Презентация урока по химии по теме "Общая характеристика металлов" 9 класс

Небольшие значения электроотрицательности ( от 0,7 до 1,9 ).
Некоторые химические элементы металлы обладают двойственными свойствами: Al, Zn, Fe… ( амфотерность ).
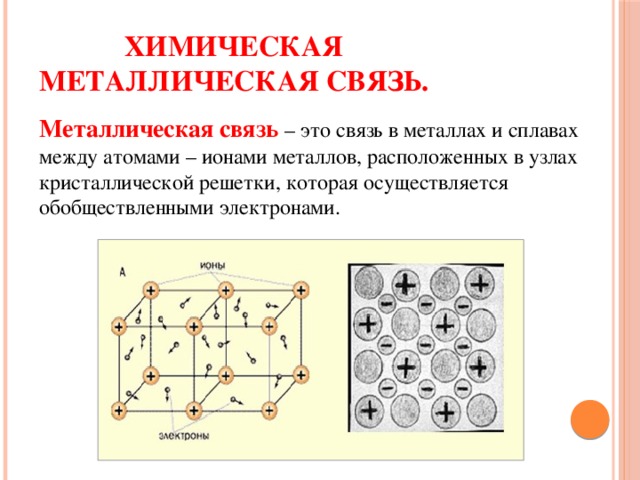
Химическая металлическая связь.
Металлическая связь – это связь в металлах и сплавах между атомами – ионами металлов, расположенных в узлах кристаллической решетки, которая осуществляется обобществленными электронами.

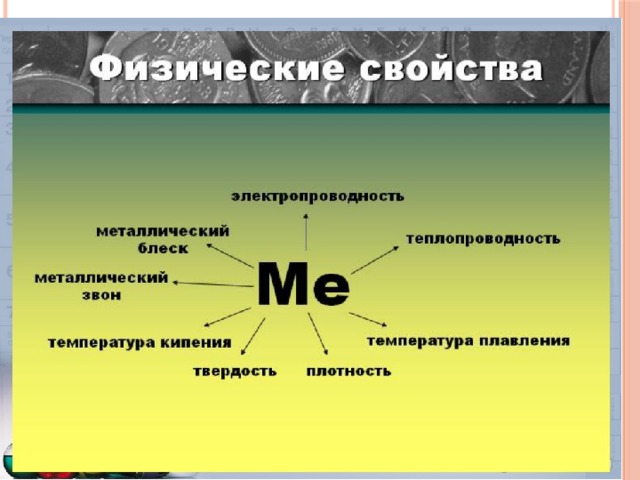
Металлы – простые вещества.
Все металлы обладают общими физическими свойствами:
Пластичность – смещение слоев ионов под внешним воздействием на кристалл относительно друг друга.
Металлический блеск – наличие свободных электронов.
Электро- и теплопроводность – обусловлена нахождением в кристалле хаотически движущихся электронов.

Химические свойства металлов
Взаимодействие металлов с галогенами
2Na + Cl 2 → 2NaCl
2Sb + 2Cl 2 → 2SbCl 3
2Fe + 3Cl 2 → 2FeCl 3
Взаимодействие металлов с водой
Взаимодействие металлов с серой
2К + 2H 2 O = 2КOH + H 2
2Са + Н 2 О → 2Сa(ОН)
o o +3 -2
2Al + 3S → Al 2 S 3
(Щелочные и щелочно-земельные металлы)
o +1 t o
3Fe + 4H 2 O → Fe 3 O 4 + 4H 2 ↑
(малоактивные)
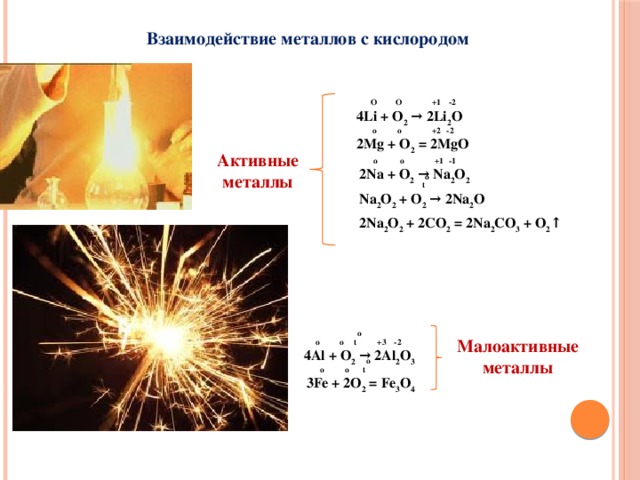
Взаимодействие металлов с кислородом
4Li + O 2 → 2Li 2 O
2Mg + O 2 = 2MgO
2Na + O 2 → Na 2 O 2
Na 2 O 2 + O 2 → 2Na 2 O
2Na 2 O 2 + 2CO 2 = 2Na 2 CO 3 + O 2 ↑
o o t o +3 -2
4Al + O 2 → 2Al 2 O 3
Малоактивные
o o t o
3Fe + 2O 2 = Fe 3 O 4

Взаимодействие металлов с кислотами
o +1 -1 +2 -1 o
Zn + 2HCl → ZnCl 2 + H 2
Zn + 2H → Zn + H 2
2CH 3 COOH + Zn → (CH 3 COO) 2 Zn + H 2
Zn + 2H → Zn + H 2 ↑
Взаимодействие металлов с солями
Fe + CuSO 4 → Cu↓ +FeSO 4
Fe + Cu → Cu + Fe
(окислительно-восстановительная реакция)
Cu + 2AgNO 3 → Cu(NO 3 ) 2 + 2Ag↓
Cu + 2Ag → Cu + Ag↓

1. Все металлы проявляют только восстановительные свойства
2. Атомы металлов легко отдают электроны внешнего (а некоторые – и предвнешнего) электронного слоя, превращаясь в положительные ионы.
3. Металлы имеют большой атомный радиус и малое число электронов (от 1 до 3) на внешнем слое.
Металлы: общая характеристика
Расположение
элементов – металлов
в ПСХЭ:
1 группа главная подгруппа – щелочные металлы
2 группа главная подгруппа – щелочно-земельные
металлы
3 группа главная подгруппа – все кроме бора
4 группа главная подгруппа – все кроме углерода и
кремния
5 группа главная подгруппа – сурьма и висмут
6 группа главная подгруппа – только полоний
Во всех побочных подгруппах – только металлы
НАХОЖДЕНИЕ В ПРИРОДЕ
Большая часть
металлов существует
в природе в виде
минеральных
образований - руд
Некоторые неактивные
металлы существуют в
виде самородков:
золото, серебро,
платина, медь
Металлы – это химические элементы,
атомы которых отдают электроны
внешнего ( предвнешнего)
электронного слоя, превращаясь в
положительные ионы (катионы).
o
2+
Fe – 2e → Fe
ГЛАВНЫЕ ОСОБЕННОСТИ
ЭЛЕМЕНТОВ МЕТАЛЛОВ.
Число валентных электронов (1-3 ).
Исключительно восстановительные свойства
( отдают свои электроны).
Сравнительно большие радиусы атомов.
Небольшие значения электроотрицательности (от 0,7 до 1,9).
Некоторые химические элементы металлы обладают
двойственными свойствами: Al, Zn, Fe… (амфотерность).
ХИМИЧЕСКАЯ
МЕТАЛЛИЧЕСКАЯ СВЯЗЬ.
Металлическая связь – это связь в металлах и сплавах
между атомами – ионами металлов, расположенных в узлах
кристаллической решетки, которая осуществляется
обобществленными электронами.
МЕТАЛЛЫ – ПРОСТЫЕ
ВЕЩЕСТВА.
Все металлы обладают общими физическими свойствами:
Пластичность – смещение слоев ионов под внешним
воздействием на кристалл относительно друг друга.
Металлический блеск – наличие свободных электронов.
Электро- и теплопроводность – обусловлена
нахождением в кристалле хаотически движущихся
электронов.
ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
Взаимодействие металлов с галогенами
o
o
+1
-1
2Na + Cl2 → 2NaCl
o
+3
-1
2Sb + 2Cl2 → 2SbCl3
o
o
+3 -1
2Fe + 3Cl2 → 2FeCl3
Взаимодействие
металлов с серой
Взаимодействие
металлов с водой
o
o
o
+2 -2
+1
+1
-1
o
2К + 2H2O = 2КOH + H2
Fe + S → FeS
o
o
o
+3 -2
2Al + 3S → Al2S3
+2
-1
2Са + Н 2О → 2Сa(ОН)
2
(Щелочные и щелочно-земельные металлы)
o
+1
t
o
3Fe + 4H2O → Fe3O4 + 4H2↑
(малоактивные)
Взаимодействие металлов с кислородом
O
O
+1 -2
o
o
+2 -2
4Li + O2 → 2Li2O
2Mg + O2 = 2MgO
Активные
металлы
o
o
+1 -1
2Na + O2 → oNa2O2
t
Na2O2 + O2 → 2Na2O
2Na2O2 + 2CO2 = 2Na2CO3 + O2↑
o
o
t
o
+3 -2
4Al + O2 →o2Al2O3
o
o
t
3Fe + 2O2 = Fe3O4
Малоактивные
металлы
Взаимодействие металлов с кислотами
o
+1 -1
+2 -1
o
Zn + 2HCl → ZnCl2 + H2
o
+
+2
o
Zn + 2H → Zn + H2
o
+
2+
2CH3COOH + Zn → (CH3COO)2Zn + H2
o
+
2+
o
o
Zn + 2H → Zn + H2↑
Взаимодействие металлов с солями
Fe + CuSO4 → Cu↓ +FeSO4
o
2+
o
2+
Fe + Cu → Cu + Fe
(окислительно-восстановительная реакция)
o
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag↓
o
+
2+
o
Cu + 2Ag → Cu + Ag↓
Химические свойства металлов
1. Все металлы проявляют только восстановительные
свойства
2. Атомы металлов легко отдают электроны внешнего (а
некоторые – и предвнешнего) электронного слоя,
превращаясь в положительные ионы.
3. Металлы имеют большой атомный радиус и малое число
электронов (от 1 до 3) на внешнем слое.
Исключение:
Ge, Sn, Pb ─ 4 электрона;
Sb, Bi ─ 5 электронов;
Po ─ 6 электронов.
Проверь себя:
Какие из соединений вступают
в реакцию с металлами:
H2SO4
О2
H 2O
CuSO4
K2O
BaSO4
S
Cr
Fe2O3
Читайте также:
