Хром металл химические свойства
Обновлено: 05.10.2024
Поверхностная оксидная пленка является причиной инертности хрома при обычной температуре, благодаря чему этот металл не подвергается атмосферной коррозии (в отличие от железа).
При нагревании хром проявляет свойства довольно активного металла, что соответствует его положению в электрохимическом ряду напряжений.
1. Взаимодействие с O2
Тонкоизмельченный хром интенсивно горит в токе кислорода. На воздухе реакция с O2 происходит лишь на поверхности металла.
При осторожном окислении амальгамированного хрома образуется низший оксид CrO.
2. Взаимодействие с другими неметаллами
(Сr не взаимодействует с Н2, но поглощает его в больших количествах)
CrCl3 и CrS - ионные соединения.
CrN и rxCy - ковалентные тугоплавкие инертные вещества, по твердости сравнимы с алмазом.
3. Взаимодействие с разбавленными растворами HCl и H2SO4
4. Действие концентрированных HNO3, H2SO4 и «царской водки» на хром.
Эти кислоты не растворяют хром при обычной температуре, они переводят его в «пассивное» состояние.
Пассивацию можно частично снять сильным нагреванием, после чего хром начинает очень медленно растворяться в кипящих конц. HNO3, H2SO4, «царской водке».
- смесь концентрированных HNO33 и НСl (1:3), растворяет золото и платиновые металлы (Pd,Os,Ru).
5. Вытеснение малоактивных Me из водных р-ров солей.
6. Взаимодействие с солями, разлагающимися с образованием кислорода.
Соединения Cr (II)
СrO - оксид хрома (II).
Твердое черное вещество, н. р. в Н2O.
Способы получения
1) медленное окисление хрома, растворенного в ртути
2) обезвоживание Сr(ОН)2 в восстановительной атмосфере:
Химические свойства
СrO - неустойчивое вещество, легко окисляется при небольшом нагревании до Сr2O3; при более высоких Т диспропорционирует:
СrO - типичный основный оксид, проявляет характерные для этого класса свойства. Реакции необходимо проводить в восстановительной среде.
Сr(OН)2 - гидроксид хрома (II)
твердое желтое вещество, н. р. в Н2O.
обменными реакциями из солей Сr 2+ :
Неустойчивое вещество, разлагается при нагревании; на воздухе быстро окисляется с образованием зеленого гидроксида хрома (III);
Соли Сr 2+
Наиболее важные: CrCl2, CrSO4, (СН3СОО)2Сr. Гидратированный ион Сr 2+ имеет бледно-голубую окраску.
Способы получения:
1. Сr + неметалл (S, Hal2)
2. Восстановление солей Сr 3+ :
1. Соли Сr 2+ - сильные восстановители, так как очень легко окисляются до солей Сr 3+
2. Раствор CrSO4 в разбавленной H2SO4 - превосходный поглотитель кислорода:
3. С аммиаком соли Сr 2+ образуют комплексные соли - аммиакаты:
Для Сr 2+ характерно образование двойных сульфатов, например: K2Cr(SO4)2• 6Н2O
Соединения Сr(III)
, важнейшее природное соединение хрома. Сr2О3, полученный химическими методами, представляет собой темно-зеленый порошок.
1. Синтез из простых веществ:
2. Термическое разложение гидроксида хрома (III) или дихромата аммония:
3. Восстановление дихроматов углеродом или серой:
Сr2O3 используется для изготовления краски «хромовая зеленая», обладающей термо- и влагоустойчивостью.
Сr2O3 - типичный амфотерный оксид
В порошкообразном виде реагирует с сильными кислотами и сильными щелочами, в кристаллическом виде - химически инертное вещество.
К наиболее практически важным реакциям относятся следующие:
1. Восстановление с целью получения металлического хрома:
2. Сплавление с оксидами и карбонатами активных металлов:
Образующиеся метахромиты являются производными метахромистой кислоты НСrO2.
3. Получение хлорида хрома (III):
Сr(ОН)3 - гидроксид хрома (III).
Образуется в виде синевато-серого осадка при действии щелочей на соли Сr 3+ :
Практически нерастворимый в воде гидроксид может существовать в виде коллоидных растворов.
В твердом состоянии гидроксид хрома (III) имеет переменный состав Сr2O3• nН2O. Теряя молекулу воды, Сr(ОН)3 превращается в метагидроксид СrО(ОН).
Сr(ОН)3 - амфотерный гидроксид, способный растворяться как в кислотах, так и в щелочах:
Сr(ОН)3 + ЗОН - = [Cr(OH)6] 3- гексагидроксохромитанион
При сплавлении с твердыми щелочами образуются метахромиты:
Соли Cr 3+ .
Растворением осадка Сr(ОН)3 в кислотах получают нитрат Cr(NO3)3, хлорид СrСl3, сульфат Cr2(SO4)3 и другие соли. В твердом состоянии чаще всего содержат в составе молекул кристаллизационную воду, от количества которой зависит окраска соли.
Самой распространенной является двойная соль КСr(SO4)2• 12H2O - хромокалиевые квасцы (сине-фиолетовые кристаллы).
Хромиты, или хроматы (III) - соли, содержащие Сr 3+ в составе аниона. Безводные хромиты получают сплавлением Сr2O3 с оксидами двухвалентных металлов:
В водных растворах хромиты существуют в виде гидроксокомплексов.
К наиболее характерным свойствам солей Cr(III) относятся следующие:
1. Осаждение катиона Сг 3+ под действием щелочей:
Характерный цвет осадка и его способность растворяться в избытке щелочи используется для отличия ионов Сг 3+ от других катионов.
2. Легкая гидролизуемость в водных растворах, обусловливающая сильнокислый характер среды:
Сr 3+ + Н2O = СrОН 2+ + Н +
Соли Сr (III) с анионами слабых и летучих кислот в водных растворах не существуют; так как подвергаются необратимому гидролизу, например:
3. Окислительно-восстановительная активность:
а) окислитель: соли Cr(III) → соли(VI)
см. «Получение солей Cr(VI)»
б) восстановительь: соли Cr(III) → соли(II)
см. «Получение солей Cr(II)»
4. Способность к образованию комплексных соединений - аммиакатов и аквакомплексов, например:
Соединения Cr(VI)
CrO3 - оксид хрома (VII) триоксид хрома, хромовый ангидрид.
Кристаллическое вещество темно-красного цвета, очень гигроскопичное, легко растворимое в воде. Основной способ получения:
СrО3 - кислотный оксид, активно взаимодействует с водой и щелочами, образуя хромовые кислоты и хроматы.
Хромовый ангидрид - чрезвычайно энергичный окислитель. Например, этанол воспламеняется при соприкосновении с СrO3:
Продуктом восстановления хромового ангидрида, как правило, является Сr2O3.
Хромовые кислоты - Н2СrO4, Н2Сr2O7.
При растворении CrO3 в воде образуются 2 кислоты:
Обе кислоты существуют только в водных растворах. Между ними устанавливается равновесие:
Обе кислоты очень сильные, по первой ступени диссоциированы практически полностью:
- соли, содержащие анионы хромовой кислоты CrO4 2- . Почти все имеют желтую окраску (реже - красную). В воде хорошо растворяются только хроматы щелочных металлов и аммония. Хроматы тяжелых металлов н. р. в Н2O. Наиболее распространены: Na2CrO4, К2CrO4, РЬCrO4 (желтый крон).
1. Сплавление CrO3 с основными оксидами, основаниями:
2. Окисление соединений Cr(III) в присутствии щелочей:
3. Сплавление Сr2O3 со щелочами в присутствии окислителя:
Хроматы существуют только в разбавленных щелочных растворах, которые имеют желтую окраску, характерную для анионов СrO4 2- . При подкислении раствора эти анионы превращаются в оранжевые дихромат-анионы:
2СrO4 2- + 2Н + = Сr2O7 2- + Н2O Это равновесие мгновенно сдвигается в ту или иную сторону при изменении рН растворов.
Хроматы - сильные окислители.
При нагревании хроматы тяжелых металлов разлагаются; например:
- соли, содержащие анионы дихромовой кислоты Сr2O7 2-
В отличие от монохроматов имеют оранжево-красную окраску и обладают значительно лучшей растворимостью в воде. Наиболее важные дихроматы - К2Сr2O7, Na2Cr2O7, (NH4)2Cr2O7.
Их получают из соответствующих хроматов под действием кислот, даже очень слабых, например:
Водные растворы дихроматов имеют кислую среду вследствие устанавливаемого равновесия с хроматанионами (см. выше). Окислительные свойства дихроматов наиболее сильно проявляются в подкисленных растворах:
При добавлении восстановителей к кислым растворам дихроматов окраска резко изменяется от оранжевой до зеленой, характерной для соединений Сг 3+ .
Примеры ОВР с участием дихроматов в качестве окислителей
Эта реакция используется для получения хромокалиееых квасцов KCr(SO4)2 • 12H2O
Хром — общая характеристика элемента, химические свойства хрома и его соединений
Хром — элемент побочной подгруппы 6-ой группы 4-го периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 24. Обозначается символом Cr (лат. Chromium). Простое вещество хром— твёрдый металл голубовато-белого цвета.

Химические свойства хрома
При обычных условиях хром реагирует только со фтором. При высоких температурах (выше 600°C) взаимодействует с кислородом, галогенами, азотом, кремнием, бором, серой, фосфором.
2Cr + N 2 – t° → 2CrN
В раскалённом состоянии реагирует с парами воды:
Хром растворяется в разбавленных сильных кислотах (HCl, H 2 SO 4 )
В отсутствии воздуха образуются соли Cr 2+ , а на воздухе – соли Cr 3+ .
Наличие защитной окисной плёнки на поверхности металла объясняет его пассив-ность по отношению к концентрированным растворам кислот – окислителей.
Соединения хрома
Оксид хрома (II) и гидроксид хрома (II) имеют основной характер.
Соединения хрома (II) — сильные восстановители; переходят в соединения хрома (III) под действием кислорода воздуха.
Оксид хрома ( III) Cr 2 O 3 – зелёный, нерастворимый в воде порошок. Может быть получен при прокаливании гидроксида хрома (III) или дихроматов калия и аммония:
Амфотерный оксид. При сплавлении Cr 2 O 3 со щелочами, содой и кислыми солями получаются соединения хрома со степенью окисления (+3):
При сплавлении со смесью щёлочи и окислителя получают соединения хрома в степени окисления (+6):
Гидроксид хрома (III) С r (ОН) 3 . Амфотерный гидроксид. Серо-зеленый, разлагается при нагревании, теряя воду и образуя зеленый метагидроксид СрО(ОН). Не растворяется в воде. Из раствора осаждается в виде серо-голубого и голубовато-зеленого гидрата. Реагирует с кислотами и щелочами, не взаимодействует с гидратом аммиака.
Обладает амфотерными свойствами — растворяется как в кислотах, так и в щелочах:
Cr(OH) 3 + KOH → KCrO 2 +2H 2 O Сr(ОН) 3 + МОН = МСrO 2(зел.) + 2Н 2 O (300—400 °С, М = Li, Na)
Сr(ОН) 3 →(120 o C – H 2 O ) СrO(ОН) →(430-1000 0 С – H 2 O ) Cr 2 O 3
Получение : осаждение гидратом аммиака из раствора солей хрома(Ш):
Сr 3+ + 3(NH 3 Н 2 O) = С r (ОН) 3 ↓ + ЗNН 4+
Cr 2 (SO 4 ) 3 + 6NaOH → 2Cr(OH) 3 ↓+ 3Na 2 SO 4 (в избытке щелочи — осадок растворяется)
Соли хрома (III) имеют фиолетовую или тёмно-зелёную окраску. По химическим свойствам напоминают бесцветные соли алюминия.
Соединения Cr (III) могут проявлять и окислительные, и восстановительные свойства:
Zn + 2Cr +3 Cl 3 → 2Cr +2 Cl 2 + ZnCl 2
2Cr +3 Cl 3 + 16NaOH + 3Br 2 → 6NaBr + 6NaCl + 8H 2 O + 2Na 2 Cr +6 O 4
Соединения шестивалентного хрома
Оксид хрома (VI) CrO 3 — ярко-красные кристаллы, растворимые в воде.
Получают из хромата (или дихромата) калия и H 2 SO 4 (конц.).
CrO 3 — кислотный оксид, со щелочами образует жёлтые хроматы CrO 4 2- :
В кислой среде хроматы превращаются в оранжевые дихроматы Cr 2 O 7 2- :
В щелочной среде эта реакция протекает в обратном направлении:
Дихромат калия – окислитель в кислой среде:
Хромат калия К 2 Cr О 4 . Оксосоль. Желтый, негигроскопичный. Плавится без разложения, термически устойчивый. Хорошо растворим в воде ( желтая окраска раствора отвечает иону СrO 4 2- ), незначительно гидролизуется по аниону. В кислотной среде переходит в К 2 Cr 2 O 7 . Окислитель (более слабый, чем К 2 Cr 2 O 7 ). Вступает в реакции ионного обмена.
Качественная реакция на ион CrO 4 2- — выпадение желтого осадка хромата бария, разлагающегося в сильнокислотной среде. Применяется как протрава при крашении тканей, дубитель кож, селективный окислитель, реактив в аналитической химии.
Уравнения важнейших реакций:
Получение : спекание хромита с поташом на воздухе:
Дихромат калия K 2 Cr 2 O 7 . Оксосоль. Техническое название хромпик . Оранжево-красный, негигроскопичный. Плавится без разложения, при дальнейшем нагревании разлагается. Хорошо растворим в воде ( оранжевая окраска раствора отвечает иону Сr 2 O 7 2- ). В щелочной среде образует К 2 CrO 4 . Типичный окислитель в растворе и при сплавлении. Вступает в реакции ионного обмена.
Качественные реакции — синее окрашивание эфирного раствора в присутствии Н 2 O 2 , синее окрашивание водного раствора при действии атомарного водорода.
Применяется как дубитель кож, протрава при крашении тканей, компонент пиротехнических составов, реагент в аналитической химии, ингибитор коррозии металлов, в смеси с Н 2 SO 4 (конц.) — для мытья химической посуды.
Получение: обработка К 2 СrO 4 серной кислотой:
Характеристика переходных элементов (меди, цинка, хрома, железа) по их положению в Периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов
Кодификатор ЕГЭ. Раздел 1.2.3. Характеристика переходных элементов (меди, цинка, хрома, железа) по их положению в Периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов.
У атомов переходных элементов (меди, цинка, хрома и железа) происходит заполнение энергетического d-подуровня.
Рассмотрим строение электронной оболочки этих элементов. У атомов цинка и железа заполнение электронной оболочки происходит согласно энергетическому ряду орбиталей (подуровней), который рассмотрен в статье Строение атома. Электронная конфигурация атома железа:
+26Fe [Ar]3d 6 4s 2 [Ar] 4sУ атома цинка на происходит полное заполнение 3d-подуровня:
+30Zn [Ar]3d 10 4s 2 [Ar] 4s
У атомов хрома и меди наблюдается « проскок» или « провал» электрона, когда один электрон переходит с более энергетически выгодного 4s-подуровня на менее выгодный 3d-подуровень. Этот переход обусловлен тем, что в результате образуются более устойчивые электронные конфигурации (3d 5 у атома хрома и 3d 10 у атома меди). Дело в том, что энергетически более выгодно, когда d-орбиталь заполнена наполовину или полностью.
Мы используем, конечно же, реальную электронную конфигурацию меди и хрома, теоретическая будет неверной.
Обратите внимание! У всех 3d-элементов внешним энергетическим уровнем считается четвертый уровень и 4s-подуровень. При образовании катионов атомы металлов отдают электроны с внешнего энергетического уровня.
| Атом | Электронная конфигурация | Характерные валентности | Число электронов на внешнем энергетическом уровне | Характерные степени окисления |
| Хром | [Ar]3d 5 4s 1 | II, III. VI | 1 | +2, +3, +6 |
| Железо | [Ar]3d 6 4s 2 | II, III. VI | 2 | +2, +3, +6 |
| Медь | [Ar]3d 10 4s 1 | I, II | 1 | +1, +2 |
| Цинк | [Ar]3d 10 4s 2 | II | 2 | +2 |
Рассмотрим характеристики хрома, железа, меди и цинка:
Свойства соединений железа, меди, цинка и хрома.
Для хрома характерны степени окисления +2, +3 и +6. Оксид и гидроксид хрома (II) (CrO и Cr(OH)2) проявляют основные свойства. Степени окисления +3 соответствуют амфотерные оксид и гидроксид: Cr2O3 и Cr(OH)3 соответственно. Соединения хрома +6 проявляют сильные кислотные свойства: оксид CrO3 и сразу две сильных кислоты: хромовая H2CrO4 и дихромовая H2Cr2O7. Соединения хрома (II) проявляют сильные восстановительные свойства, соединения хрома (VI) проявляют только сильные окислительные свойства.
Характерные степени окисления железа : +2 и +3. Оксид и гидроксид железа (II) — основные (FeO и Fe(OH)2), а соединения железа (III) проявляют амфотерные свойства (Cr2O3 и Cr(OH)3 соответственно) с преобладанием основных. Соединения железа (II) проявляют также восстановительные свойства.
Для меди характерны степени окисления +1 и +2. Оксид меди (I) CuO и гидроксид меди (I) CuOH — основные. Оксид и гидроксид меди (II) проявляют амфотерные свойства с преобладанием основных: CuO и Cu(OH)2.
Характерная степень окисления цинка +2. Соединения цинка (II) проявляют амфотерные свойства: ZnO и Zn(OH)2.
Хром, железо и медь
Твердый металл голубовато-белого цвета. Этимология слова "хром" берет начало от греч. χρῶμα — цвет, что связано с большим разнообразием цветов соединений хрома. Массовая доля этого элемента в земной коре составляет 0.02% по массе.

Для хрома характерны степени окисления +2, +3 и +6. У соединений, где хром принимает степень окисления +2, свойства основные, +3 - амфотерные, +6 - кислотные.

- Fe(CrO2)2 - хромистый железняк, хромит
- (Mg, Fe)Cr2O4 - магнохромит
- (Fe, Mg)(Cr, Al)2O4 - алюмохромит

В промышленности хром получают прокаливанием хромистого железняка с углеродом. Также применяют алюминотермию для вытеснения хрома из его оксида.
- Реакции с неметаллами
Уже на воздухе вступает в реакцию с кислородом: на поверхности металла образуется пленка из оксида хрома (III) - Cr2O3 - происходит пассивирование. Реагирует с неметаллами при нагревании.

Протекает в раскаленном состоянии.

С холодными концентрированными серной и азотной кислотой реакция не идет. Она начинается только при нагревании.
Хром способен вытеснить из солей металлы, стоящие в ряду напряжений правее него.
Соединения хрома (II)
Соединение хрома (II) носят основный характер. Оксид хрома (II) окисляется кислородом воздуха до более устойчивой формы - оксида хрома (III), реагирует с кислотами, кислотными оксидами.

Гидроксид хрома (II), как нерастворимый гидроксид, легко разлагается при нагревании на соответствующий оксид и воду, реагирует с кислотами, кислотными оксидами.

Соединения хрома (III)
Это наиболее устойчивые соединения, которые носят амфотерный характер. К ним относятся оксид хрома (III) гидроксид хрома (III).

Оксид хрома (III) реагирует как с щелочами, так и с кислотами. В реакциях с щелочами при нормальной температуре (в растворе) образуются комплексные соли, при прокаливании - смешанные оксиды. С кислотами оксид хрома (III) образует различные соли.
H2O + NaOH + Cr2O3 → Na3[Cr(OH)6] (в растворе, гексагидроксохромат натрия)
Cr2O3 + 2NaOH → (t°) 2NaCrO2 + H2O (прокаливание, хромит натрия)
Cr2O3 + HCl = CrCl3 + H2O (сохраняем степень окисления Cr +3 )

Оксид хрома (III) реагирует с более активными металлами (например, при алюминотермии).
При окислении соединение хрома (III) получают соединения хрома (VI) (в щелочной среде).
Соединения хрома (VI)
В этой степени окисления хром проявляет кислотные свойства. К ним относится оксид хрома (VI) - CrO3, и две кислоты, находящиеся в растворе в состоянии равновесия: хромовая - H2CrO4 и дихромовая кислоты - H2Cr2O7.
Принципиально важно помнить окраску хроматов и дихроматов (часто она бывает дана в заданиях в качестве подсказки). Хроматы окрашивают раствор в желтый цвет, а дихроматы - в оранжевый цвет.

Хроматы переходят в дихроматы с увеличением кислотности среды (часто в реакциях с кислотами). Цвет раствора меняется с желтого на оранжевый.
Если же оранжевому раствору дихромата прилить щелочь, то он сменит свой цвет на желтый - образуется хромат.
Разложение дихромата аммония выглядит очень эффектно и носит название "вулканчик" :)
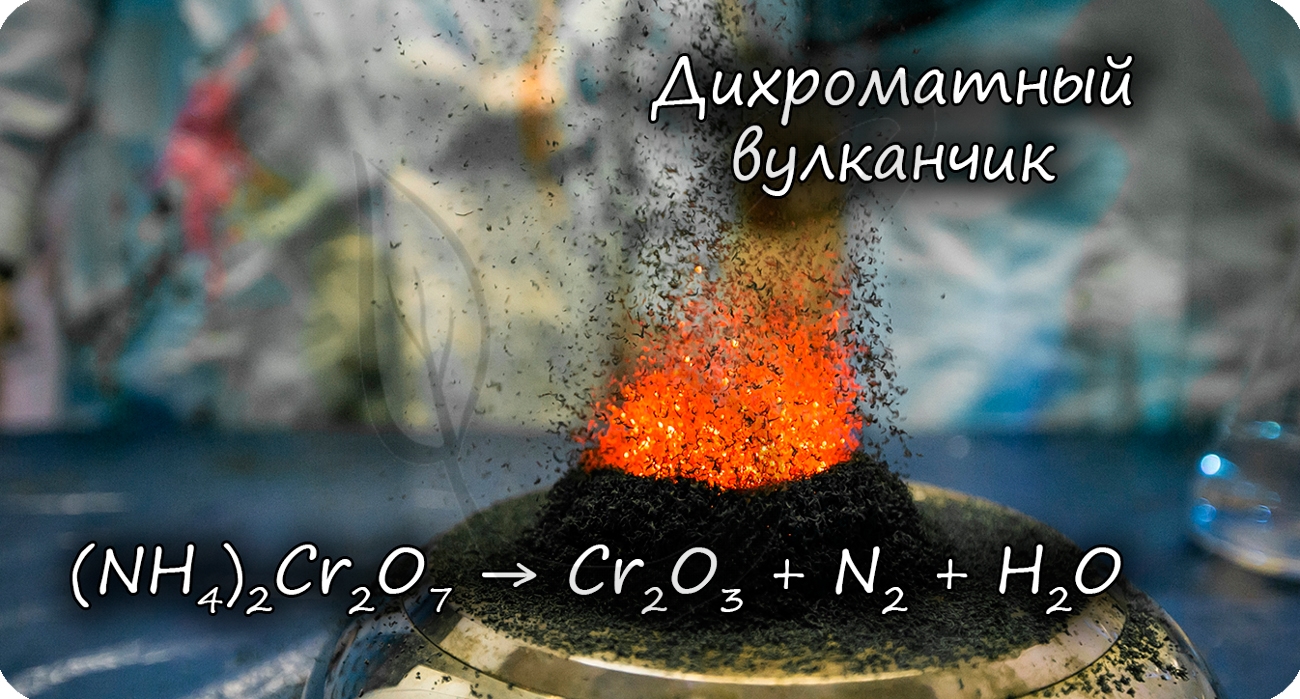
В степени окисления +6 соединения хрома проявляют выраженные окислительные свойства.
Железо
Является одним из самых распространенных элементов в земной коре (после алюминия), составляет 4,65% ее массы.

Для железа характерны две основные степени окисления +2, +3, +6.

- Fe2O3 - красный железняк, гематит
- Fe3O4 - магнитный железняк, магнетит
- Fe2O3*H2O - бурый железняк, лимонит
- FeS2 - пирит, серый или железный колчедан
- FeCO3 - сидерит

Получают железо восстановлением из его оксида - руды. Восстанавливают с помощью угарного газа, водорода.
Основными сплавами железа являются чугун и сталь. В стали содержание углерода менее 2%, меньше содержится P, Mn, Si, S. Чугун отличается бо́льшим содержанием углерода (2-6%), содержит больше P, Mn, Si, S.

Fe + S = FeS (t > 700°C)
Fe + S = FeS2 (t 2+ в растворе является реакция с красной кровяной солью - K3[Fe(CN)6] - гексацианоферратом (III) калия. В результате реакции образуется берлинская лазурь (прусский синий).
Качественной реакцией на ионы Fe 2+ также является взаимодействие с щелочью (гидроксидом натрия). В результате выпадает осадок зеленого цвета.
Соединения железа (III) проявляют амфотерные свойства. Оксид и гидроксид железа (III) реагирует и с кислотами, и с щелочами.
Fe(OH)3 + KOH = K3[Fe(OH)6] (гексагидроксоферрат калия)
При сплавлении комплексные соли не образуются из-за испарения воды.
Гидроксид железа (III) - ржавчина, образуется на воздухе в результате взаимодействия железа с водой в присутствии кислорода. При нагревании легко распадается на воду и соответствующий оксид.

Качественной реакцией на ионы Fe 3+ является взаимодействие с желтой кровяной солью K4[Fe(CN)6]. В результате реакции образуется берлинская лазурь (прусский синий).
Реакция хлорида железа (III) с роданидом калия также является качественной, в результате нее образуется характерный раствор ярко красного цвета.

И еще одна качественная реакция на ионы Fe 3+ - взаимодействие с щелочью (гидроксидом натрия). В результате выпадает осадок бурого цвета.
Соединения железа (VI) - ферраты - соли несуществующей в свободном виде железной кислоты. Обладают выраженными окислительными свойствами.
Ферраты можно получить в ходе электролизом щелочи на железном аноде, а также действием хлора на взвесь Fe(OH)3 в щелочи.

Один из первых металлов, освоенных человеком вследствие низкой температуры плавления и доступности получения руды.

Основные степени окисления меди +1, +2.

- CuFeS2 - медный колчедан, халькопирит
- Cu2S - халькозин
- Cu2CO3(OH)2 - малахит

Пирометаллургический метод получения основан на получении меди путем обжига халькопирита, который идет в несколько этапов.
Гидрометаллургический метод заключается в растворении минералов меди в разбавленной серной кислоте и дальнейшем вытеснении меди более активными металлами, например - железом.

Медь, как малоактивный металл, выделяется при электролизе солей в водном растворе на катоде.
CuSO4 + H2O = Cu + O2 + H2SO4 (медь - на катоде, кислород - на аноде)
Во влажном воздухе окисляется с образованием основного карбоната меди.
При нагревании реагирует с кислородом, селеном, серой, при комнатной температуре с: хлором, бромом и йодом.
4Cu + O2 = (t) 2Cu2O (при недостатке кислорода)
2Cu + O2 = (t) 2CuO (в избытке кислорода)

Медь способна реагировать с концентрированными серной и азотной кислотами. С разбавленной серной не реагирует, с разбавленной азотной - реакция идет.
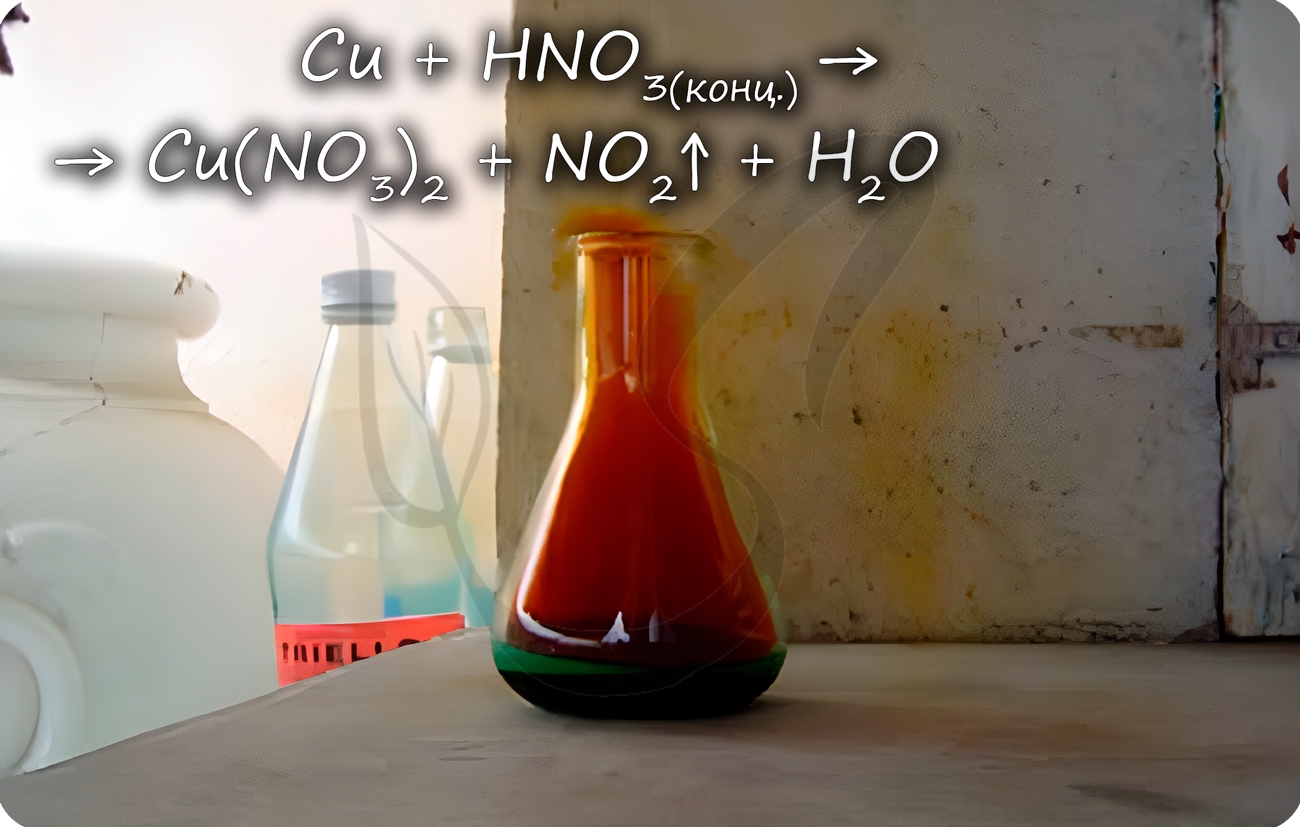
Реагирует с царской водкой - смесью соляной и азотной кислот в соотношении 1 объем HNO3 к 3 объемам HCl.
Медь способна восстанавливать неметаллы из их оксидов.
Cu + SO2 = (t) CuO + S
Cu + NO = (t) CuO + N2↑
Соединения меди I
В степени окисления +1 медь проявляет основные свойства. Соединения меди (I) можно получить путем восстановления соединений меди (II).
Оксид меди (I) можно восстановить до меди различными восстановителями: угарным газом, алюминием (алюминотермией), водородом.
Оксид меди (I) окисляется кислородом до оксида меди (II).
Оксид меди (I) вступает в реакции с кислотами.
Гидроксид меди CuOH неустойчив и быстро разлагается на соответствующий оксид и воду.
Соединения меди (II)
Степень окисления +2 является наиболее стабильной для меди. В этой степени окисления у меди есть оксид CuO и гидроксид Cu(OH)2. Данные соединения проявляют преимущественно основные свойства.
Оксид меди (II) получают в реакциях термического разложения гидроксида меди (II), реакцией избытка кислорода с медью при нагревании.
- Реакции с кислотами
CuO + CO = Cu + CO2
Гидроксид меди (II) - Cu(OH)2 - получают в реакциях обмена между растворимыми солями меди и щелочью.

При нагревании гидроксид меди (II), как нерастворимое основание, легко разлагается на соответствующий оксид и воду.
Как сказано выше, гидроксид меди (II) носит преимущественно основный характер, однако способен проявлять и амфотерные свойства. В растворе концентрированной щелочи он растворяется, образуя гидроксокомлпекс.
Обратите особое внимание на реакцию взаимодействия соли меди (II) - сульфата меди (II), карбоната натрия и воды.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Читайте также:
