Ia группа это группа металлов
Обновлено: 07.07.2024
Металлы IIA группы — очень активные! Если кинуть их в воду, то происходят мощные взрывы. Давайте познакомимся с этими металлами поближе.
Что особенного в элементах IIА группы
IIA группа называется главной подгруппой второй группы, в которую входят щелочноземельные металлы. К ним относятся всего 4 химических элемента: кальций Ca, стронций Sr, барий Ba и радий Ra. В отличие от щелочных металлов, они существенно более твердые, но всё также имеют серебристо-белый цвет.
Электронная конфигурация металлов IIA группы достаточно простая: эти элементы содержат два электрона на внешнем энергетическом уровне, и в основном состоянии имеют конфигурацию ns 2 .
Но так как для образования связей с другими элементами необходимо наличие валентных электронов, то металлам IIA группы необходимо распарить электроны. Таким образом они помещают каждый в свою «комнату» – в квантовую ячейку.
К чему же это все приводит? Атомы этих металлов переходят в возбужденное состояние и в составе сложных веществ приобретают электронную конфигурацию ns 1 np 1 .
В результате, появляются два неспаренных электрона, поэтому у металлов IIA группы постоянная валентность II и постоянная степень окисления +2.
| Какие из щелочноземельных металлов самые распространенные и самые редкие? В природе самым распространенным щелочноземельным металлом является кальций, содержание которого относительно массы земной коры оценивается до 13,3 %. Радиоактивный радий — самый редкий из всех щелочноземельных металлов, его содержание около 1⋅10 −10 %. |
Способ получения
Как и при получении щелочных металлов, основным способом получения щелочноземельных металлов, а также магния и бериллия является электролиз расплавов солей и гидроксидов:
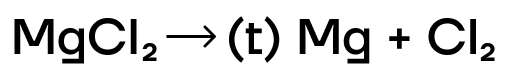
Подробнее об электролизе можно почитать в статье «Электролиз расплавов и растворов».
Химические свойства
- Как и для щелочных металлов, металлы IIA группы реагируют с простыми веществами.
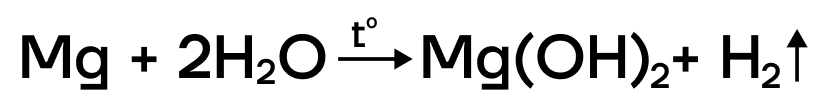
- Все щелочноземельные металлы взаимодействуют с холодной водой с образованием соответствующих гидроксидов. Магний же реагирует только с горячей водой:
- Щелочноземельные металлы в расплаве способны вытеснять менее активные металлы из их оксидов.
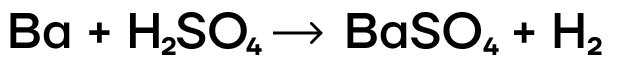
- Металлы IIA группы являются чуть менее активными, чем щелочные металлы, поэтому они могут реагировать с растворами кислот, при этом образуя соответствующие соли:
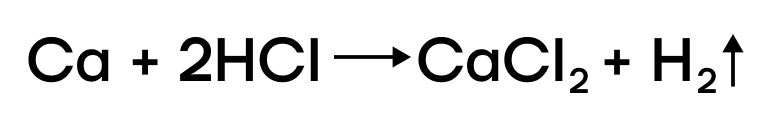
- Магний способен вытеснять металлы из растворов солей:
- Как и щелочные металлы, металлы IIA группы образуют ацетилениды (то есть карбиды, которые при гидролизе образуют ацетилен). Но магний, помимо ацетиленида, образует карбид особого строения:
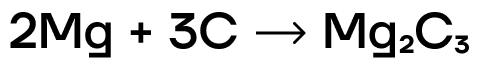

Думаю, ты не раз обнаруживал на дне чайника непонятные белые образования после кипячения воды. Это называется накипью.
Жесткость воды
Под жесткостью воды подразумевают совокупность свойств, зависящих от присутствия в ней преимущественно солей кальция и магния: гидрокарбонатов, сульфатов и хлоридов. При этом различают:
- постоянную жесткость, или некарбонатную, которая обусловлена присутствием сульфатов и хлоридов кальция и магния;
- временную жесткость,или карбонатную, которая обусловлена присутствием гидрокарбонатов кальция и магния.
Как можно устранить жесткость воды?
- Кипячение воды. При этом гидрокарбонаты будут разлагаться на соответствующие карбонаты, которые оседают на стенках чайника, например:

- Добавление карбоната натрия. Этим способом можно устранить и постоянную, и временную жесткость:
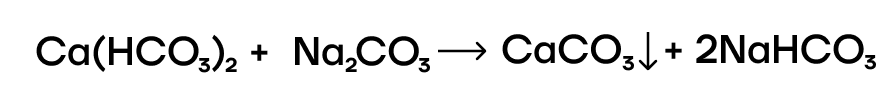
Как распознать катионы щелочноземельных металлов?

Фактчек
- Во IIA группу входят щелочноземельные металлы, а также бериллий и магний.
- У этих элементов постоянная валентность II, степень окисления +2.
- Для них характерны реакции с простыми веществами, водой, кислотами.
- Некоторые соли кальция и магния определяют жесткость воды.
Проверь себя
Задание 1.
Характерная степень окисления металлов IIA группы равна:
Задание 2.
Какой из металлов IIA группы реагирует с водой только при нагревании?
Задание 3.
Что образует кальций при взаимодействии его с кислородом?
- Оксид кальция;
- Пероксид кальция;
- Надпероксид кальция;
- Озонид кальция.
Задание 4.
Чем обусловлена временная жесткость воды?
- Присутствием хлоридов кальция и магния;
- Присутствием гидрокарбонатов кальция и магния;
- Присутствием сульфатов кальция и магния;
- Присутствием карбонатов кальция и магния.
ОТВЕТЫ: 1. — 2; 2. — 3; 3. — 1; 4. — 2.
1.2.2. Общая характеристика металлов IА–IIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов.
В IA группу (главная подгруппа первой группы) таблицы Менделеева входят металлы — литий Li, натрий Na, калий К, рубидий Rb, цезий Cs и франций Fr. Традиционно, данные элементы называют щелочными металлами (ЩМ), так как их простые вещества образуют при взаимодействии с водой едкие щелочи. Последний из известных представителей группы щелочных металлов (Fr) является радиоактивным элементом, в связи с чем его химические свойства изучены недостаточно: период полураспада его наиболее долгоживущего изотопа 223 Fr составляет всего лишь около 22 мин.
Электронные формулы, а также некоторые свойства щелочных металлов представлены в таблице ниже:
| Свойство | Li | Na | К | Rb | Cs | Fr |
| Заряд ядра Z | 3 | 11 | 19 | 37 | 55 | 87 |
| Электронная конфигурация в основном состоянии | [He]2s1 | [Ne]3s1 | [Аr]4s1 | [Kr]5s1 | [Хе]6s1 | [Rn]7s1 |
| Металлический радиус rмет, нм | 0,152 | 0,186 | 0,227 | 0,248 | 0,265 | 0,270 |
| Ионный радиус rион*, нм | 0,074 | 0,102 | 0,138 | 0,149 | 0,170 | 0,180 |
| Радиус гидратированного иона,rион , нм | 0,340 | 0,276 | 0,232 | 0,228 | 0,228 | — |
| Энергия ионизации, кДж/моль: I1 I2 | 520,2 7298 | 495,8 4562 | 418,8 3052 | 403,0 2633 | 375,7 2234 | (380) (2100) |
| Электроотрицательность | 0,98 | 0,93 | 0,82 | 0,82 | 0,79 | 0,70 |
При движении вниз по IA группе возрастает радиус атомов металлов (rмет), что, собственно, характерно для любых элементов всех главных подгрупп. Относительно малое увеличение радиуса при переходе от K к Rb и далее к Cs обусловлено заполнением 3d- и 4d-подуровней соответственно.
Ионные радиусы ЩМ существенно меньше металлических, что связано с потерей единственного валентного электрона. Они также закономерно возрастают от Li + к Cs + . Размеры же гидратированных катионов изменяются в противоположном направлении, что объясняется в рамках простейшей электростатической модели. Наименьший по размеру ион Li + лучше катионов остальных щелочных металлов притягивает к себе полярные молекулы воды, образуя наиболее толстую гидратную оболочку. Исследования показали, что в водном растворе катион лития Li + окружен 26 молекулами воды, из которых только 4 находятся в непосредственном контакте с ионом лития (первой координационной сфере). По этой причине многие соли лития, например, хлорид, перхлорат и сульфат, а также гидроксид выделяются из водных растворов в виде кристаллогидратов. Хлорид LiCl·Н2O теряет воду при температуре 95 °С, LiOH·Н2O — при 110°С, а LiClO4·Н2O — только при температуре выше 150°С. С увеличением ионного радиуса катиона щелочного металла сила его электростатического взаимодействия с молекулами воды ослабевает, что приводит к снижению толщины гидратной оболочки и, как следствие, радиуса гидратированного иона [М(Н2O)n] (где n = 17, 11, 10, 10 для М + = Na + , К + , Rb + , Cs + соответственно).
Внешний энергетический уровень атома ЩМ содержит один единственный электрон, который слабо связан с ядром, о чем говорят низкие значения энергии ионизации I1. Атомы щелочных металлов легко ионизируются с образованием катионов М + , входящих в состав практически всех химических соединений этих элементов. Значения I2 для всех щелочных металлов настолько высоки, что в реально осуществимых условиях ион М 2+ не образуется. Электроотрицательность щелочных элементов мала, их соединения с наиболее электроотрицательными элементами (хлор, кислород, азот)имеют ионное строение, как минимум в кристаллическом состоянии.
Маленький радиус иона Li + и высокая плотность заряда, являются причиной того, что соединения лития оказываются схожими по свойствам аналогичным соединениям магния (диагональное сходство) и в то же время отличаются от соединений остальных ЩМ.
Элементы IIA группы
В IIA группу Периодической системы элементов входят бериллий Ве, магний Мg и четыре щелочноземельных металла (ЩЗМ): кальций Са, стронций Sr, барий Ва и радий Ra, оксиды которых, раньше называемые «землями», при взаимодействии с водой образуют щелочи. Радий — радиоактивный элемент (α-распад, период полураспада примерно 1600 лет).
Электронная конфигурация и некоторые свойства элементов второй группы приведены в таблице ниже:
| Свойство | Be | Mg | Ca | Sr | Ba | Ra |
| Заряд ядра Z | 4 | 12 | 20 | 38 | 56 | 88 |
| Электронная конфигурация в основном состоянии | [He]2s 2 | [Ne]3s 2 | [Ar]4s 2 | [Kr]5s 2 | [Xe]6s 2 | [Rn]7s 2 |
| Металлический радиус rмет, нм | 0,112 | 0,160 | 0,197 | 0,215 | 0,217 | 0,223 |
| Ионный радиус rион*, нм | 0,027 | 0,72 | 0,100 | 0,126 | 0,142 | 0,148 |
| Энергия ионизации, кДж/моль: |
По электронному строению атомов элементы второй группы близки щелочным металлам. Они имеют конфигурацию благородного газа, дополненную двумя s-электронами на внешнем уровне. В то же время от элементов первой группы они отличаются более высокими значениями энергии ионизации, убывающими в ряду Ве—Мg—Са—Sr— Ва. Эта тенденция нарушается при переходе от бария к радию: повышениe П и І, для Rа по сравнению с Ва объясняется эффектом инертной 6s 2 -пары.
Следует отметить, что в то время как для щелочных металлов характерна значительная разница между I1 и I2 для элементов второй группы подобный скачок наблюдается между I2 и I3. Именно поэтому щелочные металлы в сложных веществах проявляют только степень окисления +1, а элементы второй группы +2. Наличие единственной положительной степени окисления и невозможность восстановления ионов M 2+ в водной среде придает большое сходство всем металлам s-блока.
Изменение свойств по группе следует общим закономерностям, рассмотренным на примере щелочных металлов. Элемент второго периода бериллий, подобно элементу первой группы литию, значительно отличается по своим свойствам от других элементов второй группы. Так, ион Be 2+ благодаря чрезвычайно малому ионному радиусу (0,027 нм), высокой плотности заряда, большим значениям энергий атомизации и ионизации оказывается устойчивым лишь в газовой фазе при высоких температурах. Поэтому химическая связь в бинарных соединениях бериллия даже с наиболее электроотрицательными элементами (кислород, фтором) обладает высокой долей ковалентности. Химия водных растворов бериллия также имеет свою специфику: в первой координационной сфере бериллия могут находиться лишь четыре лиганда ([Be(H2O)4] 2+ , (Bе(OH)4] — ), что связано с малым ионным радиусом металла и отсутствием d-орбиталей.
Щелочноземельные металлы (Са, Sr, Ва, Ra) образуют единое семейство элементов, в пределах которого некоторые свойства (энергия гидратации, растворимость и термическая устойчивость солей) меняются монотонно с увеличением ионного радиуса, а многие их соединения являются изоморфными.
Элементы IIIA группы
Элементы IIIA группы: бор В, алюминий Al, галлий Ga, индий In и таллий Tl — имеют мало стабильных изотопов, что характерно для атомов с нечетными порядковыми номерами. Электронная конфигурация внешнего энергетического уровня в основном состоянии ns 2 nр 1 характеризуется наличием одного неспаренного электрона. В возбужденном состоянии элементы IIIA группы содержат три неспаренных электрона, которые, находясь в sp 2 -гибридизации, принимают участие в образовании трех ковалентных связей. При этом у атомов остается одна незанятая орбиталь. Поэтому многие ковалентные соединения элементов IIIA группы являются акцепторами электронной пары (кислоты Льюиса), т.е. могут образовывать четвертую ковалентную связь по донорно-акцепторному механизму, создавая которую, они изменяют геометрию своего окружения — она из плоской становится тетраэдрической (состояние sp 3 -гибридизации). Бор сильно отличается по свойствам от других элементов IIIA группы. Он является единственным неметаллом, химически инертен и образует ковалентные связи со фтором, азотом, углеродом и т.д. Химия бора более близка химии кремния, в этом проявляется Диагональное сходство. У атомов алюминия и его тяжелых аналогов появляются вакантные d-орбитали, возрастает радиус атома. Галлий, индий и таллий расположены в Периодической системе сразу за металлами d-блока, поэтому их часто называют постпереходными элементами. Заполнение d-оболочки сопровождается последовательным сжатием атомов, в 3d-pяду оно оказывается настолько сильным, что нивелирует возрастание радиуса при появлении четвертого энергетического уровня. В результате d-сжатия ионные радиусы алюминия и галлия близки, а атомный радиус галлия даже меньше, чем алюминия.
Для таллия, свинца, висмута и полония наиболее устойчивы соединения со степенью окисления +1, +2, +3, +4 соответственно.
| Свойство | B | Al | Ga | In | Tl |
| Заряд ядра Z | 5 | 13 | 31 | 49 | 81 |
| Электронная конфигурация в основном состоянии | [He]2s 2 2p 1 | [Ne]3s 2 3p 1 | [Ar]3d 10 4s 2 4p 1 | [Kr]4d 10 5s 2 5p 1 | [Xe]4f 14 5d 10 6s 2 6p 1 |
| Атомный радиус, нм | 0,083 | 0,143 | 0,122 | 0,163 | 0,170 |
| Энергия ионизации, кДж/моль: I1 I2 I3 | 801 2427 3660 | 577 1817 2745 | 579 1979 2963 | 558 1821 2704 | 589 1971 2878 |
| Электроотрицательность | 2,04 | 1,61 | 1,81 | 1,78 | 2,04 |
Для соединений элементов IIIA группы наиболее характерна степень окисления +3. В ряду бор-алюминий-галлий-индий-таллий устойчивость таких соединений уменьшается, а устойчивость соединений со степенью окисления +1, напротив, увеличивается. Энергия связи М—Hal в галогенидах последних при переходе от легких к более тяжелым элементам М уменьшаются, амфотерные свойства оксидов и гидроксидов смещаются в сторону большей основности, склонность катионов к гидролизу (взаимодействию с водой) ослабевает.
Химия индия и особенно галлия вообще очень близка химии алюминия. Соединения этих металлов в низших степенях окисления (Ga2O, Ga2S, InCl и др.) в водных растворах диспропорционируют. Для таллия состояние +1, напротив, является наиболее устойчивым из-за инертности электронной пары 6s 2 .
2.2.2. Химические свойства металлов IIA группы.
IIA группа содержит только металлы – Be (бериллий), Mg (магний), Ca (кальций), Sr (стронций), Ba (барий) и Ra (радий). Химические свойства первого представителя этой группы — бериллия — наиболее сильно отличаются от химических свойств остальных элементов данной группы. Его химические свойства во многом даже более схожи с алюминием, чем с остальными металлами IIA группы (так называемое «диагональное сходство»). Магний же по химическим свойствами тоже заметно отличается от Ca, Sr, Ba и Ra, но все же имеет с ними намного больше сходных химических свойств, чем с бериллием. В связи со значительным сходством химических свойств кальция, стронция, бария и радия их объединяют в одно семейство, называемое щелочноземельными металлами.
Все элементы IIA группы относятся к s-элементам, т.е. содержат все свои валентные электроны на s-подуровне. Таким образом, электронная конфигурация внешнего электронного слоя всех химических элементов данной группы имеет вид ns 2 , где n – номер периода, в котором находится элемент.
Вследствие особенностей электронного строения металлов IIA группы, данные элементы, помимо нуля, способны иметь только одну единственную степень окисления, равную +2. Простые вещества, образованные элементами IIA группы, при участии в любых химических реакциях способны только окисляться, т.е. отдавать электроны:
Ме 0 – 2e — → Ме +2
Кальций, стронций, барий и радий обладают крайне высокой химической активностью. Простые вещества, образованные ими, являются очень сильными восстановителями. Также сильным восстановителем является магний. Восстановительная активность металлов подчиняется общим закономерностям периодического закона Д.И. Менделеева и увеличивается вниз по подгруппе.
Взаимодействие с простыми веществами
с кислородом
Без нагревания бериллий и магний не реагируют ни с кислородом воздуха, ни с чистым кислородом ввиду того, что покрыты тонкими защитными пленками, состоящими соответственно из оксидов BeO и MgO. Их хранение не требует каких-либо особых способов защиты от воздуха и влаги, в отличие от щелочноземельных металлов, которые хранят под слоем инертной по отношению к ним жидкости, чаще всего керосина.
Be, Mg, Ca, Sr при горении в кислороде образуют оксиды состава MeO, а Ba – смесь оксида бария (BaO) и пероксида бария (BaO2):
Следует отметить, что при горении щелочноземельных металлов и магния на воздухе побочно протекает также реакция этих металлов с азотом воздуха, в результате которой, помимо соединений металлов с кислородом, образуются также нитриды c общей формулой Me3N2.
с галогенами
Бериллий реагирует с галогенами только при высоких температурах, а остальные металлы IIA группы — уже при комнатной температуре:
с неметаллами IV–VI групп
Все металлы IIA группы реагируют при нагревании со всеми неметаллами IV–VI групп, но в зависимости от положения металла в группе, а также активности неметаллов требуется различная степень нагрева. Поскольку бериллий является среди всех металлов IIA группы наиболее химически инертным, при проведении его реакций с неметаллами требуется существенно большая температура.
Следует отметить, что при реакции металлов с углеродом могут образовываться карбиды разной природы. Различают карбиды, относящиеся к метанидам и условно считающимися производными метана, в котором все атомы водорода замещены на металл. Они так же, как и метан, содержат углерод в степени окисления -4, и при их гидролизе или взаимодействии с кислотами-неокислителями одним из продуктов является метан. Также существует другой тип карбидов – ацетилениды, которые содержат ион C2 2- , фактически являющийся фрагментом молекулы ацетилена. Карбиды типа ацетиленидов при гидролизе или взаимодействии с кислотами-неокислителями образуют ацетилен как один из продуктов реакции. То, какой тип карбида – метанид или ацетиленид — получится при взаимодействии того или иного металла с углеродом, зависит от размера катиона металла. С ионами металлов, обладающих малым значением радиуса, образуются, как правило, метаниды, с ионами более крупного размера – ацетилениды. В случае металлов второй группы метанид получается при взаимодействии бериллия с углеродом:
Остальные металлы II А группы образуют с углеродом ацетилениды:
С кремнием металлы IIA группы образуют силициды — соединения вида Me2Si, с азотом – нитриды (Me3N2), фосфором – фосфиды (Me3P2):
с водородом
Все щелочноземельные металлы реагируют при нагревании с водородом. Для того чтобы магний прореагировал с водородом, одного нагрева, как в случае со щелочноземельными металлами, недостаточно, требуется, помимо высокой температуры, также и повышенное давление водорода. Бериллий не реагирует с водородом ни при каких условиях.
Взаимодействие со сложными веществами
с водой
Все щелочноземельные металлы активно реагируют с водой с образованием щелочей (растворимых гидроксидов металлов) и водорода. Магний реагирует с водой лишь при кипячении вследствие того, что при нагревании в воде растворяется защитная оксидная пленка MgO. В случае бериллия защитная оксидная пленка очень стойкая: с ним вода не реагирует ни при кипячении, ни даже при температуре красного каления:
c кислотами-неокислителями
Все металлы главной подгруппы II группы реагируют с кислотами-неокислителями, поскольку находятся в ряду активности левее водорода. При этом образуются соль соответствующей кислоты и водород. Примеры реакций:
c кислотами-окислителями
− разбавленной азотной кислотой
С разбавленной азотной кислотой реагируют все металлы IIA группы. При этом продуктами восстановления вместо водорода (как в случае кислот-неокислителей) являются оксиды азота, преимущественно оксид азота (I) (N2O), а в случае сильно разбавленной азотной кислоты – нитрат аммония (NH4NO3):
− концентрированной азотной кислотой
Концентрированная азотная кислота при обычной (или низкой) температуре пассивирует бериллий, т.е. в реакцию с ним не вступает. При кипячении реакция возможна и протекает преимущественно в соответствии с уравнением:
Магний и щелочноземельные металлы реагируют с концентрированной азотной кислотой с образованием большого спектра различных продуктов восстановления азота.
− концентрированной серной кислотой
Бериллий пассивируется концентрированной серной кислотой, т.е. не реагирует с ней в обычных условиях, однако реакция протекает при кипячении и приводит к образованию сульфата бериллия, диоксида серы и воды:
Барий также пассивируется концентрированной серной кислотой вследствие образования нерастворимого сульфата бария, но реагирует с ней при нагревании, сульфат бария растворяется при нагревании в концентрированной серной кислоте благодаря его превращению в гидросульфат бария.
Остальные металлы главной IIA группы реагируют с концентрированной серной кислотой при любых условиях, в том числе на холоду. Восстановление серы происходит преимущественно до сероводорода:
с щелочами
Магний и щелочноземельные металлы со щелочами не взаимодействуют, а бериллий легко реагирует как растворами щелочей, так и с безводными щелочами при сплавлении. При этом при осуществлении реакции в водном растворе в реакции участвует также и вода, а продуктами являются тетрагидроксобериллаты щелочных или щелочноземельных металлов и газообразный водород:
При осуществлении реакции с твердой щелочью при сплавлении образуются бериллаты щелочных или щелочноземельных металлов и водород
с оксидами
Щелочноземельные металлы, а также магний могут восстанавливать менее активные металлы и некоторые неметаллы из их оксидов при нагревании, например:
Метод восстановления металлов из их оксидов магнием называют магниетермией.
Общая характеристика металлов IА–IIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов
Атомы элементов IА–IIIА групп имеют сходство в строении электронных оболочек и закономерностях изменения свойств, что приводит к некоторому сходству их химических свойств и свойств их соединений.
Металлы IA (первой группы главной подгруппы) также называются «щелочные металлы«. К ним относятся литий, натрий, калий, рубидий, цезий. Франций – радиоактивный элемент, в природе практически не встречается. У всех металлов IA группы на внешнем энергетическом уровне, на s-подуровне в основном состоянии есть один неспаренный электрон:
… ns 1 — электронное строение внешнего энергетического уровня щелочных металлов
Металлы IA группы — s-элементы. В химических реакциях они отдают один валентный электрон, поэтому для них характерна постоянная степень окисления +1.
Рассмотрим характеристики элементов IA группы:
Все щелочные металлы — сильные восстановители. Это самые активные металлы, которые могут непосредственно взаимодействовать с неметаллами. С ростом порядкового номера и уменьшением энергии ионизации металлические свойства элементов усиливаются. Щелочные металлы образуют с кислородом оксиды Э2О. Оксиды щелочных металлов реагируют с водой с образованием основания (щелочи):
Водородные соединения щелочных металлов — это гидриды с общей формулой ЭН. Степень окисления водорода в гидридах равна -1.
Металлы IIA (второй группы главной подгруппы) — щелочноземельные. Раньше к щелочноземельным металлам относили только кальций, стронций, барий и радий, но по решению ИЮПАК бериллий и магний также называются щелочноземельными.
У щелочноземельных металлов на внешнем энергетическом уровне расположены два электрона. В основном состоянии это два спаренных электрона на s-подуровне:
… ns 2 — электронное строение внешнего энергетического уровня элементов IIA группы
Щелочноземельные металлы — s-элементы. Отдавая два валентных электрона, они проявляют постоянную степень окисления +2. Все элементы подгруппы бериллия — сильные восстановители, но восстановительные свойства выражены слабее, чем у щелочных металлов.
Характеристики элементов IIA группы:
Металлы подгруппы бериллия довольно активны. На воздухе они легко окисляются, образуя основные оксиды с общей формулой ЭО. Этим оксидам соответствуют гидроксиды Э(ОН)2.
Первый элемент IIA группы, бериллий, по большинству свойств гораздо ближе к алюминию (диагональное сходство). Это проявляется в свойствах бериллия. Например, он не взаимодействует с водой. Магний взаимодействует с водой только при нагревании. Кальций, стронций и барий — это типичные металлы. Они реагируют с водой при обычных условиях.
Элементам IIA группы соответствуют гидриды с общей формулой ЭН2.
Элементы IIIA (третьей группы главной подгруппы) — это бор, алюминий, галлий, индий, таллий и нихоний. В основном состоянии содержат на внешнем энергетическом уровне три электрона, которые распределены по s- и р-подуровням:
… ns 2 nр 1 — электронное строение внешнего энергетического уровня элементов IIIA группы
Все элементы подгруппы бора относятся к р-элементам. В химических соединениях проявляются степень окисления +3. Хотя для таллия более устойчивая степень окисления +1.
Металлические свойства у элементов подгруппы бора выражены слабее, чем у элементов IIA подгруппы. Элмент бор относится к неметаллам. Энергия ионизации атома у бора наибольшая среди элментов IIIA подгруппы. Алюминий относится к типичным металлам, но оксид и гидроксид алюминия проявляют амфотерные свойства. У таллия более сильно выражены металлические свойства, в степени окисления +1 он близок по свойствам к щелочным металлам. Наибольшее практическое значение среди элементов IIIA подгруппы имеет алюминий.
Металлы IA группы
Эти металлы — очень активные! Именно их кидают в ванны с водой, в результате чего происходят мощщные взрывы.
Щелочные металлы
IA группа называется главной подгруппой первой группы, в которую входят щелочные металлы: литий Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr.
Щелочные металлы — серебристо-белые металлы с высокой электро- и теплопроводностью, обладают ковкостью, пластичностью и металлическим блеском.
Главная особенность строения атомов химических элементов IA группы заключается в том, что они содержат один электрон на внешнем энергетическом уровне — их электронная конфигурация ns 1 .
Из этого следует, что атомам щелочных металлов энергетически выгодно отдать электрон и приобрести конфигурацию инертного газа, приобретая при этом степень окисления +1.
Основным способом получения таких металлов является электролиз расплавов солей.
Их химические свойства крайне логичны:
- как типичные металлы они будут вступать в реакции со своими противоположностями — неметаллами;
- как восстановители — реагировать с окислителями (в том числе восстанавливать металлы и неметаллы из их оксидов);
- как металлы, стоящие в ряду активности до водорода — вступать в реакции вытеснения с водой, кислотами-неокислителями и солями менее активных металлов.
- Реакции с неметаллами
Как типичные восстановители, щелочные металлы могут взаимодействовать со своими противоположностями — неметаллами.
| Гидриды металлов подвергаются необратимому гидролизу |
В реакциях с щелочными металлами кислород образует ряд веществ:
- литий («кандидат от народа»), как и подавляющее большинство металлов, образует оксид;
4Li + O2 = 2Li2O - натрий образует пероксид;
2Na + O2 = Na2O2 - калий и все нижестоящие металлы — надпероксиды/супероксиды.
K + O2 = KO2
- Реакции с водой
В ряду активности щелочные металлы находятся до водорода, поэтому они способны вытеснять водород из воды:
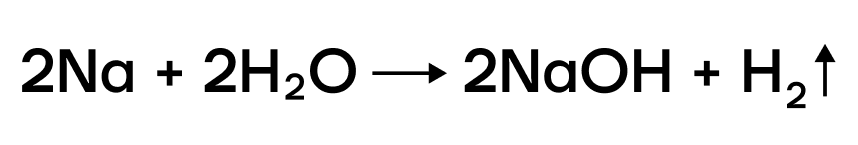
Можно представить воду как HOH, тогда металл (например, натрий) будет замещать один из атомов водорода с образованием NaOH.
За счет крайне низких значений электроотрицательности металлы очень слабо притягивают к себе электроны, а следовательно, у них «легко их украсть». Делаем вывод: в ОВР щелочные металлы проявляют ярко выраженные восстановительные свойства, повышая в реакциях степени окисления.
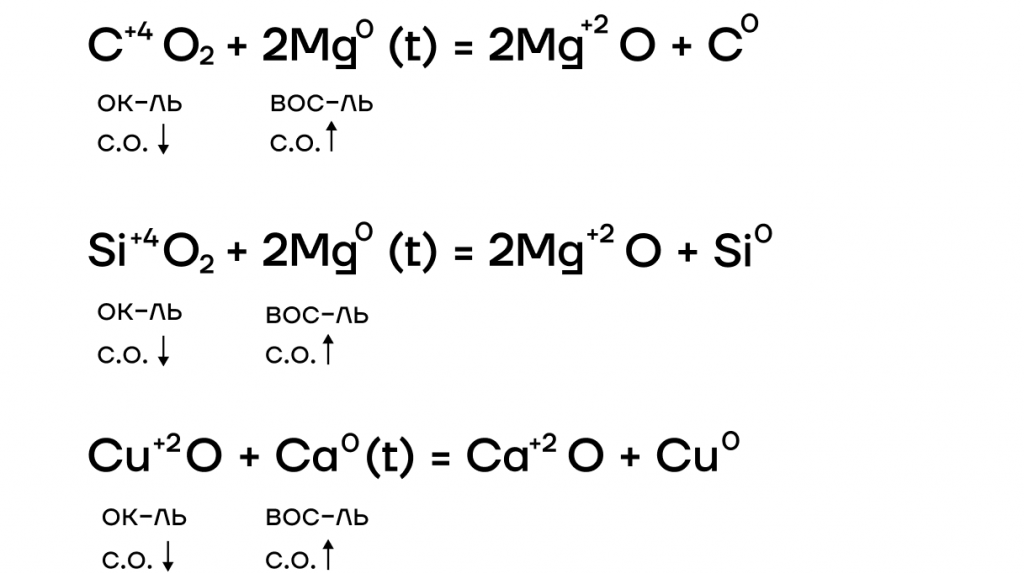
Оксиды щелочных металлов
По физическим свойствам это — бесцветные кристаллические вещества, хорошо растворимые в воде.
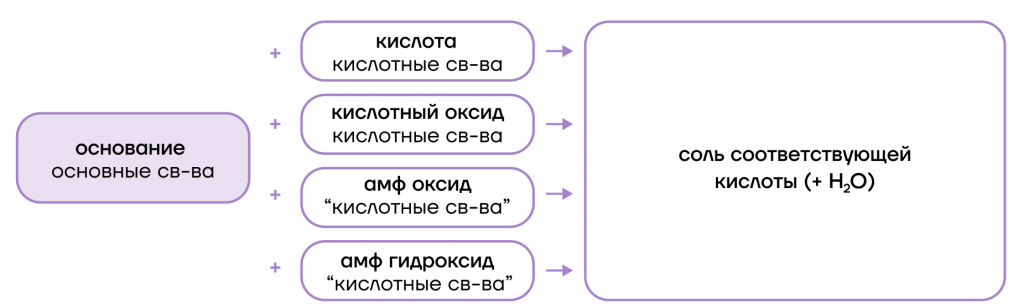
Они являются основными оксидами, поэтому:

- вступают в основно-кислотные взаимодействия со своими противоположностями, обладающими кислотными свойствами: кислотами, кислотными оксидами, амфотерными оксидами и гидроксидами:
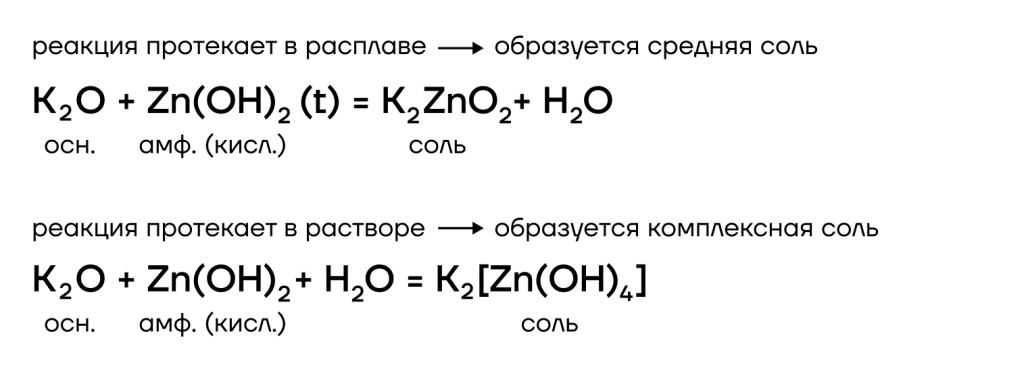
Гидроксиды щелочных металлов
Что же это такое? По-другому их называют щелочами. Они представляют собой бесцветные кристаллические вещества, хорошо растворимые в воде.
По химическим свойствам они являются типичными сильными основаниями, то есть:
- диссоциируют в растворах с образованием гидроксид-анионов. создавая в растворах щелочную среду:
- вступают в основно-кислотные взаимодействия со своими противоположностями (кислотами и кислотными оксидами + амфотерные оксиды и гидроксиды), образуя соли;
- вступают в реакции ионного обмена с кислотами и солями:
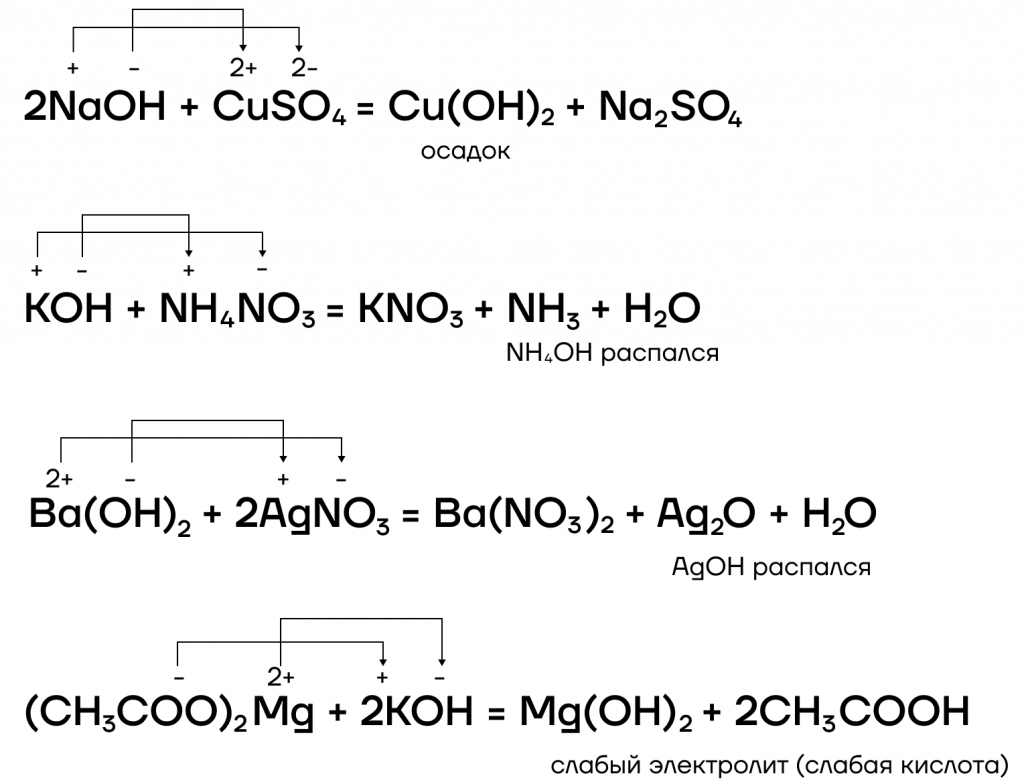
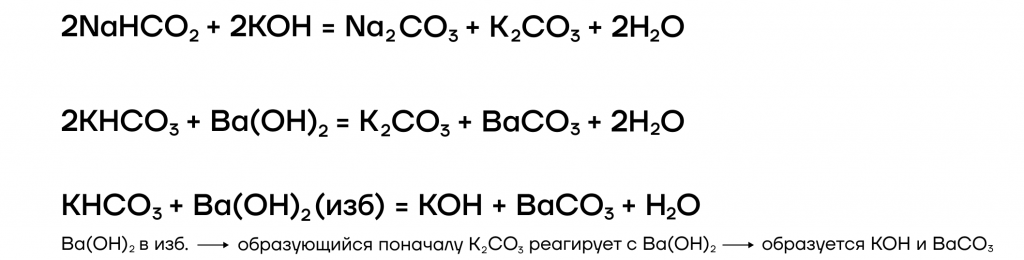
Какие же специфические свойства щелочей существуют? Рассмотрим некоторые из них:
- Окислительно-восстановительные реакции с металлами
Из металлов со щелочами напрямую взаимодействуют только амфотерные бериллий Be, цинк Zn, алюминий Al.
| Эти металлы можно запомнить по аббревиатуре BeZnAl |
А какие соли тогда будут образовываться? В растворе образуются комплексные соли, а в расплаве (t) — средние. В качестве еще одного продукта реакции выделяется газообразный водород.
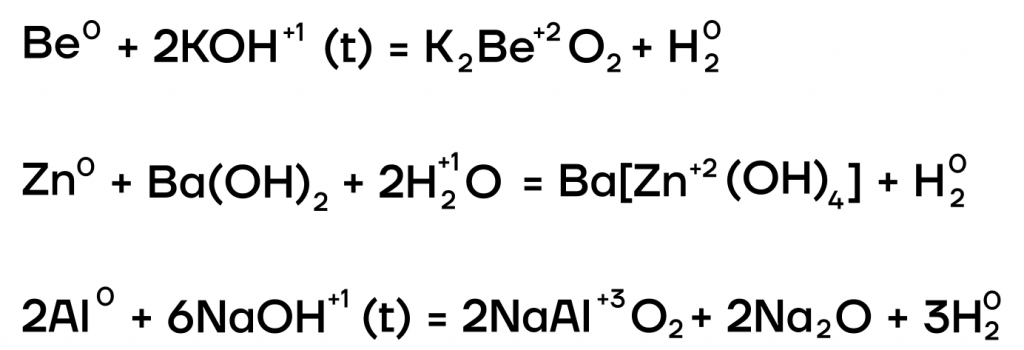
- Окислительно-восстановительные реакции с неметаллами
Неметаллы, которые могут реагировать со щелочами, можно запомнить по «крестообразному» расположению в таблице Менделеева:

Пероксиды щелочных металлов
Что же такое пероксиды? Пероксиды — сложные вещества, которые содержат группу —О—О—, где кислород имеет степень окисления −1.
- Металлы IA группы называются щелочными металлами, которые представлены литием, натрием, калием, рубидием, цезием и францием.
- Постоянная валентность щелочных металлов I, постоянная степень окисления — +1.
- Основной способ получения щелочных металлов — электролиз расплавов солей.
- Щелочные металлы — чрезвычайно активные металлы, могут реагировать с большим рядом простых веществ, с водой.
Задание 1.
Какой из щелочных металлов имеет самое большое число электронов?
Задание 2.
Щелочные металлы имеют постоянную степень окисления:
Задание 3.
Щелочные металлы образуют с серой соединения, называемые:
- Сульфиты;
- Сульфиды;
- Сульфаты;
- Сульфонаты.
Задание 4.
При реакции калия с кислородом образуется:
- Оксид калия;
- Пероксид калия;
- Супероксид калия;
- Озонид калия
Задание 5.
При внесении солей натрия в пламя оно приобретает окраску:
- Фиолетовую;
- Желтую;
- Небесно-голубую;
- Малиновую
Ответы: 1. — 6; 2. — 1; 3. — 2; 4. — 3; 5. — 2.
Читайте также:
