Инертные металлы в таблице менделеева
Обновлено: 08.07.2024
Содержание
Химические свойства
Инертные газы отличаются химической неактивностью (отсюда и название). Тем не менее, в 1962 году Нил Барлетт показал, что все они при определенных условиях могут образовывать соединения (особенно охотно со фтором). Наиболее «инертны» неон и гелий: чтобы заставить их вступить в реакцию, нужно применить много усилий, искусственно ионизируя каждый атом. Ксенон же, наоборот, слишком активен (для инертных газов) и реагирует даже при нормальных условиях, демонстрируя чуть ли не все возможные степени окисления (+1, +2, +4, +6, +8). Радон тоже имеет высокую химическую активность, но он сильно радиоактивен и быстро распадается, поэтому подробное изучение его химических свойств осложнено, в отличие от ксенона. Унуноктий, несмотря на его принадлежность к 18 группе периодической таблицы, может не являться инертным газом, так как предполагается, что при нормальных условиях в силу релятивистских эффектов он будет находиться в твердом состоянии [2] .
Физические свойства

Инертные газы бесцветны и не имеют запаха. В небольшом количестве они присутствуют в воздухе и некоторых горных породах, а также в атмосферах некоторых планет-гигантов.
Биологическое действие
Инертные газы не ядовиты. Однако атмосфера с увеличенной концентрацией инертных газов и соответствующим снижением концентрации кислорода может оказывать удушающее действие на человека, вплоть до потери сознания и смерти [3] [4] . Известны случаи гибели людей при утечках аргона.
Вдыхание радиоактивного радона может вызвать рак.
Инертные газы обладают биологическим действием, которое проявляется в их наркотическом воздействии на организм и по силе этого воздействия располагаются в следующем порядке (в сравнении приведены также азот и водород): Xe — Кr — Ar — N2 — H2 — Ne — He. При этом ксенон и криптон проявляют наркотический эффект при нормальном барометрическом давлении, аргон — при давлении свыше 0,2 МПа, азот — свыше 0,6 МПа, водород — свыше 2,0 МПа. Наркотическое действие неона и гелия в опытах не регистрируются, так как под давлением раньше возникают симптомы «нервного синдрома высокого давления» (НСВД) [5] .
Применение
Инертные газы имеют очень низкие точки кипения и плавления, что позволяет их использовать в качестве холодильного агента в криогенной технике. В частности, жидкий гелий, который кипит при 4,2 К (−268,95 °C; −452,11 °F), используется для магнитной сверхпроводимости, которая используется для магнитно-резонансной томографии и ядерного магнитного резонанса. Жидкий неон хотя и не достигает таких низких температур как жидкий гелий, также находит применение в криогенике, потому что у него охлаждающие свойства более чем в 40 раз выше, чем у жидкого гелия и более чем в три раза выше, чем у жидкого водорода.
Гелий используется как компонент дыхательного газа (дыхательной смеси) вместо азота, благодаря пониженной растворимости в жидкостях, особенно в липидах. Газы поглощаются кровью и биологическими тканями, когда они находятся под давлением, как например в подводном плавании, что является причиной эффекта, известного как азотное отравление. Благодаря меньшей растворимости, маленький гелий задерживается клеточной мембраной, и поэтому гелий используется в дыхательных смесях, таких как тримикс и гелиокс, уменьшая наркотический эффект газов, возникающий на глубине. Пониженная растворимость гелия даёт другие выгоды в условии, известном как декомпрессионная болезнь. Уменьшение остатка растворённого газа в теле означает, что меньшее количество газовых пузырьков образуется во время всплытия. Другой инертный газ, аргон, рассматривается как лучший выбор для использования в качестве прослойки к сухому костюму [6] для подводного плавания, а также в больших количествах используется для обработки жидкой стали.
После крушения дирижабля Гинденбург в 1937, гелий заменил водород в качестве поднимающего газа в дирижаблях и воздушных шарах благодаря лёгкости и невоспламеняемости, несмотря на 8,6 % уменьшение плавучести (buoyancy).
14 различных типов металлов

Термин "металл" происходит от греческого слова "metalléuō", что означает выкапываю или добываю из земли. Наша планета содержит много металла. На самом деле из 118 элементов периодической системы порядка 95 являются металлами.
Это число не является точным, потому что граница между металлами и неметаллами довольно расплывчата: нет стандартного определения металлоида, как нет и полного согласия относительно элементов, соответствующим образом классифицированных как таковые.
Сегодня мы используем различные виды металлов, даже не замечая их. Начиная с зажимов в сантехнике и заканчивая устройством, которое вы используете для чтения этой статьи, все они сделаны из определенных металлов. Фактически, некоторые металлические элементы необходимы для биологических функций, таких как приток кислорода и передача нервных импульсов. Некоторые из них также широко используются в медицине в виде антацидов.
Все металлы в периодической таблице можно классифицировать по их химическим или физическим свойствам. Ниже мы перечислили некоторые различные типы металлов вместе с их реальным применением.
Классификация по физическим свойствам
14. Легкие металлы

Сплав титана 6AL-4V
Примеры: Алюминий, титан, магний
Легкие металлы имеют относительно низкую плотность. Формального определения или критериев для идентификации этих металлов нет, но твердые элементы с плотностью ниже 5 г/см³ обычно считаются легкими металлами.
Металлургия легких металлов была впервые развита в середине 19 века. Хотя большинство из них происходит естественным путем, значительная их часть образуется при электротермии и электролизе плавленых солей.
Их сплавы широко используются в авиационной промышленности благодаря их низкой плотности и достаточным механическим свойствам. Например, сплав титана 6AL-4V составляет почти 50 процентов всех сплавов, используемых в авиастроении. Он используется для изготовления роторов, лопастей компрессоров, мотогондол, компонентов гидравлических систем.
13. Тяжелые металлы

Окисленные свинцовые конкреции и кубик размером 1 см3
Примеры: железо, медь, кобальт, галлий, олово, золото, платина.
Тяжелые металлы - это элементы с относительно высокой плотностью (обычно более 5 г/см³) и атомным весом. Они, как правило, менее реактивны и содержат гораздо меньше растворимых сульфидов и гидроксидов, чем более легкие металлы.
Эти металлы редки в земной коре, но они присутствуют в различных аспектах современной жизни. Они используются в солнечных батареях, сотовых телефонах, транспортных средствах, антисептиках и ускорителях частиц.
Тяжелые металлы часто смешиваются в окружающей среде из-за промышленной деятельности, ухудшая качество почвы, воды и воздуха, а затем вызывая проблемы со здоровьем у животных и растений. Выбросы транспортных средств, горнодобывающие и промышленные отходы, удобрения, свинцово-кислотные батареи и микропластики, плавающие в океанах, являются одними из наиболее распространенных источников тяжелых металлов в этом контексте.
12. Белый металл

Подшипники из белого металла
Примеры: Обычно изготавливается из олова, свинца, висмута, сурьмы, кадмия, цинка.
Белые металлы - это различные светлые сплавы, используемые в качестве основы для украшений или изделий из серебра. Например, многие сплавы на основе олова или свинца используются в ювелирных изделиях и подшипниках.
Белый металлический сплав изготавливается путем объединения определенных металлов в фиксированных пропорциях в соответствии с требованиями конечного продукта. Основной металл для ювелирных изделий, например, формуется, охлаждается, экстрагируется, а затем полируется, чтобы придать ему точную форму и блестящий вид.
Они также используются для изготовления тяжелых подшипников общего назначения, подшипников внутреннего сгорания среднего размера и электрических машин.
11. Хрупкий металл

Хрупкое разрушение чугуна
Примеры: сплавы углеродистой стали, чугуна и инструментальной стали.
Металл считается хрупким, если он твердый, но не может противостоять ударам или вибрации под нагрузкой. Такие металлы под воздействием напряжения ломаются без заметной пластической деформации. Они имеют низкую прочность на разрыв и часто издают щелкающий звук при поломке.
Многие стальные сплавы становятся хрупкими при низких температурах, в зависимости от их обработки и состава. Чугун, например, твердый, но хрупкий из-за высокого содержания углерода. Напротив, керамика и стекло гораздо более хрупки, чем металлы, из-за их ионных связей.
Галлий, висмут, хром, марганец и бериллий также хрупки. Они часто используются в различных гражданских и военных целях, связанных с высокими деформационными нагрузками. Чугун, устойчивый к повреждениям в результате окисления, используется в машинах, трубах и деталях автомобильной промышленности, таких как корпуса коробок передач и головки цилиндров.
10. Тугоплавкий металл
Микроскопическое изображение вольфрамовой нити в лампе накаливания
Примеры: молибден, вольфрам, тантал, рений, ниобий.
Тугоплавкие металлы имеют чрезвычайно высокие температуры плавления (более 2000 °С) и устойчивы к износу, деформации и коррозии. Они являются хорошими проводниками тепла и электричества и имеют высокую плотность.
Другой ключевой характеристикой является их термостойкость: они не расширяются и не растрескиваются при многократном нагревании и охлаждении. Однако они могут деформироваться при высоких нагрузках и окисляться при высоких температурах.
Благодаря своей прочности и твердости они идеально подходят для сверления и резки. Карбиды и сплавы тугоплавких металлов используются почти во всех отраслях промышленности, включая горнодобывающую, автомобильную, аэрокосмическую, химическую и ядерную.
Металлический вольфрам, например, используется в ламповых нитях. Сплавы рения используются в гироскопах и ядерных реакторах. А ниобиевые сплавы используются для форсунок жидкостных ракетных двигателей.
9. Черные и цветные металлы

Валы-шестерни из (черной) нержавеющей стали
Черные металлы: Сталь, чугун, сплавы железа.
Цветные металлы: Медь, алюминий, свинец, цинк, серебро, золото.
Термин "железо" происходит от латинского слова "Ferrum", что переводится как "железо". Таким образом, термин "черный металл" обычно означает "содержащий железо", тогда как "цветной металл" означает металлы и сплавы, которые не содержат достаточного количества железа.
Поскольку черные металлы могут иметь широкий спектр легирующих элементов, которые значительно изменяют их характеристики, очень трудно поместить свойства всех черных металлов под один зонт. Тем не менее некоторые обобщения могут быть сделаны, например, большинство черных металлов являются твердыми и магнитными.
Черные металлы используются для применения с высокой нагрузкой и низкой скоростью, в то время как цветные металлы предпочтительны для применения с высокой скоростью и нулевой нагрузкой для применения с низкой нагрузкой.
Сталь является наиболее распространенным черным металлом. Она составляет около 80% всего металлического материала благодаря своей доступности, высокой прочности, низкой стоимости, простоте изготовления и широкому спектру свойств. Она широко используется в строительстве и обрабатывающей промышленности. Фактически, рост производства стали показывает общее развитие промышленного мира.
8. Цветные и благородные металлы

Ассортимент благородных металлов
Цветные металлы: медь, алюминий, олово, никель, цинк
Благородные металлы: родий, ртуть, серебро, рутений, осмий, иридий
Цветные металлы - это обычные и недорогие металлы, которые корродируют, окисляются или тускнеют быстрее, чем другие металлы, когда подвергаются воздействию воздуха или влаги. Они в изобилии встречаются в природе и легко добываются.
Они широко используются в промышленных и коммерческих целях и имеют неоценимое значение для мировой экономики благодаря своей полезности и повсеместности. Некоторые цветные металлы обладают отличительными характеристиками, которые не могут быть продублированы другими металлами. Например, цинк используется для гальванизации стали, чтобы защитить ее от коррозии, а никель - для изготовления нержавеющей стали.
Благородные металлы, с другой стороны, устойчивы к окислению и коррозии во влажном воздухе. Согласно атомной физике, благородные металлы имеют заполненный электрон d-диапазона. В соответствии с этим строгим определением, медь, серебро и золото являются благородными металлами.
Они находят применение в таких областях, как орнамент, металлургия и высокие технологии. Их точное использование варьируется от одного элемента к другому. Некоторые благородные металлы, такие как родий, используются в качестве катализаторов в химической и автомобильной промышленности.
7. Драгоценные металлы

Родий: 1 грамм порошка, 1 грамм прессованного цилиндра и 1 г аргонодуговой переплавленной гранулы
Примеры: палладий, золото, платина, серебро, родий.
Драгоценные металлы считаются редкими и имеют высокую экономическую ценность. Химически они менее реакционноспособны, чем большинство элементов (включая благородные металлы). Они также пластичны и имеют высокий блеск.
Несколько веков назад эти металлы использовались в качестве валюты. Но сейчас они в основном рассматриваются как промышленные товары и инвестиции. Многие инвесторы покупают драгоценные металлы (в основном золото), чтобы диверсифицировать свои портфели или победить инфляцию.
Серебро - второй по популярности драгоценный металл для ювелирных изделий (после золота). Однако его значение выходит далеко за рамки красоты. Оно обладает исключительно высокой тепло- и электропроводностью и чрезвычайно низким контактным сопротивлением. Именно поэтому серебро широко используется в электронике, батареях и противомикробных препаратах.
Классификация по химическим свойствам
6. Щелочные металлы

Твердый металлический натрий
Примеры: натрий, калий, рубидий, литий, цезий и франций.
Щелочь относится к основной природе гидроксидов металлов. Когда эти металлы реагируют с водой, они образуют сильные основания, которые легко нейтрализуют кислоты.
Они настолько реактивны, что обычно встречаются в природе в слиянии с другими веществами. Карналлит (хлорид калия-магния) и сильвин (хлорид калия), например, растворимы в воде и, таким образом, легко извлекаются и очищаются. Нерастворимые в воде щелочи, такие, как фторид лития, также существуют в земной коре.
Одно из самых популярных применений щелочных металлов - использование цезия и рубидия в атомных часах, наиболее точных из известных эталонов времени и частоты. Литий используется в качестве анода в литиевых батареях, композиты калия используются в качестве удобрений, а ионы рубидия используются в фиолетовых фейерверках. Чистый металлический натрий широко используется в натриевых лампах, которые очень эффективно излучают свет.
5. Щелочноземельные металлы

Изумрудный кристалл, основной минерал бериллия.
Примеры: бериллий, кальций, магний, барий, стронций и радий.
Щелочноземельные металлы в стандартных условиях мягкие и серебристо-белые. Они имеют низкую плотность, температуру кипения и температуру плавления. Хотя они не так реакционноспособны, как щелочные металлы, они очень легко образуют связи с элементами. Как правило, они вступают в реакцию с галогенами, образуя галогениды щелочноземельных металлов.
Все они встречаются в земной коре, кроме радия, который является радиоактивным элементом. Радий уже распадался в ранней истории Земли из-за относительно короткого периода полураспада (1600 лет). Современные образцы поступают из цепочки распада урана и тория.
Щелочноземельные металлы имеют широкий спектр применения. Бериллий, например, используется в полупроводниках, теплопроводниках, электрических изоляторах и в военных целях. Магний часто сплавляют с цинком или алюминием для получения материалов со специфическими свойствами. Кальций в основном используется в качестве восстановителя, а барий используется в вакуумных трубках для удаления газов.
4. Переходные металлы
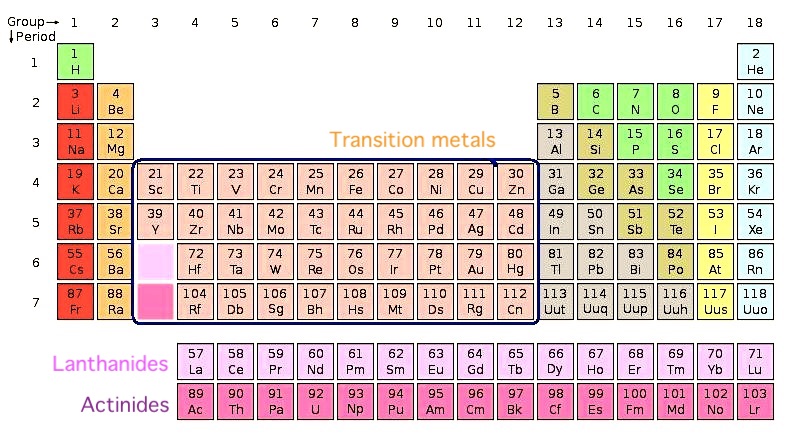
Примеры: титан, ванадий, хром, никель, серебро, вольфрам, платина, кобальт.
Большинство элементов используют электроны из своей внешней оболочки для связи с другими элементами. Переходные металлы, однако, могут использовать две крайние оболочки для соединения с другими элементами. Это химическая особенность, которая позволяет им связываться со многими различными элементами в различных формах.
Они занимают среднюю часть таблицы Менделеева, служа мостом между (или переходом) между двумя сторонами таблицы. Более конкретно, есть 38 переходных металлов в группах с 3 по 12 периодической таблицы. Все они являются пластичными, податливыми и хорошими проводниками тепла и электричества.
Многие из этих металлов, такие как медь, никель, железо и титан, используются в конструкциях и в электронике. Большинство из них образуют полезные сплавы друг с другом и с другими металлическими веществами. Некоторые из них, включая золото, серебро и платину, называются благородными металлами, потому что они крайне инертны и устойчивы к кислотам.
3. Постпереходные металлы

Висмут в виде синтетических кристаллов
Примеры: алюминий, галлий, олово, свинец, таллий, индий, висмут.
Постпереходные металлы в периодической таблице - это элементы, расположенные справа от переходных металлов и слева от металлоидов. Из-за своих свойств они также называются "бедными" или "другими" металлами.
Физически они хрупки (или мягки) и имеют более низкую температуру плавления и механическую прочность, чем переходные металлы. Их кристаллическая структура довольно сложна: они проявляют ковалентные или направленные эффекты связи.
Различные металлы этого семейства имеют различное применение. Алюминий, например, используется для изготовления оконных рам, кухонной посуды, банок, фольги, деталей автомобилей. Оловянные сплавы используются в мягких припоях, оловянных и сверхпроводящих магнитах.
Индиевые сплавы используются для изготовления плоских дисплеев и сенсорных экранов, а галлий - в топливных элементах и полупроводниках.
2. Лантаноиды

1-сантиметровый кусок чистого лантана
Примеры: лантан, церий, прометий, гадолиний, тербий, иттербий, лютеций.
Лантаноиды - это редкоземельные металлы с атомными номерами от 57 до 71. Впервые они были обнаружены в 1787 году в необычном черном минерале (гадолините), обнаруженном в Иттербю, Швеция. Позже минерал был разделен на различные элементы лантаноидов.
Лантаноиды - это металлы с высокой плотностью, плотность которых колеблется от 6,1 до 9,8 г/см³, и они, как правило, имеют очень высокие температуры кипения (1200-3500 °C) и очень высокие температуры плавления (800-1600 °C).
Сплавы лантаноидов используются в металлургии из-за их сильных восстановительных способностей. Около 15 000 тонн лантаноидов ежегодно расходуется в качестве катализаторов и при производстве стекол. Они также широко используются в лазерах и оптических усилителях.
Некоторые исследования показывают, что лантаноиды могут быть использованы в качестве противораковых средств. Лантан и церий, в частности, могут подавлять пролиферацию раковых клеток и способствовать цитотоксичности.
1. Актиниды

Металлический уран, высокообогащенный ураном-235
Примеры: актиний, уран, торий, плутоний, фермий, нобелий, лоренций
Подобно лантаноидам, актиниды образуют семейство редкоземельных элементов с аналогичными свойствами. Они представляют собой серию из 15 последовательных химических элементов в периодической системе от атомных номеров 89 до 103.
Все они радиоактивны по своей природе. Синтетически произведенный плутоний, а также природные уран и торий являются наиболее распространенными актинидами на Земле. Первым актинидом, который был открыт в 1789 году, был уран. И большая часть существующих продуктов актинидов была произведена в 20 веке.
Их свойства, такие как излучение радиоактивности, пирофорность, токсичность и ядерная критичность, делают их опасными для обращения. Сегодня значительная часть (кратковременных) актинидов производится ускорителями частиц в исследовательских целях.
Некоторые актиниды нашли применение в повседневной жизни, например, газовые баллоны (торий) и детекторы дыма (америций), большинство из них используются в качестве топлива в ядерных реакторах и для изготовления ядерного оружия. Уран-235 является наиболее важным изотопом для применения в ядерной энергетике, который широко используется в тепловых реакторах.
Инертные металлы в таблице менделеева
Выдающийся русский учёный, химик, физик и энергетик. Самым значимым его вкладом в науку стало открытие периодического закона, графическое выражение которого получило название Периодической системы химических элементов.
Периодический закон
К середине XIX века учёные располагали множеством сведений о физических и химических свойствах разных элементов и их соединений. Появилась необходимость упорядочить эти знания и представить их в наглядном виде. Исследователи из разных стран пытались создать классификацию, объединяя элементы по сходству состава и свойств веществ, которые они образуют. Однако ни одна из предложенных систем не охватывала все известные элементы.
Пытался решить эту задачу и молодой русский профессор Д.И. Менделеев. Он собирал и классифицировал информацию о свойствах элементов и их соединений, а затем уточнял её в ходе многочисленных экспериментов. Собрав данные, Дмитрий Иванович записал сведения о каждом элементе на карточки, раскладывал их на столе и многократно перемещал, пытаясь выстроить логическую систему. Долгие научные изыскания привели его к выводу, что свойства элементов и их соединений изменяются с возрастанием атомной массы, однако не монотонно, а периодически.
Так был открыт периодический закон, который учёный сформулировал следующим образом: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».

Своё открытие Менделеев совершил почти за 30 лет до того, как учёным удалось понять структуру атома. Открытия в области атомной физики позволили установить, что свойства элементов определяются не атомной массой, а зависят от количества электронов, содержащихся в нём. Поэтому современная формулировка закона звучит так:
Свойства химических элементов, а также формы и свойства образуемых ими веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов.
Этот принцип Менделеев проиллюстрировал в таблице, в которой были представлены все 63 известных на тот момент химических элемента. При её создании учёный предпринял ряд весьма смелых шагов.
Во-первых, многочисленные эксперименты позволили Менделееву сделать вывод, что атомные массы некоторых элементов ранее были вычислены неправильно, и он изменил их в соответствии со своей системой.
Во-вторых, в таблице были оставлены места для новых элементов, открытие которых учёный предсказал, подробно описав их свойства.
.jpg)
Мировое научное сообщество поначалу скептически отнеслось к открытию русского химика. Однако вскоре были открыты предсказанные им химические элементы: галлий, скандий и германий. Это разрушило сомнения в правильности системы Менделеева, которая навсегда изменила науку. Там, где раньше учёному требовалось провести ряд сложнейших (и даже не всегда возможных в реальности) опытов — теперь стало достаточно одного взгляда в таблицу.
Существует легенда, якобы знаменитая таблица явилась Менделееву во сне. Но сам Дмитрий Иванович эту информацию не подтвердил. Он действительно нередко засиживался над работой до поздней ночи и засыпал, продолжая размышлять над решением задачи, однако факт мистического озарения во сне учёный отрицал: «Я над ней, может быть, двадцать лет думал, а вы думаете, сел и вдруг — готово!».
Теперь расскажем, как устроена Периодическая таблица элементов Менделеева и как ею пользоваться.
Структура Периодической системы элементов

На настоящий момент Периодическая таблица Менделеева содержит 118 химических элементов. Каждый из них занимает своё место в зависимости от атомного числа. Оно показывает, сколько протонов содержит ядро атома элемента и сколько электронов в атоме находятся вокруг него. Атом каждого последующего элемента содержит на один протон больше, чем предыдущий.
Периоды — это строки таблицы. На данный момент их семь. У всех элементов одного периода одинаковое количество заполненных электронами энергетических уровней.
Группы — это столбцы. В группы в Периодической таблице объединяются элементы с одинаковым числом электронов на внешнем энергетическом уровне их атомов. В кратком варианте таблицы, используемой в школьных учебниках, элементы разделены на восемь групп. Каждая из них делится на главную (A) и побочную (B) подгруппы, которые объединяют элементы со сходными химическими свойствами.
.jpg)
Каждый элемент обозначается одной или двумя латинскими буквами. Порядковый номер элемента (число протонов в его ядре) обычно пишется в левом верхнем углу. Также в ячейке элемента указана его относительная атомная масса (сумма масс протонов и нейтронов). Это усреднённая величина, для расчёта которой используются атомные массы всех изотопов элемента с учётом их содержания в природе. Поэтому обычно она является дробным числом.
Чтобы узнать количество нейтронов в ядре элемента, необходимо вычесть его порядковый номер из относительной атомной массы (массового числа).
Свойства Периодической системы элементов
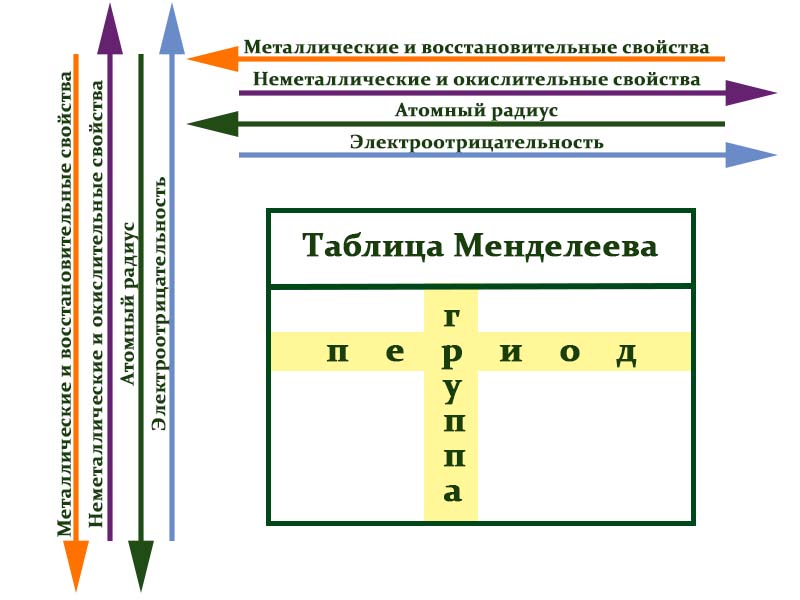
Расположение химических элементов в таблице Менделеева позволяет сопоставлять не только их атомные массы, но и химические свойства.
Вот как они изменяются в пределах группы (сверху вниз):
- Металлические свойства усиливаются, неметаллические ослабевают.
- Увеличивается атомный радиус.
- Усиливаются основные свойства гидроксидов и кислотные свойства водородных соединений неметаллов.
В пределах периодов (слева направо) свойства элементов меняются следующим образом:
- Металлические свойства ослабевают, неметаллические усиливаются.
- Уменьшается атомный радиус.
- Возрастает электроотрицательность.

Элементы Периодической таблицы Менделеева
По положению элемента в периоде можно определить его принадлежность к металлам или неметаллам. Металлы расположены в левом нижнем углу таблицы, неметаллы — в правом верхнем углу. Между ними находятся полуметаллы. Все периоды, кроме первого, начинается щелочным металлом. Каждый период заканчивается инертным газом.
Щелочные металлы
.jpg)
Первая группа главная подгруппа элементов (IA) — щелочные металлы. Это серебристые вещества (кроме цезия, он золотистый), настолько мягкие, что их можно резать ножом. Поскольку на их внешнем электронном слое находится только один электрон, они очень легко вступают в реакции. Плотность щелочных металлов меньше плотности воды, поэтому они в ней не тонут, а бурно реагируют с образованием щёлочи и водорода. Реакция идёт настолько энергично, что водород может даже загореться или взорваться. Эти металлы настолько активно реагируют с кислородом в воздухе, что их приходится хранить под слоем керосина (а литий — под слоем вазелина).
Учите химию вместе с домашней онлайн-школой «Фоксфорда»! По промокоду CHEMISTRY892021 вы получите бесплатный недельный доступ к курсам химии за 8 класс и 9 класс.
Щелочноземельные металлы
.jpg)
Вторая группа главная подгруппа (IIА) представлена щелочноземельными металлами с двумя электронами на внешнем энергетическом уровне атома. Бериллий и магний часто не относят к щелочноземельным металлам. Они тоже имеют серебристый оттенок и легко взаимодействуют с другими элементами, хотя и не так охотно, как металлы из первой группы главной подгруппы. Температура плавления щелочноземельных металлов выше, чем у щелочных. Ионы магния и кальция обусловливают жёсткость воды.
Лантаноиды и актиноиды
В третьей группе побочной подгруппе (IIIB) шестого и седьмого периодов находятся сразу несколько металлов, сходных по строению внешнего энергетического уровня и близких по химическим свойствам. У этих элементов электроны начинают заполнять третий по счёту от внешнего электронного слоя уровень. Это лантаноиды и актиноиды. Для удобства их помещают под основной таблицей.
.jpg)
Лантаноиды иногда называют «редкоземельными элементами», поскольку они были обнаружены в небольшом количестве в составе редких минералов и не образуют собственных руд.
.jpg)
Актиноиды имеют одно важное общее свойство — радиоактивность. Все они, кроме урана, практически не встречаются в природе и синтезируются искусственно.
Переходные металлы
.jpg)
Элементы побочных подгрупп, кроме лантаноидов и актиноидов, называют переходными металлами. Они вполне укладываются в привычные представления о металлах — твёрдые (за исключением жидкой ртути), плотные, обладают характерным блеском, хорошо проводят тепло и электричество. Валентные электроны их атомов находятся на внешнем и предвнешнем энергетических уровнях.
Неметаллы
.jpg)
Правый верхний угол таблицы до инертных газов занимают неметаллы. Неметаллы плохо проводят тепло и электричество и могут существовать в трёх агрегатных состояниях: твёрдом (как углерод или кремний), жидком (как бром) и газообразном (как кислород и азот). Водород может проявлять как металлические, так и неметаллические свойства, поэтому его относят как к первой, так и к седьмой группе Периодической системы.
Подгруппа углерода

Четвёртую группу главную подгруппу (IVА) называют подгруппой углерода. Углерод и кремний обладают всеми свойствами неметаллов, германий и олово занимают промежуточную позицию, а свинец имеет выраженные металлические свойства. Углерод образует несколько аллотропных модификаций — вариантов простых веществ, отличающихся по своему строению, а именно: графит, алмаз, фуллерит и другие.
Большинство элементов подгруппы углерода — полупроводники (проводят электричество за счёт примесей, но хуже, чем металлы). Графит, германий и кремний используют при изготовлении полупроводниковых элементов (транзисторы, диоды, процессоры и так далее).
Подгруппа азота

Пятую группу главную подгруппу (VA) называют пниктогенами или подгруппой азота. В ходе реакций эти элементы могут как отдавать электроны, так и принимать их, завершая внешний энергетический уровень.
Физические свойства элементов подгруппы азота различны. Азот является бесцветным газом. Фосфор, мягкое вещество, образует несколько вариантов аллотропных модификаций — белый, красный и чёрный фосфор. Мышьяк — твёрдый полуметалл, способный проводить электрический ток. Висмут — блестящий серебристо-белый металл с радужным отливом.
Азот — основное вещество в составе атмосферы нашей планеты. Некоторые элементы подгруппы азота токсичны для человека (фосфор, мышьяк, висмут). При этом азот и фосфор являются важными элементами почвенного питания растений, поэтому они входят в состав большинства удобрений. Азот и фосфор также участвуют в формировании важнейших молекул живых организмов — белков и нуклеиновых кислот.
Подгруппа кислорода

Халькогены или подгруппа кислорода — элементы шестой группы главной подгруппы (VIA). Для завершения внешнего электронного уровня атомам этих элементов не хватает лишь двух электронов, поэтому они проявляют сильные окислительные (неметаллические) свойства. Однако, по мере продвижения от кислорода к полонию они ослабевают.
Кислород образует две аллотропные модификации — кислород и озон — тот самый газ, который образует экран в атмосфере планеты, защищающий живые организмы от жёсткого космического излучения.
Кислород и сера легко образуют прочные соединения с металлами — оксиды и сульфиды. В виде этих соединений металлы часто входят в состав руд.
Галогены

Седьмая группа главная подгруппа (VIIA) представлена галогенами — неметаллами с семью электронами на внешнем электронном слое атома. Это сильнейшие окислители, легко вступающие в реакции. Галогены («рождающие соли») назвали так потому, что они реагируют со многими металлами с образованием солей. Например, хлор входит в состав обычной поваренной соли.
Самый активный из галогенов — фтор. Он способен разрушать даже молекулы воды, за что и получил своё грозное имя (слово «фтор» переводится на русский язык как «разрушительный»). А его «близкий родственник» — иод — используется в медицине в виде спиртового раствора для обработки ран.
Инертные газы

Инертные газы, расположенные в последней, восьмой группе главной подгруппе (VIIIA) — элементы с полностью заполненным внешним электронным уровнем. Они практически не способны участвовать в реакциях. Поэтому их иногда называют «благородными», проводя параллель с представителями высшего общества, которые брезгуют контактировать с посторонними.
У инертных газов есть удивительная способность: они светятся под действием электромагнитного излучения, поэтому используются для создания ламп. Так, неон используется для создания светящихся вывесок и реклам, а ксенон — в автомобильных фарах и фотовспышках.
Гелий обладает массой всего в два раза больше массы молекулы водорода, но, в отличие от последнего, не взрывоопасен и используется для заполнения воздушных шаров.
Записали!
Скоро с вами свяжется консультант, расскажет об обучении в нашей онлайн-школе.
Проверьте вашу электронную почту — там письмо о том, что стоит сделать перед консультацией.

У нас вы сможете учиться в удобном темпе, делать упор на любимые предметы и общаться со сверстниками по всему миру.
Попробовать бесплатно
БЛАГОРОДНЫЕ МЕТАЛЛЫ
БЛАГОРОДНЫЕ МЕТАЛЛЫ, группа инертных металлов, встречающихся в природе обычно в чистом виде, а не в виде соединений или руд. Эта группа включает СЕРЕБРО, ЗОЛОТО, ПЛАТИНУ, ОСМИЙ, ИРИДИЙ. ПАЛЛАДИЙ, РОДИЙ и РУТЕНИЙ. Однако МЕДЬ иногда тоже встречается в природе в чистом виде, но ее не включают в данную группу, тогда как РТУТЬ, встречающуюся и в чистом виде, и в рудах (таких как КИНОВАРЬ), часто включают. Таким образом, благородные металлы - достаточно свободная группа. Золото и платина - драгоценные металлы, используемые в ювелирном деле благодаря их редкости, блеску, коррозийной стойкости, хорошей ковкости и пластичности. Осмий - самый тяжелый из всех подобных металлов. В сплаве с иридием, называемым осмидием, он применяется для покрытия перьев чернильных ручек. Платина и палладий используются в промышленности в качестве КАТАЛИЗАТОРОВ. см. также НЕБЛАГОРОДНЫЕ МЕТАЛЛЫ .
Научно-технический энциклопедический словарь .
Смотреть что такое "БЛАГОРОДНЫЕ МЕТАЛЛЫ" в других словарях:
БЛАГОРОДНЫЕ МЕТАЛЛЫ — (драгоценные металлы), химические элементы: золото Au, серебро Ag, платина Pt и платиновые металлы. Имеют высокую химическую стойкость, красивый внешний вид в изделиях (отсюда название); Au и Ag валютные металлы. Благородные металлы встречаются в … Современная энциклопедия
Благородные металлы — (драгоценные металлы), химические элементы: золото Au, серебро Ag, платина Pt и платиновые металлы. Имеют высокую химическую стойкость, красивый внешний вид в изделиях (отсюда название); Au и Ag валютные металлы. Благородные металлы встречаются в … Иллюстрированный энциклопедический словарь
БЛАГОРОДНЫЕ МЕТАЛЛЫ — (precious metals) Металлы: серебро, золото и платина. сравни: неблагородные металлы (base metals). Бизнес. Толковый словарь. М.: ИНФРА М , Издательство Весь Мир . Грэхэм Бетс, Барри Брайндли, С. Уильямс и др. Общая редакция: д.э.н. Осадчая И.М..… … Словарь бизнес-терминов
БЛАГОРОДНЫЕ МЕТАЛЛЫ — золото, серебро, платина и металлы платиновой группы (рутений, родий, палладий, осмий, иридий). Обладают химической стойкостью, тугоплавкостью (кроме Au и Ag), красивым внешним видом в изделиях (отсюда название) … Большой Энциклопедический словарь
БЛАГОРОДНЫЕ МЕТАЛЛЫ — золото, серебро, платина, палладий, иридий, родий, рутений и осмий, получившие название главным образом благодаря высокой химической стойкости и красивому внешнему виду в ювелирных изделиях. Кроме того, золото, серебро и платина обладают высокой… … Большая политехническая энциклопедия
Благородные металлы — Данные в этой статье приведены по состоянию на конец 80 х годов XX века. Вы можете помочь, обновив информацию в статье … Википедия
благородные металлы — золото, серебро, платина и металлы платиновой группы (рутений, родий, палладий, осмий, иридий). Обладают химической стойкостью, тугоплавкостью (кроме Au и Ag), красивым внешним видом в изделиях (отсюда название). * * * БЛАГОРОДНЫЕ МЕТАЛЛЫ… … Энциклопедический словарь
благородные металлы — золото, серебро, платина и палладий. Эти металлы ценятся за их внутреннюю стоимость, обеспечивающую мировые валюты, а также за их промышленное применение. Фундаментальные понятия предложения и спроса являются важными факторами, влияющими на цены … Финансово-инвестиционный толковый словарь
благородные металлы — taurieji metalai statusas T sritis chemija apibrėžtis Au, Ag, Pt ir jos grupės metalai. atitikmenys: angl. noble metals; precious metals rus. благородные металлы; драгоценные металлы ryšiai: sinonimas – brangieji metalai … Chemijos terminų aiškinamasis žodynas
благородные металлы — taurieji metalai statusas T sritis ekologija ir aplinkotyra apibrėžtis Cheminiam poveikiui labai atsparūs metalai: auksas, platina, iridis, osmis, sidabras, paladis, rodis, rutenis. Auksas, sidabras ir platina nesioksiduoja ore; iridis, rutenis… … Ekologijos terminų aiškinamasis žodynas
Расшифровка таблицы Менделеева: как пользоваться

В статье рассмотрена расшифровка таблицы Менделеева, с помощью которой можно быстро в ней разобраться. Из таблицы Менделеева можно почерпнуть огромное количество информации о каждом химическом элементе. Ее можно использовать на ЕГЭ, если уметь грамотно ей пользоваться.
- Периодическая система Менделеева систематизирует элементы и их свойства. В ней все элементы упорядочены с учетом их атомного числа и повторяющихся химических свойств.
- Периодический закон: свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера).
Расшифровка обозначений элементов

Каждому химическому элементу в таблице отведена одна клеточка, в которой указаны символ и название элемента, порядковый номер и относительная атомная масса.
Расшифровка обозначений элементов таблицы Менделеева:
- Обозначение: одной или двумя латинскими буквами.
- Порядковый номер элемента или атомный номер равен числу протонов в его ядре. Обычно пишется в левом верхнем углу.
- Относительная атомная масса (сумма масс протонов и нейтронов). Это усреднённая величина, для расчёта которой используются атомные массы всех изотопов элемента с учетом их содержания в природе. Поэтому обычно она является дробным числом.
- Если округлить атомную массу до ближайшего целого, мы получим так называемое массовое число.
- Разность массового числа и атомного числа дает количество нейтронов в ядре. Так, число нейтронов в ядре гелия равно двум, а у лития – четырем.
- Число положительных протонов, как правило, равно числу отрицательных электронов в атоме (за исключением изотопов).
- Электронная конфигурация — формула расположения электронов по различным электронным оболочкам атома химического элемента или молекулы.
Чтобы узнать количество нейтронов в ядре элемента, необходимо из относительной атомной массы (массового числа) вычесть порядковый номер.
Элементы периодической таблицы Менделеева
Металлы расположены в левом нижнем углу таблицы, неметаллы — в правом верхнем углу. Между ними находятся полуметаллы. Все периоды, кроме первого, начинается щелочным металлом. Каждый период заканчивается инертным газом.
- Металлы обладают хорошей электро- и теплопроводностью, способны отражать яркий свет, имеют высокую температуру плавления (остаются твердыми при нормальных значениях окружающей среды, исключение — ртуть).
- Неметаллы встречаются в природе в трех состояниях: газ (например, водород), жидкость (например, бром) и твердые вещества (например, фосфор). Он не способны проводить тепло и электричество. Имеют более низкую температуру плавления в сравнении с металлами, более хрупкие и ломкие. Могут иметь разнообразный внешний вид (элементы с низкой плотностью и яркостью).
- Металлоиды имеют смешанные свойства металлов и неметаллов (например, кремний). Они имеют среднюю тепло- и электропроводность. Различаются между собой по температуре плавления, плотности, цвету и форме. Внешний вид может быть схож с металлами или неметаллами.
Расшифровка групп и периодов таблицы Менделеева
В таблице химические вещества расположены в специальном порядке: слева направо по мере роста их атомных масс. Все они в периодической системе объединены в периоды и группы.
Периоды — это горизонтальные ряды в таблице. У всех элементов одного периода одинаковое количество заполненных электронами энергетических уровней.
Номер периода, в котором находится элемент, совпадает с номером его валентной оболочки. Эта валентная оболочка постепенно заполняется от начала к концу периода.
- Металлические свойства убывают, неметаллические и окислительные -возрастают. Каждый период начинается активным металлом и заканчивается инертным газом.
- Уменьшается атомный радиус.
- Увеличивается электроотрицательность.
Группы — это столбцы. Элементы во всех группах имеют одинаковое электронное строение внешних электронных оболочек. В каждой группе на внешнем энергетическом атома одинаковое число электронов, то есть номер группы совпадает с числом валентных электронов, которые могут участвовать в образовании химических связей. Поэтому номер группы часто совпадает с валентностью элементов. Например, номер группы совпадает с валентностью s-элементов и с наибольшей возможной валентностью p-элементов.
- Металлические свойства увеличиваются, неметаллические и окислительные- убывают.
- Увеличивается радиус атома элементов в рамках одной группы.
- Уменьшается электроотрицательность.
Атомное число показывает, сколько протонов содержит ядро атома элемента и сколько электронов в атоме находятся вокруг него. Атом каждого последующего элемента содержит на один протон больше, чем предыдущий.
Валетность — это свойство элементов образовывать химические связи. То есть это количество химических связей, которые образует атом или число атомов, которое может присоединить или заместить атом данного элемента. Валентность бывает: постоянная и переменная (зависит от состава вещества, в которое входит элемент).
Определить валентность:
— Постоянная валентность идентична номеру группы главной подгруппы. Номера групп в таблице изображаются римскими цифрами.
— Переменная валентность (часто бывает у неметаллов) определяется по формуле: 8 вычесть № группы, в которой находится вещество.
Расшифровка периодов и групп периодической таблицы Менделеева
Каждый элемент имеет свой порядковый (атомный) номер, располагается в определённом периоде и определённой группе.
Периоды
- Малые периоды: первый, второй и третий периоды. В них содержится соответственно 2, 8 и 8 элементов;
- Большие периоды: остальные элементы. В четвёртом и пятом периодах расположены по 18 элементов, в шестом — 32, а в седьмом (пока незавершенном) — 31 элемент.
В таблице 7 периодов. В каждом содержится определённое число элементов:
1-й период — 2 элемента (малый период),
2-й период — 8 элементов (малый период),
3-й период — 8 элементов (малый период),
4-й период — 18 элементов (большой период),
5-й период — 18 элементов (большой период),
6-й период — 32 элемента (18+14) (большой период),
7-й период — 32 элемента (18+14) (большой период).
Группы и подгруппы
- Главные подгруппы включают в себя элементы малых периодов и одинаковые с ним по свойствам элементы больших периодов.
- Побочные подгруппы состоят только из элементов больших периодов. Химические свойства элементов главных и побочных подгрупп значительно различаются.
В Периодической таблице может использоваться разное обозначение групп. Поэтому согласно такому обозначению бывает разная расшифровка групп таблицы менделеева:
- 18 групп, пронумерованных арабскими цифрами.
- 8 групп, пронумерованных цифрами с добавлением букв A или B.
Группы A — это главные подгруппы.
Группы B — это побочные подгруппы в больших периодов. Это только металлы.
IA, VIIIA — по 7 элементов;
IIA — VIIA — по 6 элементов;
IIIB — 32 элемента (4+14 лантаноидов +14 актиноидов);
VIIIB — 12 элементов;
IB, IIB, IVB — VIIB — по 4 элемента.
Римский номер группы, как правило, показывает высшую валентность в оксидах (но для некоторых элементов не выполняется).
Элементы с порядковыми номерами 58–71 (лантаноиды) и 90–103 (актиноиды) вынесены из таблицы и располагаются под ней. Это элементы IIIB группы. Лантаноиды относятся к шестому периоду, а актиноиды — к седьмому.
Элементы главной подгруппы
1 группа главная подгруппа элементов (IA) — щелочные металлы.
Это мягкие металлы, серебристого цвета, хорошо режутся ножом. Все они обладают одним электроном на внешней оболочке и прекрасно вступают в реакцию.
Литий Li (3), Натрий Na (11), Калий K (19), Рубидий Rb (37), Цезий Cs (55), Франций Fr (87).
2 группа главная подгруппа (IIА) -щелочноземельными металлами.
Имеют серебристый оттенок. На внешнем уровне помещено по два электрона, и, соответственно, эти металлы менее охотно взаимодействуют с другими элементами. По сравнению со щелочными металлами, щелочноземельные металлы плавятся и кипят при более высоких температурах.
Кальций Ca (20), Стронций Sr (38), Барий Ba (56), Радий Ra (88).
3 группа главная подгруппа (IIIА).
Все элементы данной подгруппы, за исключением бора, металлы. Главную подгруппу составляют составляют бор, алюминий, галлий, индий и таллий. На внешнем электронном уровне элементов по три электрона. Они легко отдают эти электроны или образуют три неспаренных электрона.
4 группа главная подгруппа (IVА) .
Углерод и кремний обладают всеми свойствами неметаллов, германий и олово занимают промежуточную позицию, а свинец имеет выраженные металлические свойства. Большинство элементов подгруппы углерода — полупроводники (проводят электричество за счёт примесей, но хуже, чем металлы).
5 группа главная подгруппа (VA).
Физические свойства элементов подгруппы азота различны. Азот является бесцветным газом. Фосфор, мягкое вещество, образует несколько вариантов аллотропных модификаций — белый, красный и чёрный фосфор. Мышьяк — твёрдый полуметалл, способный проводить электрический ток. Висмут — блестящий серебристо-белый металл с радужным отливом.
6 группа главной подгруппы (VIA) .
Для завершения внешнего электронного уровня атомам этих элементов не хватает лишь двух электронов, поэтому они проявляют сильные окислительные (неметаллические) свойства.
7 группа главная подгруппа (VIIA) — галогены .
(F, Cl, Br, I, At). Имеют семь электронов на внешнем электронном слое атома. Это сильнейшие окислители, легко вступающие в реакции. Галогены («рождающие соли») назвали так потому, что они реагируют со многими металлами с образованием солей.
Самый активный из галогенов — фтор. Он способен разрушать даже молекулы воды, за что и получил своё грозное имя (слово «фтор» переводится на русский язык как «разрушительный»). А его «близкий родственник» — иод — используется в медицине в виде спиртового раствора для обработки ран.
8 группа главная подгруппа (VIIIA) — инертные (благородные) газы.
(He, Ne, Ar, Kr, Xe, Rn, Og). У них полностью заполнен внешний электронный уровень. Они практически не способны участвовать в реакциях. Поэтому их иногда называют «благородными». У инертных газов есть способность: они светятся под действием электромагнитного излучения, поэтому используются для создания ламп. Так, неон используется для создания светящихся вывесок и реклам, а ксенон — в автомобильных фарах и фотовспышках.
Элементы побочной подгруппы
Элементы побочных подгрупп кроме лантаноидов и актиноидов — переходные металлы.
Твёрдые (исключение жидкая ртуть), плотные, обладают характерным блеском, хорошо проводят тепло и электричество.
Переходные металлы занимают группы 3—12 в периодической таблице. Большинство из них плотные, твердые, с хорошей электро- и теплопроводностью. Их валентные электроны (при помощи которых они соединяются с другими элементами) находятся в нескольких электронных оболочках.
3 группа побочная подгруппа (IIIB) шестого и седьмого периодов — лантаноиды и актиноиды.
Для удобства их помещают под основной таблицей.
- Лантаноиды иногда называют «редкоземельными элементами», поскольку они были обнаружены в небольшом количестве в составе редких минералов и не образуют собственных руд.
- Актиноиды имеют одно важное общее свойство — радиоактивность. Все они, кроме урана, практически не встречаются в природе и синтезируются искусственно.
Неметаллы
Правый верхний угол таблицы до инертных газов -неметаллы.
Неметаллы плохо проводят тепло и электричество и могут существовать в трёх агрегатных состояниях: твёрдом (как углерод или кремний), жидком (как бром) и газообразном (как кислород и азот). Водород может проявлять как металлические, так и неметаллические свойства, поэтому его относят как к первой, так и к седьмой группе.
Кислородные и водородные соединения
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения.
Существует 8 форм кислородных соединений: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4,
где R — элемент группы.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Существуют 4 формы водородных соединений: RH4, RH3, RH2, RH.
Характер соединений: RH — сильнокислый; RH2 — слабокислый; RH3 — слабоосновный; RH4 — нейтральный.
Читайте также:
