Интересные факты о щелочных металлах
Обновлено: 19.05.2024
Что же такое щелочные металлы? Это элементы первой группы, основной подгруппы периодической системы элементов Д. И. Менделеева. К ним относятся такие металлы: Li, Na, K, Rb, Cs, Fr. Они обладают рядом свойств, которые присущи этой группе.

Особенности
Эти металлы имеют небольшие значения плотностей (литий, натрий, калий легче води), низкие температуры плавления (максимальная у лития – 180,6 °C). Они мягкие, легко режутся ножом, быстро окисляются, поэтому их хранят в емкостях заполненных химически малоактивными газами или жидкостями (обычно керосин).
Все металлы данной подгруппы имеют серебристо-белый цвет. В периодической системе элементов Д. И. Менделеева щелочные металлы всегда следуют за инертными газами. Инертные или благородные газы очень плохо вступают в какие-либо химические реакции, они химически неактивные газы и это объясняется тем, что их электронные оболочки полностью заполнены.
В отличие от газов у щелочных металлов появляется один неспаренный электрон на внешнем энергетическом уровне. Поэтому в химических реакциях эти металлы выступают донорами электронов. Они всегда имеют степень окисления +1, химически очень активны – активно реагируют с кислотами (со взрывом), бурно реагируют с водой выделяя водород и образуя щёлочи MeOH (здесь Me – металл). Активность данных металлов увеличивается от Li к Fr.

Литий
Литий — это первый элемент в группе щелочных металлов. Атомная масса — 6,941, состоит из двух природных изотопов 6Li (7,5 %) и 7Li (92,5 %), также известно о получении искусственным путем еще двух изотопов, но продолжительность их жизни очень мала.
Интересный факт о щелочном металле — стоимость 7Li в несколько раз выше за стоимость 6Li, хотя первый более распространён. История открытия данного элемента связана с именем шведского химика И. А. Арфведсона.

Калий
Калий, наравне с натрием, играет важнейшую роль в работе клеток живых организмов, поддерживая их мембранный потенциал. В организме человека содержится около 175 граммов этого металла, и для поддержания этого запаса его нужно ежедневно пополнять примерно на 4 грамма .
В природе встречается часто, но только в составе соединений, занимает третье место по количеству содержания его в воде. При недостатке в почве, этот металл вводят в виде удобрений: хлорида калия KCl, сульфата калия K2SO4 и золы растений.
Многим известно такое вещество, как цианистый калий; но не многие знают, где его используют. А используют его для гальванического серебрения а также золочения неблагородных металлов, извлечения дорогостоящих металлов, а именно серебра и золота, из руд.

Цезий
Цезий был открыт в 1860 году в целебных минеральных источниках Шварцвальдена. Атомная масса – 132,905.
Данный металл используется в таких отраслях: автоматике и электронике, в радиолокации и кино, а также в атомных реакторах и космических кораблях. Это был первый элемент, который открыли с помощью спектрального анализа.

Франций
Франций — это самый нестабильный и тяжёлый элемент среди щелочных металлов с атомной массой 223 и периодом полураспада 22 минуты. Из-за таких характеристик его было очень сложно выделить.
Это очень редкий металл которого, по подсчетам учёных, в земной коре находится всего около 500 грамм, поэтому франций исследовали на искусственно созданных образцах.
Натрий
Натрий — один из самых распространённых щелочных металлов. Из-за этого его используют в разнообразных отраслях. Например, раствором цианида натрия обрабатывают руды драгоценных металлов. В результате получают координационные соединения из которого с помощью цинка выделяют чистое золото или серебро.
Натрий также используют на атомных подводных лодках как теплоноситель из-за его некоторых физических свойств (большая разница между температурами плавления и кипения). В природе натрий не встречается в чистом виде – слишком активен, поэтому — только в составе руд.
Интересный факт — в атмосфере на высоте около 80 км обнаружен слой атомарного натрия. Это объясняется тем что на таких высотах нет элементов с которыми натрий смог бы взаимодействовать.
Рубидий
Рубидий — это по-своему интересный щелочной металл. Имея атомную массу 85,467 металл является радиоактивным. При соприкосновением с воздухом рубидий воспламеняется и горит розовато-фиолетовым пламенем, с водой, F, Cl, Br, I, S – происходит взрыв.
Интересная особенность рубидия — это способность вырабатывать электрический ток под воздействием солнечного излучения.
Хотя щелочные металлы и обладают рядом особенностей присущих им всем, каждый из них также имеет свойства, характерные только для него. Некоторые элементы до сих пор очень плохо изучены, а учитывая востребованность металлов данной группы разными отраслями промышленности, давно назрела необходимость заполнить пустые места в научных справочниках.
Волшебница Химия

В отличие от газов у щелочных металлов появляется один неспаренный электрон на внешнем энергетическом уровне. Поэтому в химических реакциях эти металлы выступают донорами электронов. Они всегда имеют степень окисления +1, химически очень активны – активно реагируют с кислотами (со взрывом), бурно реагируют с водой выделяя водород и образуя щёлочи Что же такое щелочные металлы? Это элементы первой группы, основной подгруппы периодической системы элементов Д. И. Менделеева. К ним относятся такие металлы: Li, Na, K, Rb, Cs, Fr. Они обладают рядом свойств, которые присущи этой группе.
Интересный факт о щелочном металле — стоимость лития-7 в несколько раз выше за стоимость лития-6, хотя первый более распространён. История открытия данного элемента связана с именем шведского химика И. А. Арфведсона.
В природе встречается часто, но только в составе соединений, занимает третье место по количеству содержания его в воде. При недостатке в почве, этот металл вводят в виде удобрений: хлорида калия KCl, сульфата калия K 2 SO 4 и золы растений.
Франций — это самый нестабильный и тяжёлый элемент среди щелочных металлов с атомной массой 223 и периодом полураспада 22 минуты. Из-за таких характеристик его было очень сложно выделить.Был открыт французской исследовательницей Маргаритой Перей.
Щелочные металлы – список и особенности взрывоопасных элементов
Продукты на основе этих металлов стали неотъемлемой частью жизни человека. Это и поваренная соль, и пищевая сода, и марганцовка.
Щелочные металлы ценят преподаватели химии: опыты с такими субстанциями способны увлечь химией любого.

Что представляют собой
Щелочные металлы – это элементы, занимающие почти весь первый столбец таблицы Менделеева. Кроме них, там расположился только водород.
К щелочным металлам относятся:
Названы щелочными вследствие растворимости соединений водой.
Результат воздействия воды – гидроксиды. Они также растворимы, потому называются щелочами.
Древние славяне под выщелачиванием подразумевали растворение вещества водой.
Особенности структуры
У атома щелочного металла на внешнем слое один электрон. Степень окисления у металлов группы одна – +1.
Этим обусловлена сходность характеристик элементов щелочного сегмента.
Как представлены в природе
Щелочная группа представлена на планете по-разному:
- Самые распространенные элементы – натрий с калием.
- Литий, рубидий, цезий причислены к редким и рассеянным.
- Самым редкостным щелочным металлом является франций. По редкости этот радиогенный материал – второй на планете: суммарный объем в земной коре не превышает трети килограмма.
Из-за повышенной активности щелочные металлы в природе не встречаются. Лишь как соединения с прочими элементами.
Поставщики натрия с калием:
- Хлорид натрия – обычная каменная соль. Ее содержит вода морей и океанов.
- Глауберова соль.
- Соли калия находят в почвах.
Металлы входят в структуру ряда минералов. Это в основном алюмосиликаты: альбит – натриевый; ортоклаз (полевой шпат) – калийный.
Технология получения
Щелочные металлы получают несколькими способами:
- Электролиз. Материалом служат расплавы их хлоридов (или других галогенидов) либо гидроксиды. Растворы солей как исходник не годятся: конечным продуктом становятся водород и щелочи.
- Восстановление из бромида, хромата либо хлорида. Восстановителями выступают магний, цирконий, кальций, кремний. Процесс получения протекает в вакууме при температурах под 1000°С, образующийся металл периодически отгоняется.
Натрий восстанавливают из карбоната. Ингредиенты: уголь, известняк, температура 990°C. Для промышленных нужд синтезируют гидроксид из крепкого раствора поваренной соли.
Физико-химические свойства
Металлы щелочного сегмента наделены общими и оригинальными физическими и химическими свойствами.
Физические характеристики
Элементы группы наделены общими физическими свойствами:
- Мягкость. Любой (кроме лития) легко режется.
- Легкость. Плотность лития, натрия, калия меньше единицы. Они не тонут в воде.
- Серебристо-белый цвет. Только цезий наделен желтоватостью на серебристом фоне.
- Металлический отблеск.
Оксиды группы обладают типичными для этого вида соединений свойствами: реагируют с водой, кислотами, их оксидами. У каждого свой цвет. Устойчивость и цветность оксидов щелочных элементов увязана с габаритами атома.
Химические параметры
Главная особенность щелочной группы – чрезмерная химическая активность:
- Разогретые щелочные элементы реагируют с азотом, кремнием, галогенами, серой, фосфором, углеродом. Результат – соответствующие продукты (галогениды, сульфиды, карбиды, силициды, др.)
- При нагревании с прочими металлами образуются полуметаллы (интерметаллиды).
- На воздухе сгорают.
При взаимодействии металлов с водой выделяется водород, возможен взрыв.
Окраска пламени щелочными металлами и их соединениями:
| Щелочной металл | Цвет пламени |
|---|---|
| Li | Карминно-красный |
| Na | Жёлтый |
| K | Фиолетовый |
| Rb | Буро-красный |
| Cs | Фиолетово-красный |
Элементы, не тонущие в воде, горят и взрываются в ней:
- Калий создает пламя фиалковой гаммы, взрыв самый сильный.
- У натрия пламя желтое, взрыв послабее.
- Литий просто горит.
Взрывом заканчивается реакция с кислотами.
Все щелочные металлы бурно реагируют на воду. Процесс сопровождается водородным фонтаном, затем пламенем, взрывом.
Мирно протекают реакции со спиртами, карбоновыми кислотами, другими органическими субстанциями.
| Формула кислородного соединения | Цвет |
|---|---|
| Li2O | Белый |
| Na2O | Белый |
| K2O | Желтоватый |
| Rb2O | Жёлтый |
| Cs2O | Оранжевый |
| Na2O2 | Светло- жёлтый |
| KO2 | Оранжевый |
| RbO2 | Тёмно- коричневый |
| CsO2 | Жёлтый |
Как опознать щелочной металл
Вид щелочного металла «выдает» окрас пламени:
Натрий либо его соединения делают пламя охристо-желтым.
Где используются
Промышленники оценили утилитарные свойства щелочных металлов. Они легкоплавки, пластичны (раскатываются до фольги), хорошо куются, пропускают тепло и электричество.
Самый известный продукт – поваренная соль (формула NaCl). Ее дополняют кальцинированная сода с едким натром (карбонат, гидроксид натрия), марганцовка (перманганат калия).
Их производят миллионами тонн:
- Каустическая сода (в просторечии едкий натр) – ингредиент при варке мыла, производстве алюминия, искусственных волокон.
- Кальцинированная сода – сырье для получения мыла, стекла, заменитель хозяйственного мыла.
Каустическая и кальцинированная сода, глауберова соль несъедобны. Только столовая сода и поваренная соль.
- Пищевая сода нашла применение как домашнее средство для устранения ангины, обязательный ингредиент выпечки, натуральный консервант.
Альбит и ортоклаз классифицируются как коллекционный и декоративно-поделочный материал.
Техника безопасности
Химически активные элементы требуют осторожности.
При самостоятельной работе соблюдают следующие правила:
- Перед началом работы надеть защитные перчатки и очки (маску).
- Кусочек отрезают скальпелем от массива, не вытаскивая из керосина.
- В емкости, заполненной аргоном, счищают с поверхности остатки оксидов.
- Очищенный образец помещают в сосуд, где будет проводиться опыт.
- Остатки, не затронутые реакцией, засыпают сухим спиртом.
Аналогичный порядок работы со щелочноземельными элементами. Они так же химически активны.
Щелочные и щелочноземельные металлы хранят притопленными в керосине: контакт с водой, воздухом заканчивается взрывом.
Щелочные металлы
Этот химический элемент представляет собой мягкий щелочной металл серебристого цвета. Он легко окисляется на воздухе, образуя оксид натрия. При горении же превращается в пероксид. В промышленности его используют как сильный восстановитель. Иногда натрий применят для создания электрических проводов. Представляем интересные факты о натрии.
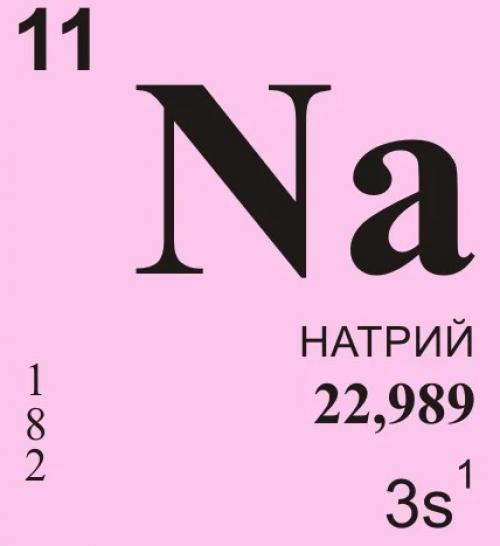
Этот элемент является весьма интересным не только для учёных, но и для людей, которые плохо разбираются в химии. Далее будут перечислены несколько фактов об одном из сильнейших восстановителей на планете Земля:
Факты о щелочных металлах. Литий

Элемент №3, названный литием (от греческого λιτοσ – камень), открыт в 1817 г.
Шведский химик И.А. Арфведсон, ученик знаменитого Берцелиуса, анализировал минерал, найденный в железном руднике Уто. Он быстро установил, что этот минерал – типичный алюмосиликат, и выяснил, сколько в нем кремния, алюминия и кислорода – на долю этих трех распространеннейших элементов приходилось 96% веса минерала.
Интересные факты о металлах химия. 22 занятных факта о благородных металлах

1. Швейцарская фирма Valcambi выпускает золотые слитки Combibar в форме, напоминающей плитку шоколада. Главное их преимущество перед привычными слитками заключается в том, что такую плитку можно легко разломать на дольки весом в 1 грамм и использовать как подарок или альтернативное платёжное средство. Кроме золота, компания выпускает подобные изделия из серебра, платины и палладия.
Интересные факты о щелочных металлах. 22 занятных факта о благородных металлах

Сталь интересные факты. Интересные факты о стали

Сталь — это сплав железа с углеродом и другими элементами, которые придают железу прочность. Сталь используется для изготовления разнообразных конструкций и инструментов. Интересные факты о стали расскажут больше познавательного об этом материале.
Интересные факты про металлы
Металлы — это группа элементов, обладающая характерными металлическими свойствами, такими как высокая тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность и др. К металлам относятся примерно 70 % всех химических элементов. Металлы — один из самых распространённых материалов, используемых цивилизацией на протяжении практически всей её истории. В природе они могут встречаться в различном виде: в самородном состоянии, в виде оксидов, солей, а также сопутствуют различным минералам.

Химия металлы интересные факты. Самые необычные металлы

К категории необычные металлы стоило бы отнести тантал. Это дорогой и редкий металл. За 1 килограмм тантала, в зависимости от его чистоты, можно получить от 500 до 4500 долларов. Именно из-за сложностей в получении чистого такого металла в чистом виде он был назван в честь героя греческих мифов, который постоянно пытался достать хотя бы небольшое количество пищи и воды.Говоря про самые интересные металлы, важно отметить и индий. Если бы драгоценные металлы были личностями, то индий ассоциировался бы с плаксивым ребенком. Этот металл достаточно мягкий и внутри имеет тон индиго внутри. Также он издает специфические звуки в момент сгибания.Титан – это удивительный и мистический металл, который назвали в честь царицы фей. Он легкий, подобно воздушные крылья феи.
Читайте также:
