Ионная связь образуется между активными металлами и неактивными металлами
Обновлено: 20.09.2024
Теорию ионной связи предложил в 1916г. немецкий ученый В. Коссель. Эта теория объясняет образование связей между атомами типичных металлов и атомамитипичных неметаллов:CsF, CsCl, NaCl, KF, KCl, Na2O и др.
Согласно этой теории, при образовании ионной связи атомы типичных металлов отдают электроны, а атомы типичных неметаллов принимают электроны.
В результате этих процессов атомы металлов превращаются в положительно заряженные частицы, которые называются положительными ионами или катионами; а атомы неметаллов превращаются в отрицательные ионы — анионы. Заряд катиона равен числу отданных электронов.
Атомы металлов отдают электроны внешнего слоя, а образующиеся ионы имеют завершенные электронные структуры (предвнешнего электронного слоя).
Величина отрицательного заряда аниона равна числу принятых электронов.
Атомы неметаллов принимают такое количество электронов, какое им необходимо для завершения электронного октета (внешнего электронного слоя).
Например: общая схема образования молекулы NaCl из атомов Na и С1: Na°-le = Na +1 Образование ионов
Na +1 + Сl - = Nа + Сl -
Na°+ Сl°= Nа + Сl - Соединение ионов
· Связь между ионами называется ионной связью.
Соединения, которые состоят из ионов, называются ионными соединениями.
Алгебраическая сумма зарядов всех ионов в молекуле ионного соединения должна быть равна нулю,потому что любая молекула является электронейтральной частицей.
Резкой границы между ионной и ковалентнои связями не существует. Ионную связь можно рассматривать как крайний случай полярной ковалентнои связи, при образовании которой общая электронная пара полностьюсмещается к атому с большей электроотрицательностью.
Атомы большинства типичных металлов на внешнем электронном слое имеют небольшое число электронов (как правило, от 1 до 3); эти электроны называются валентными. В атомах металлов прочность связи валентных электронов с ядром невысокая, то есть атомы обладают низкой энергией ионизации. Это обусловливает легкость потери валентных электронов ч превращения атомов металла в положительно заряженные ионы (катионы):
В кристаллической структуре металла валентные электроны обладают способностью легко перемещаться от одного атома к другому, что приводит к обобществлению электронов всеми соседними атомами. Упрощенно строение кристалла металла представляется следующим образом: в узлах кристаллической решетки находятся ионы Ме п+ и атомы Ме°, а между ними относительно свободно перемещаются валентные электроны, осуществляя связь между всеми атомами и ионами металла (рис. 3). Это особый тип химической связи, называемой металлической.
· Металлическая связь — связь между атомами и ионами металлов в кристаллической решетке, осуществляемая обобществленными валентными электронами.
Благодаря этому типу химической связи металлы обладают определенным комплексом физических и химических свойств, отличающим их от неметаллов.
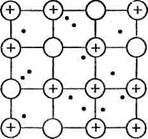
Рис. 3. Схема кристаллической решетки металлов.
Прочность металлической связи обеспечивает устойчивость кристаллической решетки и пластичность металлов (способность подвергаться разнообразной обработке без разрушения). Свободное передвижение валентных электронов позволяет металлам хорошо проводить электрический ток и тепло. Способность отражать световые волны (т.е. металлический блеск) также объясняется строением кристаллической решетки металла.
Таким образом, наиболее характерными физическими свойствами металлов в зависимости от наличия металлической связи являются:
■металлический блеск и непрозрачность;
■пластичность, ковкость, плавкость;
■высокие электро- и теплопроводность; и склонность к образованию сплавов.
Химические связи
Химическая связь - связь между атомами в молекуле или молекулярном соединении, возникающая в результате переноса электронов с одного атома на другой, либо обобществления электронов для обоих атомов.
Различают несколько типов химических связей: ковалентная, ионная, металлическая, водородная.

Ковалентная связь ( лат. со - совместно + valens - имеющий силу)
Ковалентная связь возникает между двумя атомами по обменному механизму (обобществление пары электронов) или донорно-акцепторному механизму (электронов донора и свободной орбитали акцептора).
Ковалентной связью соединены атомы в молекулах простых веществ (Cl2, Br2, O2), органических веществ (C2H2), а также, в общем случае, между атомами неметалла и другого неметалла (NH3, H2O, HBr).
Если атомы, образующие ковалентную связь, имеют одинаковые значения электроотрицательности, то связь между ними называется ковалентной неполярной связью. В таких молекулах нет "полюса" - электронная плотность распределяется равномерно. Примеры: Cl2, O2, H2, N2, I2.
Если атомы, образующие ковалентную связь, имеют разные значения электроотрицательности, то связь между ними называется ковалентной полярной. В таких молекулах имеется "полюс" - электронная плотность смещена к более электроотрицательному элементу. Примеры: HCl, HBr, HI, NH3, H2O.

Ковалентная связь может быть образована по обменному механизму - обобществлению электронной пары. В таком случае каждый атом "одинаково" вкладывается создание связи. Например, два атома азота, образующие молекулу N2, отдают по 3 электрона с внешнего уровня для создания связи.

Существует донорно-акцепторный механизм образования ковалентной связи, при котором один атом выступает в качестве донора неподеленной электронной пары. Другой атом не тратит свои электроны, а только лишь предоставляет орбиталь (ячейку) для этой электронной пары.
- NH4 + - в ионе аммония
- NH4 + Cl, NH4 + Br - внутри иона аммония во всех его солях
- NO3 - - в нитрат ионе
- KNO3, LiNO3 - внутри нитрат иона во всех нитратах
- O3 - озон
- H3O + - ион гидроксония
- CO - угарный газ
- K[Al(OH)4], Na2[Zn(OH)4] - во всех комплексных солях есть хотя бы одна ковалентная связь, возникшая по донорно-акцепторному механизму

Ионная связь
Ионная связь - один из видов химической связи, в основе которого лежит электростатическое взаимодействие между противоположно заряженными ионами.
В наиболее частом случае ионная связь образуется между типичным металлом и типичным неметаллом. Примеры:
Большой подсказкой служит таблица растворимости, ведь все соли имеют ионные связи: CaSO4, Na3PO4. Даже ион аммония не исключение, между катионом аммония и различными анионами образуются ионные связи, например в соединениях: NH4I, NH4NO3, (NH4)2SO4.
Часто в химии встречаются несколько связей внутри одной молекулы. Рассмотрим, например, фосфат аммония, обозначив тип каждой связи внутри этой молекулы.

Металлическая связь
Металлическая связь - вид химической связи удерживающая вместе атомы металла. Этот тип связи выделен отдельно, так как его отличием является наличие высокой концентрации в металлах электронов проводимости - "электронного газа". По природе металлическая связь близка к ковалентной.
"Облако" электронов в металлах способно приходить в движение под различным воздействием. Именно оно является причиной электропроводности металлов.

Водородная связь
Водородная связь - вид химической связи, образующийся между некоторыми молекулами, содержащими водород. Одна из наиболее частых ошибок считать, что в самом газе, водороде, имеются водородные связи - это вовсе не так.
Водородные связи возникают между атомом водорода и другим более электроотрицательным атомом (O, S, N, C).
- H2O
- NH3
- HF
- Органических спиртов: С2H5OH, C3H7OH
- Органических кислот: CH3COOH, C2H5COOH

Отчасти за счет водородных связей наблюдается то самое исключение, связанное с усилением кислотных свойств в ряду галогеноводородных кислот: HF → HCl → HBr → HI. Фтор является самым ЭО-ым элементов, сильно притягивает к себе атом водорода другой молекулы, что снижает способность кислоты отщеплять водород и снижает ее силу.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь - Химическая связь и строение вещества - ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ
6. Укажите два вещества, в каждом из которых имеются связи, образованные по донорно-акцепторному механизму.
7. Водородная связь образуется между молекулами
8. Общим для металлической и ковалентной связи является
1) наличие общих пар электронов
2) наличие молекул
3) наличие отрицательных ионов
4) обобществление электронов
9. Наименьшую длину связь Н — Э имеет в молекуле
10. В молекуле фенола
1) 12 σ-связей и 3 π-связи
2) 13 σ-связей и 3 π-связи
3) 8 σ-связей и 3 π-связи
4) 13 σ-связей и 6 π-связей
Тесты с выбором ответа для самостоятельного решения
11. Между атомами разных неметаллов образуется связь
2) ковалентная неполярная
4) ковалентная полярная
12. Неполярная ковалентная связь имеется в молекуле
13. Связь, образованная по донорно-акцепторному механизму, имеется в соединении
14. Водородная связь образуется между молекулами в каждом из двух соединений
15. Укажите два вещества, в каждом из которых имеются ковалентные полярные связи.
16. Укажите два вещества, в каждом из которых имеются только ионные связи.
17. Укажите два вещества, в каждом из которых имеются ковалентные неполярные связи.
18. Водородная связь образуется между молекулами
19. Металлические связи образуются
1) между атомами активных металлов и активных неметаллов
2) между атомами неактивных металлов и неактивных неметаллов
3) между атомами разных неметаллов
20. В молекуле ортофосфорной кислоты
1) 6 σ-связей и 2 π-связи
3) 7 σ-связей и 1 π-связь
4) 5 σ-связей и 3 π-связи
Ответы на тесты раздела 1.3.1
1. 3 2. 1 3. 4 4. 2 5. 3 6. 2 7. 3 8. 4 9. 1 10. 2 11. 4 12. 4 13. 1 14. 3 15. 3 16. 4 17. 1 18. 2 19. 4 20. 3
Решения тестов раздела 1.3.1
Решение 1. Ковалентная неполярная связь обычно образуется между одинаковыми атомами неметаллов, например, в молекулах Н2, O2, N2 и др. Ковалентная неполярная связь — это связь с помощью общей пары электронов, которая располагается на середине расстояния между двумя одинаковыми атомами.
Насыщаемость ковалентной связи состоит в том, что атомы образуют ограниченное число связей, равное их валентности. Направленность ковалентной связи обозначает, что связь образуется в определенном направлении — направлении максимального перекрывания орбиталей. В отличие от ковалентной связи ионная связь — ненасыщаемая и ненаправленная.
Таким образом, между атомами одного и того же неметалла образуется ковалентная неполярная связь.
Решение 2. Ковалентная полярная связь образуется между атомами разных неметаллов. Ковалентная полярная связь — это связь с помощью общей пары электронов, которая сдвинута в сторону более электроотрицательного атома. Такая связь имеется в молекуле СO2. В KI имеются ионные связи, в F2 и Н2 — связи ковалентные неполярные.
Решение 3. Ионная связь — это электростатическая связь между ионами противоположных зарядов. Ионная связь образуется между атомами активных металлов и атомами активных неметаллов, например, в KI, СаСl2 и др.
Решение 4. Ионная связь образуется между атомами активных металлов и атомами активных неметаллов. Атом металла имеется только в сульфате калия. В этом соединении имеются ионные связи между катионами калия К + и анионами SO4 2- . Другие соединения (H2SO4, ССl4, С2Н5ОН) образованы с помощью ковалентной полярной связи.
Решение 5. По донорно-акцепторному механизму связь образуется с помощью общей пары электронов, образованной из свободной орбитали одного атома — акцептора и не поделенной орбитали другого атома — донора. Акцепторами являются катионы водорода Н + и катионы металлов Fe 3+ , Cu 2+ , Ag + и др. Донорами являются анионы ОН - , CN - , Сl - и др. и нейтральные молекулы NH3, Н2О. Ион аммония NH4 + образуется с помощью донорно-акцепторной связи из катиона водорода и молекулы аммиака, поэтому все соли аммония образованы с участием донорно-акцепторной связи. Такой солью среди перечисленных веществ является хлорид аммония NH4Cl.
Решение 6. В координационных соединениях связи образованы по донорно-акцепторному механизму. Внешним признаком записи формул координационных соединений является наличие квадратных скобок, которые отделяют внутреннюю сферу комплекса от внешней сферы. Например: в формуле красной кровяной соли, или гексацианоферрата(III) калия, K3[Fe(CN)6]. Связь между ионами внешней сферы 3К + и ионами внутренней сферы Fe(CN)6 3 — ионная. Связь между центральным ионом Fe 3+ и лигандами CN - образована по донорно-акцепторному механизму. Кроме того, как отмечалось ранее, связи, образованные по донорно-акцепторному механизму, характерны для солей аммония. Таким образом, связи, образованные по донорно-акцепторному механизму, имеются в таких соединениях, как гидроксид диамин серебра(I) [Ag(NH3)2]OH, сульфат аммония (NH4)2SO4, гексацианоферрат(III) калия K3[Fe(CN)6], тетрагидроксоалюминат натрия Na[Al(OH)4], хлорид метиламмония [CH3NH3]Cl.
Решение 7. Водородная связь образуется между положительно заряженными атомами водорода, с одной стороны, и электроотрицательными атомами (F, О, N), с другой стороны. Водородные связи отсутствует между молекулами алканов, алкенов и алкинов, поскольку в этих соединениях нет электроотрицательных атомов. Водородные связи отсутствует между молекулами альдегидов, кетонов, простых и сложных эфиров, хотя в этих соединениях есть электроотрицательные атомы кислорода, но атомы водорода соединены с атомами углерода и не несут достаточного положительного заряда. Водородные связи образуются между молекулами спиртов и кислот, поскольку в этих соединениях присутствуют электроотрицательные атомы кислорода и атомы водорода, соединенные с атомами кислорода и несущие значительный положительных заряд. Наличие водородных связей, более прочных, чем силы межмолекулярного взаимодействия, обуславливает более высокие температуры кипения спиртов и кислот по сравнению с альдегидами. Так, при обычных условиях метанол и метановая кислота — жидкости, а метаналь — газ.
Решение 8. Металлическая связь образуется с помощью свободных электронов. Кристаллические решетки металлов построены из атомов и положительных ионов металлов и свободных электронов. Там нет молекул и отрицательных ионов. Металлическая связь сходна с ковалентной связью, так как в ее основе также лежит обобществление электронов, но в металлах электроны не связаны прочно с атомами, а свободно перемещаются по кристаллу. Поэтому металлы пластичны, проводят электрический ток, проводят тепло, имеют характерный металлический блеск и т.д.
Решение 9. Длина связи, то есть расстояние между ядрами двух атомов, зависит от размеров этих атомов. Так, в ряду F - Cl - Br - I радиус атома увеличивается, поэтому длина связи в ряду молекул HF - НСl - HBr - HI также увеличивается. С увеличением длины связи энергия связи, как правило, уменьшается. Энергия связи — это энергия, необходимая для разрыва связи. Е(Н2) = 436 кДж/моль, Е(Сl2) = 242 кДж/моль, Е(N2) = 946 кДж/моль. С увеличением кратности связи ее энергия увеличивается, а длина связи уменьшается. Таким образом, наименьшая длина связи Н - Э в молекуле HF.
Решение 10. Ковалентные связи могут быть простыми (одинарными), двойными или тройными. Простые, двойные или тройные связи — это связи двух атомов с помощью одной, двух или трех общих пар электронов. Понятие “общая пара электронов” соответствует связывающему электронному облаку. Связь называется σ-связью (“сигма”-связью), если электронное облако этой связи располагается вдоль линии, соединяющей ядра двух атомов. Простая связь — это всегда σ-связь. σ-Связь может быть дополнена одной или двумя π-связями (“пи”-связями). Электронная плотность я-связей состоит из двух частей, симметрично расположенных относительно линии, соединяющей ядра двух атомов. Двойная связь состоит из одной σ-связи и одной π-связи. Тройная связь состоит из одной σ-связи и двух π-связей. Для решения вопроса о числе связей необходимо написать структурную формулу фенола, не забыв написать связи между атомами углерода с атомами водорода. Записав бензольное кольцо в виде формулы Кекуле, можно увидеть, что имеются три двойные связи, а значит, имеются три π-связи. Из формулы видно, что имеются 13 σ-связей: шесть циклических связей С-С, пять связей С-Н, одна связь С-O и одна связь О-Н.
Библиотека образовательных материалов для студентов, учителей, учеников и их родителей.
Наш сайт не претендует на авторство размещенных материалов. Мы только конвертируем в удобный формат материалы из сети Интернет, которые находятся в открытом доступе и присланные нашими посетителями.
Если вы являетесь обладателем авторского права на любой размещенный у нас материал и намерены удалить его или получить ссылки на место коммерческого размещения материалов, обратитесь для согласования к администратору сайта.
Разрешается копировать материалы с обязательной гипертекстовой ссылкой на сайт, будьте благодарными мы затратили много усилий чтобы привести информацию в удобный вид.
Ионная связь. Металлическая связь.
Ионная – связь между противоположно заряженными ионами.
Механизм образования ионной связи можно рассмотреть на примере реакции между натрием и хлором. Атом щелочного металла легко теряет электрон, а атом галогена - приобретает. В результате этого возникает катион натрия и хлорид-ион. Они образуют соединение за счет электростатического притяжения между ними.
Каждый катион может притягивать любое число анионов, и наоборот. Число взаимодействий между ионами в твердом состоянии ограничивается размерами кристалла.
Для возникновения ионной связи необходимо, чтобы сумма значений энергии ионизации Ei (для образования катиона) и сродства к электрону Ae (для образования аниона) должна быть энергетически выгодной. Это ограничивает образование ионной связи атомами активных металлов (элементы IA- и IIA-групп, некоторые элементы IIIA-группы и некоторые переходные) и активных неметаллов (галогены, халькогены, азот).
Даже в тех соединениях, которые обычно относят к ионным, не происходит полного перехода электронов от одного атома к другому; электроны частично остаются в общем пользовании.. Поэтому правильнее говорить о степени ионности (полярности) ковалентной связи.
При этом ионы стремятся расположиться таким образом, чтобы силы притяжения между ними были максимальными, а силы отталкивания - минимальными.
1.Ненаправленость, т.к электронное поле ионов имеет сферическую симетрию, поэтому ионы притягиваются одинаково в любом направлении.
2.Ненасыщеность. В реальной ситуации кол-во притягивающихся ионов лимитируется их размерами и силами отталкивания между одноименными зарядами.
Не насыщенность и не направленность приводит к тому, что ионные соединения существуют не в виде отдельных молекул, а в виде кристаллов, в которых каждый ион одного знака окружен ионами другого знака.
Экспериментально доказано, что заряды ионов меньше 1 имеют место перекрывания электронных облаков ионов, т.е ионная связь имеет долю ковалентной связи. Можно считать, что ионная связь - предельный случай ковалентной полярной связи. Ионная связь образует связь между типичным металлом и неметаллом.
Металлическая связь- связь между атомами в металлическом кристалле, возникающая за счёт обобществления их валентных электронов.
Механизм. В узлах кристаллической решётки расположены положительные ионы металла. Между ними беспорядочно, как молекулы газа, движутся электроны проводимости, происходящие из атомов металлов при образовании ионов. Эти электроны играют роль «цемента», удерживая вместе положительные ионы. Вместе с тем и электроны удерживаются ионами в пределах кристаллической решётки и не могут её покинуть. В металлах в большинстве случаев проявляются высокие координационные числа (например, 12 или 8).
Между узлами решеток находятся элементы газа. Газ состоит их D-локализованных электронов.
Идет постоянный обмен между узлами решетки и электроном газа. Все электроны газа принадлежат всем узлам решетки. Электрон газа легко подвижен. Таким строением металлической кристаллической решеткой обусловлены св-ва металлов: электропроводимость, высокая теплопроводность, пластичность (способность менять форму без разрушения при воздействии), металлический блеск.
Общие химические свойства металлов
В химических реакциях металлы выступают в роли восстановителейи повышают степень окисления, превращаясь из простых веществ в катионы.
Химические свойства металлов различаются в зависимости от химической активности металла. По активности в водных растворах металлы расположены в ряд напряжений.

В этот ряд, составленный русским химиком Н.Н. Бекетовым, включен также неметалл водород. Активность металлов убывает слева направо:
Запомнить! Металлы, стоящие в ЭХ ряду после водорода, называют неактивными металлами.
Металлы, расположенные в ЭХ ряду до алюминия называют сильноактивными или активными металлами.
Общие химические свойства металлов
1) Многие металлы вступают в реакцию с типичными неметаллами – галогенами, кислородом, серой. При этом образуются соответственно хлориды, оксиды, сульфиды и другие бинарные соединения:
- с азотом некоторые металлы образуют нитриды, реакция практически всегда протекает при нагревании;
- с серой металлы образуют сульфиды – соли сероводородной кислоты;
- с водородом самые активные металлы образуют ионные гидриды (бинарные соединения, в которых водород имеет степень окисления -1);
- с кислородом большинство металлов образует оксиды – амфотерные и основные. Основной продукт горения натрия - пероксид Na2O2; а калий и цезий горят с образованием надпероксидов MeO2.
2) Следует обратить внимание на особенности взаимодействие металлов с водой:
- Активные металлы, находящиеся в ряду активности металлов до Mg (включительно), реагируют с водой с образованием щелочей и водорода:Ca+2H2O=Ca(OH)2+H2↑
- Активные металлы (например, натрий и литий), взаимодействуют с водой со взрывом.
- Металлы средней активности окисляются водой при нагревании до оксида:
- Неактивные металлы (Au, Ag, Pt) - не реагируют с водой.
→[Li……Mg]MOH+H2↑ активные металлы (до Al)
H2O+M→[Al……PbMxOy+H2↑ среднеактивные металлы (от Al до H), только при нагревании
→[Bi……Au]≠ неактивные металлы (после Н)
Более подробно взаимодействие металлов с водой рассмотрено в темах, посвященных химии отдельных групп.
3) С разбавленными кислотами реагируют металлы, стоящие в ЭХР до водорода: происходит реакция замещения с образованием соли и газообразного водорода. При этом кислота проявляет окислительные свойства за счет наличия катиона водорода:
4) Взаимодействие азотной кислоты (любой концентрации) и концентрированной серной кислоты протекает с образованием других продуктов: кроме соли и водорода в этих реакциях выделяется продукт восстановления серной (или азотной) кислоты. Подробнее см.тему "Взаимодействие азотной кислоты с металлами и неметаллами.
Запомнить! Все металлы, стоящие в ряду левее водорода, вытесняют его из разбавленных кислот, а металлы, расположенные справа от водорода, с растворами кислот не реагируют (азотная кислота – исключение).
5) Активность металлов также влияет на возможность протекания простого вещества металлас оксидом или солью другого металла. Металл вытесняет из солей менее активные металлы, стоящие правее его в ряду напряжений.
Запомнить! Для протекания реакции между металлом и солью другого требуется, чтобы соли, как вступающие в реакцию, так и образующиеся в ходе нее, были растворимы в воде. Металл вытесняет из соли только более слабый металл.
Например, для вытеснения меди из водного раствора сульфата меди подходит железо,
но не подходят свинец – так как он образует нерастворимый сульфат. Если опустить кусочек свинца в раствор сульфата меди, то с поверхности металла покроется тонким слоем сульфата, и реакция прекратится
Другой пример: цинк легко вытесняет серебро из раствора нитрата серебра, однако реакция цинка со взвесью сульфида серебра, нерастворимого в воде, практически не протекает.
Читайте также:
