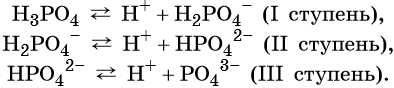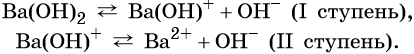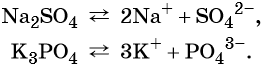Ионы металла и гидроксид ионы при электролитической диссоциации
Обновлено: 17.05.2024
Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Примеры решения задач
Задачи для самостоятельного решения
Степень диссоциации
Вещества, которые в растворах или расплавах полностью или частично распадаются на ионы, называются электролитами.
Степень диссоциации α — это отношение числа молекул, распавшихся на ионы N′ к общему числу растворенных молекул N:
α = N′/N
Степень диссоциации выражают в процентах или в долях единицы. Если α =0, то диссоциация отсутствует и вещество не является электролитом. В случае если α =1, то электролит полностью распадается на ионы.
Классификация электролитов
Согласно современным представлениям теории растворов все электролиты делятся на два класса: ассоциированные (слабые) и неассоциированные (сильные) . Неассоциированные электролиты в разбавленных растворах практически полностью диссоциированы на ионы. Для этого класса электролитов a близко к единице (к 100 %). Неассоциированными электролитами являются, например, HCl, NaOH, K2SO4 в разбавленных водных растворах.
Ассоциированные электролиты подразделяются на три типа:
- Слабые электролиты существуют в растворах как в виде ионов, так и в виде недиссоциированных молекул. Примерами ассоциированных электролитов этой группы являются, в частности, Н2S, Н2SO3, СН3СOОН в водных растворах.
- Ионные ассоциаты образуются в растворах путем ассоциации простых ионов за счет электростатического взаимодействия. Ионные ассоциаты возникают в концентрированных растворах хорошо растворимых электролитов. В результате в растворе находятся как простые ионы, так и ионные ассоциаты. Например, в концентрированном водном растворе КCl образуются простые ионы К + , Cl — , а также возможно образование ионных пар (К + Cl — ), ионных тройников (K2Cl + , KCl2 — ) и ионных квадруполей (K2Cl2, KCl3 2- , K3Cl 2+ ).
- Комплексные соединения (как ионные, так и молекулярные), внутренняя сфера которых ступенчато диссоциирует на ионные и (или) молекулярные частицы.
Примеры комплексных ионов: [Cu(NH3)4] 2+ , [Fe(CN)6] 3+ , [Cr(H2O)3Cl2] + .
При таком подходе один и тот же электролит может относиться к различным типам в зависимости от концентрации раствора, вида растворителя и температуры. Подтверждением этому являются данные, приведенные в таблице.
Таблица. Характеристика растворов KI в различных растворителях
Приближенно, для качественных рассуждений можно пользоваться устаревшим делением электролитов на сильные и слабые. Выделение группы электролитов “средней силы” не имеет смысла. Эти электролиты являются ассоциированными. К слабым электролитам обычно относят электролиты, степень диссоцииации которых мала α
Таким образом, к сильным электролитам относятся разбавленные водные растворы почти всех хорошо растворимых в воде солей, многие разбавленные водные растворы минеральных кислот (НСl, HBr, НNО3, НСlO4 и др.), разбавленные водные растворы гидроксидов щелочных металлов. К слабым электролитам принадлежат все органические кислоты в водных растворах, некоторые водные растворы неорганических кислот, например, H2S, HCN, H2CO3, HNO2, HСlO и др. К слабым электролитам относится и вода.
Диссоциация электролитов
Уравнение реакции диссоциации сильного электролита можно представить следующим образом. Между правой и левой частями уравнения реакции диссоциации сильного электролита ставится стрелка или знак равенства:
HCl → H + + Cl —
Допускается также ставить знак обратимости, однако в этом случае указывается направление, в котором смещается равновесие диссоциации, или указывается, что α≈1. Например:
NaOH → Na + + OH —
Диссоциация кислых и основных солей в разбавленных водных растворах протекает следующим образом:
NaHSO3 → Na + + HSO3 —
Анион кислой соли будет диссоциировать в незначительной степени, поскольку является ассоциированным электролитом:
HSO3 — → H + + SO3 2-
Аналогичным образом происходит диссоциация основных солей:
Mg(OH)Cl → MgOH + + Cl —
Катион основной соли подвергается дальнейшей диссоциации как слабый электролит:
MgOH + → Mg 2+ + OH —
Двойные соли в разбавленных водных растворах рассматриваются как неассоциированные электролиты:
Комплексные соединения в разбавленных водных растворах практически полностью диссоциируют на внешнюю и внутреннюю сферы:
В свою очередь, комплексный ион в незначительной степени подвергается дальнейшей диссоциации:
[Fe(CN)6] 3- → Fe 3+ + 6CN —
Константа диссоциации
При растворении слабого электролита К А в растворе установится равновесие:
КА ↔ К + + А —
которое количественно описывается величиной константы равновесия Кд, называемой константой диссоциации :
Kд = [К + ] · [А — ] /[КА] (2)
Константа диссоциации характеризует способность электролита диссоциировать на ионы. Чем больше константа диссоциации, тем больше ионов в растворе слабого электролита. Например, в растворе азотистой кислоты HNO2 ионов Н + больше, чем в растворе синильной кислоты HCN, поскольку К(HNO2) = 4,6·10 — 4 , а К(HCN) = 4,9·10 — 10 .
Для слабых I-I электролитов (HCN, HNO2, CH3COOH) величина константы диссоциации Кд связана со степенью диссоциации α и концентрацией электролита c уравнением Оствальда:
Кд = (α 2· с)/(1-α) (3)
Для практических расчетов при условии, что α
Кд = α 2· с (4)
Поскольку процесс диссоциации слабого электролита обратим, то к нему применим принцип Ле Шателье. В частности, добавление CH3COONa к водному раствору CH3COOH вызовет подавление собственной диссоциации уксусной кислоты и уменьшение концентрации протонов. Таким образом, добавление в раствор ассоциированного электролита веществ, содержащих одноименные ионы, уменьшает его степень диссоциации.
Следует отметить, что константа диссоциации слабого электролита связана с изменением энергии Гиббса в процессе диссоциации этого электролита соотношением:
ΔGT 0 = — RTlnKд (5)
Уравнение (5) используется для расчета констант диссоциации слабых электролитов по термодинамическим данным.
Примеры решения задач
Задача 1. Определите концентрацию ионов калия и фосфат-ионов в 0,025 М растворе K3PO4.
Решение. K3PO4 – сильный электролит и в водном растворе диссоциирует полностью:
Следовательно, концентрации ионов К + и РО4 3- равны соответственно 0,075М и 0,025М.
Задача 2. Определите степень диссоциации αд и концентрацию ионов ОН — (моль/л) в 0,03 М растворе NH3·H2О при 298 К, если при указанной температуре Кд(NH3·H2О) = 1,76× 10 — 5 .
Решение. Уравнение диссоциации электролита:
Концентрации ионов: [NH4 + ] = α С ; [OH — ] = α С , где С – исходная концентрация NH 3 ·H 2 О моль/л. Следовательно:
Kд = αС · αС /(1 — αС)
Кд ≈ α 2 С
Константа диссоциации зависит от температуры и от природы растворителя, но не зависит от концентрации растворов NH 3 ·H 2 О . Закон разбавления Оствальда выражает зависимость α слабого электролита от концентрации.
α = √( Кд / С) = √(1,76× 10 — 5 / 0,03) = 0,024 или 2,4 %
[OH — ] = αС, откуда [OH — ] = 2,4·10 — 2 ·0,03 = 7,2·10 -4 моль/л.
Задача 3. Определите константу диссоциации уксусной кислоты, если степень диссоциации CH3CОOH в 0,002 М растворе равна 9,4 %.
Решение. Уравнение диссоциации кислоты:
CH3CОOH → СН3СОО — + Н + .
α = [Н + ] / Сисх(CH3CОOH)
откуда [Н + ] = 9,4·10 — 2 ·0,002 = 1,88·10 -4 М.
Kд = [Н + ] 2 / Сисх(CH3CОOH)
Константу диссоциации можно также найти по формуле: Кд ≈ α 2 С .
Задача 4. Константа диссоциации HNO2 при 298К равна 4,6× 10 — 4 . Найдите концентрацию азотистой кислоты, при которой степень диссоциации HNO2 равна 5 %.
Решение.
Кд = α 2 С , откуда получаем С исх (HNO 2 ) = 4,6·10 — 4 /(5·10 — 2 ) 2 = 0,184 М.
Задача 5. На основе справочных данных рассчитайте константу диссоциации муравьиной кислоты при 298 К.
Решение. Уравнение диссоциации муравьиной кислоты
В “Кратком справочнике физико–химических величин” под редакцией А.А. Равделя и А.М. Пономаревой приведены значения энергий Гиббса образований ионов в растворе, а также гипотетически недиссоциированных молекул. Значения энергий Гиббса для муравьиной кислоты и ионов Н + и СООН — в водном растворе приведены ниже:
Вещество, ион НСООН Н + СООН — ΔGT 0 , кДж/моль — 373,0 0 — 351,5 Изменение энергии Гиббса процесса диссоциации равно:
ΔGT 0 = — 351,5- (- 373,0) = 21,5 кДж/моль.
Для расчета константы диссоциации используем уравнение (5). Из этого уравнения получаем:
lnKд = — Δ GT 0 /RT= — 21500/(8,31 298) = — 8,68
Откуда находим: Kд = 1,7× 10 — 4 .
Задачи для самостоятельного решения
1. К сильным электролитам в разбавленных водных растворах относятся:
13.2. К слабым электролитам в водных растворах относятся:
3. Определите концентрацию ионов NH4 + в 0,03 М растворе (NH4)2Fe(SO4)2;
4. Определите концентрацию ионов водорода в 6 мас.% растворе H2SO4, плотность которого составляет 1,038 г/мл. Принять степень диссоциации кислоты по первой и второй ступеням равной 100 %.
5. Определите концентрацию гидроксид-ионов в 0,15 М растворе Ba(OH)2.
6. Степень диссоциации муравьиной кислоты в 0,1 М растворе равна 4 %. Рассчитайте Концентрацию ионов водорода в этом растворе и константу диссоциации НСООН.
7. Степень диссоциации муравьиной кислоты в водном растворе увеличится при:
а) уменьшении концентрации HCOOH;
б) увеличении концентрации HCOOH;
в) добавлении в раствор муравьиной кислоты HCOONa;
г) добавлении в раствор муравьиной кислоты НCl.
8. Константа диссоциации хлорноватистой кислоты равна 5× 10 — 8 . Определите концентрацию HClO, при которой степень диссоциации HClO равна 0,5 %, и концентрацию ионов Н + в этом растворе.
0,002М; 1× 10 — 5 М.
9. Вычислите объем воды, который необходимо добавить к 50 мл 0,02 М раствора NH3·H2О, чтобы степень диссоциации NH3·H2О увеличилась в 10 раз, если Кд(NH4OH) = 1,76·10 — 5 .
10. Определите степень диссоциации азотистой кислоты в 0,25 М растворе при 298 К, если при указанной температуре Кд(HNO2) = 4,6× 10 — 4 .
Напишите, пожалуйста, правила для уравнений диссоциации веществ. Или ссылку киньте, пожалуйста.
При растворении в воде (или расплавлении) электролиты распадаются на положительно и отрицательно заряженные ионы (подвергаются электролитической диссоциации) .
Под действием электрического тока катионы (+) двигаются к катоду (-), а анионы (-) – к аноду (+).
Электролитическая диссоциация - процесс обратимый (обратная реакция называется моляризацией) .
Степень электролитической диссоциации (a) зависит от природы электролита и растворителя, температуры и концентрации. Она показывает отношение числа молекул, распавшихся на ионы к общему числу молекул, введенных в раствор .
Электролитическая диссоциация веществ, идущая с образованием свободных ионов объясняет электрическую проводимость растворов.Процесс электролитической диссоциации принято записывать в виде схемы, не раскрывая его механизма и опуская растворитель (H2O), хотя он является основным участником.
Из электронейтральности молекул вытекает, что суммарный заряд катионов и анионов должен быть равен нулю.С помощью теории электролитической диссоциации дают определения и описывают свойства кислот, оснований и солей.
Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода
Н3РО4 → Н (+) + Н2РО4(-)(первая ступень)Н2РО-4→ Н (+) + НРO4(2-) (вторая ступень)
НРО2-4→ Н (+) PО4(З-) (третья ступень)
Диссоциация многоосновной кислоты протекает главным образом по первой ступени.
Основаниями называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы.
Например: KOH→ K(+) + OH(-)Кислотность основания определяется числом его гидроксильных групп (гидроксогрупп) . Например, NН4ОН - однокислотное основание, Са (ОН) 2 - двухкислотное, Fе (ОН) 3 - трехкислотное и т. д. Двух- и многокислотные основания диссоциируют ступенчато
Ca(ОН) 2 ↔Са (ОН) + + OH(-) (первая ступень)
Ca(OH)(+) ↔Ca(2+)+OH(-) (вторая ступень)
Однако имеются электролиты, которые при диссоциации одновременно образуют катионы водорода, и гидроксид-ионы. Эти электролиты называются амфотерными или амфолитами. К ним относятся вода, гидроксиды цинка, алюминия, хрома и ряд других веществ.
Диссоциацию амфотерного гидроксида цинка Zn(ОН) 2 можно выразить уравнением
2ОН (-) + Zn(2+) + 2Н2О ↔ Zn(ОН) 2 + 2Н2О ↔ [Zn(ОН) 4](2-)+ 2Н (+)Солями называются электролиты, при диссоциации которых образуются катионы металлов а также катион аммония NH4(+) и анионы кислотных остатков.
Кислые и основные соли диссоциируют ступенчато.
У кислых солей вначале отщепляются ионы металлов, а затем катионы водорода KHSO4 ↔ K(+) + HSO4(-) а затем: HSO4(-)↔ H(+)+SO4(2-)
У основных солей вначале отщепляются кислотные остатки, а затем гидроксид-ионы. Mg(OH)Cl ↔ Mg(OH)(+)+Cl(-) и потом
Mg(OH)(+) ↔ Mg(2+)+OH(-)
Теорию электролитической диссоциации изложил С. Аррениус.
Удачи!Катионы и анионы. Электролитическая диссоциация кислот, щелочей и солей (средних)
![]()
Катионами называют положительно заряженные ионы.
Анионами называют отрицательно заряженные ионы.
В процессе развития химии понятия «кислота» и «основание» претерпели серьёзные изменения. С точки зрения теории электролитической диссоциации кислотами называют электролиты, при диссоциации которых образуются ионы водорода H + , а основаниями — электролиты, при диссоциации которых образуются гидроксид-ионы OH – . Эти определения в химической литературе известны как определения кислот и оснований по Аррениусу.
В общем виде диссоциацию кислот представляют так:
где A – — кислотный остаток.
Такие свойства кислот, как взаимодействие с металлами, основаниями, основными и амфотерными оксидами, способность изменять окраску индикаторов, кислый вкус и т. д., обусловлены наличием в растворах кислот ионов H + . Число катионов водорода, которые образуются при диссоциации кислоты, называют её основностью. Так, например, HCl является одноосновной кислотой, H2SO4 — двухосновной, а H3PO4 — трёхосновной.
Многоосновные кислоты диссоциируют ступенчато, например:
![]()
От образовавшегося на первой ступени кислотного остатка H2PO4 – последующий отрыв иона H + происходит гораздо труднее из-за наличия отрицательного заряда на анионе, поэтому вторая ступень диссоциации протекает гораздо труднее, чем первая. На третьей ступени протон должен отщепляться от аниона HPO4 2– , поэтому третья ступень протекает лишь на 0,001%.
В общем виде диссоциацию основания можно представить так:
где M + — некий катион.
Такие свойства оснований, как взаимодействие с кислотами, кислотными оксидами, амфотерными гидроксидами и способность изменять окраску индикаторов, обусловлены наличием в растворах OH – -ионов.
Число гидроксильных групп, которые образуются при диссоциации основания, называют его кислотностью. Например, NaOH — однокислотное основание, Ba(OH)2 — двухкислотное и т. д.
Многокислотные основания диссоциируют ступенчато, например:
![]()
Большинство оснований в воде растворимо мало. Растворимые в воде основания называют щелочами.
Прочность связи М—ОН возрастает с увеличением заряда иона металла и увеличением его радиуса. Поэтому сила оснований, образуемых элементами в пределах одного и того же периода, уменьшается с возрастанием порядкового номера. Если один и тот же элемент образует несколько оснований, то степень диссоциации уменьшается с увеличением степени окисления металла. Поэтому, например, у Fe(OH)2 степень основной диссоциации больше, чем у Fe(OH)3.
Электролиты, при диссоциации которых одновременно могут образовываться катионы водорода и гидроксид-ионы, называют амфотерными. К ним относят воду, гидроксиды цинка, хрома и некоторые другие вещества. Их полный перечень приведён в уроке 6, а их свойства рассмотрены в уроке 16.
Солями называют электролиты, при диссоциации которых образуются катионы металлов (а также катион аммония NH4 + ) и анионы кислотных остатков.
![]()
Химические свойства солей будут описаны в уроке 18.
Тренировочные задания
1. К электролитам средней силы относится
2. К сильным электролитам относится
3. Сульфат-ион в значительном количестве образуется при диссоциации в водном растворе вещества, формула которого
4. При разбавлении раствора электролита степень диссоциации
1) остается неизменной
2) понижается
3) повышается
4) с начала повышается, потом понижается5. Степень диссоциации при нагревании раствора слабого электролита
6. Только сильные электролиты перечислены в ряду:
7. Водные растворы глюкозы и сульфата калия соответственно являются:
1) с ильным и слабым электролитом
2) неэлектролитом и сильным электролитом
3) слабым и сильным электролитом
4) слабым электролитом и неэлектролитом8. Степень диссоциации электролитов средней силы
1) больше 0,6
2) больше 0,3
3) лежит в пределах 0,03—0,3
4) менее 0,039. Степень диссоциации сильных электролитов
10. Степень диссоциации слабых электролитов
11. Электролитами являются оба вещества:
1) фосфорная кислота и глюкоза
2) хлорид натрия и сульфат натрия
3) фруктоза и хлорид калия
4) ацетон и сульфат натрия12. В водном растворе фосфорной кислоты H3PO4 наименьшая концентрация частиц
13. Электролиты расположены в порядке увеличения степени диссоциации в ряду
14. Электролиты расположены в порядке уменьшения степени диссоциации в ряду
15. Практически необратимо диссоциирует в водном растворе
1) уксусная кислота
2) бромоводородная кислота
3) фосфорная кислота
4) гидроксид кальция16. Электролитом, более сильным по сравнению с азотистой кислотой, будет
1) уксусная кислота
2) сернистая кислота
3) фосфорная кислота
4) гидроксид натрия17. Ступенчатая диссоциация характерна для
1) фосфорной кислоты
2) соляной кислоты
3) гидроксида натрия
4) нитрата натрия18. Только слабые электролиты представлены в ряду
1) сульфат натрия и азотная кислота
2) уксусная кислота, сероводородная кислота
3) сульфат натрия, глюкоза
4) хлорид натрия, ацетон19. Каждое из двух веществ является сильным электролитом
1) нитрат кальция, фосфат натрия
2) азотная кислота, азотистая кислота
3) гидроксид бария, сернистая кислота
4) уксусная кислота, фосфат калия20. Оба вещества являются электролитами средней силы
1) гидроксид натрия, хлорид калия
2) фосфорная кислота, азотистая кислота
3) хлорид натрия, уксусная кислота
4) глюкоза, ацетат калияИоны металла и гидроксид ионы при электролитической диссоциации
Известно, что существуют две основные причины прохождения электрического тока через проводники: либо за счёт движения электронов в электрическом поле, либо за счет движения ионов. Электрическая проводимость присуща, прежде всего, металлам. Ионная проводимость присуща многим химическим соединения, обладающим ионным строением, например, солям в твёрдом или расплавленном состояниях, а также многим водным и неводным растворам. В связи с этим все вещества принято условно делить на две категории:
а) вещества, растворы которых обладают ионной проводимостью, называются электролитами;
б) вещества, растворы которых не обладают ионной проводимостью, называются неэлектролитами.
К электролитам относится большинство неорганических кислот, оснований и солей. К неэлектролитам относятся многие органические соединения, например, спирты, углеводы.
Оказалось, что, кроме хорошей электропроводности, растворы электролитов обладают более низкими значениями давлениями пара растворителя и температуры плавления и более высокими температурами кипения по сравнению с соответствующими значениями для чистого растворителя или для раствора неэлектролита в этом же растворителе. Для объяснения этих свойств, шведский ученый С. Аррениус в 1887 г. предложил теорию электролитической диссоциации.
Под электролитической диссоциацией понимается распад молекул электролита в растворе с образованием положительно и отрицательно заряженных ионов - катионов и анионов под действием растворителя. Например, молекула уксусной кислоты может диссоциировать в водном растворе следующим образом:
Сущность теории электролитической диссоциации С. Аррениуса
1. Электролиты при растворении в воде распадаются (диссоциируют) на ионы: положительные (катионы) и отрицательные (анионы).
2. Под действием электрического тока положительно заряженные ионы движутся к отрицательному полюсу источника тока - катоду, и поэтому называются катионами, а отрицательно заряженные ионы движутся к положительному полюсу источника тока - аноду, и поэтому называются анионами.
3. Электролитическая диссоциация - процесс обратимый для слабых электролитов, т. е. вместе с распадом молекул на ионы (диссоциация) идет процесс соединения ионов в молекулы (ассоциация).
Электролиты подразделяются в зависимости от степени диссоциации на сильные и слабые.
вещества, которые диссоциируют полностью и необратимо, т. е. в растворе присутствуют только гидратиро-ванные ионы. Относятся все соли, сильные кислоты `"HI"`, `"HCl"`, `"HBr"`, `"HNO"_3`, `"H"_2"SO"_4`, `"HMnO"_4`, `"HClO"_4`, `"HClO"_3`, щелочи `"NaOH"`, `"LiOH"`, `"KOH"`, `"RbOH"`, `"CsOH"`, `"Ca"("OH")_2`, `"Ba"("OH")_2`, `"Sr"("OH")_2`.
С точки зрения теории электролитической диссоциации, кислотой называется соединение, образующее при диссоциации в водном растворе только ионы `"H"^+`:
Если кислота является двухосновной, то диссоциация кислоты происходит ступенчато. Количество стадий определяется основностью кислоты:
Сила бескислородных кислот возрастает в ряду однотипных соединений при переходе вниз по подгруппе кислотообразующего элемента: `"HCl"-"HBr"-"HI"`. Бромоводородная кислота `"HBr"` и йодоводородная `"HI"` кислоты сильнее хлороводородной, что объясняется увеличением межъядерных расстояний в их молекулах.
Фтороводородная (плавиковая) кислота `"HF"` растворяет стекло, но это вовсе не говорит о её силе. В ряду бескислородных галогенсодержащих кислот она относится к кислотам средней силы ввиду низкой концентрации в растворе ионов водорода из-за способности молекул `"HF"` к объединению (ассоциации), благодаря сильным водородным связям, возникающим при взаимодействии ионов `"F"^-` с молекулами `"HF"` (водородные связи) с образованием ионов `"HF"_2^-`, `"H"_2"F"_3^-` и других боле сложных частиц. В результате концентрация ионов водорода в водном растворе фтороводородной кислоты оказывается сильно пониженной.
Сила однотипных кислородных кислот изменяется в противоположном направлении, например, йодная кислота `"HIO"_4` слабее хлорной кислоты `"HClO"_4`. Если элемент образует несколько кислородных кислот, то наибольшей силой обладает кислота, в которой кислотообразующий элемент имеет самую высокую валентность.
Так, в ряду кислот `"HClO"-"HClO"_2-"HClO"_3-"HClO"_4` хлорная кислота наиболее сильная.
Схематически процесс распада (диссоциации) соляной кислоты на ионы можно представить следующим образом. Чтобы вещество в воде было электролитом, его молекула должна быть полярной.
Полярная молекула вещества окружена полярными молекулами воды, которые разрывают молекулу на две противоположно заряженные частицы – ионы.
с точки зрения теории электролитической диссоциации, представляет собой вещество, способное отдавать в растворе гидроксильную группу `"OH"^-`:
Диссоциация многокислотного гидроксида происходит ступенчато, например:
В свете теории электролитической диссоциации соли представляют собой соединения, образующие в водном растворе положительно заряженные ионы металла и отрицательно заряженные ионы кислотного остатка (для средних солей), а также кроме них ионы водорода (для кислых солей) и гидроксид-ионы (для основных солей):
вещества, которые диссоциируют частично и обратимо.
В растворе слабого электролита присутствуют гидратированные ионы и некоторая часть недиссоциированных молекул.
К слабым электролитам относятся:
3) оставшиеся кислоты, не относящиеся к сильным, например, `"HF"`, `"H"_2"S"`, `"HNO"_2`, `"H"_3"PO"_4` и другие, а также незамещённые органические кислоты. При растворении углекислого газа в воде образуется его гидрат `"CO"_2*"H"_2"O"` и в незначительном количестве угольная кислота `"H"_2"CO"_3`. Тем не менее, для диссоциации воспользуемся формулой угольной кислоты:
Практически диссоциация осуществляется лишь по первой ступени. Образующийся гидрокарбонат-ион `"HCO"_3^-` ведёт себя как слабый электролит.
Причиной диссоциации электролита в водных растворах является его гидратация, т. е. взаимодействие электролита с молекулами воды и разрыв химической связи в нем. В результате такого взаимодействия образуются гидратированные, т. е. связанные с молекулами воды, ионы.
Диссоциации проходит благодаря тому, что при гидратации ионов выделяется больше энергии, чем требуется на разрыв связи в молекуле. Примерно также происходит растворение ионного кристалла в воде и образование ионов. У кристаллов энергия гидратации ионов выше энергии кристаллической решётки.
Следует учитывать, что в растворах электролитов хаотически движущиеся гидратированные ионы могут столкнуться и вновь объединиться между собой. Этот обратный процесс называется ассоциацией. При некоторой постоянной температуре в данной системе устанавливается химическое равновесие, при котором скорость диссоциации станет равной скорости ассоциации.
Также необходимо учитывать, что свойства гидратированных ионов отличаются от свойств негидратированных ионов. Например, негидратированный ион меди `"Cu"^(2+)` - белый в безводных кристаллах сульфата меди (II) `"СuSO"_4` и имеет голубой цвет, когда гидратирован, т. е. связан с молекулами воды `"Cu"^(2+)*"H"_2"O"`. Гидратированные ионы имеют как постоянное, так и переменное количество молекул воды.
Основные свойства гидроксидов одного и того же элемента усиливаются с уменьшением его валентности. Так, основные свойства у гидроксида железа (II) выражены сильнее, чем у гидроксида железа (III) и наоборот.
Слабым электролитом является гидроксид аммония `"NH"_4"OH"`. При растворении аммиака `"NH"_3` в воде образуется раствор, который слабо проводит электрический ток и имеет горько-мыльный вкус. Среда раствора основная. В растворе образуются гидрат аммиака `"NH"_3*"H"_2"O"` и в незначительном количестве гидроксид аммония `"NH"_4"OH"`, который диссоциирует как слабый электролит с образованием ионов аммония `"NH"_4^+` и гидроксид-иона `"OH"^-`.
К слабым электролитам относят некоторые соли, например хлорид цинка `"ZnCl"_2`, тиоцианат железа `"Fe"("NCS")_3`, цианид ртути `"Hg"("CN")_2`, которые также диссоциируют по ступеням.
Разделение электролитов на сильные, средние и слабые зависит от доли продиссоциированных молекул или степени диссоциации `alpha`, которая показывает отношение числа молекул, распавшихся на ионы `(N_"д")`, к общему числу введённых в раствор молекул `(N_"р")`:
Электролиты со степенью диссоциации `30%` и более называют сильными, со степенью диссоциации `3`-`30%` называют средними (средней силы), со степенью диссоциации менее `3%` - слабыми.
Степень диссоциации не является строгим показателем силы электролита, т. к. она зависит от концентрации раствора, природы растворителя, присутствия в растворе другие электролитов.
При понижении концентрации степень диссоциации может повышаться, и в очень разбавленных растворах слабый электролит может находиться в состоянии почти полной диссоциации, в то же время в концентрированном растворе сильный электролит может вести себя как слабый и даже как неэлектролит.
Степень диссоциации как сильных, так и слабых электролитов зависит от концентрации раствора (степень диссоциации тем выше, чем более разбавлен раствор). Более точной характеристикой диссоциации электролита является константа диссоциации, которая от концентрации раствора не зависит.
Выражение для константы диссоциации можно получить, если записать уравнение реакции диссоциации электролита АК в общем виде:
Поскольку диссоциация слабого электролита является обратимым равновесным процессом, то к данной реакции применим закон действующих масс, и можно определить константу равновесия как
где `K_"дис"` - константа диссоциации, которая зависит от температуры и природы электролита и растворителя, но не зависит от концентрации электролита;
`[AK]` – концентрация недиссоцированных молекул;
`[A^-]`, `[K^+]` - молярные концентрации анионов и катионов.
Рассчитайте количество ионов водорода в `1` л раствора серной кислоты с концентрацией `0,1` моль/л.
`0,1` моль `0,1` моль
Количество ионов водорода равно `0,1` моль.
Запишем уравнение диссоциации по второй ступени и по справочным данным определим степень диссоциации (`0,3`):
$$ <\mathrm >_^\rightleftarrows $$ `"H"^+ +"SO"_4^(2-)`. `0,1` моль `0,03` моль Используем формулу для нахождения степени диссоциации (при решении задачи степень диссоциации удобно выразить в долях от единицы):
`n("диссоцH"_2"SO"_4)=0,1` моль/л `*0,3=0,03` моль.
Таким образом, в растворе появилось ионов `"H"^+` :
`0,1` моль `+ 0,03` моль `= 0,13` моль.
Следовательно, концентрация ионов водорода в растворе серной кислоты равна `0,13` моль/л.
Степень диссоциации гидроксида бария по первой ступени `- 92%`, по второй ступени `- 56%`. Рассчитайте число катионов бария и число гидроксид-ионов в `0,5` л `1,5 M` растворе.
1) Запишем уравнение электролитической диссоциации гидроксида бария:
1 ступень: `"Ba(OH")_2-> "BaOH"^+ + "OH"^-`,
2) Найдём количество вещества гидроксида бария, содержащегося в данном образце раствора:
3) Зная степень диссоциации вычислим число молекул `"Ba(OH")_2` распавшихся на ионы по первой ступени диссоциации:
Согласно диссоциации по `"I"` ступени, это количество вещества равно количеству вещества гидроксид-ионов, образовавшихся по первой ступени диссоциации, и количество ионов `"Ba(OH")^+`:
4) Исходя из количества вещества гидроксокатионов бария, образовавшихся на первой стадии диссоциации, и степени диссоциации по второй ступени, вычислим количество ионов `"Ba"("OH")^+`, диссоциирующих по второй ступени:
В соответствии с диссоциацией по `"II"` ступени, это количество вещества равно количеству вещества катионов `"Ba"^(2+)` и количеству ионов `"OH"^-`, образовавшихся по `"II"` ступени диссоциации:
5) Найдём число катионов `"Ba"^(2+)`, образующихся при диссоциации:
6) Вычислим количество вещества гидроксид-ионов, образовавшихся на обеих стадиях диссоциации, и их число:
Теория электролитической диссоциации
![]()
Электролиты – это вещества, растворы и расплавы которых проводят электрический ток.Электрический ток – это упорядоченное движение заряженных частиц под действием электрического поля. Таким образом, в растворах или расплавах электролитов есть заряженные частицы. В растворах электролитов, как правило, электрическая проводимость обусловлена наличием ионов.
Ионы – это заряженные частицы (атомы или группы атомов). Разделяют положительно заряженные ионы (катионы) и отрицательно заряженные ионы (анионы).
Электролитическая диссоциация — это процесс распада электролита на ионы при его растворении или плавлении.
Разделяют вещества — электролиты и неэлектролиты. К неэлектролитам относятся вещества с прочной ковалентной неполярной связью (простые вещества), все оксиды (которые химически не взаимодействуют с водой), большинство органических веществ (кроме полярных соединений — карбоновых кислот, их солей, фенолов) — альдегиды, кетоны, углеводороды, углеводы.
К электролитам относят некоторые вещества с ковалентной полярной связью и вещества с ионной кристаллической решеткой.
В чем же суть процесса электролитической диссоциации?
Поместим в пробирку несколько кристаллов хлорида натрия и добавим воду. Через некоторое время кристаллы растворятся. Что произошло?
Хлорид натрия – вещество с ионной кристаллической решеткой. Кристалл NaCl состоит из ионов Na + и Cl — . В воде этот кристалл распадается на структурные единицы-ионы. При этом распадаются ионные химические связи и некоторые водородные связи между молекулами воды. Попавшие в воду ионы Na + и Cl — вступают во взаимодействие с молекулами воды. В случае хлорид-ионов можно говорить про электростатическое притяжение дипольных (полярных) молекул воды к аниону хлора, а в случае катионов натрия оно приближается по своей природе к донорно-акцепторному (когда электронная пара атома кислорода помещается на вакантные орбитали иона натрия). Окруженные молекулами воды ионы покрываются гидратной оболочкой. Диссоциация хлорида натрия описывается уравнением:NaCl = Na + + Cl –
![Диссоциация хлорида натрия]()
При растворении в воде соединений с ковалентной полярной связью, молекулы воды, окружив полярную молекулу, сначала растягивают связь в ней, увеличивая её полярность, затем разрывают её на ионы, которые гидратируются и равномерно распределяются в растворе. Например, соляная ксилота диссоциирует на ионы так: HCl = H + + Cl — .
![Диссоциация соляной кислоты]()
При расплавлении, когда происходит нагревание кристалла, ионы начинают совершать интенсивные колебания в узлах кристаллической решётки, в результате чего она разрушается, образуется расплав, который состоит из ионов.
Процесс электролитической диссоциации характеризуется величиной степени диссоциации молекул вещества:
Степень диссоциации — это отношение числа продиссоциировавших (распавшихся) молекул к общему числу молекул электролита. Т.е., какая доля молекул исходного вещества распадается в растворе или расплаве на ионы.
Nпродисс — это число продиссоциировавших молекул,
Nисх — это исходное число молекул.
По степени диссоциации электролиты делят на делят на сильные и слабые.
Сильные электролиты (α≈1):
1. Все растворимые соли (в том числе соли органических кислот — ацетат калия CH3COOK, формиат натрия HCOONa и др.)
2. Сильные кислоты: HCl, HI, HBr, HNO3, H2SO4 (по первой ступени), HClO4 и др.;
3. Щелочи: NaOH, KOH, LiOH, RbOH, CsOH; Ca(OH)2, Sr(OH)2, Ba(OH)2.
Сильные электролиты распадаются на ионы практически полностью в водных растворах, но только в ненасыщенных. В насыщенных растворах даже сильные электролиты могут распадаться только частично. Т.е. степень диссоциации сильных электролитов α приблизительно равна 1 только для ненасыщенных растворов веществ. В насыщенных или концентрированны растворах степень диссоциации сильных электролитов может быть меньше или равна 1: α≤1.
Слабые электролиты (α <1):
1. Слабые кислоты, в т.ч. органические;
2. Нерастворимые основания и гидроксид аммония NH4OH;
3. Нерастворимые и некоторые малорастворимые соли (в зависимости от растворимости).
Неэлектролиты:
1. Оксиды, не взаимодействующие с водой (взаимодействующие с водой оксиды при растворении в воде вступают в химическую реакцию с образованием гидроксидов);
2. Простые вещества;
3. Большинство органических веществ со слабополярными или неполярными связями (альдегиды, кетоны, углеводороды и т.д.).
![Электролиты]()
Как диссоциируют вещества? По степени диссоциации различают сильные и слабые электролиты.
Сильные электролиты диссоциируют полностью (в насыщенных растворах), в одну ступень, все молекулы распадаются на ионы, практически необратимо. Обратите внимание — при диссоциации в растворе образуются только устойчивые ионы. Самые распространенные ионы можно найти в таблице растворимости — это ваша официальная шпаргалка на любом экзамене. Степень диссоциации сильных электролитов примерно равна 1. Например, при диссоциации фосфата натрия образуются ионы Na + и PO4 3– :
Диссоциация слабых электролитов : многоосновных кислот и многокислотных оснований происходит ступенчато и обратимо. Т.е. при диссоциации слабых электролитов распадается на ионы только очень небольшая часть исходных частиц. Например, угольная кислота:
HCO3 – ↔ H + + CO3 2–
Гидроксид магния диссоциирует также в 2 ступени:
Mg(OH)2 ⇄ Mg(OH) + OH –
Mg(OH) + ⇄ Mg 2+ + OH –
Кислые соли диссоциируют также ступенчато, сначала разрываются ионные связи, затем — ковалентные полярные. Например, гидрокабонат калия и гидроксохлорид магния:
KHCO3 ⇄ K + + HCO3 – (α=1)
Mg(OH)Cl ⇄ MgOH + + Cl – (α=1)
MgOH + ⇄ Mg 2+ + OH – (α
Степень диссоциации слабых электролитов намного меньше 1: α
Основные положения теории электролитической диссоциации, таким образом:
1. При растворении в воде электролиты диссоциируют (распадаются) на ионы.
2. Причина диссоциации электролиты в воде – это его гидратация, т.е. взаимодействие с молекулами воды и разрыв химической связи в нем.
3. Под действием внешнего электрического поля положительно заряженные ионы двигаюися к положительно заряженному электроду — катоду, их называют катионами. Отрицательно заряженные электроны двигаются к отрицательному электроду – аноду. Их называют анионами.
4. Электролитическая диссоциация происходит обратимо для слабых электролитов, и практически необратимо для сильных электролитов.
5. Электролиты могут в разной степени диссоциировать на ионы — в зависимости от внешних условий, концентрации и природы электролита.
6. Химические свойства ионов отличаются от свойств простых веществ. Химические свойства растворов электролитов определяются свойствами тех ионов, которые из него образуются при диссоциации.
Примеры .
1. При неполной диссоциации 1 моль соли общее количество положительных и отрицательных ионов в растворе составило 3,4 моль. Формула соли – а) K2S б) Ba(ClO3)2 в) NH4NO3 г) Fe(NO3)3
Решение: для начала определим силу электролитов. Это легко можно сделать по таблице растворимости. Все соли, приведенные в ответах — растворимые, т.е. сильные электролиты. Далее, запишем уравнения электролитической диссоциации и по уравнению определим максимально число ионов в каждом растворе:
а) K2S ⇄ 2K + + S 2– , при полном распаде 1 моль соли образуется 3 моль ионов, больше 3 моль ионов не получится никак;
б) Ba(ClO3)2 ⇄ Ba 2+ + 2ClO3 – , опять при распаде 1 моль соли образуется 3 моль ионов, больше 3 моль ионов не образуется никак;
в) NH4NO3 ⇄ NH4 + + NO3 – , при распаде 1 моль нитрата аммония образуется 2 моль ионов максимально, больше 2 моль ионов не образуется никак;
г) Fe(NO3)3 ⇄ Fe 3+ + 3NO3 – , при полном распаде 1 моль нитрата железа (III) образуется 4 моль ионов. Следовательно, при неполном распаде 1 моль нитрата железа возможно образование меньшего числа ионов (неполный распад возможен в насыщенном растворе соли). Следовательно, вариант 4 нам подходит.
Читайте также: