Ионы металлов имеют отрицательный заряд
Обновлено: 01.06.2024
Все вещества во Вселенной имеют свою структуру строения, которая объясняет их химические и физические свойства. Помимо агрегатного состояния и строения химических решеток, важное значение в системе строения имеет вид связи, которыми связаны частицы вещества.
Понятие о связи между частицами появилось в научном мире в XVIII веке, когда Уильям Хиггинс опубликовал свою научную работу о «некой связи, которая соединяет частицы веществ». Это знание стало предвестником теории о валентности, которая позже сменилась теорией о химических связях.
Современное знание о химии различает следующие типы связей:
- металлическая;
- ковалентная;
- ионная;
- водородная;
- ван-дер-ваальсова.
Ионная связь может рассматриваться в качестве крайней формы ковалентной полярной связи. Это значит, что она происходит только между ионами и только между частицами с разной электроотрицательностью.
Ионная связь — особый вид химической связи между заряженными частицами (ионами), основанное на силах электростатического притяжения.
Ионная связь, образуется между элементами, электроотрицательность которых сильно отличается. При этом один из атомов превращается в положительно заряженный ион — катион, а второй в отрицательно заряженный — анион. Это объясняется тем, что электроны атома с меньшей ЭО практически полностью переходят к атому с большей ЭО.
Ионная связь характерна для соединений элементов-металлов с неметаллами.
Ионная связь характеризуется 2 главными чертами:
Эти качества влияют на растворимость соединений с ионной связью — они хорошо и практически полностью растворяются в полярных растворителях.
Электронное строение, как отличить от ковалентной
В отличие от ковалентной химической связи ионная связь образуется между ионами.
Ионы — частицы веществ, имеющие положительный или отрицательный заряд, но при этом образующиеся из нейтральных частиц.
По сути строения соединений, ионная связь является крайней формой ковалентной полярной связи. Полностью ионной связи в природе не существует — на какой-то процент она всегда остается ковалентной. Более того, в одном соединении одновременно могут существовать несколько видов связи, как это происходит, например, в молекуле фосфата аммония ( N H 4 ) 3 P O 4 .
Однако отличить ковалентную от ионной связи все же можно:
- Ионная связь всегда образуется между положительно и отрицательно заряженными ионами.
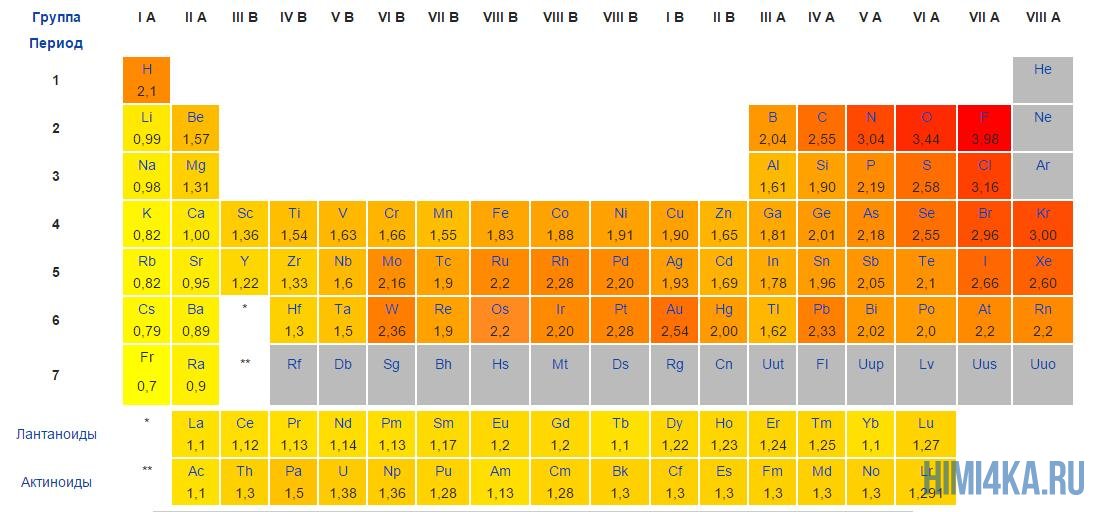
- Разница ЭО у химических элементов в ионной связи всегда превышает 1,7-2 по Полингу.
- Электронная пара не просто смещена, а практически полностью переходит к атому с большей ЭО.
- Внешняя электронная оболочка атомов связанных ионной связью будет либо полностью занятой, либо практически пустой.
- Ионная связь не имеет кратности, не направлена и не насыщена.
Механизм формирования ионной связи на примере формирования фторида натрия можно проследить на схеме:
Заряды ионов и их классификация
Классификация ионов происходит по нескольким признакам:
- по заряду;
- по наличию водной оболочки;
- по составу.
Заряды ионов бывают положительными и отрицательными. Положительные ионы называются катионами. Отрицательные — анионами. При ионной связи они соединяются для образования химических соединений.
По второму признаку ионы бывают гидратированными и негидратированными. Первые находятся в растворах и кристаллогидратах. Вторые — в безводных солях.
По составу ионы делятся на простые и сложные. Простые ионы образуются из одного атома. Сложные — состоят из нескольких.
По значению заряда ионы классифицируются на:
- однозарядные ( K + );
- двузарядные ( В а 2 + );
- трехзарядные ( A l 3 + ).
Особенности ионной связи
Вещества с ионной химической связью имеют ряд особенностей:
- низкая летучесть;
- высокая температура плавления;
- низкая электростатическая проводимость из-за специфического строения кристаллической решетки;
- твердость, но при этом хрупкость веществ;
- заметная растворимость соединений в полярных растворителях.
Как возникает, процесс взаимодействия, формулы
При формировании соединения с ионной связью одна из частиц отдает электроны, а вторая принимает их на свою электронную орбиталь.
Положительно заряженный ион образуется при отдаче электрона, анион же образуется при присоединении дополнительных электронов к атому. Обычно это атомы металла и неметалла, соответственно.
Пример ионной связи между металлом и неметаллом:
Иногда ионная связь образуется из неметаллов. Тогда электронная пара смещается к элементу с большей ЭО.
Ионная и металлическая связь
До появления знания об электроне, в науке главенствовала теория о валентности как о скрепляющей атомы внутри вещества силе.
Ее предвестником стала научная работа Уильяма Хиггинса, ирландского химика конца XVIII века, который описал существование неких связей между частицами веществ.
В начале прошлого века, когда появилась модель атомного ядра и выяснилось, что оно состоит из частиц трех видов: электронов, протонов и нейтронов — теория о валентности сменилась теорией о химических связях.
Феномен химических связей объясняется стремлением всего к упорядочиванию. Частицы веществ стремятся к наиболее стабильным и устойчивым формам с минимальным расходом энергии, благодаря чему появляется множество соединений.
Современная химия различает до шести видов связей, но чаще всего рассматривает только первые четыре из них:
- металлическая;
- ковалентная;
- ионная;
- водородная;
- ван-дер-ваальсова;
- двухэлектронная трехцентровая химическая.
От типа химической связи зависят ее свойства, а также строение химических решеток, структура и способы взаимодействия атомов и частиц.
Самой распространенной химической связью является ковалентная полярная, а остальные чаще всего являются либо крайними ее формами, либо вариациями с металлическими и нехарактерными неметаллическими химическими элементами в соединениях.
Ионная химическая связь
Ионная связь получила свое название от «иона» — частицы, вступающей в связь в соединении.
Ионная химическая связь — особый вид химической связи между частицами, основное действие которого направленно на заряженные частицы — ионы.
Ионная связь является крайней формой ковалентной полярной связи. При образовании, происходит поляризация атомов, в следствии чего образуются ионы.
Ионы — одноатомные или многоатомные частицы, имеющие ярко выраженный электрический заряд. Делятся на катионы — положительно заряженные атомы, и анионы — отрицательно заряженные.
Ионы могут иметь разный заряд и классифицируются по значению заряда на:
- однозарядную ( K + );
- двузарядную ( O 2 + );
- трехзарядную ( A l 3 + ) группы.
Частицы, вступающие в ионную связь, должны иметь большую разницу в 2 определение — электроотрицательности — способности притягивать электронные пары к себе. По Полингу для образования ионной связи необходима разница в 1,7 и более.
При таком виде химической связи происходит почти полный переход одного электрона к другому атому. Частицы с меньшей ЭО практически полностью переходят во владения частицы с большей ЭО, однако полного перехода никогда не случается.
Отчуждение электронов называется окислением, а присоединение — восстановлением.
Полного разделения на + и – заряженные частицы нет, так как частицы пересекаются своим электронными орбиталями и связываются очень прочной связью, а также имеют сильное электростатическое взаимодействие между частицами.
Ионная связь характерна для соединений металлов и неметаллов, реже для соединений неметаллов с неметаллами, присутствует в оксидах, гидроксидах, гидридах щелочных и щелочноземельных металлов, в солях, соединениях металлов с галогенами.
Ионная связь характеризуется двумя главными чертами:
Металлическая связь
Атомы металлов имеют возможность соединяться не только с неметаллами, но и между собой. В таком случае происходит формирование металлической связи.
Металлическая химическая связь — особый вид химической связи, образующийся между атомами металлов за счет обобществления их крайних электронных оболочек и валентных электронов.
В металлическую связь вступают частицы двух видов:
- ионизированных атомов металлов, которые в процессе формирования отдают электроны, а значит получают положительный заряд;
- свободных электронов, называемых «электронным газом», имеющих отрицательный заряд по своей природе происхождения.
Металлическая связь образуется только в веществах, а не между отдельными атомами. При этом связи внутри вещества связи не перманенты и не отличаются постоянством.
Кристаллическая решетка в веществах с металлической связью образуется в виде некого каркаса, в узлах которого находятся ионы металлов, а между ними в свободной форме путешествует «электронный газ», состоящий из свободных электронов.
Форма кристаллической решетки отличается в зависимости от группы, к которой относится металл:
- щелочные металлы (литий Li, калий K, рубидий Rb и другие) имеют объемно-центрированную кубическую кристаллическую решетку;
- переходные элементы (алюминий Al, медь Cu, цинк Zn и другие) имеют гранецентрированную кубическую форму решетки;
- щелоноземельные металлы (бериллий Be, кальций Ca, радий Ra, кроме бария) имеют гексагональную решетку;
- индий In имеет тетрагональную решетку;
- ртуть Hg имеет ромбоэдричсекую решетку.
Соединения, обладающие металлической связью, представляют собой либо чистые соединения металлов, либо их сплавы, которые образуют новые вещества, например, бронзу, сталь, чугун, латунь и другие.
Все металлы и их сплавы имеют сходные физические свойства:
- металлический блеск;
- теплопроводность материала;
- высокая ковкость, пластичность материала;
- хорошая электропроводность;
- твердое агрегатное состояние в нормальных условиях среды;
- высокая плотность материала.
Чем отличаются друг от друга и от ковалентной, что общего
Основные виды химической связи имеют довольно сходный принцип строения по природе происхождения. Они переплетаются между собой и имеют общие признаки. Более того, внутри одной молекулы нередко бывают сразу несколько видов химических связей.
Металлическая и ионная связь сходны между собой, а также сходны с ковалентной связью.
Металлическая и ковалентная связи сходны тем, что электроны, вступающие в связь обоих видах, становятся общими и принадлежат всем атомам либо в виде электронных пар, либо в виде электронного газа.
Ионная и ковалентная связи имеют сходство принципом строения. По сути происхождения, ионная связь является крайней формой ковалентной полярной связи. Полностью ионной связи в природе не существует — на какой-то процент она всегда остается ковалентной.
Металлическая связь сходна с ионной тем, что атомы металлов в соединениях легко отдают свои валентные электроны, которые слабо связаны со своими атомными ядрами. Отрыв электронов от ядра приводит к формированию ионизированных катионов металлов.
Однако отличия между связями все же есть. Именно по ним можно определить тип химической связи в соединении.
Металлическая от ковалентной связи отличается, в первую очередь, тем, что происходит между двумя атомами металлов, а не неметаллов. Благодаря этому она имеет высокую концентрацию электронов проводимости в своих атомах. Она менее прочна, чем ковалентная, а ее энергия связей меньше в 3-4 раза.
В отличие от ковалентной связи металлическая:
- ненасыщаема — объединяет большое количество атомов;
- ненаправлена — из-за сферической формы орбиталей;
- делокализирована — электроны в связи обобществляются всеми атомами соединения.
Ионная связь в отличие от ковалентной происходит между атомами металлов и неметаллов, реже между неметаллами. Она образуется между катионами и отрицательно заряженными электронами, которые не привязаны к одному ядру, а свободно движутся по кристаллической решетке.
Металлическая от ионной связи отличается:
- типом связываемых частиц — у металлической связи нет как такового аниона, вместо него катионы притягивают электронный газ;
- прочностью связи при ударе — взаимное смещение катионов не приводит к разрыву, но если в связи находятся катион и анион, то связь может быть разорвана.
Как образуется ионная и металлическая связь, примеры
Ионная связь образуется между металлом и неметаллом (иногда неметаллом и неметаллом) с разным уровнем электроотрицательности. Ионы могут быть простыми и иметь только один атом, как, например, C l - , N a + , так и сложными и иметь несколько атомов и общий уровень заряда при них, как, например, N H 4 - .
Графически образование ионной связи можно проследить на схеме образования соединения натрия и хлора:
По принципу ионной связи образуются также хлороводород HCl, оксид кальция CaO, фторид натрия NaF, бромид серебра AgBr и другие.
Металлическая связь образуется между двумя неметаллами. В связь вступают ионы металла и свободные электроны. Основой для образования металлической химической связи является наличие свободных атомных орбиталей, а также свободных электронов.
Схему образования металлической связи одной формулой можно записать следующим образом:
Число n будет зависеть от места химического элемента в Периодической системе химических элементов Д. И. Менделеева. Число внешних электронов равно номеру группы, в которой находится металл.
Урок 6. Простые ионы
В уроке 6 «Простые ионы» из курса «Химия для чайников» познакомимся с простыми ионами и выясним, чему равен его заряд; также рассмотрим как образуется ионная химическая связь; научимся определять степень окисления и валентность элементов. Данный урок очень важный, и чтобы его лучше понять, обязательно просмотрите прошлые уроки, особое внимание уделяя уроку 1 «Схема строения атомов», а также уроку 3 «Схема образования молекул».
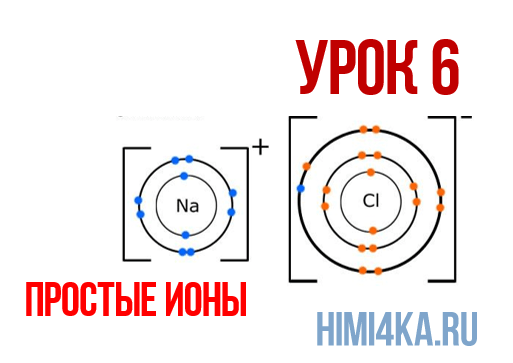
Ионная химическая связь
Мы уже кратко рассматривали ковалентную полярную химическую связь, в которой из-за незначительного различия в электроотрицательности атомов (0.4-2.0) электронная пара распределяется между ними не равномерно. Для тех, кто забыл, напоминаю, что электроотрицательность — это способность атомов притягивать к себе электроны.
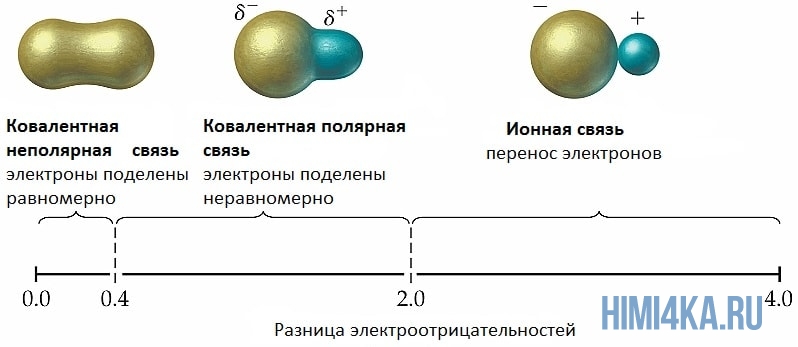
Однако, если электроотрицательность атомов различается больше чем на 2 по таблице электроотрицательности, то электронная пара полностью переходит к более электроотрицательному атому, и в результате образуется ионная химическая связь. Ионная химическая связь образуется только между атомами типичных металлов (т.к. они легко теряют внешние электроны) и неметаллов (т.к. они обладают большой электроотрицательностью).
Положительные и отрицательные ионы
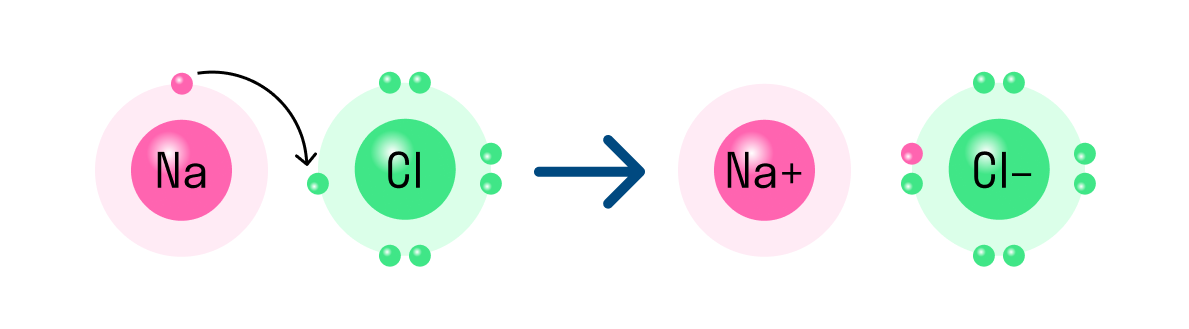
Наглядным примером ионной химической связи может служить обычная поваренная соль NaCl, которая присутствует на каждой кухне. Атомы натрия (и вообще всех металлов) слабо удерживают внешние электроны, тогда как атомы хлора напротив, обладают очень большой способностью притягивать к себе электроны, т.е обладают большой электроотрицательностью.
Поэтому при образовании молекулы NaCl каждый атом Na теряет один электрон (e — ), образуя положительный ион натрия Na + , а каждый атом Cl, наоборот, приобретает этот потерянный электрон натрия, образуя отрицательный ион хлора Cl — . Это записывается в виде двух реакций:
Записать ½Cl2 пришлось потому, что газообразный хлор в природе состоит из двухатомных молекул, а не из свободных одиночных атомов хлора.
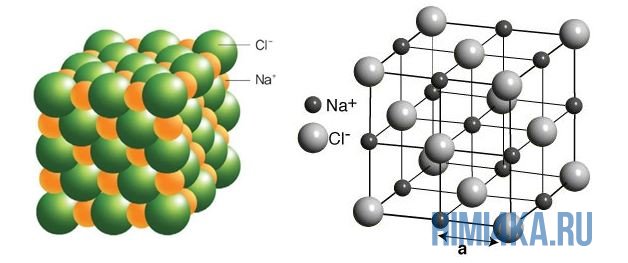
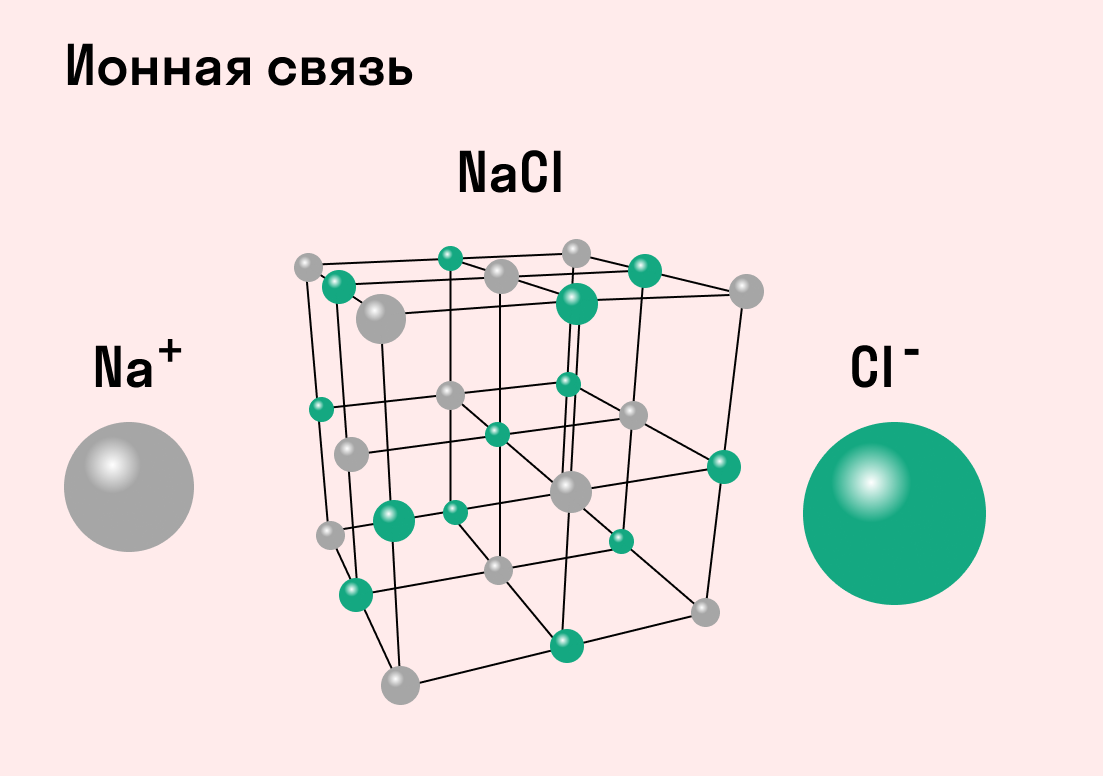
На рисунке выше, изображена кристаллическая решетка NaCl, где каждый хлорид-ион Cl — окружен со всех сторон соседними положительными ионами натрия Na + ; ионы натрия Na + точно также окружены ближайшими хлорид-ионами Cl — . Подобное расположение ионов обладает высокой устойчивостью.
Положительно заряженные ионы называются катионами. К ним в основном относятся металлы, так как они легко отдают от одного до трех электронов. Ниже приведены примеры катионов:

Анионами являются неметаллы, поскольку с радостью присоединяют к себе электроны, превращаясь в отрицательно заряженные ионы. Примеры анионов:

Степень окисления веществ
Заряд простого, одноатомного иона, например Mg 2+ или F 2- , называется его степенью окисления. Степень окисления — это такое число электронов, которое необходимо прибавить (восстановить) к иону или отнять (окислить) у него, чтобы он превратился обратно в нейтральный атом.
- Реакция восстановления: Mg 2+ + 2e — → Mg
- Реакция окисления: F 2- → F + 2e —
Процесс присоединения электронов к атому или просто их смещение в сторону данного атома называется реакцией восстановления, а оттягивание электронов от атома или их полное удаление называется реакцией окисления. Вот вам отличная шпаргалка со степенями окисления простых ионов:

Пример 12. Окисляется или восстанавливается хлор при образовании хлорид-иона? Какова степень окисления этого иона?
Решение: Хлор восстанавливается, поскольку к каждому атому хлора необходимо присоединить один электрон, чтобы образовался хлорид-ион. Хлорид-ион, Сl — , имеет степень окисления -1.
Пример 13. Окисляются или восстанавливаются металлы при образовании ими ионов? Какова степень окисления иона алюминия?
Решение: При образовании ионов металлов последние окисляются, поскольку при этом происходит удаление электронов от атомов металла. Ион алюминия, Аl 3+ , имеет степень окисления +3.
Валентность химических элементов
Валентностью называют число химических связей, которые данный атом образует с другими атомами в молекуле. Однако, если говорить простыми словами, то под валентностью понимается все та же степень окисления, но в отличии от нее валентность не имеет знака и не равна нулю.
| Молекулярная формула | Валентность | Степень окисления |
| H2O | H(I), O(II) | H +1 , O -2 |
| CS2 | C(IV), S(II) | C +4 , S -2 |
| CH4 | C(IV), H(I) | C -4 , H +1 |
Название ионов
Ионы металлов, которые имеют различные (переменные) степени окисления, записываются следующим образом:
- Fe 2+ железо(II) или ион двухвалентного железа
- Fe 3+ железо(III) или ион трехвалентного железа
- Сu + медь(I) или ион одновалентной меди
- Cu 2+ медь (II) или ион двухвалентной меди
- Sn 2+ олово(II) или двухвалентного олова
- Sn 4+ олово(IV) или ион четырехвалентного олова
Пример 2: Окисление или восстановление происходит при превращении иона трехвалентного железа в ион двухвалентного? Запишите уравнение этого процесса.
Решение: Уравнение реакции имеет следующий вид: Fe 3+ + e — → Fe 2+ . Она представляет собой процесс восстановления, поскольку к исходному иону присоединяется электрон.
Надеюсь урок 6 «Простые ионы» оказался для вас понятным и полезным. Если у вас возникли вопросы, пишите их в комментарии.
Ионы металлов имеют отрицательный заряд
Ион - это заряженная частица, образованная из молекулы или атома путём потери или приобретения одного электрона. Отсюда следует, что в ионе количество протонов не равно количеству электронов. После изучения статьи Вы узнаете, какими бывают заряженные частицы, что такое ионы, катионы и анионы, также Вы сможете по номеру элемента узнать, каким зарядом он может обладать.
Число электронов в ионе
Количество электронов в нейтральном атоме равно количеству протонов в ядре, например, у хрома (24Cr) 24 протона, соответствено, вокруг ядра вращается 24 электрона. Как было рассказано в статье "электронная конфигурация атома", каждый электрон двигается по некой орбитали, то есть обладает заданным количеством энергии.
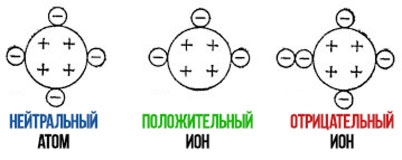
Если ион образован из-за потери электрона, то заряд иона становится положительным (электрон имеет отрицательный заряд), схема для запоминания:
Аналогично при присоединении электрона:
Энергия ионизации
Если электрону сообщить достаточное количество энергии, то электрон "оторвётся" от атома. Чем ближе электрон к ядру - тем сложнее его отрывать, а значит, больше энергии необходимо передать. Энергия, необходимая для отрыва электрона, называется энергией ионизации или ионизационный потенциал (I). Значения I затабулированы и могут быть найдены в различных справочниках.
Энергия сродства электрону
Также электроны могут присоединяться к атому, в процессе присоединения электрон выделяет энергию, такая энергия называется энергией сродства электрону, для каждого электрона конкретного атома энергия сродства численно равна и противоположна по знаку энергии ионизации, например, 17Cl, что бы оторвать 17й электрон у атома хлора, необходимо сообщить ему 13 эВ, любой другой электрон, который присоединится на место 17го электрона также выделит 13 эВ.
Катионы и анионы
Атомы, в которых количество протонов не равно количеству электронов называются ионами, поскольку электрон имеет отрицательный заряд, то если электронов больше протонов, то суммарный заряд отрицательный: S 2- означает, что в данном атоме серы количество электронов больше чем протонов на два электрона. Соответственно, если электронов меньше чем протонов, то суммарный заряд положительный и обозначается H + . Отрицательно заряженные атомы называются анионами, положительно заряженные атомы - катионами.
Какой заряд будет у атома?
Теоретически возможно отобрать все электроны у атома, но это возможно только в лабораторных условиях и за пределами лаборатории атомы в таком состоянии находиться не будут, почему?
Вернёмся к устройству электронной оболочки. Вокруг атома электроны сгруппированы по энергетическим уровням, каждый заполненный уровень экранирует ядро и является более стабильным, нежели не до конца заполненный уровень. То есть электронная конфигурация стремиться к состоянию заполненного подуровня: если на p-оболочке находится 5 электронов, то вероятнее атом примет один электрон, нежели отдаст пять. Так, например, у атома хлора, пять электронов на 3p-подуровне, энергия сродства хлора - 3.61 эВ, энергия ионизации - 13 эВ. У натрия на последнем подуровне один электрон, энергия сродства - 0,78 эВ, потенциал ионизации - 0,49 эВ, поэтому вероятнее натрий отдаст один электрон, нежели примет его.
Зная потенциал ионизации и энергию сродства мы можем сделать предположение о взаимодействии веществ. Если смешать натрий и хлор, и сообщить им энергию, то вероятнее всего Na будет отдавать один электрон Cl и в результате получится смесь ионов Na + и Cl - .
Пример
Так можно по номеру элемента предположить, какой заряд он будет иметь, например, 19й элемент, электронная конфигурация - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 , вероятнее всего, такой элемент может либо отдать, либо принять один электрон. У 27го элемента электронная конфигурация выглядит так: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 7 , у d-подуровня всего может быть 10 атомов, т.е. либо атом примет 1,2 или 3 электрона, либо отдаст 1,2,3. 7 электронов, так, вероятнее, он примет 3, т.е. возможные состояния - это +1, +2 и +3,
Теперь Вы знаете, что такое ионы, осталось изучить химическую связи и Вы сможете составлять окислительно-восстановительные реакции!
Ионная связь
В этом материале речь пойдет о том, что такое ионная связь и чем она отличается от других видов, которые изучают на уроках химии в 8 классе.
О чем эта статья:
Общие сведения о химических связях
Давайте вспомним, как образуются химические связи. Для этого представим атом: он состоит из ядра с положительным зарядом и набора отрицательно заряженных электронов, которые располагаются на нескольких уровнях. Внешний уровень называется валентным, на нем располагаются валентные электроны. Они могут образовывать пары или быть свободными, т. е. неспаренными.
Во взаимодействии двух атомов участвуют свободные электроны внешней оболочки. Сколько таких электронов имеется у атома — столько химических связей он может образовать.
При этом каждый атом стремится приобрести устойчивую конфигурацию — двух- или восьмиэлектронную внешнюю оболочку, подобную той, что есть у инертного газа. Атом может достичь ее, отдавая или принимая часть электронов, а также образуя общую электронную пару с другим атомом. Если в результате получается два разноименно заряженных иона, говорят об ионном типе связи. Он характерен для взаимодействия атомов металла и неметалла.
Определение ионной связи
Рассмотрим этот тип связи на примере реакции натрия и водорода, в результате которой получается гидрид натрия. У атома натрия Na есть один свободный электрон на внешнем уровне, в то время как атому водорода H не хватает одного электрона, чтобы завершить внешнюю оболочку и принять стабильную форму. Поскольку натрий имеет более низкую электроотрицательность, чем водород, он отдает свой валентный электрон и получает отрицательный заряд. Водород принимает этот электрон и получает положительный заряд. В итоге образуется два иона — катион Na + и анион H - .
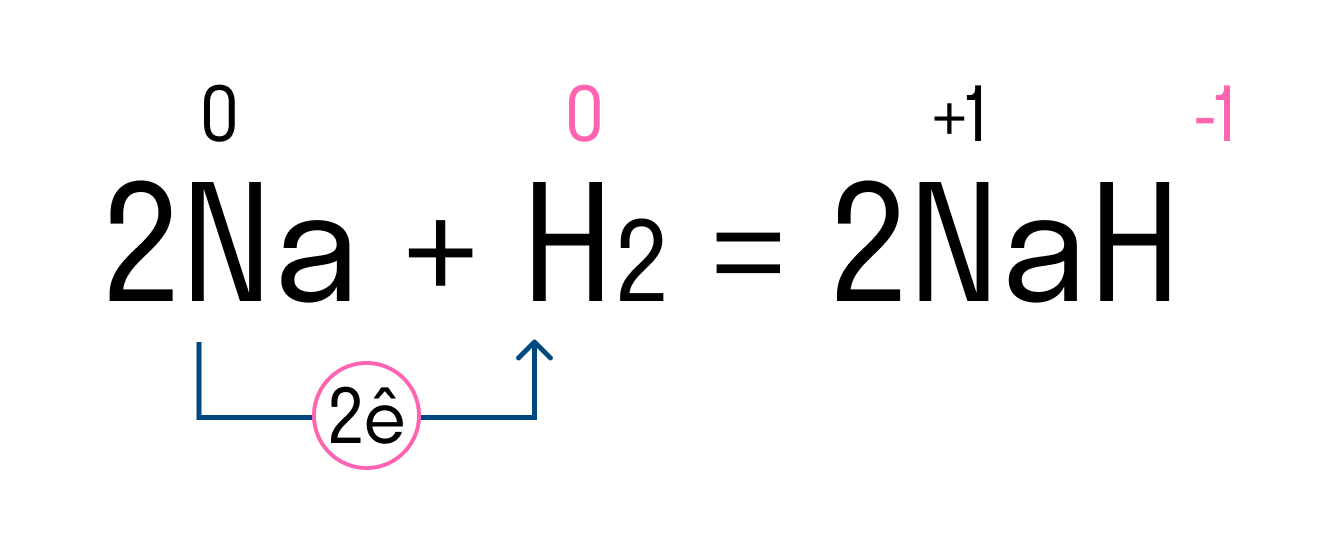
Между положительным ионом Na + и отрицательным H - возникает электростатическое притяжение, которое и удерживает их вместе. Так образуется ионная связь в гидриде натрия.
Ионная связь — это тип химической связи, характерный для разноименно заряженных ионов, которые образовались в результате отдачи и присоединения электронов атомами. В нее вступают элементы с большой разностью электроотрицательности. Обычно так взаимодействуют атомы металла и неметалла.
Чаще всего именно так связаны в соединениях щелочные и щелочноземельные металлы с галогенами. Поскольку у щелочных металлов электроотрицательность ниже, их атомы становятся катионами, а атомы галогенов — анионами.
Механизм образования ионной связи похож на донорно-акцепторный механизм ковалентной связи. Первую даже называют крайним выражением второй.
Соли аммония NH4NO3, NH4Cl, (NH4)2SO4 хоть и не являются соединениями металла и неметалла, но также образованы с помощью ионной связи.
Координационное число
Вернемся к нашему примеру с гидридом натрия и посмотрим на кристаллическую решетку, которую имеет это ионное соединение. Каждый ион Na + контактирует с шестью ионами H - . Это максимально возможное для данного иона число химических связей, оно называется координационным.
Координационное число — это количество ближайших соседей иона в ионной кристаллической решетке. По сути это количество связей, которые образует каждый ион в составе сложного вещества.
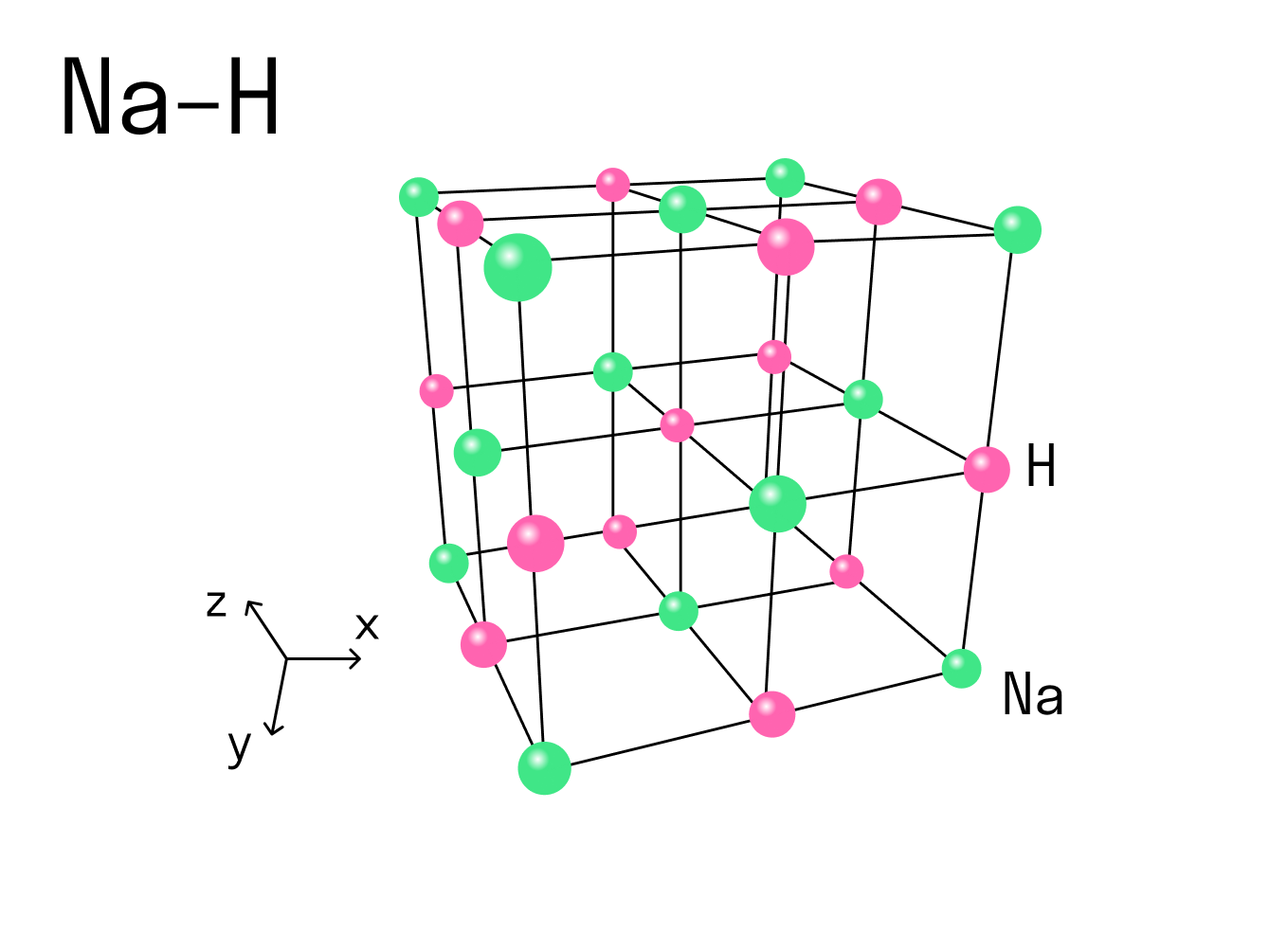
При рассмотрении ковалентной химической связи говорят о валентности — она характеризует, сколько связей есть у конкретного атома с другими атомами. Но к ионным соединениям это понятие не применяют, потому что все ионы в кристаллической решетке взаимодействуют друг с другом. Вместо этого есть координационное число, и оно отражает количество таких взаимодействий.
Примеры веществ с ионной связью
Таким же образом, как в гидриде натрия, ионы образуются и в других подобных ему соединениях. Например, в хлориде натрия NaCl атом натрия имеет один свободный электрон и отдает его атому хлора. В итоге оба завершают свой внешний уровень. Образуется ион натрия с положительным зарядом и отрицательно заряженный ион хлора.
Другой пример ионной химической связи — сульфид натрия Na2S. В данном случае у нас также есть натрий с одним свободным электроном и сера, у которой на внешнем уровне есть 2 свободных электрона из 6. Таким образом, чтобы завершить уровень и обрести стабильную форму, сере нужно 2 электрона. Поэтому в формуле сульфида серы присутствует два атома натрия.
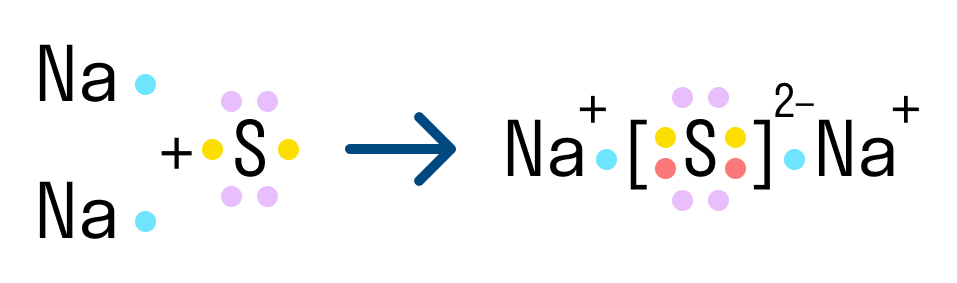
Характеристики ионной связи
Мы узнали, как образуется ионная связь, а теперь поговорим о ее характеристиках. Она существенно отличается от других типов связи между атомами.
не имеет кратности.
Разберемся в каждом пункте и начнем с направленности. Ковалентная полярная связь направлена, потому что она подразумевает смещение общей электронной пары к тому атому, который имеет большую электроотрицательность. В случае с ионами все иначе. Согласно закону Кулона притяжение между отрицательным и положительным ионом идет по прямой, соединяющей эти заряженные частицы. В кристаллической решетке все разноименно заряженные ионы взаимодействуют друг с другом и притяжение распределяется равномерно, поэтому говорят, что ионная связь не направлена.
А как насчет насыщаемости? Эта характеристика указывает на то, что атом может вступить в ограниченное количество химических связей, поскольку имеет ограниченное число неспаренных электронов. Но ионная связь — это не процесс соединения свободных электронов в пары, а взаимное притяжение ионов. Каждый ион может притягивать к себе неограниченное число ближайших соседей, поэтому нет смысла говорить о насыщаемости.
Из вышесказанного понятно, что ионная связь не имеет и кратности. Эта характеристика означает число общих электронных пар у атома, но в данном случае мы рассматриваем притяжение между ионами.

Физические свойства ионной связи
Между ионами в молекуле всегда образуется достаточно сильное притяжение, поэтому вещества с ионной связью в обычных условиях твердые и нелетучие. Такие соединения сложно разрушить при помощи тепловой энергии, что обуславливает высокую температуру кипения и плавления. При этом ионы имеют небольшой радиус взаимодействия — это придает веществам хрупкость.
Свойства ионных соединений:
растворимость в воде,
Типичным веществом с ионными связями можно считать хлорид натрия NaCl или поваренную соль. Ее кристаллы в точности соответствуют всем характеристикам.
Как определить ионную связь
Чтобы быстро понять, является ли нужное нам соединение ионным, выполните следующие действия:
Посмотрите, какие элементы входят в состав соединения. Формула вещества с ионной связью должна включать металл и неметалл. Если это щелочной металл (I группа таблицы Менделеева) и галоген (VII группа), то связь между ними точно ионная.
По шкале Полинга определите электроотрицательности обоих элементов соединения. Если разница между ними больше 1,7 — связь ионная. Это объясняется тем, что такой тип связи характерен для веществ, у которых сильно отличаются показатели электроотрицательности.
Дополнительным способом убедиться в правильности результата может стать оценка физических свойств вещества. Если оно имеет высокую температуру кипения или плавления и проводит электроток — связь скорее всего ионная.
Вопросы для самопроверки:
Опишите, как образуется ионная связь. Какие условия для этого необходимы?
Что такое координационное число элемента в ионном соединении?
Каковы основные физические свойства ионных соединений?
В чем разница между характеристиками ионной и ковалентной связей?
Как можно определить ионную связь, зная электроотрицательность элементов в соединении?
Читайте также:
