Ионы металлов в ферментах
Обновлено: 05.07.2024
Для некоторых ферментов субстратом служит комплекс превращаемого вещества с ионом металла. Например, для большинства киназ в качестве одного из субстратов выступает не молекула АТФ, а комплекс Mg 2+ -ATФ. В этом случае ион Mg 2+ не взаимодействует непосредственно с ферментом, а участвует в стабилизации молекулы АТФ и нейтрализации отрицательного заряда субстрата, что облегчает его присоединение к активному центру фермента
Схематично роль кофактора при взаимодействии фермента и субстрата можно представить как комплекс E-S-Me, где Е - фермент, S - субстрат, Me - ион металла.
Ионы металла - стабилизаторы активного центра фермента
В некоторых случаях ионы металла служат "мостиком" между ферментом и субстратом. Они выполняют функцию стабилизаторов активного центра, облегчая присоединение к нему субстрата и протекание химической реакции. В ряде случаев ион металла может способствовать присоединению кофермента. Перечисленные выше функции выполняют такие металлы, как Mg 2+ , Mn 2+ , Zn 2+ , Co 2+ , Мо 2+ . В отсутствие металла эти ферменты активностью не обладают. Такие ферменты получили название "металлоэнзимы". Схематично данный процесс взаимодействия фермента, субстрата и металла можно представить следующим образом:
2. Роль металлов в стабилизации третичной
и четвертичной структуры фермента
Ионы металлов обеспечивают сохранение вторичной, третичной, четвертичной структуры молекулы фермента. Такие ферменты в отсутствие ионов металлов способны к химическому катализу, однако они нестабильны. Их активность снижается и даже полностью исчезает при небольших изменениях рН, температуры и других незначительных изменениях внешнего окружения. Таким образом, ионы металлов выполняют функцию стабилизаторов оптимальной конформации белковой молекулы.
3. Роль металлов в ферментативном
катализе
Не менее важную роль отводят ионам металлов в осуществлении ферментативного катализа.
Участие в электрофильном катализе
Наиболее часто эту функцию выполняют ионы металлов с переменной валентностью, имеющие свободную d-орбиталь и выступающие в качестве электрофилов. В ходе электрофильного катализа ионы металлов часто участвуют в стабилизации промежуточных соединений.
Участие в окислительно-восстановительных реакциях
Ионы металлов с переменной валентностью могут также участвовать в переносе электронов. Например, в цитохромах (гемсодержащих белках) ион железа способен присоединять и отдавать один электрон:
Благодаря этому свойству цитохромы участвуют в окислительно-восстановительных реакциях.
4. Роль металлов в регуляции активности
ферментов
Иногда ионы металлов выступают в роли регуляторных молекул. Например, ионы Са 2+ служат активаторами фермента протеинкиназы С, катализирующего реакции фосфорилирования белков . Ионы Са 2+ также изменяют активность ряда кальций-кальмодулинзависимых ферментов .
Б. Коферменты
Как уже было сказано, для проявления каталитической активности большинству ферментов необходимо наличие кофермента. Исключение составляют гидролитические ферменты (например, протеазы, липазы, рибонуклеаза), выполняющие свою функцию в отсутствие кофермента.
Кофермент, локализуясь в каталитическом участке активного центра, принимает непосредственное участие в химической реакции, выступая в качестве акцептора и донора химических группировок, атомов, электронов. Кофермент может быть связан с белковой частью молекулы ковалентными и нековалентными связями. В первом случае он называется простетической группой (например, FAD, FMN, биотин, липоевая кислота). Вместе с тем известны примеры, когда кофермент присоединяется к ферменту нековалентными связями настолько прочно, что не диссоциирует от белковой молекулы, например тиаминдифосфат.
Во втором случае кофермент взаимодействует с ферментом только на время химической реакции и может рассматриваться в качестве второго субстрата. Примеры - NAD + , NADP + .
Апофермент обеспечивает специфичность действия и отвечает за выбор типа химического превращения субстрата. Один и тот же кофермент, взаимодействуя с различными апоферментами, может участвовать в разных химических превращениях субстрата. Например, пиридоксальфосфат в зависимости от того, с каким апоферментом взаимодействует, участвует в реакциях трансаминирования или декарбоксилирования аминокислот.
Химическая природа коферментов, их функции в ферментативных реакциях чрезвычайно разнообразны. Традиционно к коферментам относят производные витаминов, хотя помимо них есть значительный класс небелковых соединений, принимающих участие в проявлении каталитической функции ферментов.
К коферментам относят следующие соединения:
- производные витаминов;
- гемы, входящие в состав цитохромов, каталазы, пероксидазы, гуанилатциклазы, NO-синтазы и являющиеся простетической группой ферментов;
- нуклеотиды - доноры и акцепторы остатка фосфорной кислоты;
- убихинон, или кофермент Q, участвующий в переносе электронов и протонов в ЦПЭ;
- фосфоаденозилфосфосульфат, участвующий в переносе сульфата;
- S-аденозилметионин (SAM) - донор метильной группы;
- глутатион, участвующий в окислительно-восстановительных реакциях.
В. Мультисубстратные реакции
Большинство ферментов катализирует реакции, в которых участвует более чем один субстрат. В случае если кофермент не является простетической группой, его также можно рассматривать как ещё один субстрат. Следовательно, участников ферментативной реакции может быть несколько: непосредственно фермент, несколько субстратов и кофермент.
В этих случаях механизм ферментативной реакции, как правило, может идти по одному из двух путей: по механизму "пинг-понг" (механизму двойного замещения) или последовательному. Рассмотрим оба механизма.
1. Механизм "пинг-понг"
Схематично механизм "пинг-понг" может быть представлен следующим образом:
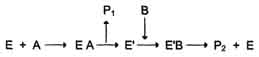
Субстрат А, взаимодействуя с ферментом (Е), превращается в продукт (Р1). Фермент остаётся в результате этого преобразования не в нативной форме, а в изменённой (Е') в результате модификации кофермента. Далее к активному центру Е' присоединяется субстрат В, подвергающийся преобразованию в продукт (Р2) с высвобождением нативной формы фермента (Е).
Последовательный механизм
В случае последовательного механизма для протекания ферментной реакции требуется одновременно взаимодействие двух субстратов. В этом случае возможно присоединение субстратов двумя различными путями:
· Механизм упорядоченного взаимодействия субстрата с активным центром фермента:
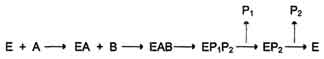
· Первым в активный центр фермента присоединяется субстрат А, облегчая присоединение субстрата В. После химической модификации также наблюдают определённый порядок высвобождения продуктов реакции.
· Механизм случайного взаимодействия субстрата с активным центром фермента:

Приоритетности за взаимодействие субстратов А и В в активном центре фермента нет (каждый субстрат имеет свой центр связывания в активном центре). Также нет строгой закономерности высвобождения продуктов реакции.
Примером последовательного упорядоченного механизма может быть реакция дегидрирования с участием коферментов NAD + , NADP + .
Оба кофермента функционируют как посредники переноса двух электронов и одного протона от донора к акцептору, другого протона - в среду .
Донор и акцептор не обязательно участвуют в одном метаболическом пути. Другими словами, восстановленная форма этих нуклеотидов действует как общий пул электронов, образованный в результате окислительных реакций, и может быть использована в различных восстановительных реакциях. Такие реакции называют сопряжёнными .
© 2014-2022 — Студопедия.Нет — Информационный студенческий ресурс. Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав (0.009)
Ионы металла - стабилизаторы активного центра фермента
Более 25% всех ферментов для проявления полной каталитической активности нуждается в ионах металлов. Рассмотрим роль кофакторов в ферментативном катализе.
1. Роль металлов в присоединении субстрата
в активном центре фермента
Ионы металла выполняют функцию стабилизаторов молекулы субстрата, активного центра фермента и конформации белковой молекулы фермента, а именно третичной и четвертичной структур.
Ионы металлов - стабилизаторы молекулы субстрата
Для некоторых ферментов субстратом служит комплекс превращаемого вещества с ионом металла. Например, для большинства киназ в качестве одного из субстратов выступает не молекула АТФ, а комплекс Mg 2+ -ATФ. В этом случае ион Mg 2+ не взаимодействует непосредственно с ферментом, а участвует в стабилизации молекулы АТФ и нейтрализации отрицательного заряда субстрата, что облегчает его присоединение к активному центру фермента (см. схему на с. 84).
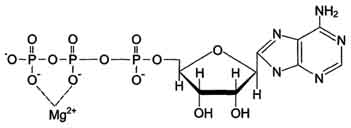
Схема
В качестве примера можно привести расположение субстратов в активном центре гексокиназы (рис. 2-3).
Гексокиназа катализирует перенос концевого, γ-фосфатного остатка молекулы АТФ на глюкозу с образованием глюкозо-6-фосфата:
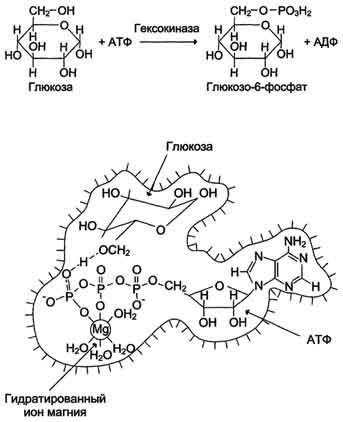
Рис. 2-3. Участие ионов магния в присоединении субстрата в активном центре гексокиназы. В активном центре гексокиназы есть участки связывания для молекулы глюкозы и комплекса Мд 2+ -АТФ. В результате ферментативной реакции происходит перенос концевого, γ-фосфатного остатка молекулы АТФ на глюкозу с образованием глюкозо-6-фосфата.
Ион Mg 2+ участвует в присоединении и "правильной" ориентации молекулы АТФ в активном центре фермента, ослабляя фосфоэфирную связь и облегчая перенос фосфата на глюкозу.
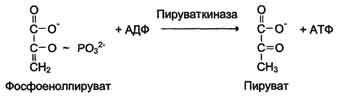
К металлоэнзимам относят, например, фермент пируват киназу (рис. 2-4), катализирующий реакцию:
Ионы металлов обеспечивают сохранение вторичной, третичной, четвертичной структуры молекулы фермента. Такие ферменты в отсутствие
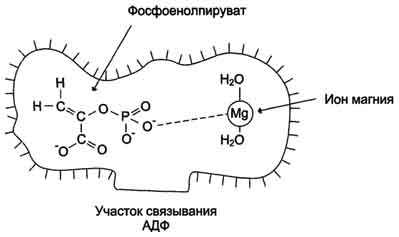
Рис. 2-4. Участие ионов магния в присоединении субстрата в активном центре пируваткиназы. Активный центр пируват-киназы имеет участки связывания для фосфоенолпирувата и АДФ. Мд 2+ участвует в стабилизации активного центра, что облегчает присоединение фосфоенолпирувата. В ходе ферментативной реакции образуется пируват и АТФ.
ионов металлов способны к химическому катализу, однако они нестабильны. Их активность снижается и даже полностью исчезает при небольших изменениях рН, температуры и других незначительных изменениях внешнего окружения. Таким образом, ионы металлов выполняют функцию стабилизаторов оптимальной конформации белковой молекулы.
Иногда в стабилизации вторичной и третичной структуры принимают участие ионы щёлочноземельных металлов. Так, для поддержания третичной конформации пируваткиназы необходимы ионы К + .
Для стабилизации четвертичной структуры алкогольдегидрогеназы, катализирующей реакцию окисления этанола, необходимы ионы цинка. Алкогольдегидрогеназа состоит из 4 субъединиц с молекулярной массой 151 кД. В состав фермента входят 4 атома Zn 2+ . Удаление Zn 2+ приводит к потере активности фермента за счёт диссоциации на 4 неактивные субъединицы с молекулярной массой 36 кД (рис. 2-5).
1. Роль металлов в присоединении субстрата в активном центре фермента
Для некоторых ферментов субстратом служит комплекс превращаемого вещества с ионом металла. Например, для большинства киназ в качестве одного из субстратов выступает не молекула АТФ, а комплекс Mg 2+ -ATФ. В этом случае ион Mg 2+ не взаимодействует непосредственно с ферментом, а участвует в стабилизации молекулы АТФ и нейтрализации отрицательного заряда субстрата, что облегчает его присоединение к активному центру фермента.
В качестве примера можно привести расположение субстратов в активном центре гексокиназы Гексокиназа катализирует перенос концевого, γ-фосфатного остатка молекулы АТФ на глюкозу с образованием глюкозо-6-фосфата:
2. Роль металлов в стабилизации третичной и четвертичной структуры фермента
Роль металлов в функционировании ферментов
Более 25% всех ферментов для проявления полной каталитической активности нуждается в ионах металлов. Роль металлов в ферментативном катализе разнообразна.
Во-первых, металл может способствовать образованию промежуточного соединения между ферментом и субстратом. Именно такой случай наблюдается при действии лейцинаминопептидазы и карбоксипептидазы А – присоединение фермента к субстрату осуществляется, благодаря образованию координационных связей через атом марганца (или магния) и атом цинка (рис. 1.4.24).

Рис. 1.4.24. Роль металла в присоединении субстрата к ферменту
Рис. 1.4.25. Участие молибдена в действии нитратредуктазы
В-третьих, металл может обеспечивать сохранение вторичной, третичной и четвертичной структуры ферментного белка. В этом отношении прекрасным примером является α-амилаза. Все виды α-амилазы – панкреатическая, солодовая, плесневая, бактериальная и слюнная – содержат кальций, который необходим именно для поддержания вторичной и третичной структуры фермента.
Лишённая кальция α-амилаза имеет такую же активность, как и нативный, содержащий кальций фермент. Это ясно видно из рис. 1.4.26. Этот же рисунок показывает, что фермент, лишенный кальция, крайне неустойчив, чрезвычайно легко денатурируется и теряет активность в результате двухчасовой инкубации при рН, отклоняющемся от оптимального.

Рис. 1.4.26. Стабильность α-амилазы Bacillиs sиbtilis при инкубации в течение двух часов при 25º и разных рН (по Э. Фишеру и сотр.). 1 – без Cа 2+ ; 2 – с Са 2+

Рис. 1.4.27. Влияние ЭДТА и трипсина на α-амилазу Bacillиs sиbtilis (по Э. Фишеру). 1 – инкубация с трипсином; 2 – инкубация с ЭДТА; 3 – инкубация с ЭДТА и трипсином (рН 7,5; 25º)
Таким образом, при оптимальном рН вторичная и третичная структура фермента поддерживается благодаря водородным и другим дополнительным связям; при более кислой и более щелочной реакции среды на первый план в качестве фактора, стабилизирующего структуру фермента, выступает кальций.
Стабилизация структуры фермента под влиянием кальция проявляется также в том, что фермент, лишенный кальция, очень легко расщепляется протеолитическими ферментами. Это видно на рис. 1.4.27, показывающем активность α-амилазы, обработанной трипсином и ЭДТА, который связывает кальций, образуя е ним прочнoe внутрикомплексное соединение (хелат). Из рисунка также видно, что трипсин практически не расщепляет α-амилазу; однако если α-амилаза предварительно обработана ЭДТА, то она быстро расщепляется трипсином. Таким образом, кальций в данном случае играет роль фактора, предохраняющего α-амилазу от расщепления протеолитическими ферментами.
Что касается роли металла в поддержании четвертичной структуры ферментного белка, то в этом отношении хорошим примером является дрожжевая алкоголь дегидрогеназа. Этот фермент имеет молекулярную массу 151 кДа, содержит четыре атома цинка в молекуле и четыре молекулы NАD + . Удаление цинка из молекулы алкогольдегидрогеназы вызывает не только её инактивацию, но и диссоциацию ферментного белка на четыре неактивные субъединицы с молекулярной массой 36 кДа каждая.
Наконец, четвертый возможный способ действия металла – когда металл способствует соединению апофермента с коферментом. Подобное действие металла наблюдается в случае алкогольдегидрогеназы и глицеральдегидфосфатдегидрогеназы.
Заканчивая раздел, посвященный роли металлов в ферментативном катализе, нужно подчеркнуть, что за последние годы все чаще выявляется, что тот или иной металл в незначительных количествах играет важную роль в ферментативных реакциях. Роль так называемых микроэлементов в обмене веществ растений и животных как раз и заключается в том, что они необходимы для построения и нормального функционирования целого ряда ферментов.
Все это еще раз свидетельствует о том, что различные стороны обмена веществ неразрывно связаны между собой – недостаток или нарушение обмена какого-либо металла в растительном или животном организме сразу же сказывается на действии того или иного фермента, вызывая соответствующее заболевание
3. Роль металлов в ферментативном катализе
4. Роль металлов в регуляции активности ферментов
гемы, входящие в состав цитохромов, каталазы, пероксидазы, гуанилатциклазы, NO-синтазы и являющиеся простетической группой ферментов;
нуклеотиды - доноры и акцепторы остатка фосфорной кислоты;
убихинон, или кофермент Q, участвующий в переносе электронов и протонов в ЦПЭ;
фосфоаденозилфосфосульфат, участвующий в переносе сульфата;
S-аденозилметионин (SAM) - донор метильной группы;
глутатион, участвующий в окислительно-восстановительных реакциях.
Читайте также:
