Из указанных в ряду химических элементов выберите три элемента металла расположите выбранные
Обновлено: 19.09.2024
Тип 3 № 9617Из числа указанных в ряду элементов выберите два элемента, которые в соединении с кислородом проявляют степень окисления +4. Запишите в поле ответа номера выбранных веществ.
Сера взаимодействует с кислородом с образованием оксидов (+2; +4; +6). Максимальная степень окисление (+6), т. к. сера находится в 6 группе, и может иметь только чётные степени окисления: .
Элемент Si — кремний — находится в 4 группе, поэтому его высшая степень окисления +4: .
Элементы-металлы находятся в 3 периоде. Восстановительные свойства увеличиваются с уменьшением номера группы.
Тип 2 № 12840Выберите три элемента, которые в Периодической системе находятся в одном периоде, и расположите эти элементы в порядке уменьшения основных и увеличения кислотных свойств высшего гидроксида. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Для выполнения заданий 1–3 используйте следующий ряд химических элементов:
Ответом в заданиях 1–3 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
Тип 1 № 12839Определите, атомы каких из указанных элементов имеют в основном состоянии два неспаренных электрона. Запишите в поле ответа номера выбранных элементов.
1. Углерод: - два неспаренных p-электрона
2. Бериллий: - нет неспаренных электронов.
3. Магний: - нет неспаренных электронов.
4. Сера: - два неспаренных p-электрона
5. Фосфор: - три неспаренных p-электрона
Тип 3 № 12841Выберите два элемента, которые в соединениях с водородом могут иметь степень окисления –3. Запишите в поле ответа номера выбранных элементов в порядке возрастания.
В молекулах этана () и фосфина () углерод и фосфор имеют степени окисления −3.
В одном (третьем) периоде находятся магний, сера и фосфор. В периоде с увеличением порядкового номера элемента основные свойства соответствующих высших гидроксидов ослабевают, поэтому последовательность данных атомов в порядке уменьшения основных и увеличения кислотных свойств высшего гидроксида выглядит следующим образом: магний — фосфор — сера.
Тип 2 № 13008Выберите три элемента, которые в Периодической системе находятся в одном периоде, и расположите эти элементы в порядке увеличения основных и уменьшения кислотных свойств высшего гидроксида. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Тип 1 № 13007Определите, атомы каких из указанных элементов имеют в основном состоянии три неспаренных электрона. Запишите в поле ответа номера выбранных элементов.
Тип 3 № 13009Выберите два элемента, у которых высшая степень окисления равна +3. Запишите в поле ответа номера выбранных элементов в порядке возрастания.
Элемент может иметь степень окисления от максимальной положительной до максимальной отрицательной. Максимальная положительная степень окисления элемента обычно численно совпадает с номером его группы в периодической системе. Максимальная отрицательная степень окисления элемента равна максимальной положительной степени окисления минус восемь.
Алюминий и бор расположены в IIIA группе.
В одном (втором) периоде находятся литий, бор и азот. В периоде с увеличением порядкового номера элемента основные свойства соответствующих высших гидроксидов ослабевают, поэтому последовательность данных атомов в порядке увеличения основных и уменьшения кислотных свойств высших гидроксидов выглядит следующим образом: азот — бор — литий.
Тип 2 № 18026Из указанных в ряду химических элементов выберите три элемента-металла. Расположите выбранные элементы в порядке возрастания восстановительных свойств соответствующих им простых веществ. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Тип 1 № 18025Определите элементы, атомы которых в основном состоянии содержат два неспаренных электрона. Запишите номера выбранных элементов.
Из указанных в ряду химических элементов выберите три элемента металла расположите выбранные
Привет! Нравится сидеть в Тик-Токе?
Готовься в формате Тик-Ток на курсах от Незнайки. Мы запустили свою онлайн-школу ЕГЭ - Рубикон.

Вариант 16
Часть 1.
Ответом к заданиям 1–26 является последовательность цифр. Цифры в ответах на задания 5, 10–12, 18, 19, 22–26 могут повторяться.
Определите, атомы каких из указанных в ряду элементов в основном состоянии содержат один неспаренный электрон. Запишите в поле ответа два номера выбранных элементов.
1) S 2) Na 3) Al 4) Si 5) Mg
Из указанных в ряду химических элементов выберите три элемента-металла. Расположите выбранные элементы в порядке возрастания восстановительных свойств. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Из числа указанных в ряду элементов выберите два элемента, которые в соединении с кислородом проявляют степень окисления +4. Запишите в поле ответа номера выбранных элементов.
Из предложенного перечня веществ выберите два вещества, в которых присутствует ионная химическая связь.
Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
2) кислотные оксиды
3) оснóвные оксиды
Из предложенного перечня веществ выберите два вещества, с каждым из которых взаимодействует цинк.
1. азотная кислота (р-р)
2. гидроксид железа(II)
3. сульфат магния (р-р)
4. гидроксид натрия (р-р)
5. хлорид алюминия (р-р)
Из предложенного перечня веществ выберите два оксида, которые реагируют с водой.
В пробирку с раствором соли Х добавили раствор вещества Y. В результате реакции наблюдали образование белого осадка. Из предложенного перечня веществ выберите вещества X и Y, которые могут вступать в описанную реакцию
3. нитрат натрия
5. хлорид алюминия
В заданной схеме превращений
веществами Х и Y являются:
Установите соответствие между уравнением реакции и веществом-окислителем в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Установите соответствие между общей формулой гомологического ряда и названием вещества, принадлежащего к этому ряду: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
3) муравьиная кислота
Из предложенного перечня веществ выберите два вещества, которые являются изомерами циклопентана.
Из предложенного перечня веществ выберите два вещества, каждое из которых реагирует с раствором перманганата калия.
Из предложенного перечня веществ выберите два вещества, с которыми взаимодействует фенол.
1. соляная кислота
2. гидроксид натрия
4. азотная кислота
5. сульфат натрия
Из предложенного перечня веществ выберите два вещества, которые подвергаются гидролизу.
Задана следующая схема превращений веществ:
1,2-дибромэтан → X → бромэтан → Y → этилформиат
Определите, какие из указанных веществ являются веществами Х и Y.
Установите соответствие между названием исходного вещества и продуктом, который преимущественно образуется при взаимодействии этого вещества с бромом: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ИСХОДНОГО ВЕЩЕСТВА
1) 2) 3) 4) 5) 6)Установите соответствие между схемой реакции и органическим веществом, которое является продуктом этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
4) диэтиловый эфир
5) ацетат меди(II)
6) этановая кислота
Из предложенного перечня веществ выберите два вещества, реакция термического разложения которых является окислительно-восстановительной.
1. нитрат алюминия
2. гидрокарбонат калия
3. гидроксид алюминия
4. карбонат аммония
5. нитрат аммония
Из предложенного перечня выберите два внешних воздействия, которые приводят к увеличению скорости реакции азота с водородом.
1. понижение температуры
2. повышение давления в системе
3. уменьшение концентрации водорода
4. увеличение концентрации азота
5. использование ингибитора
Установите соответствие между формулой вещества и продуктами электролиза водного раствора этого вещества на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
1) кислород и металл
2) водород и кислород
3) галоген и металл
4) водород и сера
5) водород и галоген
Установите соответствие между названием соли и средой водного раствора этой соли: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
А) сульфат железа(III)
Б) хлорид хрома(III)
В) сульфат натрия
Г) сульфид натрия
Установите соответствие между способом воздействия на равновесную систему
СO(г) + Cl2(г) 2(г) + Q
и направлением смещения химического равновесия в результате этого воздействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ВОЗДЕЙСТВИЕ НА СИСТЕМУ
А) увеличение концентрации оксида углерода(II)
Б) повышение температуры
В) понижение давления
Г) увеличение концентрации хлора
НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ
1) смещается в сторону обратной реакции
2) практически не смещается
3) смещается в сторону прямой реакции
Установите соответствие между двумя веществами и реагентом, с помощью которого можно различить эти вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Установите соответствие между веществом и областью его применения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Б) тетрахлорид углерода
1) получение высокомолекулярных соединений
2) производство удобрений
3) в качестве растворителя
4) получение капрона
5) в качестве топлива
Какую массу гидроксида калия необходимо растворить в 150 г воды для получения раствора с массовой долей щёлочи 25%? (Запишите число с точностью до целых.)
Ответ: __________ г.
В реакцию, термохимическое уравнение которой
вступило 88 г углекислого газа. Какое количество теплоты выделится при этом? (Запишите число с точностью до целых.)
Ответ: _____________ кДж.
Определите массу цинка, который вступает в реакцию с соляной кислотой для получения 2,24 л (н.у.) водорода. (Запишите число с точностью до десятых.)
Ответ: ____________ г.
Часть 2.
Запишите сначала номер задания (30, 31 и т. д.), затем подробное решение. Ответы записывайте чётко и разборчиво.
Составьте уравнение реакции, используя для расстановки коэффициентов метод электронного баланса:
Определите окислитель и восстановитель.
Смесь газов, полученную при прокаливании нитрата меди(II), поглотили водой, при этом образовалась кислота. Фосфид кальция обработали водой, при этом выделился газ. Этот газ осторожно пропустили через горячий концентрированный раствор полученной кислоты. Напишите уравнения четырёх описанных реакций.
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
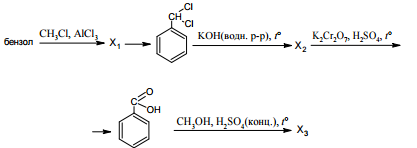
При написании уравнений реакций используйте структурные формулы органических веществ.
Гидрокарбонат натрия массой 43,34 г прокалили до постоянной массы. Остаток растворили в избытке соляной кислоты. Получившийся при этом газ пропустили через 100 г 10%-ного раствора гидроксида натрия. Определите состав и массу образовавшейся соли, её массовую долю в растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
При сгорании 16,2 г органического вещества нециклического строения получили 26,88 л (н.у.) углекислого газа и 16,2 г воды. Известно, что 1 моль этого органического вещества в присутствии катализатора присоединяет только 1 моль воды и данное вещество не реагирует с аммиачным раствором оксида серебра.
На основании данных условия задачи:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу органического вещества;
3) составьте структурную формулу органического вещества, которая однозначно отражает порядок связи атомов в его молекуле;
Досрочный вариант ЕГЭ по химии-2022 Вариант 2
1) Na 2) S 3) Al 4) O 5) Cr
1. Определите, атомы каких из указанных в ряду элементов в основном состоянии содержат одинаковое число s-электронов. Запишите в поле ответа номера выбранных элементов.
2. Из указанных в ряду химических элементов выберите три элемента-металла. Расположите выбранные элементы в порядке возрастания восстановительных свойств образуемых ими простых веществ. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
3. Из указанных в ряду элементов выберите два элемента, у которых в образуемых ими ионах ЭОх 2- совпадает степень окисления. Запишите в поле ответа номера выбранных элементов.
4. Из предложенного перечня выберите два вещества, которые имеют ионную и ковалентную неполярную связь.
1) фосфат натрия
2) метилацетат
3) бензоат аммония
4) диэтиловый эфир
5) пероксид натрия
Запишите номера выбранных веществ.
5. Среди предложенных формул веществ, расположенных в пронумерованных ячейках, выберите формулы: А) кислоты; Б) средней соли; В) кислотного оксида.

Запишите в таблицу номера ячеек, в которых расположены вещества, под соответствующими буквами.
6. В одну из пробирок с порошком оксида цинка добавили слабый электролит X, а в другую – раствор вещества Y. В результате в первой пробирке наблюдали растворение твердого вещества. В пробирке с раствором вещества Y произошла реакция, которую описывает сокращенное ионное уравнение:
ZnO + 2H + = Zn 2+ + H2O
выберите вещества X и Y, которые могут вступать в описанные реакции.
1) йодоводород
2) хлорид аммония
3) гидрокарбонат натрия
4) гидроксид натрия
5) фтороводород
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
7. Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в таблицу выбранные цифры под соответствующими буквами.
| А | Б | В | Г |
| 1 | 3 | 2 | 4 |
8. Установите соответствие между исходными веществами, вступающими в реакцию, и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| А | Б | В | Г |
| 1 | 3 | 6 | 1 |
9. Задана следующая схема превращений веществ:
Fe FeS
Определите, какие из указанных веществ являются веществами X и Y.
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
10. Установите соответствие между формулой вещества и классом/группой органических соединений, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
2) диизопропиловый эфир
Запишите в таблицу выбранные цифры под соответствующими буквами.
11. Из предложенного перечня выберите два вещества, которые являются межклассовыми изомерами.
1) пропаналь
2) пропановая кислота
3) уксусная кислота
4) нитроэтан
5) глицин
Запишите в поле ответа номера выбранных веществ.
12. Из предложенного перечня выберите все вещества, которые реагируют с водородом.
1) олеиновая кислота
2) стеариновая кислота
3) ацетон
4) изопрен
5) изопропиловый спирт
Запишите в поле ответа номера выбранных веществ.
13. Из предложенного перечня выберите два вещества, которые реагируют и с глюкозой, и с фруктозой.
1) гидроксид меди (II)
2) сульфат калия
3) водород
4) медь
5) метан
Запишите в поле ответа номера выбранных веществ.
14. Установите соответствие между схемой реакции и веществом Х, принимающим в ней участие: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Б) Х + KMnO4 + Н2О ⟶ пропандиол-1,2
В) Х + KMnO4 + H+ ⟶ пропионовая кислота
| А | Б | В | Г |
| 5 | 5 | 1 | 4 |
15. Установите соответствие между веществом и его способом получения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную
цифрой.
Б) уксусная кислота
2) щелочной гидролиз метилацетата
3) щелочной гидролиз 1,1-дихлорэтана
4) окисление бутена-2 перманганатом калия в кислой среде
5) термолиз ацетата кальция
| А | Б | В | Г |
| 6 | 4 | 1 | 3 |
16. Задана следующая схема превращений веществ:
метан ⟶ Х ⟶ бензол ⟶ Y ⟶ толуол
Определите, какие из указанных веществ являются веществами X и Y.
1) бромметан
2) этен
3) нитробензол
4) ацетилен
5) бромбензол
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
18. И з предложенного перечня выберите все реакции, для которых будет увеличиваться скорость реакции при добавлении кислорода.
19. Установите соответствие между схемой реакции и свойством элемента фосфора, которое он проявляет в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
2) является восстановителем
3) является и окислителем, и восстановителем
20. Установите соответствие между формулой соли и продуктами электролиза водного раствора этой соли, которые выделились на инертных электродах: к каждой позиции,
обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Б) сульфат натрия
2) металл, галоген
3) водород, кислород
Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V).
pH («пэ аш») – водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.

21. Д ля веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
Запишите номера веществ в порядке возрастания значения pH их водных растворов.
22. У становите соответствие между способом воздействия на равновесную систему
S 2− (р-р) + H2O(ж.) ⇆ HS − (р-р) + OH − (р-р) — Q
и смещением химического равновесия в результате этого воздействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Б) разбавление водой
В) добавление твердой щелочи
2) в сторону обратной реакции
| А | Б | В | Г |
| 1 | 1 | 2 | 3 |
23. В реактор постоянного объёма поместили некоторое количество серного ангидрида. В результате протекания обратимой реакции
в реакционной системе установилось химическое равновесие.
Используя данные, приведённые в таблице, определите равновесную концентрацию сернистого газа (X) и равновесную концентрацию кислорода (Y).
24. Установите соответствие между формулами веществ и реагентом, с помощью которого можно различить водные растворы этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| А | Б | В | Г |
| 3 | 4 | 1 | 4 |
25. Установите соответствие между названием вещества и основной областью применения этого вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Б) получение взрывчатых веществ
3) уксусная кислота
26. Вычислите массу (в г) воды, которую нужно добавить в 600 г 10%-ного раствор сульфата аммония для получения 3%-ного раствора. (Запишите число с точностью до целых.)
27. Синтез углекислого газа протекает в соответствии с термохимическим уравнением реакции
Определите объем (в л) кислорода, который образуется в результате выделения 944 кДж тепла. (Запишите число точностью до целых.)
28. 175 г технического карбоната магния, содержащего 4% некарбонатной примеси, нагрели. Найдите объем (в л) выделившегося газа (н.у.) (Запишите число с точностью до десятых.)
| Для выполнения заданий 29 и 30 используйте следующий перечень веществ: хлор, хромат калия, нитрит калия, сернистый газ, ацетат серебра, нитрат алюминия. Допустимо использование водных растворов этих веществ. |
29. Из предложенного перечня веществ выберите вещества, между которыми может протекать окислительно-восстановительная реакция, в которой в растворе образуется только кислоты. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций. Составьте электронный баланс, укажите окислитель и восстановитель в этой реакции.
2Cl 0 2 0 – окислитель
S +4 2 +4 – восстановитель
30. Из предложенного перечня веществ выберите вещества, между которыми может протекать реакция ионного обмена, в результате которой из окрашенного раствора выпадает осадок. Запишите молекулярное, полное и сокращённое ионное уравнения только одной из возможных реакций.
31. Бромоводородной кислотой нейтрализовали карбонат калия. Через полученный раствор пропустили электрический ток. Образовавшийся на катоде газ пропустили над нагретым оксидом меди (II). Полученное простое вещество растворили в концентрированном растворе азотной кислоты. Напишите уравнения четырёх описанных реакций
2KBr + 2H2O 2 + 2KOH + Br2
32. Н апишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
бутен-1 ⟶ Х1 ⟶ бутин-1 ⟶ Х2 ⟶ гексин-3 3
CH3CH2CH=CH2 + Cl2 →
+ 2KOHспирт → CH3-CH2-C≡CH + KCl + 2H2O
5CH3-CH2-C≡C-CH2-CH3 + 6KMnO4 + 9H2SO4 3CH2COOH + 3K2SO4 + 6MnSO4 + 4H2O
33. К раствору сульфата железа (III) массой 632 г, содержащего в общей сложности 1,806∙10 25 атомов кислорода, добавили 79 г сульфита калия. После окончания реакции к образовавшемуся раствору прилили 552 г 10%-ного раствора карбоната калия. Вычислите массовую долю сульфата калия в образовавшемся растворе. (Образованием кислых солей пренебречь.) В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
nO = 1,306·10 25 /6,02·10 23 = 30 моль
тогда nFe = 2x моль, nS = 3x моль, n1(O) = 12x моль
у + 12х = 30
400х + 18y = 632
34. При взаимодействии соли первичного амина с нитратом серебра образуется органическое вещество А и бромид серебра. Вещество А содержит 25,93% азота, 7,41% водорода и 44,44% кислорода по массе. Напишите уравнение реакции получения вещества А из соли первичного амина и нитрата серебра. На основании данных условия задания:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества А и запишите молекулярную формулу исходного органического вещества;
2) составьте структурную формулу вещества А, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции получения вещества А из соли первичного амина и нитрата серебра
Досрочный вариант ЕГЭ по химии №1 (2020)
Цифры в ответах на задания 5, 8, 9, 11, 16, 17, 21–26 могут повторяться.
Определите элементы, атомы которых в основном состоянии содержат два неспаренных электрона.
Запишите номера выбранных элементов.
Из указанных в ряду химических элементов выберите три элемента-металла.
Расположите выбранные элементы в порядке возрастания восстановительных свойств соответствующих им простых веществ.
Запишите номера выбранных элементов в нужной последовательности.
Из указанных в ряду элементов выберите два, которые могут проявлять степень окисления +4.
Запишите номера выбранных элементов.
Из предложенного перечня выберите два вещества, в которых присутствует ковалентная полярная связь.
- 1. фторид серы(VI)
- 2. оксид бария
- 3. фторид натрия
- 4. сульфат магния
- 5. ромбическая сера
Установите соответствие между формулой оксида и группой, к которой этот оксид принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Из предложенного перечня выберите два оксида, которые реагируют с раствором гидроксида калия.
Даны две пробирки с осадком гидроксида алюминия. В одну из них добавили раствор сильной кислоты X, а в другую – раствор сильного электролита Y. В результате в каждой из пробирок наблюдали растворение осадка. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
Запишите номера выбранных веществ под соответствующими буквами.
Установите соответствие между исходными веществами, вступающими в реакцию, и продуктом(-ами) этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Определите, какие из указанных веществ являются веществами X и Y.
Установите соответствие между формулой вещества и его названием: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Из предложенного перечня выберите два вещества, которые являются изомерами н-пропилового спирта.
2) метилэтиловый эфир
4) пропионовый альдегид
Из предложенного перечня выберите две пары исходных веществ, в результате взаимодействия которых образуется метан.
3) CH3COONa и NaOH (сплавление)
Из предложенного перечня выберите две схемы реакций, в результате которых образуются сложные эфиры.
Из предложенного перечня выберите два вещества, которые образуются при щелочном гидролизе жира, формула которого
Установите соответствие между схемой реакции и органическим веществом, преимущественно образующимся в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Установите соответствие между схемой реакции и органическим веществом – продуктом реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
2) ацетат меди(II)
4) пропионат меди(II)
5) пропионовая кислота
6) глицерат меди(II)
1) хлоруксусная кислота
2) 2-хлорпропионовая кислота
4) пропионовая кислота
5) β-аминопропионовая кислота
Из предложенного перечня выберите две реакции, которые относятся к реакциям замещения.
1) толуол с хлором на свету
2) пропен с бромной водой
3) фенол с бромной водой
4) бензол с хлором на свету
5) ацетилен с хлорной водой
Из предложенного перечня выберите два фактора, которые приводят к увеличению скорости химической реакции между раствором хлорида меди(II) и цинком.
1) увеличение концентрации хлорида меди(II)
2) повышение давления в системе
3) измельчение цинка
4) понижение температуры
5) добавление воды
Установите соответствие между схемой реакции и свойством атома марганца в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
1) только восстановитель
2) не проявляет окислительно-восстановительных свойств
3) и окислитель, и восстановитель
4) только окислитель
Установите соответствие между веществом и возможным электролитическим способом его получения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
2) водного раствора AgF
4) водного раствора CuCl2
5) раствора Al2O3 в расплавленном криолите
Установите соответствие между названием соли и отношением этой соли к гидролизу: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
А) нитрат меди(II)
Б) сульфид калия
В) ацетат аммония
Г) хлорид железа(III)
1) гидролизуется по катиону
2) гидролизуется по катиону и аниону
3) гидролизу не подвергается
4) гидролизуется по аниону
Установите соответствие между уравнением обратимой реакции и направлением смещения химического равновесия при повышении давления: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
1) смещается в сторону прямой реакции
2) смещается в сторону обратной реакции
3) практически не смещается
Установите соответствие между двумя веществами, данными в виде водных растворов, и реагентом, с помощью которого можно различить эти вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Установите соответствие между мономером и полимером, образующимся при его полимеризации: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
1) дивиниловый каучук
2) натуральный каучук
Какую массу 17%-ного раствора хлорида меди(II) надо взять, чтобы при добавлении 15 г воды получить раствор с массовой долей соли 10%? (Запишите число с точностью до десятых.)
Вычислите объём кислорода, необходимый для полного сгорания 12 л сероводорода. Объёмы газов измерены при одинаковых условиях. (Запишите число с точностью до целых.)
Определите объём водорода (н.у.), который выделится при взаимодействии 1,875 моль цинка с избытком разбавленного раствора серной кислоты. (Запишите число с точностью до целых.)
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
нитрат бария, сульфид калия, соляная кислота, нитрит натрия, перманганат калия, ацетат железа(II). Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, между которыми протекает окислительно-восстановительная реакция, в результате которой выделяется газ. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми приводит к образованию осадка. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Карбид алюминия сожгли. Полученное твёрдое вещество поместили в раствор гидроксида натрия. Через образовавшийся прозрачный раствор пропустили газ, полученный при действии на магний концентрированной серной кислоты. При пропускании газа происходило выпадение белого осадка и образование соли бескислородной кислоты. Напишите уравнения
четырёх описанных реакций.
Через 640 г 15%-ного раствора сульфата меди(II) пропускали электрический ток до тех пор, пока на аноде не выделилось 11,2 л (н.у.) газа. К образовавшемуся раствору добавили 665,6 г 25%-ного раствора хлорида бария. Определите массовую долю хлорида бария в полученном растворе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
При сгорании органического вещества А массой 4,0 г получено 4,48 л (н.у.) углекислого газа и 2,88 г воды. Известно, что вещество А вступает в реакцию с раствором гидроксида бария при нагревании, в результате чего образуется предельный одноатомный спирт и соль, кислотный остаток которой содержит три атома углерода.
На основании данных условия задачи:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу вещества А;
2) составьте возможную структурную формулу вещества А, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции вещества А с раствором гидроксида бария при нагревании (используйте структурные формулы органических веществ).
Ответы к первой части пробного варианта №1
1) 14
2) 152
3) 14
4) 14
5) 434
6) 34
7) 52
8) 3552
9) 2114
10) 31
11) 132
12) 12
13) 13
14) 14
15) 45
16) 3223
17) 6351
18) 42
19) 13
20) 13
21) 344
22) 1153
23) 1421
24) 2131
25) 4233
26) 123
27) 21,4
28) 18
29) 42
Ответы ко второй части пробного варианта №1
Задание 30
5∙ | 2Cl -1 − 2ē → Cl2 0
хлор в степени окисления –1 (или соляная кислота) является восстановителем.
Задание 31
2CH3COO – + Fe 2+ + 2K + + S 2– = FeS + 2CH3COO – + 2K +
Задание 32
Задание 33
Задание 34
Через 640 г 15%-ного раствора сульфата меди(II) пропускали электрический ток до тех пор, пока на аноде не выделилось 11,2 л (н.у.) газа. К образовавшемуся раствору добавили 665,6 г 25%-ного раствора хлорида бария. Определите массовую долю хлорида бария в полученном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение:
Запишем уравнения протекающих реакций:
Вычислим массу и количество вещества сульфата меди (II) в исходном растворе:
m(CuSO4) = 640 · 0,15 = 96 г;
n(CuSO4) = 96/160 = 0,6 моль.
При пропускании электрического тока через водный раствор сульфата меди (II) выделяется кислород, причем электролизу могут подвергаться и раствор сульфата меди (II) (реакция I) и вода (реакция II).
Вычислим общее количество выделившегося кислорода:
n(O2) = 11,2/22,4 = 0,5 моль.
По уравнению реакции (I) выделилась медь и прореагировал раствор сульфата меди (II):
nI(Cu) = nI(CuSO4) = 0,6 моль;
mI(Cu) = 0,6 · 64 = 38,4 г.
Количество образовавшейся серной кислоты равно количеству прореагировавшего сульфата меди (II) (реакция I):
n(H2SO4) = nI(CuSO4 ) = 0,6 моль;
следовательно, количество образовавшегося в результате реакции (I) кислорода составляет:
nI(O2) = 0,5nI(CuSO4) = 0,3 моль;
тогда количество кислорода, выделившегося при электролизе воды (реакция II) составляет:
nII(O2) = 0,5 – 0,3 = 0,2 моль;
отсюда количество прореагировавшей воды по реакции II:
nII(H2O) = 2nII(O2) = 0,4 моль;
mII(H2O) = 0,4 · 18 = 7,2 г.
Масса выделившего по реакции I кислорода составляет:
mI(O2) = 32 · 0,3 = 9,6 г.
Вычислим массу и количество вещества хлорида бария:
m(BaCl2) = 665,6 · 0,25 = 166,4 г;
n(BaCl2) = 166,4 / 208 = 0,8 моль.
Из образовавшихся продуктов с хлоридом бария реагирует только серная кислота, следовательно,
nIII(BaCl2) = n(H2SO4) = 0,6 моль;
nост.(BaCl2) = 0,8 – 0,6 = 0,2 моль;
m ост.(BaCl2) = 0,2 · 208 = 41,6 г;
тогда количество и масса выпавшего в осадок сульфата бария составляют:
n(BaSO4) = nIII(BaCl2) = 0,6 моль;
m(BaSO4) = 0,6 · 233 = 139,8 г.
Вычислим массу образовавшегося раствора и массовую долю хлорида бария:
m(р-ра) = m(р-ра CuSO4) + m(р-ра BaCl2) – mI(Cu) – mII(H2O) – mI(O2) = 640 + 665,6 – 38,4 – 7,2 – 139,8 – 9,6 = 1110,6 г;
тогда массовая доля хлорида бария составляет:
ω(BaCl2) = mост.(BaCl2)/m(р-ра) = 41,6/1110,6 = 0,037, или 3,7 %.
Задание 35
1) Вычислим количества вещества углекислого газа и воды, образующихся при сгорании вещества А и перейдем к количествам составляющих их элементов:
n(CO2) = V(CO2)/Vm = 4,48 л/22,4 = 0,2 моль;
следовательно, n(С) = n(CO2) = 0,2 моль,
m(C) = M(C) · n(С) = 12 г/моль · 0,2 моль = 2,4 г;
n(H2O) = m(H2O)/M(H2O) = 2,88 г/18 г/моль = 0,16 моль,
следовательно, n(H) = 2n(H2O) = 2 · 0,16 моль = 0,32 моль,
m(H) = M(H) · n(H) = 1 г/моль · 0,32 моль = 0,32 г.
Проверим, есть ли в соединении кислород:
m(O) = m(орг. в-ва) − m(C) − m(H) = 4,0 г – 2,4 г − 0,32 г = 1,28 г, следовательно,
n(O) = m(O)/M(O) = 1,28 г/16 г/моль = 0,08 моль.
Найдем простейшую формулу данного соединения. Представим ее как CxHyOz:
x : y : z = 0,2 : 0,32 : 0,08 = 5 : 8 : 2.
Т.е. простейшая формула искомого соединения C5H8O2.
Поскольку вещество А вступает в реакцию с раствором гидроксида бария при нагревании, в результате чего образуется предельный одноатомный спирт и соль, кислотный остаток которой содержит три атома углерода, скорее всего искомое вещество – сложный эфир с 2 атомами углерода в спиртовом остатке.
Простейшая формула совпадает с истинной.
2) При уравнивании числа атомов водорода находим, что сложный эфир образован непредельной кислотой. Структурная формула искомого вещества А представляет собой:
3) Реакция вещества А с раствором гидроксида бария при нагревании приводит к образованию соли и спирта:
Читайте также:
