Изменение кристаллической решетки металла от температуры
Обновлено: 03.05.2024
Уральский государственный лесотехнический университет
Кафедра технологии металлов
Блюм Э.Э., Потехин Б.А., Резников В.Г.
Основы термической обработки сталей
(конспект лекций)
для самостоятельной работы студентов очного и заочного факультетов
1. Превращения при нагреве и охлаждении стали
1.1. Кристаллическое строение металлов
Металлы и сплавы тела кристаллические - атомы в них расположены в определенном порядке в пространстве. Порядок в расположении атомов в пространстве называют кристаллической решеткой .
В чистых металлах, т.е. при наличии атомов одного элемента, возможно 14 вариантов расположения атомов. Это обусловлено тем, что в кристалле каждый атом должен иметь одинаковое количество атомов-соседей, расположенных от него на одинаковом расстоянии.
В химических соединениях, т.е. при наличии атомов различных элементов, число возможных комбинаций в расположении атомов (типов решеток) становится бесконечно большим. Подавляющее большинство металлов и сплавов имеют сравнительно простые кристаллические решетки (см. рис. 1)
Наибольший интерес представляет строение железа и его сплавов (стали и чугуны)
Железо ниже температуры 911 0 С имеет кубическую объемно-центрированную кристаллическую решетку (ОЦК) и называется a Fe . Такое же строение могут иметь некоторые другие металлы ( Ti , V , W , Mo , Cr , Mn ).
При температурах 911-1390 0 С железо имеет кубическую гранецентрированную кристаллическую решетку (ГЦК) и называется g Fe . Такая же решетка имеется у некоторых других металлов ( Cu , Al , Pb ).
Кратчайшее расстояние между центрами атомов в кристаллической решетке называется параметром решетки (а). Параметры измеряют в ангетремах (А) или килоиксах (КХ)
Параметры решетки соизмеримы с радиусом атомов. Например, у a Fe а=2,8608А, R ат =1,26А,у g Fe а=3,649А, R ат =1,29А
1.2. Аллотропия металлов
Аллотропия - способность некоторых металлов изменять тип кристаллической решетки при изменении внешних условий (температуры и давления). Обычно каждый тип решетки устойчив в определенном интервале температур, но в некоторых случаях, например при быстром охлаждении может одновременно существовать несколько типов решеток. Различные модификации (типы решеток) одного и того же металла обозначают греческими буквами: a , b , g , d и т.д. Буквой обозначается самая низкотемпературная модификация.
Например, при нагреве железа происходят следующие превращения:
a Fe ® b Fe ® g Fe ® d Fe ® Ж
магнитно не магнитны
Признаки аллотропического превращения следующие:
1. Изменяется тип кристаллической решетки;
2. Наблюдается тепловой эффект;
3. Свойства изменяются скачком
Таким образом в железе наблюдается два аллотропических превращения (при температурах 911 и 1390 0 ).
С изменением типа кристаллической решетки железа резко изменяется растворимость в нем углерода. Так максимальная растворимость углерода в a Fe 0,02% (при t =723 0 ), а в g Fe 2,14% (при t =1130 0 ). Это черезвычайно важно для понимания процессов происходящих при термической обработке стали.
Аллотропия наблюдается в ряде металлов ( Sn , Ti , Ni , Mn , Cr и др.).
1.3. Строение металлических сплавов
Химические элементы из которых состоит сплав называют компонентами. При взаимодействии компонентов в сплавах образуются фазы. Фаза - однородная часть сплава отделенная от других поверхностью раздела. При изучении процессов, происходящих при нагреве и охлаждении сплавов, используются диаграммы состояния, которые строят опытным путем. Диаграммой состояния называют график, который показывает фазовое состояние сплава в зависимости от температуры и химического состава. Следует иметь в виду, что диаграммы состояния построены для условий медленного нагрева или охлаждения.
В сплавах могут быть следующие типы твердых фаз: кристаллы чистых компонентов, кристаллы твердых растворов, кристаллы химических соединений.
Кристаллы чистых компонентов состоят из одинаковых атомов, расположенных в виде кристаллической решетки.
Кристаллы твердых растворов состоят из разноименных атомов, образующих общую кристаллическую решетку, тип которой такой же, как у одного из входящих компонентов. При рассмотрении в микроскоп твердые растворы выглядят, как чистые металлы, т.е. являются однофазными. В отличие от химических соединений твердые растворы существуют не при определенном соотношении компонентов, а в интервале концентраций. Поэтому они на диаграммах состояния всегда занимают определенные области. Твердые растворы, как правило, имеют невысокую твердость.
В промышленных сплавах наиболее часто встречаются два типа твердых растворов: замещения и внедрения.
В твердых растворах замещения атомы растворимого элемента занимают в кристаллической решетке места атомов растворителя. Такие твердые растворы могут быть ограниченной и неограниченной растворимости. При неограниченной растворимости любое количество атомов одного компонента может быть заменено атомами другого компонента. Это возможно при выполнении следующих условий: у обоих компонентов одинаковый тип кристаллической решетки, сходное строение валентной электронной оболочки атомов, малое различие в размерах атомов.
Если у двух металлов с одинаковым типом кристаллической решетки диаметры атомов различаются значительно, то растворение второго компонента приводит к сильным искажениям кристаллической решетки. Когда эти искажения достигают определенной величины, решетка становится неустойчивой, что приводит к пределу растворимости.
Твердые растворы замещения всегда образуются между металлами, например, железо с Cr , Mn , Ni , W , Co .
В твердых растворах внедрения атомы растворимого элемента размещаются в междуузельных пространствах кристаллической решетки элемента растворителя. Такие твердые растворы образуются в том случае, когда диаметр атомов растворимого элемента много меньше, чем диаметр атомов элемента растворителя. Поэтому такие твердые растворы образуются между металлами и неметаллами (С,Н,О,N), имеющими малые размеры атомов. Образование таких твердых растворов приводит к некоторому искажению кристаллической решетки и к увеличению параметра решетки. Примером таких твердых растворов в стали служит феррит (твердый раствор внедрения углерода в a Fe ) и аустенит (твердый раствор внедрения углерода в g Fe ).Схемы твердых растворов замещения и внедрения показаны на рис. 2.
Следует, однако, иметь в виду, что в промышленных сплавах, например в сталях, нет в чистом виде твердых растворов замещения и внедрения. Даже простые углеродистые стали представляют собой сложные многокомпонентные сплавы, в которых образуются твердые растворы внедрения на базе твердых растворов замещения.
Химические соединения - такие фазы, которым можно приписать простые стехиометрические формулы. Они имеют обычно сложную кристаллическую решетку с упорядоченным расположением атомов, тип которой отличается от решеток входящих в них компонентов. Состав химических соединений, в отличие от тверды растворов, постоянный и не изменяется с изменением температуры. Поэтому на диаграммах состояния химические соединения показывают вертикальной прямой линией.
Свойства химических соединений всегда сильно отличаются от свойств входящих в них компонентов.
В сталях наибольший интерес представляет химическое соединение Fe 3 C, обладающее высокой твердостью и хрупкостью.
При рассмотрении сплавов в микроскоп видны структурные составляющие . Структурными составляющими называют участки сплава, которые выглядят одинаково (светлыми, темными, пестрыми). Структурные составляющие выявляют путем травления полированных образцов-шлифов кислотами или другими реактивами. Структурные составляющие могут состоять из одной или нескольких фаз.
Все сплавы в твердом состоянии могут состоять из следующих структурных составляющих:
1. Кристаллов твердых растворов,
2. Кристаллов химических соединений,
3. Механической смеси кристаллов различных типов (кристаллов чистых компонентов, твердых растворов и химических соединений).
При образовании механических смесей особо выделяют однородные механические смеси, которые являются самостоятельными структурными составляющими и при рассмотрении в микроскоп выглядят однородными участками.
Если однородная механическая смесь образовалась при кристаллизации из жидкого состояния, то она называется эвтектикой. Например, при кристаллизации белого чугуна содержащего 4,3%С образуется эвтектика (однородная механическая смесь состоящая из аустенита и цементита), которая имеет специальное название ледебурит .
Если однородная механическая смесь кристаллов образовалась в твердом состоянии, то она называется эвтектоидом . Например, в углеродистой стали содержащей 0,83%С при охлаждении ниже 723 0 аустенит распадается на феррит и цементит. Такая однородная механическая смесь в сталях имеет специальное название - перлит .
1.4. Превращения в стали при нагреве
Термическая обработка стали состоит в нагреве до определенной температуры, выдержке и охлаждении с определенной скоростью.
При кажущейся простоте этих операций в процессе их выполнения в стали протекают сложные процессы, которые и определяют свойства после термической обработки.
На рис. 3. Показан фрагмент диаграммы Fe-C, где находятся углеродистые стали. Линии на диаграмме имеют специальные обозначения. Линия А 1 (723 0 ) показывает начало образования аустенита при нагреве, линия А 3 - конец образования аустенита, линия А ст - конец растворения цементита в аустените.
После медленного охлаждения, а диаграмма и построена при медленном охлаждении, структуры стали в зависимости от содержания углерода будут различными.
5.5. Изменение кристаллической решетки при нагревании и остывании.
Некоторые металлы (железо, олово, титан) способны испытывать превращения в твердом состоянии, они изменяют тип кристаллической решетки при изменении температуры, т.е. подвергаются так называемой вторичной кристаллизации (перекристаллизации). Например, железо имеет четыре аллотропические формы: α-Fe; β-Fe, γ-Fe, δ-Fe. Практическое значение имеют α-Fe и γ-Fe, так как β-Fe и δ-Fe отличаются от α-Fe только величиной межатомного расстояния, а для β-Fe характерно отсутствие магнитных свойств.
α-железо (α-Fe) при температурах до 911˚С имеет тип кристаллической решетки ОЦК, при дальнейшем ее повышении (911…1401˚С) атомы перестраиваются в кристаллическую решетку типа ГЦК, образуется γ-железо (γ-Fе), при температурах более 1401˚С атомы вновь перестраиваются в объемно-центрированную кубическую кристаллическую решетку, образуется α-Fe.
Температура, при которой происходит переход металла из одного аллотропического вида в другой, называется критической. Величины этих температур видны на диаграмме охлаждения и нагревания чистого железа (рис. 5.7), которые соответствуют горизонтальным участкам графика, свидетельствующих о том, что фазовые превращения происходят с выделением тепла при охлаждении и поглощением его при нагревании.

Рис. 5.7. Кривые охлаждения и нагревания железа
Существование одного и того же металла в нескольких кристаллических формах (модификациях) называется – полиморфизмом. А переход из одной модификации в другую – полиморфным превращением, которое сопровождается выделением или поглощением теплоты.
Разные полиморфные модификации обозначают буквами греческого алфавита α, β, γ, δ, которые добавляют к названиям металлов, например α-Fe, γ-Fe.
При полиморфных превращениях изменяется не только строение кристаллической решетки металла, но и его свойства – прочность, пластичность и др.
Полиморфизм металлов имеет большое значение, т.к. определяет свойства металлов при механической и термической обработке, его работе в условиях низких и высоких температур.
5.6.Изменения структуры в результате проката.
Полученная в результате остывания слитка структура стали получает дальнейшее изменение во время проката.
Прокат большинства изделий стали производится в горячем состоянии, при температурах, зависящих от состава стали. Для строительных сталей (С~0,2%) температура начала проката составляет 1200 – 1000 0 , она выше температуры аллотропического превращения стали при нагревании, распадения цементита и перехода феррита в аустенит, поэтому сталь при прокате имеет однородную структуру аустенита. Аустенит при высоких температурах весьма пластичен и подвижен, в соответствии с чем при прокате зерна претерпевают весьма значительные деформации, вытягиваются и поворачиваются в направлении проката, крупные зерна распадаются на мелкие. Пузыри, неплотности, трещины, которые имел мягкий металл, при этом уничтожаются и завариваются, плотность стали увеличивается.
Одновременно с этим происходит явление рекристаллизации металла. Явление рекристаллизации состоит в росте зерна металла, нагретого до определенной температуры – выше 450 0 – после получения металлом пластической деформации (рис. 5.8). Причиной рекристаллизации являются собственные напряжения II рода, проявляющиеся в результате пластической деформации и повышающие энергетический уровень материала.
При ослаблении материала, связанного с повышением температуры, эта накопленная энергия проявляется в росте зерен; температура рекристаллизации является границей между холодной обработкой стали, связанной в основном с упрочнением, и горячей, связанной с разупрочнением и разрыхлением. При некоторых значениях пластической деформации (порядка 10%) рост зерна стали достигает исключительных размеров при существенном снижении прочности и продукция получается недоброкачественной; однако деформации проката всегда выше критических значений. При больших значениях деформаций зерно измельчается, становится однородным и имеет меньше склонности к росту.


Рис. 5.8. Изменение размера зерна в зависимости от степени деформации
Рис. 5.9. Зависимость величины зерна от температуры окончания проката
Большое значение имеет температура окончания проката, так при температуре окончания 800 – 900 0 получается мелкое зерно. При более высоких температурах величина зерна увеличивается и получается недоброкачественная (видманштетовая) структура (перегретая сталь) (рис. 5.10). Таким образом, для получения доброкачественной стали требуется весьма точный температурный режим (рис. 5.9).

Рис. 5.10. Видманштеттова структура стали
Весьма существенной является величина природного зерна; при мелком однородном зерне спокойной стали и при пластических деформациях выше критических значений рост зерен при рекристаллизации оказывается несущественным. Но при неоднородном зерне кипящей стали, при неправильностях термического режима проката возможен рост зерен и ухудшение продукции. Однако все же, как правило, прокат улучшает качество стали, она получается более однородной, обычно с мелким или вытянутым зерном (при более низкой температуре окончания проката), но несколько менее изотропной (по направлению проката механические качества повышаются).
При температуре проката собственные напряжения стали снимаются, сталь получает однородную структуру аустенита. Дальнейшие изменения структуры и напряженного состояния связаны с режимом остывания стального изделия после проката. При медленном и равномерном остывании сталь проходит температуру аллотропического превращения и получает перлито-ферритовую структуру, соответствующую содержанию в ней углерода. При распаде аустенита несомненно появляются собственные напряжения II и Ш рода, но эти напряжения скорее полезны, чем вредны, так как они упрочняют структуру стали. Однако равномерное остывание прокатного профиля вследствие своеобразия его формы (уголок, двутавр, швеллер) обычно не имеет места, так как концы полок, фасонных сечений вследствие большей поверхности соприкасания с воздухом остывают скорее, чем корневые части; при этом усиливается ликвация.
Раздел 6. Металлы Атомно-кристаллическое строение металлов
Металлы – кристаллические вещества, характеризующие высокими электро- и теплопроводностью, ковкостью, способностью хорошо отражать электромагнитные волны и другими специфическими свойствами. Свойства металлов обусловлены их строением: в их кристаллической решётке есть не связанные с атомами электроны, которые могут свободно перемещаться.
Строение металлов представлено в виде мнимой пространственной решетки из пересекающихся стержней, в местах пересечения, которых располагаются атомы, потерявшие свои валентные электроны. Эти электроны становятся общими для всей совокупности атомов. Электроны образуют электронное облако, или электронный газ и хаотически движутся в пространстве между атомами. Атомы в узлах решетки совершают колебательное движение с частотой 10 13 колебаний в сек. Скорость хаотического движения электронов, и амплитуда колебаний атомов зависит от температуры (с повышением температуры скорость движения электронов и колебаний атомов увеличивается).
Строение всех металлов характеризуется закономерным и периодически повторяющимся расположением атомов в кристаллической решётке.
Любая решётка характеризуется размером, этот размер носит название период или параметр кристаллической решётки – это расстояние между ближайшими параллельными кристаллическими плоскостями (а). Если а- одинаков во всех направлениях, то решетка кубическая.

Минимальный объём носит название элементарная кристаллическая ячейка – это минимальный объём кристаллической решётки, перемещая которую, можно построить всю решётку.

Различают простую элементарную кристаллическую ячейку (1), когда атомы располагаются только в узлах сечения.
Сложная элементарная кристаллическая ячейка, когда атомы располагаются не только в узлах ячейки, но и в между узлиях (2), (3), (4).

Чаще всего это кубическая объемно-центрированная, кубическая гранецентрированная и гексагональная решетки
В объемно-центрированной кубической (ОЦК) решетке восемь атомов располагаются в вершинах куба и один в центре. ОЦК решетку имеют железо при комнатной температуре, ванадий, вольфрам, молибден, хром и др. металлы (рис. 3 а).
В гранецентрированной кубической (ГЦК) решетке атомы расположены в вершинах куба и в центрах шести граней. ГЦК решетку имеют алюминий, медь, никель, свинец, серебро и др. металлы (рис. 3 б).
Гексагональная плотноупакованная (ГПУ) решетка представляет собой шестигранную призму, в основании которой расположены правильные шестиугольники. Атомы расположены в вершинах и центрах этих шестиугольников. ГПУ решетку имеют магний, цинк, титан, цирконий и др. металлы (рис. 3 в).
Рисунок 3 - Типы кристаллических решеток металлов:
А) объемноцентрированная кубическая
б) гранецентрированная кубическая
в) гексагональная плотноупакованная
Некоторые металлы, в зависимости от температуры, могут иметь различный тип кристаллической решётки, т.е. могут существовать в различных кристаллических модификаций.
Полиморфизм (аллотропия) – когда металл имеет разную кристаллическую решётку в зависимости от условия образования. Переход одной решётки в другую называется полиморфное или аллотропическое состояние. Полиморфные превращения в металлах происходят при изменении температуры. Так, при температуре свыше 723°С железо переходит из α – модификации в γ – модификацию, при этом изменяются физико-механические свойства металла.
Чтобы отличить одну кристаллическую решётку железа Fe от другой ставят значок α или γ
До 910°С железо Fe существует в модификации α – Feα (ОЦК)
При температуре с 910°С до 1400°С – Feγ (ГЦК)
При температуре 1400°С – 1539°С – Feδ (ОЦК)
В монокристаллах свойства металла по различным направлениям различны – это явление носит название анизотропией.
В реальных поликристаллических металлах свойства по любому направлению одинаково – это явление называется изотропией.
Материаловедение / Лекции металловедение 1
Металловедение – прикладная наука, изучающая взаимосвязи между составом, строением и свойствами металлов и сплавов в различных условиях.
Изучение этой дисциплины позволяет осуществить правильный и рациональный выбор материалов для конкретных условий работы той или иной детали, изделия или конструкции в целом.
Металлы и их сплавы повсеместно используются для конструкций машин, оборудования, инструмента и т.д. В последнее время в промышленности стали использоваться искусственно созданные материалы такие как керамика, пластмассы, синтетические волокна, каучуки, композиционные материалы. Однако, металлы и металлические материалы служат основным конструкционным материалом и в обозримом будущем по-прежнему будут доминировать.
Синтетические материалы в мировом производстве заменили всего лишь около 6% металлов. И это не случайно. Свойства, которыми обладают металлы и их сплавы, не присущи никакому другому материалу.
Металлы характеризуются прочностью, твердостью, пластичностью, устойчивостью против воздействия температур, агрессивных сред, обладают высокой электро- и теплопроводностью и многими другими ценными свойствами. Кроме того, металлические материалы хорошо обрабатываются, режутся, могут свариваться.
Чистые металлы составляют основу огромного количества сплавов. Изменяя химический состав, вводя в него небольшие добавки тех или иных химических элементов, можно получать сплавы почти с любыми заранее заданными свойствами.
Таким образом, задача металловедения – правильный выбор металлического материала для изготовления деталей, изделий, работающих в конкретных, заданных условиях ( возможное воздействие внешних нагрузок, влияние температуры, агрессивных сред, радиации и т.д.) и обеспечение надежности и длительной работоспособности этих изделий.
Металлические материалы обычно делятся на две большие группы:
-- сплавы на основе железа (сталь и чугун), которые называются черными металлами;
-- сплавы на основе остальных металлов (алюминий, магний, титан, медь, молибден, ниобий и другие), которые называют цветными металлами.
Наибольшее распространение в промышленности получили сплавы на основе железа. Эти универсальные конструкционные материалы не только обладают высокими свойствами, но имеют относительно небольшую стоимость.
АТОМНО-КРИСТАЛЛИЧЕСКОЕ СТРОЕНИЕ
МЕТАЛЛОВ И СПЛАВОВ
Общее свойство металлов и сплавов - их кристаллическое строение, характеризующееся закономерным расположением атомов в пространстве.
Атомно-кристаллическое строение (АКС) - это строго определенное закономерное расположение атомов в пространстве.
Для количественного описания и оценки АКС вводится понятие кристаллической решетки - воображаемой пространственной сетки, в узлах которой находятся атомы. Атомно-кристаллическая структура может быть представлена изображением одной элементарной ячейки, повторяющейся во всех трех измерениях.
Элементарная ячейка - наименьший объем, трансляцией которого можно полностью воспроизвести структуру кристалла (рис.1.1).

Рис.1.1
В кристалле атомы сближены до соприкосновения. Для упрощения пространственное изображение АКС и кристаллических решеток принято заменять схемами, где центры тяжести частиц представлены точками. В точках пересечения прямых линий располагаются атомы; они называются узлами решетки (рис.1.2).

Расстояния между центрами ближайших атомов (a, b, c ) называются параметрами (периодами) решетки.
Величина периодов в металлах порядка 0,1…7 нм. Размеры элементарных ячеек 0,2…0,3 нм.
Для кубической кристаллической решетки а = b = с.
Координационное число — количество атомов, находящихся на одинаковом и наименьшем расстоянии от данного.
Период решетки характеризует ее размеры, координационное число - характеризует плотность упаковки элементарной ячейки.
Углы между гранями кристаллической решетки (α, β, γ) характеризуют тип кристаллической решетки.
Для кубической решетки α=β=γ= 90 о .
Плоскость, проходящая через узлы кристаллической решетки, называется кристаллографической плоскостью.
Прямая, проходящая через узлы кристаллической решетки, называется кристаллографическим направлением.
Типы кристаллических решеток.
Существует 14 типов кристаллических решеток (решетки Бравэ). Рассмотрим 3 из них, которые наиболее часто встречаются у основной группы металлов и наиболее распространены в природе:
Объемоцентрированная кубическая решетка (ОЦК).

Рис.1.3
В кристаллической решетке ОЦК (рис.1.3) атомы расположены в вершинах элементарной ячейки и в центре куба. Такая ячейка содержит 9 атомов.
Кубическую объемоцентрированную решетку имеют хром, вольфрам, железо, ванадий, молибден и другие металлы.
Гранецентрированная кубическая решетка (ГЦК)

Рис.1.4
В ячейке кубической гранецентрированной решетки (рис.1.4) атомы находятся в вершинах куба и на пересечении диагоналей каждой плоскости. Такая ячейка имеет 14 атомов.
Решетку ГЦК имеют свинец, никель, медь, железо, серебро и другие металлы.
З. Гексагональная плотноупакованная решетка (ГПУ).

Рис.1.5
В гексагональной плотноупакованной решетке (рис.1.5) атомы расположены в вершинах и в центре шестигранных оснований призмы, а три атома – в средней плоскости призмы. Ячейка ГПУ решетки содержит 17 атомов.
Гексагональную кристаллическую решетку имеют магний, кадмий, цинк и другие металлы.
Некоторые металлы могут изменять тип кристаллической решетки при изменении температуры (при нагреве, либо охлаждении). Такие металлы называются полиморфными.
Явление полиморфизма – изменение типа кристаллической решетки при изменении температуры.
Реальное строение металлов и сплавов
Идеальная кристаллическая решетка представляет собой многократное повторение элементарных кристаллических ячеек. Таких кристаллов в природе практически не существует. Их можно создать только в лабораторных условиях (их называют металлические усы, т.к. их толщина соответствует нескольким межатомным расстояниям).
В реальных кристаллах всегда присутствуют дефекты кристаллического строения, которые нарушают периодичность расположения атомов в кристаллической решетке. Эти дефекты оказывают существенное влияние на свойства материалов.
Различают два вида дефектов кристаллического строения: точечные и линейные.
Точечные дефекты характеризуются малыми размерами во всех трех измерениях. Величина их не превышает нескольких атомных диаметров.
К точечным дефектам относятся :
-- вакансии ( свободные места в узлах кристаллической решетки (рис.1.6);
-- атомы внедрения и замещения (примесные атомы, которые могут находиться и в узлах решетки, и в междоузлии, рис.1.7 а, б)

Рис.1.6. Вакансии
Атомы совершают колебательные движения возле узлов решетки. Под воздействием внешних воздействий (например, температуры) отдельные атомы приобретают энергию, значительно большую, чем средняя энергия соседних атомов в решетке. Эти атомы могут перемещаться из одного места в другое. Наиболее легко перемещаются атомы поверхностного слоя, выходя на поверхность. Место, где находились такие атомы, называется вакансией (рис.1.6). На это место перемещается один из соседних атомов и т.д. Таким образом, вакансия перемещается вглубь кристалла.
При комнатной температуре концентрация вакансий сравнительно невелика и составляет около 1 на 10 18 атомов, но количество вакансий в кристаллической решетке резко возрастает при нагреве и может достигать огромных величин. Так, например, в решетке некоторых металлов в 1 см 3 количество вакансий может достигать 10 13 .
К точечным дефектам относят также атомы, внедренные в междоузлие кристаллической решетки (рис.1.7 а) и замещенные атомы, когда место атома основного металла замещается в кристаллической решетке атомом другого элемента (рис.1.7 б).

Рис. 1.7. Примесные атомы внедрения (а) и замещения (б).
Точечные дефекты приводят к локальным искажениям в кристаллической решетке и локальным изменениям межатомных связей. С увеличением количества точечных дефектов может возрастать сопротивление кристаллической решетки дальнейшему смещению атомов.
С другой стороны, присутствие вакансий в решетке объясняет возможность такого физического процесса, как диффузия.
Диффузия – перемещение атомов на различные расстояния, превышающие межатомные для данного металла.
Перемещение атомов осуществляется путем обмена местами с вакансиями. Поскольку с увеличением температуры резко возрастает количество вакансий, то очевидно, что и процессы диффузии активизируются и ускоряются с увеличением температуры.
Точечные дефекты, перемещаясь по кристаллической решетке, могут объединяться в группы, образуя линейные дефекты. Скопление примесных атомов могут образовывать в определенных объемах решетки «лишнюю» кристаллографическую плоскость, а объединение вакансий, наоборот, формировать «недостающую» кристаллографическую плоскость.
Линейные дефекты кристаллического строения характеризуются малыми размерами в двух измерениях и значительной протяженностью в третьем измерении. Такие дефекты называются дислокациями (рис.1.8).
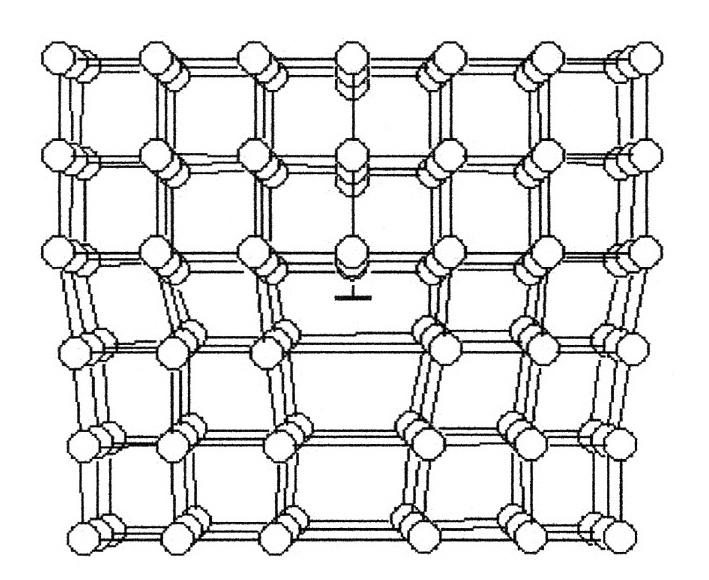
Рис.1.8. Схема расположения дислокации.
Основной вид дислокаций – краевая. В результате своего перемещения по кристаллу краевые дислокации могут выходить на поверхность кристалла. Из рис.1.8 и 1.9 видно, что атомы над краевой дислокацией испытывают сжатие, а нижние атомы – растяжение. Это приводит к значительным искажениям в той части кристаллической решетки, в которой находится дислокация, т.е. экстраплоскость.

Рис. 1.9. Расположение кристаллографических плоскостей в идеальном
кристалле (а) и незавершенная плоскость (экстраплоскость) в
кристалле с дислокацией (б).
Если экстраплоскость находится в верхней части кристалла (рис.1.10, а), то дислокацию называют «положительной» и обозначают значком «┴». Если находится в нижней части кристалла, то дислокацию называют «отрицательной» и обозначают значком «┬». Различие между положительными и отрицательными дислокациями чисто условное. Перевернув кристалл, мы превращаем положительную дислокацию в отрицательную и наоборот. Дислокации одного знака отталкиваются, а противоположного притягиваются.

Рис. 1.10. Расположение положительной (а) и отрицательной (б) дислокаций.
Дислокации внутри решетки могут взаимодействовать с точечными дефектами. Так, присоединение к лишней экстраплоскости атома внедрения перемещает дислокацию в направлении размещения этого атома. Присоединение к экстраплоскости вакансии, наоборот, перемещает дислокацию в направлении противоположном расположению вакансии.
Кроме того, дислокации могут самостоятельно перемещаться по кристаллу под воздействием приложенных к металлу напряжений. Наиболее распространенный для металлов способ и механизм перемещения дислокаций является пластический сдвиг (скольжение) (рис.1.11а, б). Распространение скольжения дислокаций по плоскости скольжения происходит последовательно. Каждый шаг перемещения дислокации из одного положения в другое совер-шается разрывом лишь одной вертикальной атомной плоскости. При этом для перемещения дислокаций требуется значительно меньшее усилие, чем для жесткого смещения одной части кристалла относительно другой по кристаллографической плоскости.
При движении дислокации вдоль направления сдвига (приложения нагрузки τ) через весь кристалл происходит смещение верхней и нижней части на одно межатомное расстояние. В результате перемещения дислокация выходит на поверхность кристалла, где остается так называемая «ступенька скольжения» (рис.1.11 в). Дислокации легче перемещаются в направлениях перпендикулярных экстраплоскости.
С наличием дислокаций в кристаллах и возможностью их перемещения связан такой важный процесс, происходящий в металлах, как пластическая деформация.
Любая пластическая деформация происходит в металлах только при приложении внешней нагрузки (напряжений). А движение дислокаций и начинается при приложении нагрузки, т.е. сама пластическая деформация связана с движением дислокаций.
Таким образом, механизм пластической деформации заключается в движении и размножении дислокаций в кристалле.
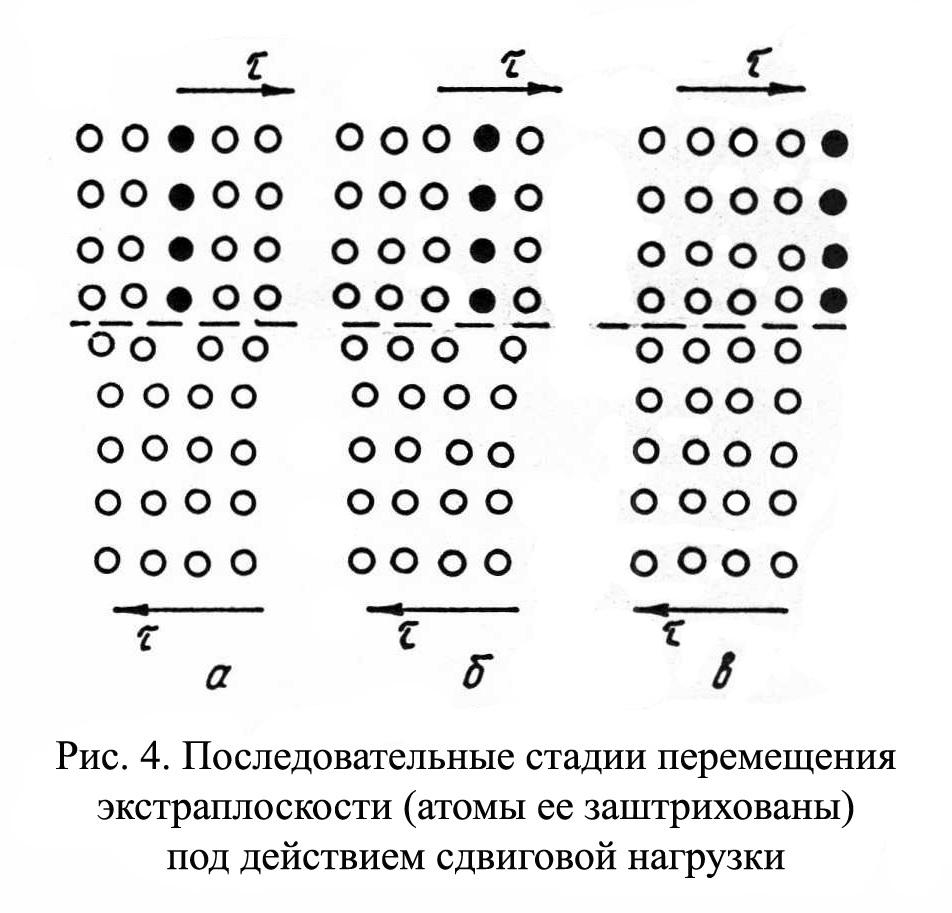
Рис.1.11. Стадии перемещения дислокаций.
Помимо краевых дислокаций в кристаллах могут образовываться винтовые дислокации (рис. 1.12). Винтовые дислокации могут образовываются путем частичного сдвига атомных слоев внутри кристалла. Кристалл как бы закручивается винтом вокруг линии воображаемого разреза. Образование винтовой дислокации носит очень сложный характер.
Основной вклад в процесс пластической деформации вносят дислокации краевые, поэтому в дальнейшем основное внимание будет уделено краевым дислокациям.

а)

б)
Рис. 1.12. Схема образования (а) и расположение атомов (б) винтовой
дислокации в кристалле.
Количество дислокаций в кристаллах может достигать большой величины и рассчитывается через плотность дислокаций ρ.
ρ=∑ l / V
Под плотностью дислокаций понимают суммарную длину дислокаций ∑ l
приходящуюся на единицу объема V кристалла. Размерность плотности дислокаций см/см 3 или см -2 . В исходном состоянии плотность дислокаций в металлах около 10 6 - 10 3 . После пластической деформации плотность дислокаций значительно возрастает и может составлять 10 11 - 10 12 .
Плотность дислокаций определяется экспериментально по специальным методикам и при очень большом увеличении. Подсчитывается число выходов дислокаций на единицу площади поверхности металла.
Использование теории дислокаций позволило объяснить многие вопросы, связанные с изменением прочности металлов и сплавов.
Превращения, происходящие в железе и стали при нагреве и охлаждении
Внимательно всмотревшись в излом металла, ясно можно увидеть, что он представляет собой нагромождение (совокупность) отдельных кристаллов (зерен), крепко сцепленных между собой. Мельчайшей частицей металла, как и всякого другого вещества, является атом. В элементарных ячейках, из которых состоят кристаллы железа, атомы расположены в определенном порядке. Это расположение изменяется в зависимости от температуры нагрева. При любой температуре ниже 910° атомы в ячейках кристаллов располагаются в виде куба, образуя так называемую кристаллическую решетку альфа-железа. В этом кубе восемь атомов расположены в углах решетки и один в центре.
При нагреве свыше 910° происходит перегруппировка атомов и кристаллическая решетка представляет собою форму куба с четырнадцатью атомами; условно ее называют решеткой гамма-железа. При температуре 1390° решетка гамма-железа перестраивается в решетку с девятью атомами, носящую название дельта-железо. Эта решетка отличается от решетки альфа-железа несколько большим расстоянием между центрами атомов и сохраняется до момента расплавления железа, т. е. до 1535° (Рис. 1).
Перестройка кристаллической решетки при медленном охлаждении происходит в обратном порядке: дельта-железо при 1390° превращается в гамма-железо, а гамма-железо при 898° превращается в альфа-железо.
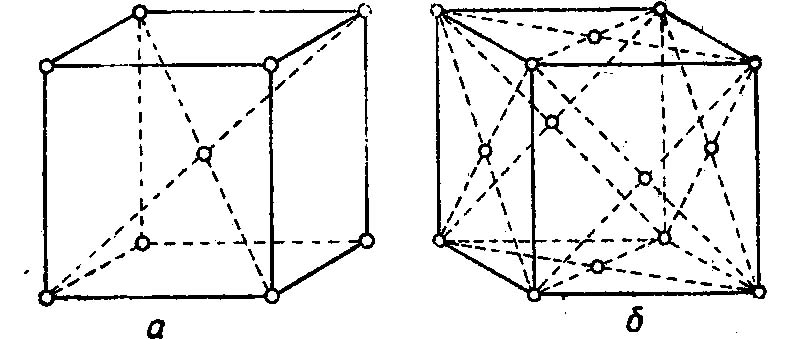
Рис. 1. Строение кристаллической решетки: а — альфа и дельта железа; б — гамма железа.
Критические точки превращения
На рис.2 показаны кривые охлаждения и нагревания чистого железа. Как видно из этих кривых, в процессе перестройки одной решетки в другую, а также при расплавлении и затвердевании железа происходят температурные остановки, являющиеся результатом выделения дополнительного количества тепла при охлаждении и поглощении дополнительного количества тепла при нагревании.
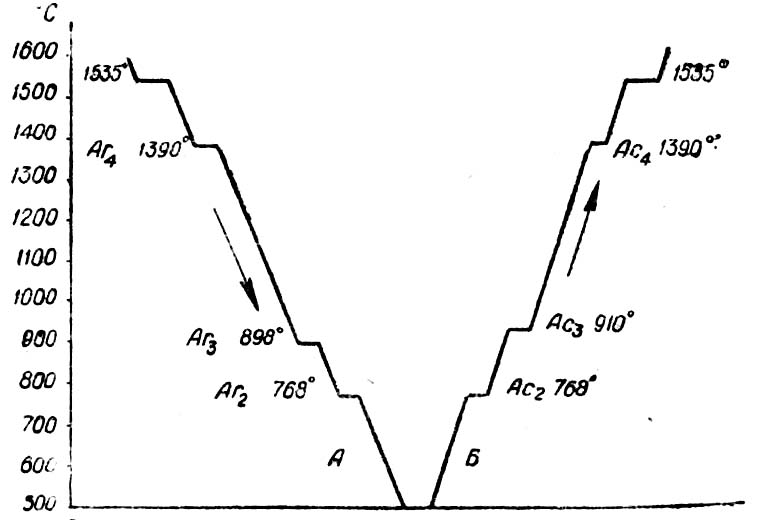
Рис. 2. Кривые охлаждения и нагрева чистого железа.
Температурные остановки, при которых происходят перестройки решеток, называются критическими температурами или критическими точками и обозначаются Аrпри охлаждении и Ас при нагревании. В точках Аr2и Ас2,не происходит перестройка атомной решетки, а изменяются магнитные свойства железа. При температуре выше 768° железо теряет способность притягиваться магнитом. При очень малой скорости нагревания и охлаждения критические точки А с3и Аr3не совпадают друг с другом на 12°. При увеличении скорости охлаждения несовпадение критических точек увеличивается, так как температура значительно снижается и железо переохлаждается. Это явление, носит название гистерезис.
При нагревании и охлаждении стали происходит также перестройка атомной решетки, но температуры критических точек не постоянны. Они зависят от содержания углерода и легирующих примесей в стали, а также от скорости нагревания и охлаждения.
На рис. 3 представлена диаграмма состояния углеродистой стали при медленном охлаждении и нагревании.
Рис.3. Диаграмма состояния углеродистых сталей.
Структура стали
Структурой стали называется внутреннее ее строение. Углерод в стали находится в виде химического соединения с железом, и это соединение называется — цементит. Кроме цементита, в стали имеется феррит, представляющий собой почти чистое железо. В зависимости от содержания углерода большая или меньшая часть феррита находится в механической смеси с цементитом, образуя новую структуру — перлит. Если небольшой кусок металла прошлифовать, отполировать и протравить в специальном реактиве, то под микроскопом можно различить структуры. Ниже приводится описание структур железоуглеродистых сплавов.
Аустенит представляет собою твердый раствор углерода и других элементов в гамма-железе. Наибольшее содержание углерода, которое может раствориться в ау-стените — это 2%. Аустенит образуется при затвердевании жидкой стали и при нагреве твердой стали выше критических температур.
В обычных сталях аустенит устойчив только лишь при температуре выше критических точек. При охлаждении, даже самом быстром, с этих температур аустенит превращается в другие структуры. При комнатной температуре аустенит полностью сохраняется в ряде марок нержавеющих сталей, в высокомарганцовистой стали и в незначительном количестве остается при закалке некоторых марок инструментальной и конструкционной сталей.
Аустенит мягок, пластичен, тягуч, мало упруг. Твердость его по Бринелю находится в пределах 170—220.
Аустенит немагнитен, обладает невысокой электропроводностью.
Феррит представляет собой твердый раствор углерода и других элементов в альфа-железе. Наибольшее содержание углерода, которое может раствориться в феррите, это 0,04%. Феррит устойчив при температурах ниже критической точки AC1. Он выделяется из аустенита при медленном охлаждении последнего ниже A6i. Феррит мягок, сильно тягуч. Твердость HB= 60—100. Феррит магнитен до 768°. Свыше этой температуры он теряет магнитные свойства.
Цементит представляет собой химическое соединение железа с углеродом Fe3C—карбид железа. Цементит содержит углерода 6,67%. Выделяется из жидкого и твердого раствора при медленном охлаждении. Цементит весьма тверд и хрупок. Твердость его НB= 800—820. Он магнитен до 210°. Выше этой температуры цементит теряет магнитные свойства.
Перлит представляет собой механическую смесь феррита и цементита. Он образуется из аустенита при медленном его охлаждении. Температура превращения аустенита в перлит 723°С. При весьма медленном переходе через эту температуру цементит образуется в виде зерен (глобулей), и тогда перлит называется зернистым. При более быстром охлаждении цементит приобретает форму пластинок, и такой перлит называется пластинчатым. При весьма быстром охлаждении в результате значительного переохлаждения аустенита вместо перлита получаются другие структуры, о которых речь будет ниже.
Перлит магнитен, прочен и пластичен. Твердость его находится в пределах от 160 до 230 кг/мм 2 по Бринелю. При обработке резанием наиболее чистую поверхность дает структура зернистого перлита.
Мартенсит образуется в результате весьма быстрого охлаждения (закалки) аустенита. При быстром охлаждении успевает произойти перестройка кристаллической решетки гамма-железа в решетку альфа-железа, выделение же углерода в карбид железа не успевает произойти, и он весь остается растворенным в решетке альфа-железа. Так как нормально альфа-железо может растворить в себе не более 0,04% углерода, то такой раствор называют пересыщенным. Он отличается весьма большой твердостью (свыше Rc= 60) и хрупкостью. Следует указать, что решетка альфа-железа, получающаяся в результате закалки, имеет искаженную форму. Так, размеры ее граней не одинаковы — в одном направлении они удлинены за счет других (см. рис. 4). Такая решетка называется тетрагональной. Чем больше в стали углерода, тем больше тетрагональность решетки и тем более велики внутренние напряжения. При нагревании до температур 100—200° тетрагональность мартенсита уменьшается, форма кристаллической его решетки приближается к форме правильного куба, и вместе с этим уменьшаются внутренние напряжения. Мартенсит магнитен.
Рис. 4. Строение кристаллической решетки стали, закаленной на мартенсит.
Троостит представляет собой высокодисперсную (мелкораздробленную) смесь феррита и карбидов. Он образуется при охлаждении аустенита с замедленной против закалки скоростью или в результате нагрева (отпуска) мартенсита в пределах 250—400°.
При нагреве закаленной стали происходит постепенное выделение углерода из кристаллической решетки с образованием карбидов. Троостит менее прочен, более пластичен, чем мартенсит. Твердость его НB330—400. При охлаждении аустенита в горячих средах в интервале 250—400° (изотермическое превращение аустенита) происходит образование игольчатого троостита, несколько более прочного, чем обычный троостит.
Сорбит представляет собой дисперсную смесь феррита и карбидов. Он образуется при охлаждении аустенита с небольшой скоростью или при нагреве (отпуске) мартенсита до 400—650°. Карбиды сорбита более крупные, чем троостита. Сорбит пластичен, вязок и магнитен. Твердость НВ 270—320.
Ледебурит представляет собой эвтектическую смесь аустенита и цементита. Он содержит углерода 4 3% Образуется ледебурит при затвердевании жидкого сплава с содержанием углерода свыше 2%. Ледебурит хрупок.
На рис. 5. представлены фотоснимки структур стали с различным содержанием углерода.
Структура стали с содержанием углерода 0,83% состоит из сплошного перлита и называется эвтектоидной; при меньшем содержании углерода структура стали состоит из перлита и феррита и носит название доэвтектоидной, а при большем содержании углерода — из перлита и цементита и называется заэвтектоидной. Температура 723°, при которой перлит переходит в аустенит, также называется критической и обозначается Ас.
Для того чтобы доэвтектоидную и эвтектоидную сталь полностью отжечь, нормализовать или закалить, их нужно нагреть до такой температуры, при которой они перешли бы в аустенитное состояние.
Рис. 5. Микроструктура отожженной углеродистой стали:
а - с содержанием углерода -0,1%
б - с содержанием углерода -0,85%
в - с содержанием углерода -1,1%
Превращения, происходящие в стали при нагревании
По диаграмме на рис. 3 можно проследить за изменениями структуры трех разных марок стали при нагревании:
- Сталь с содержанием углерода 0,83%. Структура стали представляет собой перлит. При температуре 723° в точке Aс1 перлит переходит в аустенит.
- Сталь с содержанием углерода 0,4%. Структура стали представляет собой перлит и феррит. При температуре 723° в точке К1 перлит переходит в аустенит, и по мере повышения температуры происходит растворение свободного феррита в аустените. При пересечении линии GS в точке К2 закончится растворение феррита и структура будет полностью состоять из аустенита. Для этой стали точка К1на диаграмме будет нижней критической точкой Ас1,а К2— верхней критической точкой Ас1,.
- Сталь с содержанием углерода 1,2%. Структура стали представляет собой перлит и цементит. При температуре 723° в точке Pi перлит переходит в аустенит, и при дальнейшем повышении температуры происходит постепенное растворение цементита в аустените. При пересечении линии SEв точке Р2 это растворение закончится. Для этой стали точка Р1 явится нижней критической точкой Ас1, а точка Ρ2 — верхней критической точкой, которая для заэвтектоидных сталей обозначается Асm.
Линия на диаграмме, обозначенная буквами GS, соответствует окончанию растворения феррита в аустените в доэвтектоидных сталях, а линия SE соответствует окончанию растворения цементита в аустените в заэвтектоидных сталях.
Следует указать, что заэвтектоидные стали при операциях термической обработки не нагревают выше линии Аcт(такая высокая температура нагрева приведет к перегреву и ухудшению свойств стали), а ограничиваются нагревом выше первой критической точки ACl, что полностью обеспечивает получение необходимых свойств.
Превращения, происходящие в стали при медленном охлаждении
В сталях, нагретых до аустенитного состояния, при весьма медленном охлаждении произойдут обратные превращения, а именно:
а) в стали с содержанием углерода 0,83% аустенит превратится в перлит;
б) в стали с содержанием углерода 0,4% сначала из аустенита начнет выделяться феррит, а затем в районе температуры 700° оставшийся аустенит превратится в перлит и
в) в стали с содержанием углерода 1,2% сначала из аустенита выделится цементит, а затем в районе температуры 700° оставшийся аустенит превратится в перлит.
Даже при весьма медленном охлаждении температура распада аустенита не совпадает с теми температурами, при которых аустенит образовался при нагревании. Чем скорость охлаждения больше, тем больше становится гистерезис, т. е. разница между критическими температурами (точками) при нагревании и охлаждении.
Превращения, происходящие в стали при быстром охлаждении
Как указывалось выше, при быстром охлаждении не успевает произойти превращение аустенита в перлит с выделением избыточного феррита или цементита, а в зависимости от скорости охлаждения аустенит превращается в новые структуры - мартенсит, троостит или сорбит. Сталь с этими структурами отличается от сталей со структурами перлита и феррита повышенной твердостью, прочностью и уменьшенной пластичностью. Если углеродистую сталь, нагретую выше критических температур, охладить очень быстро, то аустенит превратится в мартенсит и это превращение начнется лишь при температуре около 200°. При несколько меньшей скорости охлаждения образуется структура троостит, а при еще меньшей — сорбит.
В производственных условиях при охлаждении углеродистой инструментальной стали в воде образуется мартенсит, при охлаждении в масле — троостит и при охлаждении в струе воздуха -сорбит. На рис. 6 показаны микроструктуры закаленной стали.
Рис. 6. Микроструктура закаленной стали:
а — игольчатый мартенсит;
В легированных сталях, благодаря присутствию специальных элементов, для образования мартенсита не требуется столь большой скорости охлаждения, как для углеродистых сталей, и мартенсит образуется при охлаждении в масле, а для быстрорежущих сталей — и при охлаждении на воздухе.
Троостит и сорбит можно получить не только в результате ускоренного охлаждения, нои путем нагрева закаленной стали, имеющей структуру мартенсита, до температуры ниже Aс1, т. е. путем отпуска стали. В этом случае троостит получается при нагреве стали до 400°, а сорбит—при нагреве до 650°. При нагреве до промежуточных температур получаются смешанные структуры: при нагреве от 250—400° — мартенсит и троостит и при нагреве от 400—650° — троостит и сорбит. В производственных условиях троостит и сорбит получают путем отпуска закаленной стали.
Превращения, происходящие в стали при охлаждении в среде, имеющей температуру выше 200° (изотермическое превращение)
Если деталь, нагретую выше критической точки, поместить в среду, имеющую температуру от 700 до примерно 200°, и выдержать в ней до выравнивания температуры по всему сечению, то аустенит превратится в ту структуру, которая соответствует превращению при данной температуре.
О поведении стали при изотермической обработке, выборе температуры и времени выдержки судят по кривым изотермического превращения, построенным для разных марок стали.
Рис. 7. Диаграмма изотермического превращения аустенита углеродистой стали.
На рис. 7 дан вид диаграммы изотермического превращения в стали. На горизонтальной оси отложено время начала и конца превращения, а на вертикальной— температура, при которой оно происходит. Линия А с соответствует переходу аустенита в перлит, а линия Мн — образованию мартенсита из аустенита. На кривой I начинаются, а на кривой II заканчиваются структурные превращения.
Если углеродистую инструментальную сталь, нагретую до 800°, поместить в масло, расплавленную соль или щелочь при температуре 250°, в ней образуется игольчатый троостит с высокой твердостью Rc=45—55. Если эту же сталь охладить в среде, имеющей температуру свыше 600°, в ней образуется перлит и такая сталь легко обрабатывается на станках. При охлаждении стали в среде с промежуточными температурами образуются структуры троостита и сорбита с соответствующей твердостью.
Изотермический отжиг нашел большое применение при термической обработке инструментальных сталей как процесс, резко уменьшающий время по сравнению с другими видами отжига.
Изотермическая закалка в инструментальном деле применяется редко из-за недостаточной для инструмента твердости, достигаемой при этом процессе.
Источник:
Остапенко Н.Н.,Крапивницкий Н.Н. Технология металлов. М. Высшая школа,1970г.
Каменичный И.С. Практика термической обработки инструмента. Киев, 1959 г.
Читайте также:
