Изоляция металла от окружающей среды
Обновлено: 04.10.2024
Современная защита металлов от коррозии базируется на следующих методах:
- повышение химического сопротивления конструкционных материалов,
- изоляция поверхности металла от агрессивной среды,
- понижение агрессивности производственной среды,
- снижение коррозии наложением внешнего тока (электрохимическая защита).
Эти методы можно разделить на две группы. Первые два метода обычно реализуются до начала производственной эксплуатации металлоизделия (выбор конструкционных материалов и их сочетаний еще на стадии проектирования и изготовления изделия, нанесение на него защитных покрытий). Последние два метода, напротив, могут быть осуществлены только в ходе эксплуатации металлоизделия (пропускание тока для достижения защитного потенциала, введение в технологическую среду специальных добавок-ингибиторов) и не связаны с какой-либо предварительной обработкой до начала использования.
При применении первых двух методов не могут быть изменены состав сталей и природа защитных покрытий данного металлоизделия при непрерывной его работе в условиях меняющейся агрессивности среды. Вторая группа методов позволяет при необходимости создавать новые режимы защиты, обеспечивающие наименьшую коррозию изделия при изменении условий их эксплуатации. Например, на разных участках трубопровода в зависимости от агрессивности почвы можно поддерживать различные плотности катодного тока или для разных сортов нефти, прокачиваемой через трубы данного состава, использовать разные ингибиторы.
Однако в каждом случае приходится решать каким из средств, или в каком их сочетании можно получить наибольший экономический эффект.
Широко применяются следующие основные решения защиты металлических конструкций от коррозии:
1. Защитные покрытия
Металлические покрытия.
По принципу защитного действия различают анодные и катодные покрытия. Анодные покрытия имеют в водном растворе электролитов более отрицательный электрохимический потенциал, чем защищенный металл, а катодные – более положительный. Вследствие смещения потенциала анодные покрытия уменьшают или полностью устраняют коррозию основного металла в порах покрытия, т.е. оказывают электрохимическую защиту, в то время как катодные покрытия могут усиливать коррозию основного металла в порах, однако ими пользуются, т.к. они повышают физико-механические свойства металла, например износостойкость, твердость. Но при этом требуются значительно большие толщины покрытий, а в ряде случаев дополнительная защита.
Металлические покрытия разделяются также по способу их получения (электролитическое осаждение, химическое осаждение, горячее и холодное нанесение, термодиффузионная обработка, металлизация напылением, плакирование).
Неметаллические покрытия
Данные покрытия получают нанесением на поверхность различных неметаллических материалов – лакокрасочных, каучуковых, пластмассовых, керамических и др.
Наиболее широко используются лакокрасочные покрытия, которые можно разделить по назначению (атмосферостойкие, ограниченно атмосферостойкие, водостойкие, специальные, маслобензостойкие, химически стойкие, термостойкие, электроизоляционные, консервационные) и по со составу пленкообразователя (битумные, эпоксидные, кремнийорганические, полиуретановые, пентафталевые и др.)
Покрытия, получаемые химической и электрохимической обработкой поверхности Эти покрытия представляют собой пленки нерастворимых продуктов, образовавшихся в результате химического взаимодействия металлов с внешней средой. Поскольку многие из них пористы, они применяются преимущественно в качестве подслоев под смазки и лакокрасочные покрытия, увеличивая защитную способность покрытия на металле и обеспечивая надежное сцепление. Методы нанесения – оксидирование, фосфатирование, пассивирование, анодирование.
2. Обработка коррозионной среды с целью снижения коррозионной активности.
Примерами такой обработки могут служить: нейтрализация или обескислороживание коррозионных сред, а также применение различного рода ингибиторов коррозии, которые в небольших количествах вводятся в агрессивную среду и создают на поверхности металла адсорбционную пленку, тормозящую электродные процессы и изменяющую электрохимические параметры металлов.
3. Электрохимическая защита металлов.
Путем катодной или анодной поляризации от постороннего источника тока или присоединением к защищаемой конструкции протекторов, потенциал металла смещается до значений, при которых сильно замедляется или полностью прекращается коррозия.
4. Разработка и производство новых металлических конструкционных материалов
Разработка новых материалов повышенной коррозионной устойчивости путем устранения из металла или сплава примесей, ускоряющих коррозионный процесс (устранение железа из магниевых или алюминиевых сплавов, серы из железных сплавов и т.д.), или введения в сплав новых компонентов, сильно повышающих коррозионную устойчивость (например, хрома в железо, марганца в магниевые сплавы, никеля в железные сплавы, меди в никелевые сплавы и т.д.).
Переход от металлических к химически стойким материалам
Переход в ряде конструкций от металлических к химически стойким материалам (пластические высокополимерные материалы, стекло, керамика и др.).
Рациональное конструирование и эксплуатация
Рациональное конструирование и эксплуатация металлических сооружений и деталей (исключение неблагоприятных металлических контактов или их изоляция, устранение щелей и зазоров в конструкции, устранение зон застоя влаги, ударного действия струй и резких изменений скоростей потока в конструкции и др.).
Вопросам проектирования антикоррозионной защиты строительных конструкций уделяют серьезное внимание как у нас в стране, так и за рубежом. Западные фирмы при выборе проектных решений тщательно изучают характер агрессивных воздействий, условия эксплуатации конструкций, моральный срок службы зданий, сооружений и оборудования. При этом широко используются рекомендации фирм, производящих материалы для антикоррозионной защиты и располагающих лабораториями для исследования и обработки защитных систем из выпускаемых ими материалов.
Актуальность решения проблемы противокоррозионной защиты диктуется необходимостью сохранения природных ресурсов, защиты окружающей среды. Эта проблема находит широкое отражение в печати. Издаются научные труды, проспекты, каталоги, устраиваются международные выставки с целью обмена опытом между развитыми странами мира.
Таким образом, необходимость исследования коррозионных процессов является одной из наиболее важных проблем.
Еще статьи в рубрике Статьи на тему изделий из металла для строительства и ремонта, Металлические изделия в интерьере жилых помещений:
Все мы в своей жизни периодически сталкиваемся с различными видами коррозий. Бывают коррозии металла, бетона и некоторых видов пластмасс. Что бы .
Все недрагоценные металлы подвержены коррозии. Автомобиль, как бы дорог он ни был своему хозяину, увы, не исключение. Процесс окисления стального кузовного .
Категории коррозии при атмосферных условиях окружающей среды по стандарту ISO 12944-2 и ISO 9223 .
Простейшим способом химического окрашивание железа и его сплавов является непосредственный нагрев в воздушной среде, поверхностное окисление кислородом воздуха. Так производится воронение .
Воронение железа относится к процессам, которые в совокупности именуются химическим окрашиванием металлов. При химическом окрашивании, в противоположность окрашиванию механическому, состоящему в .
Тема 4.1. Методы защиты от коррозии. Изоляция металлов от агрессивной среды (ПОКРЫТИЯ):
Изоляция металлов от агрессивной среды (ПОКРЫТИЯ):
Металлические покрытия – покрытие защищаемого металла слоем другого металла, практически не корродирующего в тех же условиях.
При покрытии изделия различными металлами надо помнить, что покрытие и защищаемый металл могут образовывать гальваническую пару. Ее работа в определенных условиях может либо усиливать защитное действие, либо наоборот усиливать коррозию защищаемого металла.
Анодное покрытие. Например при локальном нарушении цинкого покрытия в гальвано паре цинк–железо анодом будет цинк, который и будет разрушаться, защищая железо.
Катодное покрытие. А в паре олово–железо при нарушении оловянного покрытия разрушению будет подвергаться железо, т.к. в этой паре именно оно является анодом.
Различия коррозиционной стойкости покрытий в тех или иных агрессивных средах и свойства конечных продуктов коррозии определяют специфические области применения этих покрытий.
| Анодное покрытие |
| (–) А, Zn | H2SO4| Fe, К (+) А (–) Zn – 2ē ® Zn 2+ К (+) 2Н + + 2ē ® Н2 |
| Zn + 2Н + ® Zn 2+ + Н2 Zn + H2SO4 ® ZnSO4+ Н2 |
| Катодное покрытие |
| (–) А, Fe | H2O, O2| Sn, К (+) А (–) Fe – 2ē ® Fe 2+ К (+) 2H2O + O2 + 4ē → 4OH – |
| 2Fe + 2H2O + O2® 2Fe 2+ + 4OH – 2Fe + 2H2O + O2 ® Fe(OH)2 ¯ |
Неметаллические покрытия – пленки высокополимерных веществ (каучуки, пластмассы), лаки, олифа, композиции из высокополимерных и неорганических красящих веществ.
Покрытие резиной называется – гуммирование, а бетоном – торкретирование
90% всех металлических изделий защищают подобным образом. Дешевы, их просто наносить, но они не прочны.
Химические покрытия(более надежны):
пленки из оксидов металлов (толщиной 0,3 микрона), получаемые при действии кислорода или подходящих окислителей (HNO3, K2Cr2O7 и др.) на поверхность металлов. Часто такие оксидные пленки образуются на поверхности металлов просто при соприкосновении с воздухом, что делает химически сравнительно активные металлы (Zn, Al) практически коррозионно-стойкими;
подобную же роль могут играть защитные нитридные пленки, образующиеся при действии азота или аммиака на поверхность некоторых металлов;
искусственное оксидирование (толщиной до 30 микрон), азотирование и фосфатирование, причем лакокрасочные покрытия наносятся на оксидированный, азотированный и фосфатированный металл.
Так оксидирование железа (выроненная сталь) проводят в смеси гидроксида натрия (800г/л) с нитратом (50г/л) и нитритом (200г/л) натрия при температуре 140 о С.
Оксидирование железа приводит к формированию на его поверхности пленок Fe3O4 – черного цвета или Fe2O3 – коричневого цвета.
А для фосфотирования применяют фосфаты марганца и железа, которые приводят к формированию трудно растворимых пленок трехвалентного железа.
Фосфатные и оксидные пленки нередко используют как электроизоляционные покрытия, например на трансформаторных пластинах (пробивное напряжение таких пленок может достигать 600 В).
Электрохимические методы защиты – основаны на изменении потенциала защищаемого металла и не связаны с изоляцией металла от коррозионной среды.
| Катодная защита |
| катодная (электрозащита) – защищаемая конструкция, находящаяся в среде электролита (например, в почвенной воде), присоединяется к катоду внешнего источника электричества (к отрицательному полюсу). В ту же агрессивную среду помещают кусок старого металла (рельс или балка), присоединенный к аноду внешнего источника электричества. Фактически он служит источником электронов, поставляемых на катод. В процессе коррозии этот кусок старого металла разрушается. |
| Протекторная зашита |
| протекторная (анодная) – используется специальный анод – протектор, в качестве которого применяют металл более активный, чем металл защищаемой конструкции (Zn, Mg). Протектор соединяют с защищаемой конструкцией проводником электрического тока. В процессе коррозии разрушается протектор. Этот метод применяется для защиты от коррозии лопастей турбин подводных частей кораблей, для защиты холодильного оборудования, работающего с солевыми продуктами. |
| (–) А, Zn | H2O, O2| Fe, К (+) А (–) Zn – 2ē ® Zn 2+ К (+) 2H2O + O2 + 4ē → 4OH – |
| 2Zn + 2H2O + O2 ® 2Zn 2+ + 4OH – 2Zn + 2H2O + O2 ® 2Zn(OH)2 |
Воздействие на агрессивную среду
Для замедления коррозии металлических изделий в агрессивную среду вводят вещества (чаще всего органические), называемые ингибиторами коррозии, которые пассивируют поверхность металла и препятствуют развитию коррозионных процессов. Это имеет большое значение в тех случаях, когда металл необходимо защищать от разъедания кислотами. Ингибиторы коррозии широко применяют при химической очистке паровых котлов от накипи, для снятия окалины с отработанных изделий, а также при хранении и перевозке HCl в стальной таре. В качестве органических ингибиторов коррозии применяют тиомочевину (сульфид-диамид углерода C(NH2)2S), диэтиламин, уротропин (гексаметилентетрамин (CH2)6N4) и другие производные аминов, а в качестве неорганических – силикаты, нитриты, дихроматы щелочных металлов и др.
К этой же группе методов защиты металлов от коррозии относится также освобождение воды, идущей на питание паровых котлов, от растворенного в ней кислорода, что достигается, например, при фильтровании воды через слой железных стружек.
Методы изоляции металла от окружающей среды
Изоляцию защищаемого металла от окружающей среды производят, используя различные покрытия (рис. 10), которые либо наносятся на поверхность металла (металлические и неметаллические), либо образуются при химической обработке поверхности (химические покрытия).
Металлические покрытия слоем более химически стойкого металла являются одним из наиболее распространенных способов защиты металлов от коррозии.
Способы нанесения металлических покрытий. В зависимости от способа получения металлического покрытия различают: 1) гальванические покрытия, 2) горячие покрытия, 3) металлизацию, 4) контактные покрытия.
Получение гальванических покрытий происходит в процессе электролиза. Покрытия получаются наиболее равномерными, что улучшает стойкость против коррозии. Используя гальванические покрытия, можно улучшить декоративные качества изделия.
Издавна известны горячее лужение и цинкование стали. Например, при горячем цинковании стальное изделие погружают в ванну с расплавленным цинком. После охлаждения цинк кристаллизуется на поверхности стального изделия красивыми узорами.
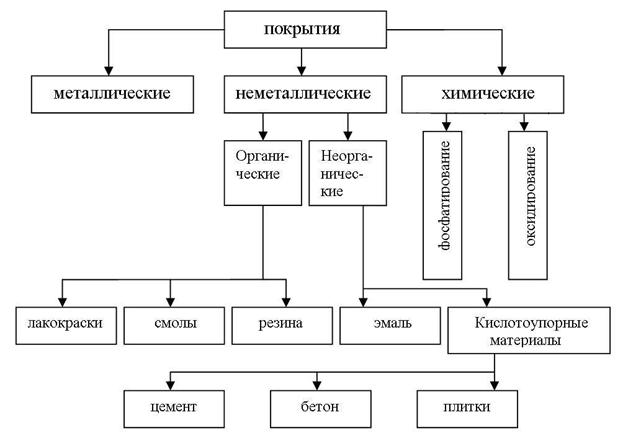 |
| Рис. 10. Защитные покрытия |
Метод металлизации используют с целью экономии металла. Распыление расплавленного металла на защищаемую поверхность производят с помощью струи сжатого воздуха из распыляющего устройства. Этот метод позволяет защищать от коррозии крупногабаритные изделия.
Контактные покрытия получаются в ходе химических реакций в растворе солей на поверхности защищаемого металла,
например:
Железо, как более активный металл, восстанавливает ионы меди из раствора. Однако использование этого метода не гарантирует надежной защиты, так как покрытия получаются неплотные, неравномерные.
Анодные и катодные покрытия. Это деление основано на том, как ведут себя металлические покрытия при электрохимической коррозии.
К катодным относятся покрытия, выполненные из тех металлов, электродные потенциалы которых имеют более положительное значение, чем у защищаемого металла, например, медь, никель, серебро. При повреждении покрытия возникает гальванопара, в которой основной материал является анодом и растворяется, а материал покрытия — катодом, на котором выделяется водород или поглощается кислород. Поэтому катодные покрытия, обеспечивающие хорошую защиту при газовой коррозии, ненадежны в электропроводящих средах, так как повреждение покрытия приводит к усиленной коррозии.
Например, лужение железных изделий заключается в нанесении слоя малоактивного, и потому устойчивого к коррозии олова. При повреждении покрытия образуется гальванопара:
Стандартный электродный потенциал железа Е 0 Fe 2+ /Fe= – 0,44 B, олова Е 0 Sn 2+ /Sn = – 0,136 B. Роль анода в данной коррозионной гальванопаре играет железо как более электроотрицательный (более активный) металл, а роль катода — олово. В процессе работы гальванопары железо окисляется, а на олове (на катоде) в кислой среде происходит восстановление ионов водорода из раствора:
Анод: Fe – 2ē = Fe 2+ (окисление);
Катод: 2H + + 2ē = H2 (восстановление).
Суммарное уравнение: Fe + 2H + = Fe 2+ +H2.
Продукт коррозии: FeCl2.
Чтобы удостовериться в протекании коррозии лужёного железа по указанной схеме, в раствор добавляют гексацианоферрат (III) калия K3[Fe(CN)6]. Это характерный реактив для обнаружения ионов Fe 2+ , с которыми гексацианоферрат-ион образует окрашенное в темно-синий цвет комплексное соединение (тривиальное название турнбулева синь):
В случае нарушения покрытия в месте повреждения появляется темно-синее окрашивание, свидетельствующее, что в растворе в результате коррозии появляются ионы Fe 2+ , а значит, коррозии подвергается железо, а не олово.
Анодные покрытия изготавливаются из металлов, Е 0 которых имеют более положительное значение, чем у защищаемого металла, например, цинк на железе. В этом случае основной металл является катодом и не корродирует до тех пор, пока не окислится весь цинк. Таким образом, слой цинка работает сначала как изолирующее покрытие, а при повреждении еще и как протектор.
Стандартный электродный потенциал железа Е 0 Fe 2+ /Fe= – 0,44 B, олова Е 0 Zn 2+ /Zn = – 0,76 B. Роль анода выполняет цинк, как более электроотрицательный металл, роль катода — железо.
В кислой среде образуется гальванопара:
Анод: Zn – 2ē = Zn 2+ (окисление);
Суммарное уравнение: Zn + 2H + = Zn 2+ +H2.
Продукт коррозии: ZnCl2.
Неметаллические покрытия могут быть по своей природе как 1) неорганическими, так и 2) органическими. Защитное действие этих покрытий сводится, в основном, к изоляции металла от окружающей среды. В качестве неорганических покрытий применяют неорганические эмали, оксиды металлов, соединения хрома, фосфора, кислотоупорные материалы (цемент, бетон, плитки) и др. К органическим относятся лакокрасочные покрытия, покрытия смолами, пластмассами, полимерными пленками, резиной.
Химические покрытия получают в ходе процессов фосфатирования и оксидирования (для второго процесса часто используют термин пассивирование) защищаемой поверхности металла.
Перед окрашиванием железных предметов их подвергают фосфатированию — обработке кислыми растворами солей фосфорной кислоты, например дигидрофосфатов железа (II) и марганца (II). В результате окисления железа на его поверхности появляется прочно с ним связанная пористая пленка фосфата железа (III), являющаяся хорошим грунтом для масляных красок.
Оксидирование металлов заключается в создании на поверхности плотных пленок их оксидов, что осуществляется 1) химическим или 2) электрохимическим путем.
В случае химической обработки очищенную от продуктов коррозии и обезжиренную деталь погружают на определенное время враствор окислителя, который вызывает пассивацию металла за счет образования на поверхности металла слоя продуктов окисления (пассивной плёнки)Так, железо пассивируется серной кислотой, если её концентрация превышает 75%. Также, используя способ химического оксидирования, проводят воронение стали, для чего стальной предмет выдерживают в растворе (г/л): 50 NaNO3, 200 NaNO2, NaOH в течение 90 мин. Затем изделие подвергается термической обработке при температуре 140°С.
В случае электрохимической обработки металл помещают в окислительный раствор и для интенсификации его окисления подключают к положительному полюсу (аноду) источника тока. Так, например, получают оксидированный (также используют термин анодированный) алюминий.
Защита металлических изделий от коррозии

Человек с глубокой древности использует предметы из металлов. До сих пор они остаются важной составляющей нашей жизни, причем самыми востребованными являются изделия из железа и его сплавов. Однако все они имеют один серьезный минус, а именно подверженность коррозии, то есть способность разрушаться в процессе окисления. Своевременная защита металлических изделий от коррозии дает возможность увеличить их срок службы.
Почему так важна защита металлических изделий от коррозии

Коррозия оказывает негативное электрохимическое, химическое воздействие на целостность поверхности предметов из стали, чугуна. В результате происходит разъедание металлических изделий, они портятся и не могут использоваться по назначению.
По статистике экспертов, каждый год примерно 10 % от объема всех добываемых на планете металлов приходится расходовать на устранение потерь, вызванных коррозией. Ведь последняя приводит к полной утрате металлическими предметами своих эксплуатационных свойств.
Как только на изделиях из чугуна или стали появляются признаки коррозии, у них снижается герметичность, прочность. Параллельно падает их способность проводить тепло, пластичность, отражательный потенциал, иными словами, утрачивается целый ряд немаловажных свойств. Все это приводит к тому, что конструкции оказываются непригодны для использования по назначению. Вот почему так важно грамотно и своевременно применять существующие способы защиты металлических изделий от коррозии, о которых далее пойдет речь.
Основные виды коррозии

Прежде чем приступать к защите металлических изделий от коррозии, важно понять природу этого процесса. Принято выделять такие типы коррозии:
- Атмосферная. Причиной окисления становится контакт металлического предмета с кислородом и содержащимися в воздухе водяными парами. Ржавчина образуется быстрее, когда в воздухе присутствуют загрязнения в виде химически активных веществ.
- Жидкостная. Формируется на металлических предметах, находящихся в водной среде. Если речь идет о морской воде, то в ней окисление значительно ускоряется за счет содержащегося в жидкости большого объема солей.
- Почвенная. Данному типу подвержены металлические изделия, конструкции, находящиеся в грунте. Химические реакции запускаются и протекают под действием химических элементов, входящих в состав грунта, грунтовых вод, разного рода утечек.
Коррозия на металлических изделиях может проявляться по-разному:
- формируется сплошной ржавый слой или его отдельные фрагменты;
- появляются небольшие участки ржавчины, проникающей внутрь детали;
- образуются глубокие трещины;
- окисляется один из компонентов сплава;
- происходит глубинное проникновение по всему объему;
- сочетаются сразу несколько симптомов.
Причины возникновения могут иметь природу двух видов:
- Химическую, то есть металл разрушается в результате химических реакций с активными веществами.
- Электрохимическую, связанную с тем, что при контакте с электролитическими растворами возникает электрический ток, под его действием замещаются электроны металлов. Это приводит к тому, что страдает кристаллическая структура, образуется ржавчина.
Способы защиты металлических изделий от коррозии
Можно выделить несколько основных способов защиты металлических изделий от коррозии:
- легирование металлов;
- защитные покрытия (металлические, неметаллические);
- электрохимическая защита;
- изменение свойств коррозионной среды;
- рациональное конструирование изделий.

1. Легирование металлов.
Это один из действительно эффективных способов, позволяющих увеличить стойкость металлов к ржавчине. В процессе легирования в состав сплава или металла вносят легирующие элементы, такие как хром, никель, молибден, пр. Они приводят к пассивации металла, то есть металл или сплав переходит в состояние повышенной коррозионной устойчивости за счет торможения анодного процесса. Пассивное состояние металла достигается благодаря тому, что на его поверхности формируется совершенная по структуре оксидная пленка. Она обеспечивает защиту изделия лишь при условии, что кристаллические решетки металла и образующегося оксида имеют между собой максимальное сходство.
Рекомендуем статьи по металлообработке
Легирование активно используется для защиты, например, закладных деталей от коррозии. Такую обработку проводят для железа, алюминия, меди, магния, цинка и сплавов на их основе. Получившиеся сплавы, по сравнению с исходными металлами, отличаются повышенной коррозионной стойкостью, а также жаростойкостью и жаропрочностью.
Жаростойкость – способность металла сохранять свои свойства даже при высоких температурах, когда повышается вероятность газовой коррозии.
VT-metall предлагает услуги:
Лазерная резка металла Гибка металла Порошковая покраска металла Сварочные работы
Жаропрочность – сохранение конструкционным материалом высокой механической прочности при значительном повышении температуры. Этого свойства обычно достигают легированием металлов и сплавов. Так, сталь легируется хромом, алюминием и кремнием. При высоких температурах они окисляются первыми, в результате чего формируются плотные защитные оксидные пленки, например Al2O3 и Cr2O3.
Кроме того, легирование позволяет снизить скорость электрохимической коррозии, особенно когда она сопровождается выделением водорода. Ярким примером коррозионностойких сплавов являются нержавеющие стали, где роль легирующих компонентов играют хром, никель и ряд прочих металлов.
2. Защитные покрытия.

В этом случае на поверхности металлического изделия искусственно формируются дополнительные слои для защиты. На самом деле, этот подход является наиболее распространенным среди существующих способов борьбы с коррозией. Мало того, что подобные покрытия оберегают предмет от появления ржавчины, они придают поверхностям ценные физико-химические характеристики. Речь идет об износостойкости, электрической проводимости и еще ряде свойств. Такие покрытия могут быть металлическими и неметаллическими. Однако, вне зависимости от состава, к ним предъявляются единые требования: хорошие адгезионные качества, сплошность и способность сохранять свои свойства в агрессивной среде.
Металлические покрытия выделяются на фоне других способов защиты металлических изделий от коррозии тем, что обладают неоднозначным действием. Пока защитный слой сохраняет свою целостность, он изолирует поверхность изделия от воздействия окружающей среды. То есть по своему действию близок к любой механической обработке, например, окраске, оксидной пленке, пр. В целом, металлические покрытия не должны пропускать коррозионные агенты.
Если такое покрытие повреждается либо в нем есть поры, образуется гальванический элемент. Нужно понимать, что характер коррозионного разрушения материала во многом зависит от электрохимических характеристик обоих металлов. Защитные антикоррозионные покрытия бывают катодными или анодными. В число первых входят покрытия, потенциалы которых в данной среде являются более положительными, чем у основного металла. Анодные покрытия обладают наиболее отрицательным потенциалом, чем потенциал материала изделия.
Если повреждается никелевое покрытие, на анодных участках железо окисляется за счет образования микрокоррозионных гальванических элементов. На катодных участках происходит восстановление водорода. Таким образом, катодные покрытия обеспечивают защиту металлических изделий от коррозии только при условии, что в покрытии нет пор и повреждений.
Если в цинковом слое появляется местное повреждение, защита продолжит разрушаться, но поверхность железа не пострадает от коррозии. На анодных участках происходит процесс окисления цинка, а на катодных участках – восстановление водорода.
Электродные потенциалы металлов зависят от компонентов и их доли в растворах, поэтому характер используемого для защиты покрытия может быть изменен за счет изменения состава.

Защита деталей от коррозии горячим методом осуществляется при помощи разных металлов и подходов. Сформировать металлические защитные покрытия позволяют несколько способов: электрохимический (гальванические покрытия); погружение в расплавленный металл (горячее цинкование, лужение); металлизация (нанесение расплавленного металла на защищаемую поверхность струей сжатого воздуха); химический (защита изделия посредством восстановителей, таких как гидразин).
Материалами для металлических защитных покрытий могут быть как чистые металлы (цинк, кадмий, алюминий, никель, медь, хром, серебро и др.), так и их сплавы (бронза, латунь и др.).
Неметаллические защитные покрытия делятся на неорганические и органические. Суть такой обработки состоит преимущественно в изоляции металла от окружающей среды.
Для защиты металлических изделий от коррозии неметаллическими покрытиями используют неорганические эмали, оксиды металлов, соединение хрома, фосфора, пр. В число органических входят лакокрасочные покрытия, смолы, пластмассы, полимерные пленки, резина.
По своему составу неорганические эмали являются силикатами, иначе говоря, это соединения кремния. Нужно понимать, что подобные покрытия хрупкие и растрескиваются из-за тепловых и механических ударов.
Лакокрасочные покрытия встречаются более часто. Главные условия для защиты металлических изделий от коррозии с помощью лакокрасочных покрытий: покрытие должно быть сплошным, газо- и водонепроницаемым, химически стойким, эластичным, обладать высоким сцеплением с материалом, механической прочностью, твердостью.
3. Химические способы.
Существует множество методов защиты металла, относящихся к этой группе. Одним из них является обработка поверхности веществами, вступающими с ней в химическую реакцию, в результате чего формируется пленка устойчивого химического соединения. Речь идет о таких способах как оксидирование, фосфатирование, сульфидирование, пр.
Оксидирование представляет собой способ защиты за счет образования оксидных пленок на поверхности металлических изделий.
Наиболее современным вариантом этого метода является химическая и электрохимическая обработка деталей в щелочных растворах.

Для железа и его сплавов наиболее часто используется щелочное оксидирование в растворе, содержащем NaOH, NaNO3, NaNO2 при температуре +135…+140 °С. Оксидирование черных металлов называется воронением.
Фосфатирование является методом формирования фосфатных пленок на изделиях из цветных и черных металлов. Для фосфатирования металлическое изделие погружают в растворы фосфорной кислоты и ее кислых солей (H3PO4 + Mn(H2PO4)2) при температуре +96…+98 °С.
Фосфатная пленка оказывается химически связана с материалом изделия и состоит из сросшихся между собой кристаллов, разделенных порами ультрамикроскопических размеров. Главными достоинствами фосфатных пленок являются хорошая адгезия и развитая шероховатая поверхность. Благодаря этому, такие пленки становятся отличной основой для лакокрасочных покрытий и пропитывающих смазок. Обычно данный подход выбирают для защиты деталей от коррозии, когда те будут использоваться в закрытых помещениях, либо если изделие подвергнется последующей окраске или покрытию лаком. Однако у таких пленок есть свои минусы, в первую очередь к ним относятся низкая прочность и эластичность, хрупкость.
Анодированием называется защита поверхности металла при помощи формирования оксидных пленок, обычно данный способ используется для защиты алюминия. На поверхности этого металла всегда есть тонкая оксидная пленка Al2O3 или Al2O3 ×∙(H2O)n. Однако она не способна противостоять появлению ржавчины, поэтому в результате воздействия окружающей среды на алюминии постепенно образуется слой продуктов коррозии.
Для искусственного формирования оксидных пленок используют химический и электрохимический способы. Во втором случае алюминиевое изделие используется в качестве анода электролизера. Тогда как роль электролита играет раствор серной, ортофосфорной, хромовой, борной или щавелевой кислот. Катодом может быть металл, не вступающий в реакцию с раствором электролита, допустим, нержавеющая сталь. На катоде выделяется водород, за счет чего на аноде формируется оксид алюминия.
От точного выполнения при защите деталей от коррозии требований ГОСТа зависят надежность, сроки эксплуатации изделий. Не менее важно правильно выбрать метод обработки, принимая во внимание условия эксплуатации изделий, а также их изначальные характеристики. В результате удастся обеспечить надежную защиту от ржавчины, а изделие сможет служить значительно дольше, при этом использоваться по своему прямому назначению.
Почему следует обращаться именно к нам
Мы с уважением относимся ко всем клиентам и одинаково скрупулезно выполняем задания любого объема.
Наши производственные мощности позволяют обрабатывать различные материалы:
- цветные металлы;
- чугун;
- нержавеющую сталь.
При выполнении заказа наши специалисты применяют все известные способы механической обработки металла. Современное оборудование последнего поколения дает возможность добиваться максимального соответствия изначальным чертежам.
Для того чтобы приблизить заготовку к предъявленному заказчиком эскизу, наши специалисты используют универсальное оборудование, предназначенное для ювелирной заточки инструмента для особо сложных операций. В наших производственных цехах металл становится пластичным материалом, из которого можно выполнить любую заготовку.
Преимуществом обращения к нашим специалистам является соблюдение ими ГОСТа и всех технологических нормативов. На каждом этапе работы ведется жесткий контроль качества, поэтому мы гарантируем клиентам добросовестно выполненный продукт.
Благодаря опыту наших мастеров на выходе получается образцовое изделие, отвечающее самым взыскательным требованиям. При этом мы отталкиваемся от мощной материальной базы и ориентируемся на инновационные технологические наработки.
Мы работаем с заказчиками со всех регионов России. Если вы хотите сделать заказ на металлообработку, наши менеджеры готовы выслушать все условия. В случае необходимости клиенту предоставляется бесплатная профильная консультация.
Изоляция металла от окружающей среды
8.3 ЗАЩИТА МЕТАЛЛОВ ОТ КОРРОЗИИ
Применение различных методов защиты металлов от коррозии позволяет в какой-то степени свести к минимуму потери металла от коррозии. В зависимости от причин, вызывающих коррозию, различают следующие методы защиты.
1) Обработка внешней среды, в которой протекает коррозия. Сущность метода заключается либо в удалении из окружающей среды тех веществ, которые выполняют роль деполяризатора, либо в изоляции металла от деполяризатора. Например, для удаления из воды кислорода используют специальные вещества или кипячение. Удаление кислорода из коррозионной среды называется деаэрацией. Максимально замедлить процесс коррозии можно путем введения в окружающую среду специальных веществ – ингибиторов. Широкое распространение получили летучие и парофазные ингибиторы, которые защищают от атмосферной коррозии изделия из черных и цветных металлов при хранении, транспортировке и т.д. Механизм действия ингибиторов заключается в том, что их молекулы адсорбируются на поверхности металла, препятствуя протеканию электродных процессов.
2) Защитные покрытия. Для изоляции металла от окружающей среды на него наносят различного рода покрытия: лаки, краски, металлические покрытия. Наиболее распространенными являются лакокрасочные покрытия, однако их механические свойства значительно ниже, чем у металлических. Последние по характеру защитного действия можно разделить на анодные и катодные.
Анодные покрытия . Если на металл нанести покрытие из другого, более электроотрицательного металла, то в случае возникновения условий для электрохимической коррозии * разрушаться будет покрытие, т.к. оно будет выполнять роль анода. В этом случае покрытие называется анодным. Примером анодного покрытия может служить хром, нанесенный на железо. В случае нарушения целостности покрытия при контакте с влажным воздухом будет работать гальванический элемент *:
на аноде: Cr – 2e → Cr 2+
Cr 2+ + 2 OH – → Cr (OH)2
Гидроксид хрома (II) окисляется кислородом воздуха до Cr (OH)3:
Таким образом, в результате электрохимической коррозии разрушается анодное покрытие.
Катодные покрытия . У катодного покрытия стандартный электродный потенциал * более положителен , чем у защищаемого металла. Пока слой покрытия изолирует металл от окружающей среды, электрохимическая коррозия не протекает. При нарушении сплошности катодного покрытия оно перестает защищать металл от коррозии. Более того, оно даже интенсифицирует коррозию основного металла, т.к. в возникающей гальванопаре анодом служит основной металл, который будет разрушаться. В качестве примера можно привести оловянное покрытие на железе (луженое железо). Рассмотрим работу гальванического элемента, возникающего в этом случае.
на аноде: Fe – 2e → Fe 2+
Fe 2+ + 2 OH – → Fe (OH)2
Разрушается защищаемый металл. Таким образом, при сравнении свойств анодных и катодных покрытий можно сделать вывод, что наиболее эффективными являются анодные покрытия. Они защищают основной металл даже в случае нарушения целостности покрытия, тогда как катодные покрытия защищают металл лишь механически.
3) Электрохимическая защита. Различают два вида электрохимической защиты: катодная и протекторная. В обоих случаях создаются условия для возникновения на защищаемом металле высокого электроотрицательного потенциала.
Протекторная защита . Защищаемое от коррозии изделие соединяют с металлическим ломом из более электроотрицательного металла (протектора). Это равносильно созданию гальванического элемента, в котором протектор является анодом и будет разрушаться. Например, для защиты подземных сооружений (трубопроводов) на некотором расстоянии от них закапывают металлолом (протектор), присоединив его к сооружению (рисунок 8.3).
Рисунок 8.3 – Схема протекторной защиты. А – трубопровод;
Б – протектор; В – проводник
Катодная защита отличается от протекторной тем, что защищаемая конструкция, находящаяся в электролите * (почвенная вода), присоединяется к катоду внешнего источника тока. В ту же среду помещают кусок металлолома, который соединяют с анодом внешнего источника тока (рисунок 8.4).
Рисунок 8.4 – Схема катодной защиты. А – конструкция; Б – протектор
Металлический лом подвергается разрушению, предохраняя тем самым от разрушения защищаемую конструкцию.
Во многих случаях металл предохраняет от коррозии образующаяся на его поверхности стойкая оксидная пленка (так, на поверхности алюминия образуется Al2O3, препятствующий дальнейшему окислению металла). Однако некоторые ионы, например Cl – , разрушают такие пленки и тем самым усиливают коррозию.
Читайте также:
