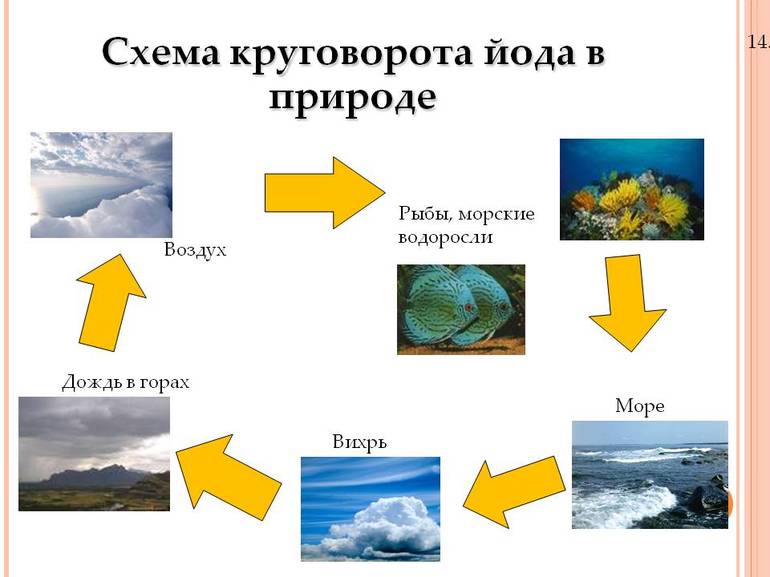
Йод металлический и кристаллический
Обновлено: 02.05.2024
Блестящий тёмно-серый неметалл. В газовом состоянии — фиолетовый.
Ио́д / Iodum (I), 53
[Kr] 4d 10 5s 2 5p 5
2,66 (шкала Полинга)
15,52 (I—I) кДж/моль
41,95 (I—I) кДж/моль
Ио́д [3] (тривиальное (общеупотребительное) название — йод [4] ; от др.-греч. ἰώδης — «фиалковый (фиолетовый)») — элемент 17-й группы периодической таблицы химических элементов (по устаревшей классификации — элемент главной подгруппы VII группы), пятого периода, с атомным номером 53. Обозначается символом I (лат. Iodum ). Химически активный неметалл, относится к группе галогенов.
Простое вещество иод (CAS-номер: 7553-56-2) при нормальных условиях — кристаллы чёрно-серого цвета с фиолетовым металлическим блеском, легко образует фиолетовые пары, обладающие резким запахом. Молекула вещества двухатомна (формула I2).
Содержание
Название и обозначение
Название элемента предложено Гей-Люссаком и происходит от др.-греч. ἰώδης , ιώο-ειδης (букв. «фиалкоподобный»), что связано с цветом пара, который наблюдал французский химик Бернар Куртуа, нагревая маточный рассол золы морских водорослей с концентрированной серной кислотой. В медицине и биологии данный элемент и простое вещество обычно называют йодом, например «раствор йода», в соответствии со старым вариантом названия, существовавшим в химической номенклатуре до середины XX века.
В современной химической номенклатуре используется наименование иод. Такое же положение существует в некоторых других языках, например в немецком: общеупотребительное Jod и терминологически корректное Iod. Одновременно с изменением названия элемента в 1950-х годах Международным союзом общей и прикладной химии символ элемента J был заменен на I.
История
Иод был открыт в 1811 г. Куртуа в золе морских водорослей, а с 1815 г. Гей-Люссак стал рассматривать его как химический элемент [5] .
Нахождение в природе


Иод — элемент редкий. Его кларк всего 400 мг/т. Но у иода есть одна особенность — крайняя рассеянность в природе. Будучи далеко не самым распространенным элементом, иод присутствует практически везде. Находится в виде иодидов в морской воде (20 — 30 мг на тонну морской воды). Присутствует в живых организмах, больше всего в водорослях (5 кг на тонну высушенной морской капусты (ламинарии)). Известен в природе также в свободной форме, в качестве минерала, но такие находки единичны, — в термальных источниках Везувия и на о. Вулькано (Италия). Запасы природных иодидов оцениваются в 15 млн тонн, 99 % запасов находятся в Чили и Японии. В настоящее время в этих странах ведётся интенсивная добыча иода, например, чилийская Atacama Minerals производит свыше 720 тонн иода в год. Наиболее известный из минералов иода — лаутарит Ca(IO3)2. Некоторые другие минералы иода — иодобромит Ag(Br, Cl, I), эмболит Ag(Cl, Br), майерсит CuI·4AgI.
Сырьём для промышленного получения иода в России служат нефтяные буровые воды, тогда как в зарубежных странах, не обладающих нефтяными месторождениями, используются морские водоросли, а также маточные растворы чилийской (натриевой) селитры, щёлок калийных и селитряных производств, что намного удорожает производство иода из такого сырья [6] .
Физические свойства
Иод при обычных условиях — твердое чёрно-серое вещество с металлическим блеском и специфическим запахом. Пары имеют характерный фиолетовый цвет, так же, как и растворы в неполярных органических растворителях, например в бензоле — в отличие от бурого раствора в полярном спирте. Иод при комнатной температуре представляет собой темно-фиолетовые кристаллы со слабым блеском. При нагревании при атмосферном давлении он сублимируется (возгоняется), превращаясь в пары фиолетового цвета; при охлаждении пары иода кристаллизуются, минуя жидкое состояние. Этим пользуются на практике для очистки иода от нелетучих примесей.
Химические свойства
Иод относится к группе галогенов.
Электронная формула (Электронная конфигурация) иода: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 5p 5 .
Изотопы
Известны 37 изотопов иода с массовыми числами от 108 до 144. Из них только период полураспада остальных изотопов иода составляет от 103 мкс до 1,57·10 7 лет [7] ; отдельные изотопы используются в терапевтических и диагностических целях.
Радиоактивный нуклид 131 I распадается с испусканием β-частиц (наиболее вероятные максимальные энергии — 0,248, 0,334 и 0,606 МэВ), а также с излучением γ-квантов с энергиями от 0,08 до 0,723 МэВ [8] .
| Массовое число | Содержание в природной смеси, % | Характер излучения | Период полураспада |
|---|---|---|---|
| 118 | — | ~10 мин | |
| 119 | — | β + | 18 мин |
| 120 | — | Э.з. | 1,1 час |
| 121 | — | β + ; γ | 1,5 час |
| 122 | — | β + | 3,5 мин |
| 123 | — | Э.з.; γ | 13 час |
| 124 | — | Э.з.; β + ; γ | 4,5 дня |
| 125 | — | Э.з.; γ | 60 дней |
| 126 | — | Э.з.; β + ; β - ; γ | 13 дней |
| 127 | 100 | ||
| 128 | — | Э.з.; β - ; γ | 25 мин |
| 129 | — | β - ; γ | 1,72·10 7 лет |
| 130 | — | β - ; γ | 12,5 час |
| 131 | — | β - ; γ | 8,05 дня |
| 132 | — | β - ; γ | 2,26 час |
| 133 | — | β - ; γ | 20,8 час |
| 134 | — | β - ; γ | 53 мин |
| 135 | — | β - ; γ | 6,7 час |
| 136 | — | β - ; γ | 1,5 мин |
| 137 | — | β - ; n | 19,3 сек |
| 138 | — | β - | 5,9 сек |
| 139 | — | β - | 2,7 сек |
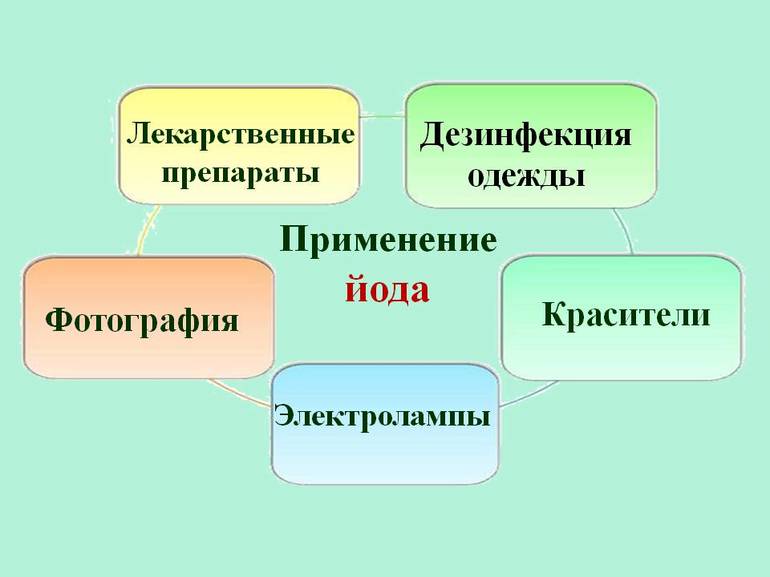
Применение
В медицине

5-процентный спиртовой раствор иода используется для дезинфекции кожи вокруг повреждения (рваной, резаной или иной раны), но не для приёма внутрь при дефиците иода в организме. Продукты присоединения иода к крахмалу, другим ВМС (т. н. «Синий йод» — Йодинол, Йокс, Бетадин и др.) являются более мягкими антисептиками.
Широко рекламируется в альтернативной (неофициальной) медицине, однако его использование без назначения врача в основном мало обосновано и нередко сопровождается различными рекламными заявлениями.
В качестве антисептика применяется всё реже и реже, наряду со спиртовым раствором иода используется Зелёнка, Фукорцин, Пиоктанин, растворы перекиси водорода и др.
В криминалистике
В криминалистике пары йода применяются для обнаружения отпечатков пальцев на бумажных поверхностях, например на купюрах.
В технике
Источники света
Производство аккумуляторов
Иод используется в качестве компонента положительного электрода (окислителя) в литиево-иодных аккумуляторах для электромобилей.
Лазерный термоядерный синтез
Некоторые иодорганические соединения применяются для производства сверхмощных газовых лазеров на возбужденных атомах иода (исследования в области лазерного термоядерного синтеза и промышленность).
Радиоэлектронная промышленность
В последние годы резко повысился спрос на иод со стороны производителей жидкокристаллических дисплеев.
Динамика потребления иода
Мировое потребление иода в 2005 составило 25,5 тыс. тонн.
Биологическая роль
Иод относится к микроэлементам и присутствует во всех живых организмах. Его содержание в растениях зависит от присутствия его соединений в почве и водах. Некоторые морские водоросли (морская капуста, или ламинария, фукус и другие) накапливают до 1 % иода. Иод входит в скелетный белок губок и скелетопротеинов морских многощетинковых червей.
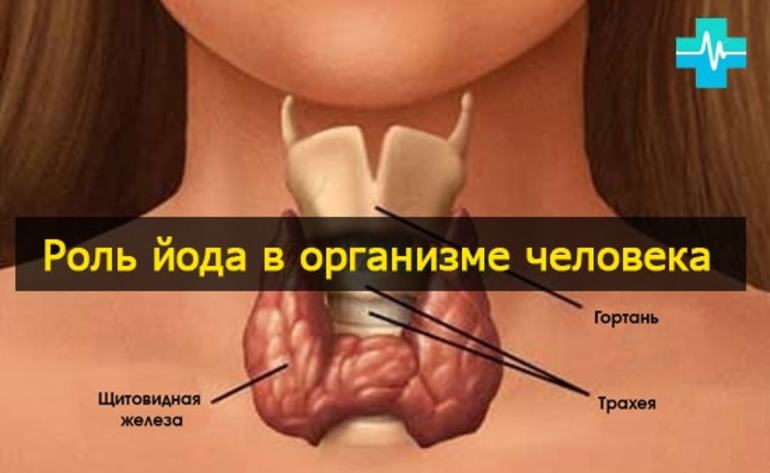
Иод и щитовидная железа
У животных и человека иод входит в состав так называемых тиреоидных гормонов, вырабатываемых щитовидной железой — тироксина и трииодтиронина, оказывающих многостороннее воздействие на рост, развитие и обмен веществ организма.
В организме человека (масса тела 70 кг) содержится 12-20 мг иода. Суточная потребность человека в иоде определяется возрастом, физиологическим состоянием и массой тела. Для человека среднего возраста нормальной комплекции (нормостеник) суточная доза иода составляет 0,15 мг. [10]
Отсутствие или недостаток иода в рационе (что типично для некоторых местностей) приводит к заболеваниям (эндемический зоб, кретинизм, гипотиреоз). В связи с этим к поваренной соли, поступающей в продажу в местностях с естественным геохимическим дефицитом иода, с профилактической целью добавляют иодид калия, иодид натрия или иодат калия (иодированная соль).
Недостаток иода приводит к заболеваниям щитовидной железы (например, к базедовой болезни, кретинизму). Также при небольшом недостатке иода отмечается усталость, головная боль, подавленное настроение, природная лень, нервозность и раздражительность; слабеет память и интеллект. Со временем появляется аритмия, повышается артериальное давление, падает уровень гемоглобина в крови.
Токсичность
Иод очень ядовит. Смертельная доза 3 г. Вызывает поражение почек и сердечно-сосудистой системы. При вдыхании паров иода появляется головная боль, кашель, насморк, может быть отёк лёгких. При попадании на слизистую оболочку глаз появляется слезотечение, боль в глазах и покраснение. При попадании внутрь появляется общая слабость, головная боль, повышение температуры, рвота, понос, бурый налёт на языке, боли в сердце и учащение пульса. Через день появляется кровь в моче. Через 2 дня появляются почечная недостаточность и миокардит. Без лечения наступает летальный исход [11] .
ПДК иода в воде 0,125 мг/дм³, в воздухе 1 мг/м³.
См. также
Примечания
Ссылки
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Иод" в других словарях:
ИОД — ИОД, Jodum (от греческого ioeides имеющий фиалковый цвет), твердый галоген с химическим обозначением J; атомный вес иода 126,932; иод занимает в периодической системе элементов по порядку 53 место, в 7 ряду VII группы. Кристаллизуется в виде… … Большая медицинская энциклопедия
ИОД — (греч. iodes фиолетовый). Простое тело, в виде сероватых блестящих пластинок, добывается из золы морских водорослей. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. ИОД простое (неразлагающееся химически на части)… … Словарь иностранных слов русского языка
ИОД — (Iodum), I, химический элемент VII группы периодической системы, атомный номер 53, атомная масса 126,9045; относится к галогенам; фиолетовые кристаллы, легко летуч, tпл 113,5шC. Используют для получения иодсодержащих соединений, как катализатор,… … Современная энциклопедия
ИОД — (йод) (лат. Iodum) I, химический элемент VII группы периодической системы, атомный номер 53, атомная масса 126,9045, относится к галогенам. Черно серые кристаллы с металлическим блеском; плотность 4,94 г/см³, tпл 113,5 .С, tкип 184,35 .С. Уже … Большой Энциклопедический словарь
ИОД — [ёд], иода, муж. (от греч. ioeides фиолетовый). Химический элемент из группы металлоидов, вещество, имеющее кристалы темносерого цвета с металлическим блеском и добываемое из золы некоторых морских водорослей (хим.). При соединении с крахмалом… … Толковый словарь Ушакова
иод — йод Словарь русских синонимов. иод сущ., кол во синонимов: 4 • галоген (7) • йод (2) … Словарь синонимов
Иод — (Iodum), I, химический элемент VII группы периодической системы, атомный номер 53, атомная масса 126,9045; относится к галогенам; фиолетовые кристаллы, легко летуч, tпл 113,5°C. Используют для получения иодсодержащих соединений, как катализатор,… … Иллюстрированный энциклопедический словарь
Иод — I (от греч. iodes фиолетовый, по цвету паров * a. iodine; н. Jod; ф. iode; и. yodo), хим. элемент VII группы периодич. системы элементов Менделеева, относится к галогенам, ат. н. 53, ат. м. 126,904. В природе известен один стабильный… … Геологическая энциклопедия
ИОД — (Iodum; ФХ, список Б), химический элемент VII группы периодической системы Д. И. Менделеева, атомная масса 126, 9044, серовато чёрные с металлическим блеском пластинки или сростки кристаллов с характерным запахом. Очень мало растворим в воде,… … Ветеринарный энциклопедический словарь
иод — см. Йод. * * * иод йод (лат. Iodum), химический элемент VII группы периодической системы, относится к галогенам. Чёрно серые кристаллы с металлическим блеском; плотность 4,94 г/см3, tпл 113,5ºC, tкип 184,35ºC. Уже при обычной температуре… … Энциклопедический словарь
Йод кристаллический – важный, но опасный химический реактив
Невозможно представить современную лабораторию или лабораторию прошлых веков без всевозможной лабораторной посуды , лабораторного оборудования и приборов , химреактивов, резинотехнических изделий . Среди этого перечня самыми главными, пожалуй, являются химические реактивы : без них невозможен ни один анализ, исследование, опыт. Всевозможная посуда из кварцевого, боросиликатного, лабораторного стекла , пластика, фарфора и других материалов, а также оборудование и приборы – это те вспомогательные элементы, которые позволяют произвести какую-либо операцию с химическим веществом или их смесью.
Среди огромного перечня химических реактивов, используемых в лабораторных условиях, особое место занимает йод кристаллический. На вид твердое кристаллическое вещество черно-серого цвета с фиолетовым металлическим блеском и специфическим резким запахом. Довольно часто в химической номенклатуре его просто называют йод. При комнатной температуре – темно-фиолетовые кристаллы со слабым отливом. При нагревании вещество образует фиолетовые пары, при охлаждении – кристаллы, минуя жидкообразное состояние. Вещество хорошо растворимо в эфире, спирте, водных растворах йодидов натрия и калия, плохо – в воде.
Данный химический реактив обладает уникальным свойством – рассеянностью в природе. Он находится практически везде: в морской воде, живых организмах, водорослях (морская капуста). В свободном состоянии встречается в виде редкого минерала в Италии на острове Вулкано. В промышленных условиях йод добывают в нефтяных буровых водах, получают из морских водорослей, натриевой селитры, и др.
Одними из главных отраслей применения йода были и остаются медицина и фармацевтика. В медицинской практике в виде 5 % спиртового раствора используется в качестве дезинфицирующего и противомикробного средства для обработки рваных, резаных ран. Несмотря на то, что йод очень важен для нормальной жизнедеятельности организма, его запрещено принимать во внутрь. Для восполнения йода в организме рекомендуется употреблять йодсодержащие продукты: морепродукты (мидии, кальмары, морская капуста, рыба), яйца, говядину, молоко, зерновые культуры, овощи и фрукты. В большом количестве йод содержится в грецких орехах, особенно в молодых (молочных). В фармакологии данное вещество входит в состав многих лекарственных и ветеринарных препаратов: антисептические мази, пластыри.
В техническом производстве данный химический элемент используется при изготовлении литиево-йодных аккумуляторов, йодных ламп, в радиоэлектронной – при производстве жидкокристаллических мониторов.
В криминалистике пары вещества применяются для обнаружения дактилоскопии на бумажных поверхностях.
Важность йода для организма
У человека и животных йод входит в состав гормонов (тироксина и триидтиронина), которые вырабатываются щитовидной железой. Эти гормоны отвечают за рост, обмен веществ и развитие организма. Суточная доза йода для человека зависит от возраста, массы тела и физиологического состояния, для среднего человека – это примерно 0,15 мг. Недостаток данного химреактива может стать причиной многих сердечно-сосудистых, почечных, щитовидных заболеваний, таких как кретинизм, эндимический зоб, гипотериоз и другие.
Несмотря на важность йода, не стоит забывать, что он ядовит. Смертельная доза составляет 3 г. При вдыхании его паров может быть головная боль, кашель, отек легких, насморк; при попадании на слизистые – покраснение, слезотечение; при употреблении вовнутрь – высокая температура, слабость, рвота, сердечная боль. Не своевременное лечение симптомов, вызванных прямым контактом с йодом, может вызвать осложнения даже с летальным исходом.
Во избежание негативных последствий, вызванных химическим элементом, при работе с ним нужно соблюдать меры предосторожности. Чтобы не допустить прямого контакта, работы проводить в защитной маске, фартуке, перчатках нитриловых или перчатках смотровых .
Где купить качественные химреактивы по приемлемой цене?
Пропиленгликоль купить , кальций хлористый , хлорное железо купить в Москве предлагает специализированный магазин химических реактивов Москва розница и опт «Прайм Кемикалс Групп». На нашем сайте Вы найдете все, чтобы оснастить свою лабораторию сертифицированной продукцией по доступной цене. Возможна доставка как по Москве, так и по всему Московскому региону.
“Prime Chemicals Croup” – один из заслуженных лидеров на российском рынке.
Йод

Йод (тривиальное (общеупотребительное) название — йод; от греч. ἰώδης — «фиалковый (фиолетовый)») — химический элемент с атомным номером 53. Принадлежит к 17-й группе периодической таблицы химических элементов (по устаревшей короткой форме периодической системы принадлежит к главной подгруппе VII группы, или к группе VIIA), находится в пятом периоде таблицы. Атомная масса элемента 126,90447 а. е. м. . Обозначается символом I (от лат. Iodum ). Химически активный неметалл, относится к группе галогенов.
Простое вещество йод при нормальных условиях — кристаллы чёрно-серого цвета с фиолетовым металлическим блеском, легко образует фиолетовые пары, обладающие резким запахом. Элементарный йод высокотоксичен. Молекула простого вещества двухатомна (формула I2).

Блестящий тёмно-серый неметалл. В газообразном состоянии — фиолетовый.

- 1 Название и обозначение
- 2 История
- 3 Нахождение в природе
- 4 Физические свойства
- 4.1 Изотопы
- 6.1 В медицине
- 6.2 В криминалистике
- 6.3 В технике: рафинирование металлов
- 6.3.1 Источники света
- 6.3.2 Производство аккумуляторов
- 6.3.3 Лазерный термоядерный синтез
- 6.3.4 Радиоэлектронная промышленность
- 7.1 Й од и щитовидная железа
- 7.2 Токсичность
![йод]()
Название элемента предложено Гей-Люссаком и происходит от др.-греч. ἰο-ειδής (букв. «фиалкоподобный»), что связано с цветом пара, который наблюдал французский химик Бернар Куртуа, нагревая маточный рассол золы морских водорослей с концентрированной серной кислотой. В медицине и биологии данный элемент и простое вещество обычно называют йодом, например, «раствор йода», в соответствии со старым вариантом названия, существовавшим в химической номенклатуре до середины XX века.
В современной химической номенклатуре используется наименование йод. Такое же положение существует в некоторых других языках, например, в немецком: общеупотребительное Jod и терминологически корректное Iod. Одновременно с изменением названия элемента в 1950-х годах Международным союзом общей и прикладной химии символ элемента J был заменен на I.
Йод был открыт в 1811 г. Куртуа в золе морских водорослей, а с 1815 г. Гей-Люссак стал рассматривать его как химический элемент.
![йод кристаллический]()
Йод — редкий элемент. Его кларк — всего 400 мг/т . Однако он чрезвычайно сильно рассеян в природе и, будучи далеко не самым распространенным элементом, присутствует практически везде. Йод находится в виде йодидов в морской воде ( 20—30 мг на тонну морской воды). Присутствует в живых организмах, больше всего в водорослях ( 2,5 г на тонну высушенной морской капусты, ламинарии). Известен в природе также в свободной форме, в качестве минерала, но такие находки единичны, — в термальных источниках Везувия и на острове Вулькано (Италия). Запасы природных йодидов оцениваются в 15 млн тонн , 99 % запасов находятся в Чили и Японии. В настоящее время в этих странах ведётся интенсивная добыча йода, например, чилийская Atacama Minerals производит свыше 720 тонн йода в год. Наиболее известный из минералов йода — лаутарит Ca(IO3)2. Некоторые другие минералы йода — йодобромит Ag(Br, Cl, I), эмболит Ag(Cl, Br), майерсит CuI·4AgI.
Сырьём для промышленного получения йода в России служат нефтяные буровые воды, тогда как в зарубежных странах, не обладающих нефтяными месторождениями, используются морские водоросли, а также маточные растворы чилийской (натриевой) селитры, щёлок калийных и селитряных производств, что намного удорожает производство йода из такого сырья.
![йод кристаллический]()
Йод при обычных условиях — твёрдое вещество, чёрно-серые или тёмно-фиолетовые кристаллы со слабым металлическим блеском и специфическим запахом.
Пары имеют характерный фиолетовый цвет, так же, как и растворы в неполярных органических растворителях, например, в бензоле — в отличие от бурого раствора в полярном этиловом спирте. Слабо растворяется в воде ( 0,28 г/л ), лучше растворяется в водных растворах йодидов щелочных металлов с образованием трийодидов (например трийодида калия KI3).
При нагревании при атмосферном давлении йод сублимирует (возгоняется), превращаясь в пары фиолетового цвета; при охлаждении при атмосферном давлении пары йода кристаллизуются, минуя жидкое состояние. Этим пользуются на практике для очистки йода от нелетучих примесей.
Жидкий йод можно получить, нагревая его под давлением.
![йод кристаллы]()
Изотопы
Известны 37 изотопов йода с массовыми числами от 108 до 144. Из них только 127 I является стабильным, период полураспада остальных изотопов йода составляет от 103 мкс до 1,57⋅10 7 лет; отдельные изотопы используются в терапевтических и диагностических целях.
Радиоактивный нуклид 131 I распадается с испусканием β-частиц (наиболее вероятные максимальные энергии — 0,248, 0,334 и 0,606 МэВ ), а также с излучением γ-квантов с энергиями от 0,08 до 0,723 МэВ .
![йод цилиндр]()
Йод относится к группе галогенов.
Электронная формула (Электронная конфигурация) йода: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 5p 5 .
Образует ряд кислот: йодоводородную (HI), йодноватистую (HIO), йодистую (HIO2), йодноватую (HIO3), йодную (HIO4).
Химически йод довольно активен, хотя и в меньшей степени, чем хлор и бром.
- Довольно известной качественной реакцией на йод является его взаимодействие с крахмалом, при котором наблюдается синее окрашивание в результате образования соединения включения. Эту реакцию открыли в 1814 году Жан-Жак Колен (Jean-Jacques Colin) и Анри-Франсуа Готье де Клобри (Henri-François Gaultier de Claubry).
- С металлами йод при легком нагревании энергично взаимодействует, образуя йодиды:
- С водородом йод реагирует только при нагревании и не полностью, образуя йодоводород:
- Йод является окислителем, менее сильным, чем фтор, хлор и бром. Сероводород H2S, Na2S2O3 и другие восстановители восстанавливают его до иона I − :
Последняя реакция также используется в аналитической химии для определения йода.
- При растворении в воде йод частично реагирует с ней (По "Началам Химии" Кузьменко: реакция не идёт даже при нагревании, текст нуждается в проверке)
- Реакция образования нитрида трийода:
Нитрид трийода в сухом кристаллическом состоянии разлагается с выделением фиолетовых паров йода, что демонстрируется как эффектная химическая реакция.
- Йодиды щелочных металлов очень склонны в растворах присоединять (растворять) молекулы галогенов с образованием полийодидов (перйодидов) — трийодид калия, дихлоройодат I калия:
![раствор йода]()
5-процентный спиртовой раствор йода используется для дезинфекции кожи вокруг повреждения (рваной, резаной или иной раны), но не для приёма внутрь при дефиците йода в организме. Продукты присоединения йода к крахмалу, другим ВМС (т. н. «Синий йод» — Йодинол, Йокс, Бетадин и др.) являются более мягкими антисептиками.
При большом количестве внутримышечных инъекций, на их месте пациенту делается йодная сетка, — йодом рисуется сетка на площади, в которую делаются инъекции (напр., на ягодицах). Это нужно для того, чтобы быстро рассасывались «шишки», образовавшиеся в местах внутримышечных инъекций.
Широко рекламируется в альтернативной (неофициальной) медицине, однако его использование без назначения врача в целом мало обосновано и нередко сопровождается различными рекламными заявлениями.
В качестве антисептика применяется всё реже и реже, наряду со спиртовым раствором йода используется зелёнка, фукорцин, пиоктанин, растворы перекиси водорода и др.
В рентгенологических и томографических исследованиях широко применяются йодсодержащие контрастные препараты.
Йод-131, как и некоторые радиоактивные изотопы йода ( 125 I, 132 I) применяются в медицине для диагностики и лечения заболеваний щитовидной железы. Изотоп широко применяется при лечении диффузно-токсического зоба (болезни Грейвса), некоторых опухолей. Согласно нормам радиационной безопасности НРБ-99/2009, принятым в России, выписка из клиники пациента, лечившегося с использованием йода-131, разрешается при снижении общей активности этого нуклида в теле пациента до уровня 0,4 ГБк .
В криминалистике пары йода применяются для обнаружения отпечатков пальцев на бумажных поверхностях, например, на купюрах.
В технике: рафинирование металлов
Йод используется в источниках света:
- галогеновых лампах — в качестве компонента газового наполнителя колбы для осаждения испарившегося вольфрама нити накаливания обратно на неё.
- металлогалогеновых дуговых лампах — в качестве газовой среды разряда используются галогениды ряда металлов, использование различных смесей которых позволяет получать лампы с большим разнообразием спектральных характеристик.
Йод используется в качестве компонента положительного электрода (окислителя) в литиево-ионных аккумуляторах для автомобилей.
Некоторые йодорганические соединения применяются для производства сверхмощных газовых лазеров на возбужденных атомах йода (исследования в области лазерного термоядерного синтеза).
Радиоэлектронная промышленность ]
В последние годы резко повысился спрос на йод со стороны производителей жидкокристаллических дисплеев.
Динамика потребления йода
Мировое потребление йода в 2005 году составило 25,8 тыс. тонн
![йод кристаллы]()
Йод относится к микроэлементам и присутствует во всех живых организмах. Его содержание в растениях зависит от присутствия его соединений в почве и водах. Некоторые морские водоросли (морская капуста, ламинария, фукус и другие) накапливают до 1 % йода. Богаты йодом водные растения семейства рясковых. Йод входит в скелетный белок губок и скелетопротеинов морских многощетинковых червей.
Йод и щитовидная железа
У животных и человека йод входит в состав так называемых тиреоидных гормонов, вырабатываемых щитовидной железой — тироксина и трийодтиронина, оказывающих многостороннее воздействие на рост, развитие и обмен веществ организма.
В организме человека (масса тела 70 кг ) содержится 12—20 мг йода. Суточная потребность человека в йоде определяется возрастом, физиологическим состоянием и массой тела. Для человека среднего возраста нормальной комплекции (нормостеник) суточная доза йода составляет 0,15 мг .
Отсутствие или недостаток йода в рационе (что типично для некоторых местностей) приводит к заболеваниям (эндемический зоб, кретинизм, гипотиреоз). В связи с этим к поваренной соли, поступающей в продажу в местностях с естественным геохимическим дефицитом йода, с профилактической целью добавляют йодид калия, йодид натрия или йодат калия (йодированная соль).
Недостаток йода приводит к заболеваниям щитовидной железы (например, к базедовой болезни, кретинизму). Также при небольшом недостатке йода отмечается усталость, головная боль, подавленное настроение, природная лень, нервозность и раздражительность; слабеет память и интеллект. Со временем появляется аритмия, повышается артериальное давление, падает уровень гемоглобина в крови.
Избыток йода в пище обычно легко переносится организмом, однако в отдельных случаях в людях с повышенной чувствительностью этот избыток может также привести к расстройствам щитовидной железы.
![кристаллы йода]()
Йод токсичен. Смертельная доза (LD50) — 3 г. Вызывает поражение почек и сердечно-сосудистой системы. При вдыхании паров йода появляется головная боль, кашель, насморк, может быть отёк лёгких. При попадании на слизистую оболочку глаз появляется слезотечение, боль в глазах и покраснение. При попадании внутрь появляется общая слабость, головная боль, повышение температуры, рвота, понос, бурый налёт на языке, боли в сердце и учащение пульса. Через день появляется кровь в моче. Через 2 дня появляются почечная недостаточность и миокардит. Без лечения наступает летальный исход.
ПДК йода в воде 0,125 мг/дм³, в воздухе 1 мг/м³.
Радиоактивный йод-131 (радиойод), являющийся бета- и гамма-излучателем, особенно опасен для организма человека, так как радиоактивные изотопы биохимически не отличаются от стабильных. Поэтому почти весь радиоактивный йод, как и обычный, концентрируется в щитовидной железе, что приводит к её облучению и дисфункции. Основным источником загрязнения атмосферы радиоактивным йодом являются атомные станции и фармакологическое производство. В то же время это свойство радиойода позволяет использовать его для борьбы с опухолями щитовидной железы и диагностики её заболеваний (см. выше).
Йод металлический и кристаллический
Иод, йод (от др.-греч. ιώδης, iodes — «фиолетовый») — элемент главной подгруппы седьмой группы, пятого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 53. Обозначается символом I (лат. Iodum). Химически активный неметалл, относится к группе галогенов. Простое вещество иод (CAS-номер: 7553-56-2) при нормальных условиях — кристаллы чёрно-серого цвета с фиолетовым металлическим блеском, легко образует фиолетовые пары, обладающие резким запахом. Молекула вещества двухатомна (формула I2).
В медицине и биологии данное вещество обычно называют йодом (например «раствор йода»), в таблице Менделеева и химической литературе употребляется название иод.
Иод был открыт в 1811 г. Куртуа в золе морских водорослей, а с 1815 г. Гей-Люссак стал рассматривать его как химический элемент.
Символ элемента J был заменен на I относительно недавно, в 50-х годах XX века.
В большом количестве находится в виде иодидов в морской воде. Известен в природе также в свободной форме, в качестве минерала, но такие находки единичны, — в термальных источниках Везувия и на о. Вулькано (Италия). Запасы природных иодидов оцениваются в 15 млн тонн, 99% запасов находятся в Чили и Японии. В настоящее время в этих странах ведётся интенсивная добыча иода, например, чилийская Atacama Minerals производит свыше 720 тонн иода в год.
Сырьём для промышленного получения йода в России служат нефтяные буровые воды, тогда как в зарубежных странах, не обладающих нефтяными месторождениями, используются морские водоросли, а также маточные растворы чилийской (натриевой) селитры, что намного удорожает производство йода из такого сырья.
Физические свойства
Пары имеют характерный фиолетовый цвет, так же, как и растворы в неполярных органических растворителях, например в бензоле — в отличие от бурого раствора в полярном спирте. Иод при комнатной температуре представляет собой темно-фиолетовые кристаллы со слабым блеском. При нагревании при атмосферном давлении он сублимируется (возгоняется), превращаясь в пары фиолетового цвета; при охлаждении пары иода кристаллизуются, минуя жидкое состояние. Этим пользуются на практике для очистки иода от нелетучих примесей.
Химические свойства
Химически иод довольно активен, хотя и в меньшей степени, чем хлор и бром.
- С металлами иод при легком нагревании энергично взаимодействует, образуя иодиды:
- С водородом иод реагирует только при нагревании и не полностью, образуя йодистый водород:
- Элементный иод — окислитель, менее сильный, чем хлор и бром. Сероводород H2S , Na2S2O3 и другие восстановители восстанавливают его до иона I - :
- При растворении в воде иод частично реагирует с ней:
Медицина
5%-ный спиртовой раствор йода используется для дезинфекции кожи вокруг повреждения (рваной, резаной или иной раны), но не для приёма внутрь при дефиците йода в организме. Продукты присоединения йода к крахмалу, другим ВМС («Синий йод» — Йодинол, Йокс, Бетадин) являются более мягкими антисептиками.
Широко используется в альтернативной (неофициальной) медицине, однако его использование без назначения врача в основном мало обосновано, и нередко сопровождается различными рекламными заявлениями.
См. также
Производство аккумуляторов
Иод используется в качестве положительного электрода (окислителя) в литиево-иодных аккумуляторах для электромобилей.
Лазерный термоядерный синтез
Радиоэлектронная промышленность
Важность для человека
Недостаток йода приводит к заболеваниям щитовидной железы (например, к базедовой болезни, кретинизму) Так же при небольшом недостатке йода отмечается усталость, головная боль, подавленное настроение, природная лень, слабеет память и интеллект, нервозность и раздражительность. Со временем появляется аритмия, повышается артериальное давление, падает уровень гемоглобина в крови.
Иод относится к микроэлементам и присутствует во всех живых организмах. Его содержание в растениях зависит от присутствия его соединений в почве и водах. Некоторые морские водоросли (морская капуста, или ламинария, фукус и другие) накапливают до 1% иода. Иод входит в скелетный белок губок и скелетопротеинов морских многощетинковых червей.
В организме человека (масса тела 70 кг) содержится 12-20 мг иода, суточная потребность в иоде составляет около 0,2 мг (200 мкг). Отсутствие или недостаток иода в рационе (что типично для некоторых местностей) приводит к заболеваниям (эндемический зоб, кретинизм, гипотиреоз). В связи с этим к поваренной соли, поступающей в продажу в местностях с естественным геохимическим дефицитом иода, с профилактической целью добавляют иодид калия, иодид натрия или иодат калия (иодированная соль).
Токсичность
Иод — токсичное вещество. Смертельная доза 2-3 г. Вызывает поражение почек и сердечно-сосудистой системы. При вдыхании паров йода появляется головная боль, кашель, насморк, может быть отёк лёгких. При попадании на слизистую оболочку глаз появляется слезотечение, боль в глазах и покраснение. При попадании внутрь появляется общая слабость, головная боль, рвота, понос, бурый налёт на языке, боли в сердце и учащение пульса. Через день воспаляются почки, появляется кровь в моче. Если не лечить через 2-3 дня могут отказать почки и наступить миокардит. Без лечения наступает летальный исход.
Периодическая система химических элементов Менделеева
Классификация хим. элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона/
198095, г.Санкт-Петербург, ул.Швецова, д.23, лит.Б, пом.7-Н, схема проезда
Химический элемент йод - формула, строение и свойства
Химический элемент йод (обозначается как I) является самым тяжёлым из часто встречающихся галогенов и находится в 17 группе (VIIA) периодической системы Менделеева с атомным номером 53 и массой 126.9045. Он существует в виде блестящего пурпурно-чёрного неметаллического твёрдого вещества в стандартных условиях, которое плавится с образованием глубокой фиолетовой жидкости.
- История открытия
- Основная информация
- Физические свойства
- Химические свойства
- Наличие в природе
- Изотопы элемента
- Получение и нахождение
- Использование и применение
- Биологическая роль
![Химический элемент йод]()
История открытия
![Открытие химического элемента йода]()
Йод был открыт в 1811 году французским химиком Бернаром Куртуа (1777—1838). Одна из первых его работ в начале 1800-х годов состояла в том, чтобы помочь своему отцу в изготовлении соединений натрия и калия (нитрат калия, KNO3) из морских водорослей.
Куртуа и его отец собирали водоросли на побережьях Нормандии и Бретани во Франции. Затем они жгли их и смачивали пепел водорослей в воде, чтобы растворить соединения натрия и калия. Однажды в 1811 году Бернар добавил серную кислоту и увидел фиолетовые пары, которые конденсировались, образуя кристаллы с металлическим блеском. Куртуа догадался, что это был новый элемент, который он назвал в честь его цвета (на греческом языке слово «иодес» означает «фиолетовый»).
Куртуа дал небольшое количество этого вещества Шарлю-Бернару Десормесу и Николя Клеману, которые провели систематическое расследование. В ноябре 1813 года они выставили йод в Императорском институте в Париже. То, что это действительно новый элемент, было доказано Джозефом Гей-Люссаком и подтверждено Хамфри Дэви, который отправил отчёт в Королевское учреждение в Лондоне, где ошибочно предположили, что он был первооткрывателем, и это убеждение сохранялось более 50 лет.
Основная информация
Йод является важным элементом, необходимым для жизни. Он наиболее известен своей ролью в выработке гормонов щитовидной железы у людей, а также у всех позвоночных. Дефицит йода может привести к серьёзным проблемам со здоровьем, включая зоб (увеличение щитовидной железы), умственную отсталость и кретинизм.
В качестве чистого элемента он представляет собой блестящий пурпурно-чёрный неметалл, твёрдый при стандартных условиях. Он легко переходит из твёрдого в газообразное состояние, минуя жидкую форму, и выделяет пурпурный пар. Хотя это технически неметалл, он обладает некоторыми металлическими качествами. Основными характеристиками элемента являются:
![Получение, применение и свойства йода]()
Йод является одним из самых ярких и красивых элементов. Как твёрдое вещество, это тяжёлый, серовато-черный, металлический материал. Среди его основных физических свойств можно выделить:
![Состав йода]()
- При нагревании не плавится. Вместо этого он испаряется. Сублимация — это процесс, при котором твёрдое вещество превращается непосредственно в газ без предварительного плавления. Образующийся пар йода имеет фиолетовый цвет и резкий запах. Если в эти пары помещается холодный объект, йод снова превращается в твёрдое вещество. Образует привлекательные, нежные металлические кристаллы.
- Растворяется в воде лишь незначительно. Но он растворяется во многих других жидкостях, образуя характерные пурпурные растворы.
- При нагревании в надлежащих условиях его можно заставить испаряться при 113,5°C и закипеть при 184 °C. Плотность элемента составляет 4,93 грамма на кубический сантиметр.
- Имеет умеренное давление паров при комнатной температуре, и в открытом сосуде медленно сгущается до глубоких фиолетовых паров, которые раздражают глаза, нос и горло (высококонцентрированный йод является ядовитым и может нанести серьёзный ущерб коже и тканям.) По этой причине йод лучше всего взвешивать в закупоренной бутылке. Для приготовления водного раствора флакон может содержать раствор йодида калия, что значительно снижает давление паров йода.
Как и другие галогены, йод является активным элементом. Однако он менее активен, чем три галогена, стоящие над ним в периодической таблице. Основные химические свойства йода:
![Свойства йода]()
![Что надо знать о йоде]()
- Его наиболее распространёнными соединениями являются щелочные металлы, натрий и калий. Но он также образует соединения с другими элементами, в том числе с галогенами. Некоторыми примерами являются монобромид йода (IBr), монохлорид йода (ICl) и пентафторид йода (IF 5).
- Молекулярная решётка йода содержит дискретные двухатомные молекулы, которые также присутствуют в расплавленном и газообразном состояниях. Выше 700 °C диссоциация на атомы йода становится заметной.
- Молекула элемента может действовать, как кислота Льюиса в том смысле, что она сочетается с различными основаниями Льюиса. Взаимодействие, однако, слабое, и лишь немногие твёрдые комплексные соединения были выделены. Они легко обнаруживаются в растворе и называются комплексами с переносом заряда. Например, йод слабо растворяется в воде и даёт желтовато-коричневый раствор. Коричневые растворы также образуются со спиртом, эфиром, кетонами и другими соединениями, действующими, как основания Льюиса через атом кислорода.
- Даёт красный раствор в бензоле, который рассматривается, как результат другого типа комплекса с переносом заряда. В инертных растворителях, таких как четырёххлористый углерод или сероуглерод, получаются растворы фиолетового цвета, которые содержат несогласованные молекулы йода.
- Реагирует также с йодид-ионами, поскольку последние могут действовать, как основания Льюиса, и по этой причине растворимость элемента в воде значительно повышается в присутствии йодида. При добавлении йодида цезия кристаллический трийодид цезия может быть выделен из красновато-коричневого водного раствора.
- Образует синий комплекс с крахмалом, и этот цветовой тест используется для обнаружения небольших количеств йода.
- Это более слабый окислитель, чем бром, хлор или фтор.
- Легко соединяется с большинством металлов и некоторыми неметаллами с образованием йодидов. Например, серебро и алюминий легко превращаются в их соответствующие йодиды, а белый фосфор легко объединяется с йодом.
- Водный раствор йодистого водорода (HI), известный как йодистоводородная кислота, является сильной кислотой, которая используется для приготовления йодидов путём реакции с металлами или их оксидами, гидроксидами и карбонатами.
- Проявляет степень окисления +5 в умеренно сильной йодной кислоте (HIO 3), которая может быть легко обезвожена с образованием белого твёрдого пентоксида йода (I 2 O 5).
Наличие в природе
![Йод, важность для человека]()
Йода не очень много в земной коре. По оценкам, его количество составляет от 0,3 до 0,5 частей на миллион. Он находится в нижней трети элементов, с точки зрения изобилия. Но, тем не менее, он более распространён, чем кадмий, серебро, ртуть и золото. Его содержание в морской воде ещё меньше — около 0,0003 частей на миллион.
Этот элемент, как правило, концентрируется в земной коре лишь в нескольких местах, когда-то покрытых океанами. За миллионы лет океаны испарились и оставили химические соединения, которые были растворены в них и сегодня существуют под землёй, как соляные копи.
![Биологическая роль]()
Существует возможность собирать этот элемент из морской воды, солоноватой воды, рассола или морских водорослей. Морская вода имеет разные названия, в зависимости от количества растворенных в ней твёрдых веществ. Водоросли являются популярным источником йода, так как поглощают элементы из морской воды. Со временем они начинают иметь гораздо более высокую концентрацию йода, чем морская вода. Морскую водоросль собирают, сушат и сжигают для сбора вещества. Процесс мало чем отличается от того, который использовал Куртуа в 1811 году.
Изотопы элемента
![Применение йода]()
Известен только один природный изотоп элемента — йод-127. Изотопы — это две или более формы элемента. Они отличаются друг от друга по их массовому числу. Число, написанное справа от названия элемента, является массовым числом. Оно представляет количество протонов плюс нейтронов в ядре атома элемента. Количество протонов определяет элемент, но количество нейтронов в атоме любого одного элемента может варьироваться. Каждая вариация является изотопом.
Примерно 30 радиоактивных изотопов йода были изготовлены искусственно. Это такие изотопы, которые распадаются на части и выделяют некоторую форму радиации. Они образуются, когда очень маленькие частицы обжигают атомы. Эти частицы прилипают к атомам и делают их радиоактивными.
Применение изотопов
Ряд изотопов йода имеет коммерческое использование. В медицинских целях они вводятся в организм пациента через рот, а затем проходят через тело в кровотоке. Когда они путешествуют, то излучают радиацию. Это излучение обнаруживается с помощью рентгеновской плёнки. Медицинский специалист может сказать, насколько хорошо организм функционирует, наблюдая диаграмму направленности. Изотопы йода используются и в следующих целях:
![Йод, важность для человека]()
- Йод-123 — в исследованиях мозга, почек и щитовидной железы.
- Йод-125 — для исследования поджелудочной железы, кровотока, печени, поглощения минеральных веществ в костях и потери белков в организме.
- А йод-131 — при исследованиях печени, почек, кровотока, лёгких, мозга, поджелудочной железы.
Наиболее распространённым изотопом является йод-131. При попадании в организм он имеет тенденцию поступать непосредственно в щитовидную железу, а затем используется для выработки гормонов щитовидной железы.
Получение и нахождение
![Получение йода]()
Этот элемент коммерчески производится из йодсодержащих рассолов. Природные рассолы или рассолы, извлечённые из нефтяных скважин, содержащие до 150 мг на литр (0,02 унции на галлон), обнаружены в Яве, Калифорнии и северной Италии. В число ведущих мировых производителей входят Чили, Япония, Китай, Россия и Азербайджан.
Примеси, такие как глина, песок и масло, удаляются фильтрацией, а раствор пропускается через поток диоксида серы, а затем через несколько контейнеров, в которых содержатся пучки медной проволоки. Образующийся йодид меди удаляют фильтрацией, промывают водой, сушат и тонко измельчают. Продукт нагревают с карбонатом калия, получая йодид калия, который затем окисляют до свободного элемента дихроматом и серной кислотой.
Использование и применение
![Сфера применения йода]()
Около 2/3 всего йода и его соединений используется в системах санитарии или в производстве различных антисептиков и лекарств. Вещество также используется для изготовления красителей, фотоплёнки и специального мыла. Он применяется в некоторых отраслях промышленности в качестве катализатора — вещества, используемого для ускорения или замедления химической реакции. Он не претерпевает никаких изменений во время реакции.
Элемент может оказывать как благоприятное, так и неблагоприятное воздействие на живые организмы. Он имеет тенденцию убивать бактерии и другие болезнетворные организмы. Это свойство вещества вызывает его использование в системах санитарии и в качестве антисептика — химического вещества, останавливающего рост микробов.
Настойка йода всегда была одним из самых популярных антисептических препаратов Её наносили на порезы и раны, чтобы предотвратить заражение. Сегодня она часто заменяется другими антисептиками.
Одной из причин того, что сегодня настойка используется реже, является то, что она также может вызвать проблемы. В более высоких дозах йод может раздражать или сжигать кожу. Он также может быть довольно ядовитым, если принимать его внутрь, поэтому важно использовать его согласно инструкции.
Другими важными областями применения йода являются:
![Важность элемента йод]()
- Поскольку он преобразуется в тироксин в щитовидной железе, небольшое его количество имеет важное значение для организма, который содержит в среднем 14 мг (0,00049 унции) элемента. Тироксин — это гормон, необходимый для поддержания нормального обмена веществ во всех клетках организма. Он способен возбудить нервную систему, в особенности кору головного мозга и промежуточный мозг. Во многих местах питьевая вода содержит достаточно йода для этой цели.
- Элемент и его соединения широко используются в аналитической химии. Многие процедуры основаны на выделении или поглощении йода и его последующем титровании с тиосульфатом натрия (йодометрия). Ненасыщенность жиров (то есть количество двойных или тройных связей между атомами углерода) определяется добавлением свободного йода (йодного числа).
- Используется в фотографии, как йодид серебра и йодид калия.
- Йодид серебра также применяется для посадки облаков, чтобы вызвать дождь.
- Используется в производстве красителей.
![Основное применение йода в промышленности и жизни человека]()
Йод является важным элементом для людей, которым требуется суточное его потребление в количестве около 0,1 мг. Максимальная безопасная для здоровья доза единовременного потребления — 0.5 г (500 мкг). Тело человека содержит до 20 миллиграмм этого элемента, главным образом в щитовидной железе, которая помогает регулировать рост и температуру тела.
Обычно люди получают достаточно йода из пищи, которую они едят. Дефицит же этого микроэлемента может вызвать опухоль щитовидной железы (известный, как зоб). Зоб вызывает большой комок в шее, поскольку щитовидная железа выходит из-под контроля. (Он может вырасти до размера виноградного плода.) Зоб пытается производить гормоны щитовидной железы, но он не получает достаточного количества йода из рациона человека, поэтому продолжает расширяться, пытаясь сделать свою работу.
Недостаток йода может вызвать и другие проблемы. Например, гормоны щитовидной железы необходимы для нормального развития мозга у нерожденного ребёнка и продолжения этого развития после рождения. Люди, которые не включают в свой рацион достаточного количества микроэлемента, не развиваются нормально.
Сегодня эксперты говорят, что низкий уровень йода является основной причиной умственной отсталости, глухоты, мутизма (неспособности говорить) и паралича. К менее серьёзным проблемам относятся сонливость, неуклюжесть и неспособность к обучению.
![Где содержится йод]()
Количество йода в организме человека очень мало. Для определения его количества вес человека делится на 2 500 000. Полученное число и есть вес элемента в организме. Для нормальных людей эта сумма примерно равна размеру головки булавки, но эта крошечная точка может иметь большое значение для здоровья.
![Йодированная соль]()
Низкий уровень микроэлемента может быть легко исправлен. Сегодня в большинстве развитых стран компании, производящие поваренную соль, добавляют небольшое количество йодида калия (KI) в соль, которая обозначается «йодированная соль». Люди, которые её используют, получают необходимое количество для нормальной работы щитовидной железы.
Но те, кто живет в развивающихся странах, могут не получать йодированной соли. Всемирная организация здравоохранения (ВОЗ) пытается найти способы обеспечения микроэлементом этих людей. По оценкам ВОЗ, 1,5 млрд человек живут в районах с низким уровнем йода. До 20 млн из этих людей могут иметь психические расстройства из-за его недостатка. ВОЗ начала программу по обеспечению будущего поколения в таких регионах этим микроэлементом, необходимым для нормального развития и функционирования.
Читайте также: