К какому типу элементов относятся щелочные и щелочноземельные металлы
Обновлено: 16.05.2024

Наиболее активными среди металлической группы являются щелочные и щелочноземельные металлы. Это мягкие лёгкие металлы, вступающие в реакции с простыми и сложными веществами.
Общее описание
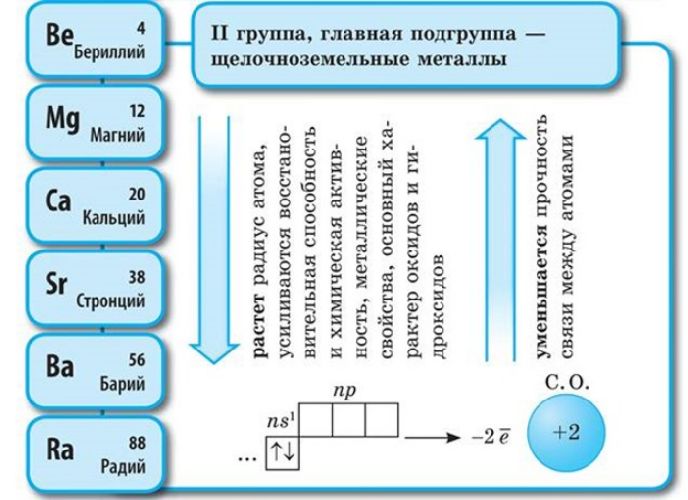
Активные металлы занимают первую и вторую группы периодической таблицы Менделеева. Полный список щелочных и щелочноземельных металлов:
Электронная конфигурация щелочных металлов – ns 1 , щелочноземельных металлов – ns 2 .
Соответственно, постоянная валентность щелочных металлов – I, щелочноземельных – II. За счёт небольшого количества валентных электронов на внешнем энергетическом уровне активные металлы проявляют мощные свойства восстановителя, отдавая внешние электроны в реакциях. Чем больше энергетических уровней, тем меньше связь с внешних электронов с ядром атома. Поэтому металлические свойства возрастают в группах сверху вниз.
Из-за активности металлы I и II групп находятся в природе только в составе горных пород. Чистые металлы выделяют с помощью электролиза, прокаливания, реакции замещения.
Физические свойства
Щелочные металлы имеют серебристо-белый цвет с металлическим блеском. Цезий – серебристо-жёлтый металл. Это наиболее активные и мягкие металлы. Натрий, калий, рубидий, цезий режутся ножом. По мягкости напоминают воск.

Рис. 2. Разрезание натрия ножом.
Щелочноземельные металлы имеют серый цвет. По сравнению со щелочными металлами являются более твёрдыми, плотными веществами. Ножом можно разрезать только стронций. Самый плотный металл – радий (5,5 г/см 3 ).
Наиболее лёгкими металлами являются литий, натрий и калий. Они плавают на поверхности воды.
Химические свойства
Щелочные и щелочноземельные металлы реагируют с простыми веществами и сложными соединениями, образуя соли, оксиды, щёлочи. Основные свойства активных металлов описаны в таблице.
Взаимодействие
Щелочные металлы
Щелочноземельные металлы
Самовоспламеняются на воздухе. Образуют надпероксиды (RO2), кроме лития и натрия. Литий образует оксид при нагревании выше 200°C. Натрий образует смесь пероксида и оксида.
На воздухе быстро образуются защитные оксидные плёнки. При нагревании до 500°С самовоспламеняются.
Реагируют при нагревании с серой, водородом, фосфором:
С азотом реагирует только литий, с углеродом – литий и натрий:
Реагируют при нагревании:
Бурно реагируют с образованием галогенидов:
Образуются щёлочи. Чем ниже металл расположен в группе, тем более активно протекает реакция. Литий взаимодействует спокойно, натрий горит жёлтым пламенем, калий – со вспышкой, цезий и рубидий взрываются.
Менее активно, чем щелочные металлы, реагируют при комнатной температуре:
Со слабыми и разбавленными кислотами реагируют с взрывом. С органическими кислотами образуют соли.
Из всех металлов реагирует только бериллий:
Вступают в реакцию все металлы, кроме бериллия. Замещают менее активные металлы:
2Mg + ZrO2 → Zr + 2MgO

Рис. 3. Реакция калия с водой.
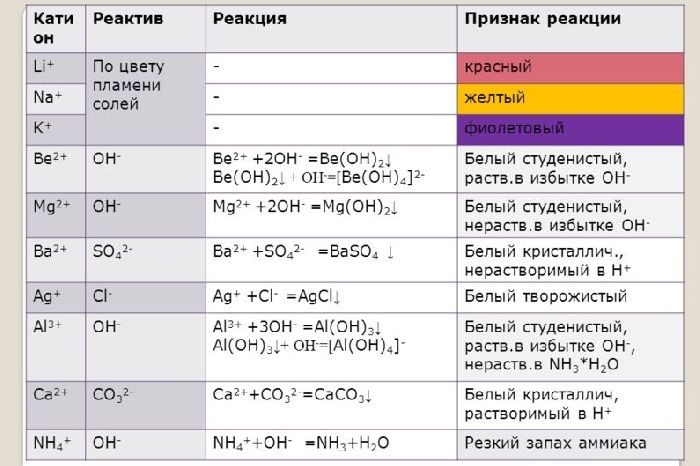
Щелочные и щелочноземельные металлы можно обнаружить с помощью качественной реакции. При горении металлы окрашиваются в определённый цвет. Например, натрий горит жёлтым пламенем, калий – фиолетовым, барий – светло-зелёным, кальций – тёмно-оранжевым.
Что мы узнали?
Щелочные и щелочноземельные – наиболее активные металлы. Это мягкие простые вещества серого или серебристого цвета с небольшой плотностью. Литий, натрий, калий плавают на поверхности воды. Щелочноземельные металлы более твёрдые и плотные, чем щелочные. На воздухе быстро окисляются. Щелочные металлы образуют надпероксиды и пероксиды, оксид образует только литий. Бурно реагируют с водой при комнатной температуре. С неметаллами реагируют при нагревании. Щелочноземельные металлы вступают в реакцию с оксидами, вытесняя менее активные металлы. Со щелочами реагирует только бериллий .
Щелочные и щелочноземельные металлы. Материалы к уроку.

Щелочные металлы
Щелочными металлами называют химические элементы I группы главной подгруппы Периодической системы элементов Менделеева. Это литий Li, натрий Na. Названы они так потому, что их гидроокиси - наиболее сильные щелочи. Химически очень активны, причем их активность возрастает от Li к Fr. Примером наиболее распространенного соединения одного из щелочных металлов является поваренная соль (хлорид натрия) NaCl. Широко известна сода (карбонат натрия) Na2CO3. Широко известен щелочной элемент К. Он входит в состав калийных удобрений. Вместе с азотными и фосфорными удобрениями это основные удобрения, применяемые в сельском хозяйстве. Реже встречаются упоминания о литиевых электрических батарейках, цезиевых фотоэлементах, рубидиевых часах. Элементы IA группы являются типичными металлами.

С элемента IA группы начинается каждый период в таблице Менделеева. Это означает, что именно у атомов этих элементов начинается заполнение следующего энергетического уровня. Поэтому на внешнем уровне у атомов всех щелочных металлов находится по одному электрону (2s1) . При переходе от Li к Fr , т.е. при движении сверху вниз по группе, у атомов возрастает число энергетических уровней, следовательно, увеличивается размер атомов, ослабевает связь внешнего электрона с ядром. Это значит, что валентный электрон атома щелочного металла все легче может перейти на орбитали атома другого элемента, а эта способность «отдавать» электроны есть свойство восстановителя.

Щелочные металлы как простые вещества
Атомы щелочных металлов имеют по одной валентной орбитали, содержащей один электрон. Поэтому эти атомы могут соединяться между собой с образованием двухатомных молекул, которые и обнаружены в газообразном состоянии металлов-элементов IA группы. Однако в твердом состоянии простые вещества, образованные этими элементами, тем не менее построены не из двухатомных молекул, а из атомов.

Физические свойства щелочных металлов
При переходе от одного элемента к другому сверху вниз по группе размеры атомов увеличиваются и эффективность перекрывания их валентных орбиталей уменьшается, снижается прочность связей между атомами. А это приводит к снижению температур плавления и кипения веществ. (Температура плавления и кипения понижаются с увеличением порядкового номера элемента.)
Относительно малая прочность связи между атомами обуславливает и низкую механическую прочность кристаллов: щелочные металлы мягкие, легко режутся ножом.

Химические свойства щелочных металлов
Щелочные металлы очень активные вещества. На воздухе они быстро реагируют с его составными частями. Результатом этого является смесь веществ, которые покрывают поверхность металла толстым рыхлым слоем. Поэтому щелочные металлы хранят в жидкостях, не реагирующих с ними, например в керосине. Щелочные металлы бурно взаимодействуют с водой:
2 Na + H2O = 2NaOH + H2 . Это окислительно-восстановительная реакция. Na – восстановитель. Т.к. Na легче воды , он остается на ее поверхности.

4 Li + O2 = 2Li2 O (оксид лития)
6 Li + N2 = 2Li3N (нитрид лития)
2Li + H2 = 2LiH (гидрид лития)
2Li+ 2H2O= 2LiOH+H2
Щелочной металл Li окрашивает пламя в карминово-красный цвет, Na – в желтый цвет, К – в фиолетовый. Это свойство применяется в бенгальских огнях, в сигнальных ракетах , в фейерверках.

Но основное применение элементы IA группы находят в виде их соединений едкий натр и сода.
Гидроксид натрия (NaOH) – щелочь. Изменяет цвет индикаторов, мылкий на ощупь.
Реагирует с кислотами:
NaOH+HCl = NaCl+H2O
с кислотными оксидами:
2NaOH+CO2=Na2CO3+H2O

Щелочноземельные металлы
Щелочноземельные металлы - это химические элементы, относящиеся к главной подгруппе II группы Периодической системы Менделеева. Название связано с тем, что их окислы - «земли» (по терминологии алхимиков) – сообщают воде щелочную реакцию. Химически щелочные металлы очень активны, причем их активность возрастает от кальция к радию.

Следует обязательно заметить, что к щелочноземельным металлам относятся элементы IIA группы, но не все, а только начиная с кальция и вниз: Ca, Sr, Ba, Ra. Оксиды этих элементов взаимодействуют с водой, образуя щелочи.

Как и у щелочных металлов у щелочноземельных металлов с увеличением размеров атомов ослабевает химическая связь между ними и кристалл разрушается при более низкой температуре.
Но в то же время на примере магния можно видеть, что не только расстоянием между ядрами атомов в кристалле определяется прочность связи. Существуют и более сложные факторы, обуславливающие это.

Например:
С увеличением размеров ионов проявляется та же закономерность в изменении свойств соответствующих оксидов и гидроксидов, с увеличением размера иона ослабевают кислотные и усиливаются основные свойства оксидов и гидроксидов.
BeO и Be(OH)2 - амфотерные соединения , MgO и Mg(OH)2 проявляют только основные свойства. Водный раствор гидроксида магния (малорастворим) проявляет отчетливые свойства основания (окрашивает раствор фенолфталеина в малиновый цвет). Реагирующие с водой оксиды щелочноземельных металлов образуют более или менее хорошо растворимые в воде щелочи.

Краткое описание документа:
- УУД: Личностные: создать условия для активизации у учащихся личностных и регулятивных УУД:
- целеполагание,
- планирование действий,
- самоконтроль,
- самостоятельную коррекцию знаний.
- умения определять способы действия,
- создавать обобщения и устанавливать аналогии,
- устанавливать причинно-следственные связи,
- организовывать сотрудничество и совместную деятельность с одноклассниками;
- работать в малых группах;
- формулировать, аргументировать и отстаивать своё мнение;
- строить логическое рассуждение,
- делать выводы.
- создать условия для изучения основных соединений щелочных металлов на Земле, положения щелочных металлов в периодической системе Д.И.Менделеева, химических и физических свойства щелочных металлов, способов получения и применения щелочных металлов и сплавов в различных областях народного хозяйства;
- создать условия для формирования умения писать уравнения химических реакций, отражающие химические свойства щелочных металлов, сравнивать основные характеристики металлов в зависимости от положения в периодической системе, находить черты сходства и различия, делать обобщения, устанавливать причинно-следственные связи.
Рабочие листы и материалы для учителей и воспитателей
Более 3 000 дидактических материалов для школьного и домашнего обучения
Химические свойства щелочных и щелочноземельных металлов
![]()
Химические свойства щелочных и щелочноземельных металлов схожи. На внешнем энергетическом уровне щелочных металлов находится один электрон, щелочноземельных – два. При реакциях металлы легко расстаются с валентными электронами, проявляя свойства сильного восстановителя.
Щелочные
В I группу периодической таблицы входят щелочные металлы:
Они отличаются мягкостью (можно разрезать ножом), низкими температурами плавления и кипения. Это наиболее активные металлы.
Химические свойства щелочных металлов представлены в таблице.
Реакция
Особенности
Уравнение
Быстро окисляются на воздухе. Литий образует оксид при температуре выше 200°C. Натрий образует смесь – 80 % пероксида (R2O2) и 20 % оксида. Остальные металлы образуют надпероксиды (RO2)
Реагирует только литий при комнатной температуре
Реакция проходит бурно
При нагревании. Образуют сульфиды, гидриды, фосфиды, силициды. С углеродом реагируют только литий и натрий, образуя карбиды
Спокойно реагирует только литий. Натрий горит жёлтым пламенем. Калий реагирует со вспышкой. Цезий и рубидий взрываются
С соляной, фосфорной, разбавленной серной кислотами реагируют с взрывом. При реакции с концентрированной серной кислотой выделяется сероводород, с концентрированной азотной кислотой образует оксид азота (I), с разбавленной азотной кислотой – азот
– 2Na + 2HCl → 2NaCl + H2;
Могут реагировать с органическими кислотами и спиртами.
Щелочноземельные
Во II группе таблицы Менделеева находятся щелочноземельные металлы:
- бериллий;
- магний;
- кальций;
- стронций;
- барий;
- радий.
![Щелочноземельные металлы]()
Рис. 2. Щелочноземельные металлы.
В отличие от щелочных металлов они более твёрдые. Ножом можно разрезать только стронций. Наиболее плотный металл – радий (5,5 г/см 3 ).
Бериллий взаимодействует с кислородом только при нагревании до 900°С. С водородом и водой не реагирует при любых условиях. Магний окисляется при температуре 650°С и взаимодействует с водородом под высоким давлением.
В таблице отражены основные химические свойства щелочноземельных металлов.
Образуют оксидные плёнки. При нагревании до 500°С самовоспламеняются
При высокой температуре образуют гидриды
С галогенами и неметаллами
Реагируют при нагревании
При комнатной температуре
Реагируют все металлы с образованием солей
Реагирует только бериллий
Замещают менее активные металлы в оксидах. Исключение – бериллий
Ионы щелочных и щелочноземельных металлов в солях легко обнаружить по изменению цвета пламени. Соли натрия горят жёлтым пламенем, калия – фиолетовым, рубидия – красным, кальция – кирпично-красным, бария – жёлто-зелёным. Соли этих металлов используют для создания фейерверков.
![Качественная реакция]()
Рис. 3. Качественная реакция.
Щелочные и щелочноземельные металлы – активные элементы периодической таблицы, вступающие в реакции с простыми и сложными веществами. Щелочные металлы более мягкие, бурно реагируют с водой и галогенами, легко окисляются на воздухе, образуя оксиды, пероксиды, надпероксиды, взаимодействуют с кислотами и аммиаком. При нагревании вступают в реакцию с неметаллами. Щелочноземельные металлы реагируют с неметаллами, кислотами, водой. Бериллий не взаимодействует с водородом и водой, но реагирует со щелочами и с кислородом при высокой температуре.
ПЕРИОДИЧЕСКАЯ ТАБЛИЦА МЕНДЕЛЕЕВА
Еще в школе, сидя на уроках химии, все мы помним таблицу на стене класса или химической лаборатории. Эта таблица содержала классификацию всех известных человечеству химических элементов, тех фундаментальных компонентов, из которых состоит Земля и вся Вселенная. Тогда мы и подумать не могли, что таблица Менделеева бесспорно является одним из величайших научных открытий, который является фундаментом нашего современного знания о химии.
![Таблица Менделеева]()
На первый взгляд, ее идея выглядит обманчиво просто: организовать химические элементы в порядке возрастания веса их атомов. Причем в большинстве случаев оказывается, что химические и физические свойства каждого элемента сходны с предыдущим ему в таблице элементом. Эта закономерность проявляется для всех элементов, кроме нескольких самых первых, просто потому что они не имеют перед собой элементов, сходных с ними по атомному весу. Именно благодаря открытию такого свойства мы можем поместить линейную последовательность элементов в таблицу, очень напоминающую настенный календарь, и таким образом объединить огромное количество видов химических элементов в четкой и связной форме. Разумеется, сегодня мы пользуемся понятием атомного числа (количества протонов) для того, чтобы упорядочить систему элементов. Это помогло решить так называемую техническую проблему «пары перестановок», однако не привело к кардинальному изменению вида периодической таблицы.
В периодической таблице Менделеева все элементы упорядочены с учетом их атомного числа, электронной конфигурации и повторяющихся химических свойств. Ряды в таблице называются периодами, а столбцы группами. В первой таблице, датируемой 1869 годом, содержалось всего 60 элементов, теперь же таблицу пришлось увеличить, чтобы поместить 118 элементов, известных нам сегодня.
Периодическая система Менделеева систематизирует не только элементы, но и самые разнообразные их свойства. Химику часто бывает достаточно иметь перед глазами Периодическую таблицу для того, чтобы правильно ответить на множество вопросов (не только экзаменационных, но и научных).
The YouTube ID of 1M7iKKVnPJE is invalid.
Периодический закон
Существуют две формулировки периодического закона химических элементов: классическая и современная.
Классическая, в изложении его первооткрывателя Д.И. Менделеева: свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов.
Современная: свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера).
Графическим изображением периодического закона является периодическая система элементов, которая представляет собой естественную классификацию химических элементов, основанную на закономерных изменениях свойств элементов от зарядов их атомов. Наиболее распространёнными изображениями периодической системы элементов Д.И. Менделеева являются короткая и длинная формы.
![]()
Группы и периоды Периодической системы
Группами называют вертикальные ряды в периодической системе. В группах элементы объединены по признаку высшей степени окисления в оксидах. Каждая группа состоит из главной и побочной подгрупп. Главные подгруппы включают в себя элементы малых периодов и одинаковые с ним по свойствам элементы больших периодов. Побочные подгруппы состоят только из элементов больших периодов. Химические свойства элементов главных и побочных подгрупп значительно различаются.
Периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров. В периодической системе имеются семь периодов: первый, второй и третий периоды называют малыми, в них содержится соответственно 2, 8 и 8 элементов; остальные периоды называют большими: в четвёртом и пятом периодах расположены по 18 элементов, в шестом — 32, а в седьмом (пока незавершенном) — 31 элемент. Каждый период, кроме первого, начинается щелочным металлом, а заканчивается благородным газом.
Физический смысл порядкового номера химического элемента: число протонов в атомном ядре и число электронов, вращающихся вокруг атомного ядра, равны порядковому номеру элемента.
![]()
Свойства таблицы Менделеева
Напомним, что группами называют вертикальные ряды в периодической системе и химические свойства элементов главных и побочных подгрупп значительно различаются.
Свойства элементов в подгруппах закономерно изменяются сверху вниз:
- усиливаются металлические свойства и ослабевают неметаллические;
- возрастает атомный радиус;
- возрастает сила образованных элементом оснований и бескислородных кислот;
- электроотрицательность падает.
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения, существует всего восемь форм кислородных соединений. В периодической системе их часто изображают общими формулами, расположенными под каждой группой в порядке возрастания степени окисления элементов: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4, где символом R обозначают элемент данной группы. Формулы высших оксидов относятся ко всем элементам группы, кроме исключительных случаев, когда элементы не проявляют степени окисления, равной номеру группы (например, фтор).
Оксиды состава R2O проявляют сильные основные свойства, причём их основность возрастает с увеличением порядкового номера, оксиды состава RO (за исключением BeO) проявляют основные свойства. Оксиды состава RO2, R2O5, RO3, R2O7 проявляют кислотные свойства, причём их кислотность возрастает с увеличением порядкового номера.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Существуют четыре формы таких соединений. Их располагают под элементами главных подгрупп и изображают общими формулами в последовательности RH4, RH3, RH2, RH.
Соединения RH4 имеют нейтральный характер; RH3 — слабоосновный; RH2 — слабокислый; RH — сильнокислый характер.
Напомним, что периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров.
В пределах периода с увеличением порядкового номера элемента:
- электроотрицательность возрастает;
- металлические свойства убывают, неметаллические возрастают;
- атомный радиус падает.
![]()
Элементы таблицы Менделеева
Щелочные и щелочноземельные элементы
К ним относятся элементы из первой и второй группы периодической таблицы. Щелочные металлы из первой группы — мягкие металлы, серебристого цвета, хорошо режутся ножом. Все они обладают одним-единственным электроном на внешней оболочке и прекрасно вступают в реакцию. Щелочноземельные металлы из второй группы также имеют серебристый оттенок. На внешнем уровне помещено по два электрона, и, соответственно, эти металлы менее охотно взаимодействуют с другими элементами. По сравнению со щелочными металлами, щелочноземельные металлы плавятся и кипят при более высоких температурах.
Щелочные металлы Щелочноземельные металлы Литий Li 3 Бериллий Be 4 Натрий Na 11 Магний Mg 12 Калий K 19 Кальций Ca 20 Рубидий Rb 37 Стронций Sr 38 Цезий Cs 55 Барий Ba 56 Франций Fr 87 Радий Ra 88 Лантаниды (редкоземельные элементы) и актиниды
Лантаниды — это группа элементов, изначально обнаруженных в редко встречающихся минералах; отсюда их название «редкоземельные» элементы. Впоследствии выяснилось, что данные элементы не столь редки, как думали вначале, и поэтому редкоземельным элементам было присвоено название лантаниды. Лантаниды и актиниды занимают два блока, которые расположены под основной таблицей элементов. Обе группы включают в себя металлы; все лантаниды (за исключением прометия) нерадиоактивны; актиниды, напротив, радиоактивны.
Лантаниды Актиниды Лантан La 57 Актиний Ac 89 Церий Ce 58 Торий Th 90 Празеодимий Pr 59 Протактиний Pa 91 Неодимий Nd 60 Уран U 92 Прометий Pm 61 Нептуний Np 93 Самарий Sm 62 Плутоний Pu 94 Европий Eu 63 Америций Am 95 Гадолиний Gd 64 Кюрий Cm 96 Тербий Tb 65 Берклий Bk 97 Диспрозий Dy 66 Калифорний Cf 98 Гольмий Ho 67 Эйнштейний Es 99 Эрбий Er 68 Фермий Fm 100 Тулий Tm 69 Менделевий Md 101 Иттербий Yb 70 Нобелий No 102 Галогены и благородные газы
Галогены и благородные газы объединены в группы 17 и 18 периодической таблицы. Галогены представляют собой неметаллические элементы, все они имеют семь электронов во внешней оболочке. В благородных газахвсе электроны находятся во внешней оболочке, таким образом с трудом участвуют в образовании соединений. Эти газы называют «благородными, потому что они редко вступают в реакцию с прочими элементами; т. е. ссылаются на представителей благородной касты, которые традиционно сторонились других людей в обществе.
Галогены Благородные газы Фтор F 9 Гелий He 2 Хлор Cl 17 Неон Ne 10 Бром Br 35 Аргон Ar 18 Йод I 53 Криптон Kr 36 Астат At 85 Ксенон Xe 54 — Радон Rn 86 Переходные металлы
Переходные металлы занимают группы 3—12 в периодической таблице. Большинство из них плотные, твердые, с хорошей электро- и теплопроводностью. Их валентные электроны (при помощи которых они соединяются с другими элементами) находятся в нескольких электронных оболочках.
Переходные металлы Скандий Sc 21 Титан Ti 22 Ванадий V 23 Хром Cr 24 Марганец Mn 25 Железо Fe 26 Кобальт Co 27 Никель Ni 28 Медь Cu 29 Цинк Zn 30 Иттрий Y 39 Цирконий Zr 40 Ниобий Nb 41 Молибден Mo 42 Технеций Tc 43 Рутений Ru 44 Родий Rh 45 Палладий Pd 46 Серебро Ag 47 Кадмий Cd 48 Лютеций Lu 71 Гафний Hf 72 Тантал Ta 73 Вольфрам W 74 Рений Re 75 Осмий Os 76 Иридий Ir 77 Платина Pt 78 Золото Au 79 Ртуть Hg 80 Лоуренсий Lr 103 Резерфордий Rf 104 Дубний Db 105 Сиборгий Sg 106 Борий Bh 107 Хассий Hs 108 Мейтнерий Mt 109 Дармштадтий Ds 110 Рентгений Rg 111 Коперниций Cn 112 Металлоиды
Металлоиды занимают группы 13—16 периодической таблицы. Такие металлоиды, как бор, германий и кремний, являются полупроводниками и используются для изготовления компьютерных чипов и плат.
Металлоиды Бор B 5 Кремний Si 14 Германий Ge 32 Мышьяк As 33 Сурьма Sb 51 Теллур Te 52 Полоний Po 84 Постпереходными металлами
Элементы, называемые постпереходными металлами, относятся к группам 13—15 периодической таблицы. В отличие от металлов, они не имеют блеска, а имеют матовую окраску. В сравнении с переходными металлами постпереходные металлы более мягкие, имеют более низкую температуру плавления и кипения, более высокую электроотрицательность. Их валентные электроны, с помощью которых они присоединяют другие элементы, располагаются только на внешней электронной оболочке. Элементы группы постпереходных металлов имеют гораздо более высокую температуру кипения, чем металлоиды.
Постпереходные металлы Алюминий Al 13 Галлий Ga 31 Индий In 49 Олово Sn 50 Таллий Tl 81 Свинец Pb 82 Висмут Bi 83 Неметаллы
Из всех элементов, классифицируемых как неметаллы, водород относится к 1-й группе периодической таблицы, а остальные — к группам 13—18. Неметаллы не являются хорошими проводниками тепла и электричества. Обычно при комнатной температуре они пребывают в газообразном (водород или кислород) или твердом состоянии (углерод).
Неметаллы Водород H 1 Углерод C 6 Азот N 7 Кислород O 8 Фосфор P 15 Сера S 16 Селен Se 34 Флеровий Fl 114 Унунсептий Uus 117 А теперь закрепите полученные знания, посмотрев видео про таблицу Менделеева и не только.
Отлично, первый шаг на пути к знаниям сделан. Теперь вы более-менее ориентируетесь в таблице Менделеева и это вам очень даже пригодится, ведь Периодическая система Менделеева является фундаментом, на котором стоит эта удивительная наука.
Читайте также: