К металлам относят почти все
Обновлено: 05.07.2024
Дополнения: электро- , кокс, Fe 3 O 4 , s - , электроны, ЭХРН, ковкость, алюминий, пластичность, восстановителей, кислотами, отдают, жёлтый, более, положительно, f -, NaCl , d -, левее, карбонаты, водород, основаниями, металлический блеск, белый, карбонат, FeS 2 , p -, CO , теплопроводность.
2. Как будет изменяться характер оксидов и гидросидов хрома при изменении степени окисления атомов хрома: +2, +3, +6? Свои рассуждения подтвердите записью соответствующих уравнений реакций, описывающих химические свойства соединений.
3. Осуществите цепочку превращений:
Al ---- Al 2 O 3 ---- Al ( OH )3 ---- NaA ( OH )4 ---- NaAlO 2
4. Медную пластинку массой 20г выдерживали в растворе нитрата серебра до полного окончания реакции, после чего масса пластинки возросла на 19%. Найдите массу выделенного серебра и массу нитрата серебра в исходном растворе.
5. Для полного хлорирования 3г смеси железа и меди потребовалось 1,12 дм 3 хлора. Определите массу раствора соляной кислоты с массовой долей кислоты 36,5%, которая прореагирует с 3г этой смеси. Рассчитайте массовые доли металлов в этой смеси.
Контрольная работа по теме «Металлы»
1. Составьте выражения, используя дополнения:
а) атомы большинства металлов на внешнем энергетическом уровне содержат … число электронов;
б) наличие у металлов общих физических свойств определяется общностью строения их …;
в) металлы вступают в реакции с простыми веществами … и со сложными веществами: …, …, …;
г) при внесении в бесцветное пламя образца соединения, содержащего ионы калия, пламя окрашивается в … цвет;
д) к общим методам получения металлов относятся: …, … и …;
е) в отличие от атомов неметаллов для атомов металлов характерны только … степени окисления;
ж) в зависимости от температуры плавления металлы делят на две группы: … и …, а по плотности на … и …;
з) оксиды и гидроксиды d - элементов металлов, в зависимости от степени окисления атомов металла, могут проявлять …, … и … свойства;
и) для обнаружения ионов бария в растворе используют растворы … кислоты и её солей, при этом выпадает … осадок … бария;
к) активные металлы( калий, натрий, кальций и др.) в основном получают … расплавов их … .
Дополнения: солями, гидрометаллургические, фиолетовый, водой, легкоплавкие, тяжёлые, сульфат, белый, лёгкие, амфотерные, кристаллических решёток, кислотами, малое, неметаллами, серной, кислотные, электролизом, солей, тугоплавкие, положительные, основные, пирометаллургические, электрометаллургические.
2. Укажите различия и сходство в химических свойствах простых веществ натрия и алюминия, их оксидов и гидроксидов. Ваши рассуждения проиллюстрируйте записью соответствующих уравнений реакций.
4. В раствор сульфата меди( II ) опустили железную пластинку массой 40г. Через некоторое время масса пластинки возросла на 5%. Определите массу выделенной меди и массу полученного сульфата железа( II ).
5. Сплав меди с алюминием общей массой 2г обработали раствором щёлочи. Остаток растворили в разбавленной азотной кислоте, образовавшуюся при этом соль выделили и прокалили. Масса остатка после прокаливания составила 0,8г. Определите объём израсходованного 40% -го раствора гидроксида натрия ( плотность 1,
Металлы как химические элементы

Подавляющее большинство (93 из 117) известных в настоящее время химических элементов относится к металлам.
Атомы различных металлов имеют много общего в строении, а образуемые ими простые и сложные вещества имеют схожие свойства (физические и химические).
Положение в периодической системе и строение атомов металлов.
В периодической системе металлы располагаются левее и ниже условной ломаной линии, проходящей от бора к астату (см. таблицу ниже). К металлам относятся почти все s-элементы (за исключением Н, Не), примерно половина р-элементов, все d— и f-элементы (лантаниды и актиниды).
У большинства атомов металлов на внешнем энергетическом уровне содержится небольшое число (до 3) электронов, только у некоторых атомов р-элементов (Sn, Pb, Bi, Ро) их больше (от четырех до шести). Валентные электроны атомов металлов слабо (по сравнению с атомами неметаллов) связаны с ядром. Поэтому атомы металлов относительно легко отдают эти электроны другим атомам, выступая в химических реакциях только в качестве восстановителей и превращаясь при этом в положительно заряженные катионы:
В отличие от неметаллов для атомов металлов характерны только положительные степени окисления от +1 до +8.
Легкость, с которой атомы металла отдают свои валентные электроны другим атомам, характеризует восстановительную активность данного металла. Чем легче атом металла отдает свои электроны, тем он более сильный восстановитель. Если расположить в ряд металлы в порядке уменьшения их восстановительной способности в водных растворах, мы получим известный нам вытеснительный ряд металлов, который называется также электрохимическим рядом напряжений (или рядом активности) металлов (см. таблицу ниже).
Распространенность металлов в природе.
В первую тройку наиболее распространенных в земной коре (это поверхностный слой нашей планеты толщиной примерно 16 км) металлов входят алюминий, железо и кальций. Менее распространены натрий, калий, магний. В таблице ниже приведены массовые доли некоторых металлов в земной коре.
железо и кальций. Менее распространены натрий, калий, магний. В таблице ниже приведены массовые доли некоторых металлов в земной коре.
Распространенность металлов в земной коре
| Металл | Массовая доля в земной коре, % | Металл | Массовая доля в земной коре, % |
|---|---|---|---|
| Al | 8,8 | Cr | 8,3 ∙ 10 -3 |
| Fe | 4,65 | Zn | 8,3 ∙ 10 -3 |
| Ca | 3,38 | Ni | 8 ∙ 10 -3 |
| Na | 2,65 | Cu | 4,7 ∙ 10 -3 |
| K | 2,41 | Pb | 1,6 ∙ 10 -3 |
| Mg | 2,35 | Ag | 7 ∙ 10 -6 |
| Ti | 0,57 | Hg | 1,35 ∙ 10 -6 |
| Mn | 0,10 | Au | 5 ∙ 10 -8 |
Элементы, массовая доля которых в земной коре составляет менее 0,01 %, называются редкими. К числу редких металлов относятся, например, все лантаниды. Если элемент не способен концентрироваться в земной коре, т. е. не образует собственных руд, а встречается в качестве примеси с другими элементами, то его относят к рассеянным элементам. Рассеянными, например, являются следующие металлы: Sc, Ga, In, Tl, Hf.
В 40-х годах XX в. немецкие ученые Вальтер и Ида Нолла к высказали мысль о том. что в каждом булыжнике на мостовой присутствуют все химические элементы периодической системы. Вначале эти слова были встречены их коллегами далеко не с единодушным одобрением. Однако по мере появления все более точных методов анализа ученые все больше убеждаются в справедливости этих слов.
Поскольку все живые организмы находятся в тесном контакте с окружающей средой, то и в каждом из них должны содержаться если не все, то большая часть химических элементов периодической системы. Например, в организме взрослого человека массовая доля неорганических веществ составляет 6 %. Из металлов в этих соединениях присутствуют Mg, Са, Na, К. В составе многих ферментов и иных биологически активных органических соединений в нашем организме содержатся V, Mn, Fe, Cu, Zn, Co, Ni, Mo, Сг и некоторые другие металлы.
В организме взрослого человека содержится в среднем около 140 г ионов калия и около 100 г ионов натрия. С пищей мы ежедневно потребляем от 1,5 г до 7 г ионов калия и от 2 г до 15 г ионов натрия. Потребность в ионах натрия настолько велика, что их необходимо специально добавлять в пищу. Значительная потеря ионов натрия (в виде NaCl с мочой и потом) неблагоприятно сказывается на здоровье человека. Поэтому в жаркую погоду врачи рекомендуют пить минеральную воду. Однако и избыточное содержание соли в пище негативно сказывается на работе наших внутренних органов (в первую очередь, сердца и почек).
Металлы

Данный видеофрагмент посвящён металлам, положению их в Периодической системе, их физическим свойствам, особенностям строения атомов металлов.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Металлы"
Как известно, из 118 химических элементов 95 относится к металлам.
В периодической системе металлы располагаются левее и ниже условной линии, проходящей от бора к астату, а также в побочных подгруппах V, VI, VII, VIII группы. К металлам относятся почти все s-элементы, кроме H, He, половина p-элементы, d- и f-элементы (лантаниды и актиниды).
Металлы s- и p-семейства – это металлы главных подгрупп, а d- и f-семейства – это металлы побочных подгрупп.
У большинства атомов металлов на внешнем энергетическом уровне содержится небольшое число (до 3) электронов, только у некоторых p-элементов, как Sn, Pb, Bi, Po их больше (4-6). Валентные электроны атомов металлов слабо связаны с ядром, что и отличает их от атомов неметаллов. Кроме этого, атомы металлов имеют сравнительно большие радиусы атомов и небольшую электроотрицательность.

Поэтому металлы относительно легко отдают электроны другим атомам, выступая в химических реакциях только в качестве восстановителей и превращаясь при этом в положительно заряженные катионы.
У металлов побочных подгрупп с увеличением заряда ядра радиус атома изменяется незначительно, так как заполняется предвнешний энергетический уровень. Поэтому электроны сильнее притягиваются к ядру и восстановительные свойства ослабевают.
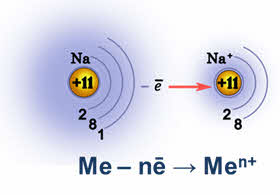
В отличие от неметаллов для атомов металлов характерны только положительные степени окисления от +1 до +8. Степень окисления металлов определяется валентными электронами внешнего и предвнешнего энергетического уровня.

Чем легче атом металла отдаёт свои электроны, тем он более сильный восстановитель.
Если расположить в ряд металлы в порядке уменьшения их восстановительной способности в водных растворах, мы получим известный нам вытеснительный ряд металлов, который называется также электрохимическим рядом напряжений (или рядом активности) металлов.

К наиболее распространённым металлам в земной коре относятся алюминий (8,8%), железо (4,65%), кальций (3,38%), натрий (2,64%), калий (2,41%), магний (2,35%) остальная часть приходится на другие металлы.

Элементы, массовая доля которых в земной коре составляет менее 0,01%, называются редкими. К числу редких металлов относятся лантаниды. Если элемент не способен концентрироваться в земной коре, то есть не образует собственных руд, а встречается в качестве примеси с другими элементами, то его относят к рассеянным элементам. Это такие элементы, как Sc, Ga, In, Tl, Hf.
В 40-х годах 20 века немецкие учёные Вальтер и Ида Ноддак высказали мысль о том, что в каждом булыжнике на мостовой присутствуют все химические элементы периодической системы.
Вначале эти слова были встречены их коллегами далеко не с единодушным одобрением. Однако по мере появления все более точных методов анализа учёные всё больше убеждались в справедливости этих слов.
Например, в организме взрослого человека массовая доля неорганических веществ составляет 6%. Из металлов здесь присутствуют Mg, Ca, Na, K.
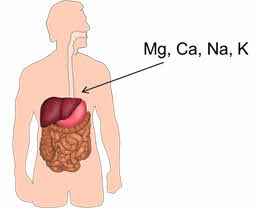
В составе многих ферментов, и иных биологически активных веществ в нашем организме содержатся V, Mn, Fe, Cu, Zn, Co, Ni, Mo, Cr и некоторые другие металлы.
В организме взрослого человека содержится в среднем около 140 г ионов калия и около 100 г ионов натрия. С пищей мы ежедневно потребляем от 1,5 г до 7 г ионов калия и от 2 г до 15 г ионов натрия.

Как известно, у металлов металлическая химическая связь, которая предопределяет ряд свойств металлов. При обычных условиях почти все металлы (кроме ртути) представляют собой твёрдые вещества, имеющие кристаллическое строение.
В металлическом кристалле атомы и катионы металлов располагаются в строго определённых местах пространства – узлах кристаллической решётки.

Кристаллическая решётка каждого металла имеет свою повторяющуюся во всех направлениях пространства характерную структуру – элементарную ячейку.
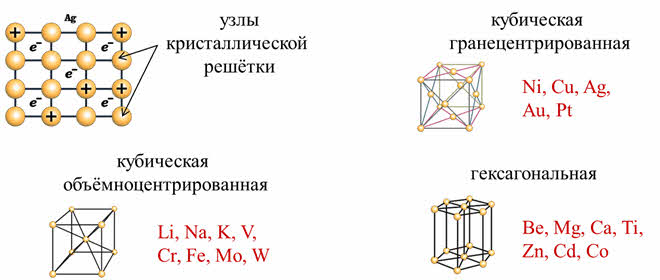
Известно много типов элементарн6ых ячеек, но наиболее распространёнными являются кубическая объёмноцентрированная, как у Li, Na, K, V, Cr, Fe, Mo, W, кубическая гранецентрированная, как у Ni, Cu, Ag, Au, Pt и гексагональная, как у Be, Mg, Ca, Ti, Zn, Cd, Co.
Для металлов характерна высокая электро- и теплопроводность, ковкость и пластичность, способность образовывать сплавы, металлический блеск.

По температуре плавления различают металлы тугоплавкие, у которых температура плавления больше 1000 0 С и легкоплавкие, у которых температура плавления меньше 1000 0 С. Самым тугоплавким металлом является W (3400 0 C), а самым легкоплавким – Hg (-39 0 C). Это свойство вольфрама позволяет использовать его в нитях ламп накаливания.

Самым электропроводным является серебро (Ag), вслед за ним идут Cu и Al.

Наиболее низкая электропроводность среди металлов у Mn. При понижении температуры электропроводность металлов возрастает, при абсолютном нуле у большинства металлов появляется сверхпроводимость.

Лучшим проводником теплоты является Ag, а худшим – Bi. Теплопроводность металлов позволяет использовать их для изготовления металлической посуды.

По твёрдости металлы очень сильно различаются. Самыми твёрдыми среди металлов являются Mo и Cr. Твёрдость щелочных металлов крайне низкая и не превышает твёрдости пластилина – их легко можно резать ножом.
По плотности металлы делят на лёгкие и тяжёлые. Если плотность металла меньше 5 г/см 3 , то этот металл является лёгким, если плотность металла больше 5 г/см 3 , то этот металл считается тяжёлым. Лёгкими считаются такие металлы, как Al, Ti, Mg, а тяжёлыми Fe, Cu, Pb, Hg.

Такое свойство металлов, как пластичность выражается в их способности деформироваться под действием механической нагрузки. Поэтому металлы можно ковать, вытягивать в проволоку, прокатывать. Наиболее пластичными металлами являются золото, серебро и медь.

Например, из золота можно изготовить фольгу толщиной 0,003 мм. Такие тонкие листы фольги можно использовать при золочении. Вспомните Янтарную комнату или изделия из золота, которые дошли до нас спустя не одно тысячелетие.

Металлы имеют металлический блеск. Наибольше светоотражающей способностью обладает ртуть, поэтому ранее её использовали для изготовления знаменитых венецианских зеркал.

В настоящее время для изготовления зеркал, прожекторов и фар используют алюминий, палладий и серебро, потому что они имеют также высокую светоотражающую способность и неядовиты, в отличие от ртути.
Многие металлы в порошке теряют блеск и приобретают чёрную или серую окраску, только магний и алюминий сохраняют её. Поэтому алюминий используют для изготовления краски «серебрянка».

Большинство металлов имеют серебристо-белый цвет, только золото имеет жёлтый цвет, а медь – красный цвет, а стронций – светло-жёлтый.

Некоторые металлы, в зависимости от условий, могут кристаллизоваться в двух и более кристаллических формах. Такое явление называется полиморфизмом (аллотропия).
Например, белое олово, или β-олово устойчиво при температуре 13,2 0 С, серое олово, или α-олово, устойчиво при температуре ниже 13,2 0 С.
Железо имеет четыре кристаллические модификации: α, β, γ, δ.
Металлы также отличаются и по их отношению к магнитному полю: металлы ферромагнитные – намагничиваются, как никель и α-железо, парамагнитные – слабо намагничиваются – это алюминий, хром и диамагнитные, которые не притягиваются к магниту, а отталкиваются – это олово и медь.
Для d-элементов характерно образование ковалентных связей, как для вольфрама, молибдена, хрома, осмия, поэтому они тугоплавкие, твёрдые и тяжёлые.
Поэтому, по степени близости физических, химических свойств выделяют группы металлов: щелочные и щелочноземельные.
Познание человеком металлов своими корнями уходит в глубокую древность. Полагают, что первыми металлами. С которыми столкнулся человек и которые он начал использовать на практике, были медь, золото и серебро.

Причина заключается в том, что именно эти металлы встречаются в природе в самородном состоянии и легко могли быть случайно найдены нашими предками. Древние медные изделия были найдены при раскопках на Анатолийском плоскогорье в Турции и датируются 6,5 – 5,5 тыс. лет до н.э.
Одним из наиболее важных этапов в использовании человеком металлов стало освоение процесса получения железа из его природных руд. Но для получения железа из руд необходима высокая температура, поэтому получать железо стали примерно к 1500 г до н. э.
История открытия алюминия связана с фамилией А. Маргграфа, который в 1754 году получил оксид алюминия из «квасцовой земли».
Только в 1825 году в виде металла алюминий был получен Г. Эрстедом. В то время стоимость алюминия превышала стоимость золота из-за чрезвычайной сложности его получения.
Таким образом, атомы металлов всегда выступают в химических реакциях в качестве восстановителей, заряд ядра атома, радиус атома оказывает влияние на восстановительные свойства металлов, в вытеснительном ряду металлов их восстановительная активность уменьшается слева направо, в отличие от неметаллов для атомов металлов характерны только положительные степени окисления. Для металлов характерна металлическая химическая связь, которая определяет физические свойства металлов.

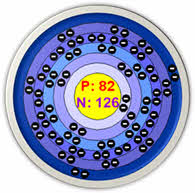
К металлам относится большая часть элементов периодической системы – 82 химических элементов. Какими свойствами они обладают, и чем отличаются от неметаллов?
Общая характеристика
Металлами называют группу элементов, в виде простых веществ, которые обладают металлическими свойствами (пластичность, ковкость, блеск, электронная проводимость и т. д.)
Основное отличие элементов-металлов – они обладают только восстановительными свойствами, а в реакциях могут только окисляться. В соединениях они могут иметь только положительные степени окисления как в элементарных положительно заряженных ионах, так и в сложных ионах, где они образуют положительные центры.
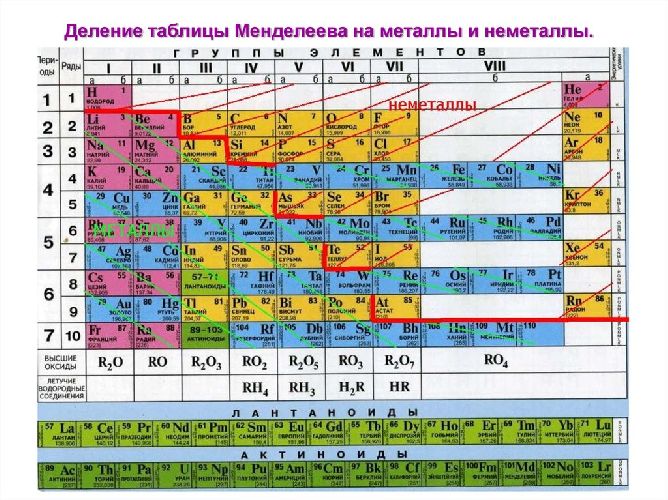
Рис. 1. Список металлов.
Как правило, на внешнем уровне элементов металлов находится небольшое число электронов (1-3), значения электроотрицательности невысокие. К металлам относятся все s-элементы (кроме водорода и гелия), d- и f-элементы, а также p-элементы под чертой бор-астат. Для типичных металлов характерен большой размер атомов, что способствует легкости отдачи валентных электронов. Образующиеся положительные ионы устойчивы, так как имеют завершенную внешнюю электронную оболочку.
Физические и химические свойства
Все металлы, кроме ртути, при нормальных условиях в виде простых веществ находятся в твердом агрегатном состоянии и образуют металлическую кристаллическую решетку.

Рис. 2. Металлы в таблице Д.И. Менделеева.
Таблица «Металлы»
В следующей таблицы представлены группы основных металлов:
| Группа металлов | Металл |
| Щелочные | литий, натрий, калий и т.д. |
| Щелочноземельные | кальций, стронций, барий и т.д. |
| Переходные | уран, титан, железо, платина и т.д. |
| постпереходные | алюминий, свинец, олово и т.д. |
| Тугоплавкие | молибден, вольфрам |
| Цветные | медь, титан, магний и т.д. |
| Благородные | золото, серебро и т.д. |
Металлы пластичны и ковки, особенно если на внешнем электронном уровне атомов по одному электрону: слои атомов перемещаются относительно друг друга без разрушения кристаллической решетки (щелочные металлы, медь, серебро, золото). В атомах непластичных хрупких металлов хрома и марганца – большое число валентных электронов.
Плотность, твердость, температура плавления металлов изменяются в широком диапазоне и зависят от атомной массы, строения атома и геометрии кристаллической решетки. Самый легкий металл – литий (плотность 0,53 г/см 3 ), самый тяжелый – осмий (плотность 22,5 г/см 3 ). Металлы с плотностью больше 5 г/см 3 относят к тяжелым, меньше 5 г/см 3 – к легким металлам.
Самая низкая температура плавления у ртути (-39 градусов по Цельсию), самый тугоплавкий металл – вольфрам (температура плавления 3410 градусов по Цельсию.) Энергия атомизации вольфрама составляет 836 кДж/моль, а температура кипения его 5930 градусов.
Металлы вступают в реакцию как с простыми, так и со сложными веществами. Как типичные восстановители металлы реагируют почти со всеми неметаллами-окислителями (кислород, сера, азот и т. д.):
Также металлы реагируют с такими сложными веществами, как оксиды и гидроксиды, разбавленные растворы кислот, с растворенными в воде щелочами.
В пределах одного и того же периода металлические свойства ослабевают, а неметаллические усиливаются; в пределах одной и той же группы (в главной подгруппе) металлические свойства усиливаются, а неметаллические ослабевают

Рис. 3. Металлы главных подгрупп.
Нахождение металлов и способы их получения
Самый распространенный на земле элемент-металл – алюминий. За ним следуют железо, кальций, натрий.
Некоторые металлы встречаются в природе в самородном состоянии (золото, ртуть, платина), но в основном они находятся в природе в виде оксидов и солей.
Получение металлов происходит с помощью металлургии (получение из руд), пирометаллургии (получение с помощью реакции восстановления при высокой температуре), гидрометаллургии (извлечение из руд в виде растворимых соединений), электрометаллургии (получение металлов электролизом расплавов и растворов их соединений).
Что мы узнали?
Металлы – вещества, которые обладают высокой электро- и теплопроводностью, ковкостью, пластичностью и металлическим блеском. В данной статье по химии 9 класса рассматриваются их физические и химические свойства, формулы класса металлов, а также способы получения.
Читайте также:
