Как действуют на жизнеспособность сперматозоидов соли тяжелых металлов
Обновлено: 20.09.2024
Качество спермы – один из важнейших факторов, определяющих мужскую фертильность. Чтобы оценить качество спермы, необходимо выяснить следующие показатели:
- Количество сперматозоидов. Норма – 20 миллионов на 1 миллилитр спермы.
- Строение и жизнеспособность. Живых сперматозоидов должно быть не менее 58 %, а с нормальным строением (с длинным хвостом, овальной головкой) – не менее 4 %.
- Подвижность. Это один из самых главных показателей, он учитывает не только способность двигаться, но и тип движения, и скорость: быстро или медленно, по прямой (поступательное движение) или вокруг своей оси. Норма – минимум 40 % подвижных сперматозоидов в семенной жидкости, а сперматозоидов с поступательным движением должно быть не меньше 32 %.
Чтобы узнать эти характеристики, сдается спермограмма. Сдавать ее желательно всем будущим отцам, так как никакие другие анализы не позволяют оценить вероятность зачатия, а многие мужчины даже не догадываются, что имеют низкую фертильность, пока не сталкиваются с тем, что у их партнерши не наступает беременность. Дело в том, что на качество спермы влияет множество факторов из обычной повседневной жизни, на которые мы не обращаем внимания.
Вредные привычки
Курение, даже пассивное, и регулярное употребление алкоголя или наркотических веществ снижает активность сперматозоидов и их концентрацию. Кроме того, курение и алкоголь – причина деформации сперматозоидов и повреждения генетического материала, который в них заложен. Многолетние вредные привычки могут даже стать причиной бесплодия.
Заболевания
Венерические болезни, хронические заболевания мочеполовой системы (например, простатит), перенесенные в детстве инфекции (паротит), сахарный диабет – все это накладывает отпечаток на качество спермы.
Неправильное питание
На качестве спермы плохо сказывается обилие жареной и жирной пищи – она угнетает синтез тестостерона, отвечающего за рост сперматозоидов. Усилители вкуса и другие искусственные добавки (ароматизаторы, красители) увеличивают количество сперматозоидов неправильной формы. Обилие быстрых углеводов снижает подвижность сперматозоидов. И это лишь несколько примеров влияния рациона на качество спермы.
Медицинские препараты, стероиды
Негативное влияние на сперму оказывают такие препараты, как противовоспалительные средства, антибиотики, антидепрессанты. Не стоит увлекаться и модными анаболическими стероидами, которые мужчины принимают для ускорения роста мышц, т. к. они подавляют созревание сперматозоидов.
Перегрев
Нагревание половых органов до температуры 39 градусов в буквальном смысле губительно для сперматозоидов. Поэтому, если вы любите баню, ограничьтесь 1-2 посещениями в месяц.
Также не подвергайтесь менее очевидному перегреву – например, когда одеваетесь не по погоде, носите слишком плотное и узкое белье или постоянно держите на коленях ноутбук.
Чрезмерная физическая активность
При изнуряющих тренировках уровень тестостерона в крови снижается. Однако бросать занятия не стоит – достаточно сократить их количество и интенсивность: умеренная нагрузка способствует повышению концентрации сперматозоидов.
Стрессы
Сильные эмоциональные потрясения угнетают работу репродуктивной системы. Стресс влияет не только на потенцию, но и на все процессы, в том числе и на сперматогенез.
Избыточный вес
Избыток массы тела сопряжен с активным превращением тестостерона в эстроген и выработкой жировой тканью эстрогенов. Как следствие, угнетается работа мужской половой системы. Из-за нарушения гормонального баланса в организме снижается концентрация жизнеспособных сперматозоидов.
Как видим, негативные факторы действуют и на процессы образования роста сперматозоидов, и на уже зрелые сперматозоиды. В обоих случаях качество спермы будет снижаться и может даже стать причиной бесплодия.
Если мужчина планирует стать отцом, к зачатию стоит подготовиться заранее.
Можно ли улучшить качество спермы?
Сперматозоиды созревают в среднем 72 дня. Поэтому если создать правильные условия для их роста и развития, то с высокой долей вероятности через три месяца качество спермы будет намного лучше.
Исследовательская работа по теме: "Влияние внешних факторов на жизнеспособность спермиев"

Исследовательская работа
Руководитель:
Самолдина Л. В.

Уссурийск, 2016г.
- Материал и методика исследований
- Схема опыта
- Результаты исследований
3.1. Влияние света на спермиев
3.2. Влияние температурного фактора на спермии
3.3. Влияние осмотического давления на спермии
3.4. Влияние антисептиков на спермии
- Выводы
- Предложения
- Список литературы
В природных условиях спермии млекопитающих животных не подвергаются воздействию внешних факторов, снижающих их живучесть.
В связи с этим у них нет защитных средств против действия многих моментов ( свет естественный, искусственный, температура, осмотическое давление и т. д), с которыми они сталкиваются вне организма.
Поэтому при массовом внедрении искусственного осеменения сельскохозяйственных животных вопросам изучения влияния факторов внешней среды на жизнеспособность спермиев посвящалось много исследовательских работ.
Так по данным Цукамото движение живчиков полностью прекращается при температуре 0 0 С, наиболее оно бывает выражено при 40 0 С, а при более высоких температурах вновь замедляется. Стойкость живчиков к более высоким температурам еще менее значительна. Обычно уже температура в 45 0 – 47 0 С лишает живчиков их оплодотворяющей способности, а при 48 0 – 50 0 С движение их полностью прекращается. Такое состояние, очевидно, обусловлено началом коагуляции белков или разрушением ферментов и является необратимым.
Понижение температуры удлиняет продолжительность выживания, замедляя обмен веществ в них в той или иной степени.
Живчики бесцветны и почти прозрачны, в связи с этим у них нет защиты против действия света, которой обычно бывают пигменты.
Экспериментальные данные В. К. Милованова, Н. Н. Яровицкого показывают, что живучесть живчиков лучше всего сохраняется в темноте, либо при ослабленном свете.
Спермий покрыт полупроницаемой оболочкой и при наличии разной концентрации растворенных веществ в спермиях и разбавителе возникает явление осмоса, перераспределения растворителя. Вода проникает в спермии при низкой концетрации солей в разбавителе или выходит в разбавитель при высокой концентрации солей в нем.
Кроме того в практике искусственного осеменения , несмотря на соблюдение всех правил асептики, полученная сперма всегда более или менее загрязнена бактериальной флорою. Поэтому стремление специалистов найти такое дезинфицирующее средство, которое могло бы действовать бактерицидно на микрофлору, не влияя отрицательно на спермиев обоснованно актуально.
Над решением этих задач работали многочисленные исследователи, начиная с основоположников искусственного осеменения И.И. Иванова, И.И. Соколовской , В. К. Милованова и др.
Антисептиками (греч. Anti -против+ s е ptikos -гнилостный) называют все вещества, обладающие противомикробным действием и применяемые главным образом наружно.
Их делят на многочисленные группы:
1.Осмотически активные вещества – не ядовитые соли (например хлористый натрий), применяемые в гипертонических концентрациях. Действие неядовитых солей сводится к отнятию воды из клеток.
2. Окислители (перекись водорода, марганцево-кислый калий, йод, хлор и др.) – изменяют окислительно-восстановительный потенциал за пределы устойчивости микробов.
3. Органические вещества (фенол, карболовая кислота, крезол, креолин и др.) широко применяемые в практике дезинфекции.
4. Спирты – для уничтожения бактерий применяют 70%, 90% и 96%-ный этиловый спирт.
К антисептикам также относятся:
5. Сложные органические вещества, такие как ихтиол, деготь, камфора и др.
6. Тяжелые металлы (ртутные соли-сумма, соли серебра ляпис, соли алюминия – жидкость Бурова и др.)
7. Красители ,применяемые в качестве бактерицидных веществ (метиленовая синька, бриллиантовая зелень и др.)
8. Детергенты (моющие средства, мыла).
Из неорганических веществ особенно ядовиты соли и окислы тяжелых металлов (ртуть, свинец), поскольку они блокируют ферментные системы спермиев. Вредно действуют на спермиев окислы цинка, алюминия, железа, меди, серебра; поэтому в практике искусственного осеменения пользуются стеклянными, пластмассовыми, хромированными, никелированными инструментами.
Установлено, что спермиев быстро убивают ртути дихлорид (сулема) в дозе 0,000003 г, перманганата калия в дозе 0,00004 г, лизол, креолин, уксусная кислота в дозе 0,0003 г на 1 г спермы. Щелочи и кислоты, эфир, нашатырный спирт, скипидар – сильные яды для спермиев.
Токсичными для спермиев могут быть также резиновые камеры, дистиллированная вода, полиэтиленовые приборы и др. При обработке резиновых камер различными моющими средствами и кипячении в дистиллированной воде в течение часа токсичность резины не исчезает. Это указывает на необходимость обязательной биологической оценки каждого прибора и препарата, выпускаемых для целей искусственного осеменения животных.
Пары летучих органических веществ (лизол, креол, скипидар, формалин, нашатырный спирт, эфир, йодоформ, ксероформ) губительно действуют на спермиев даже на расстоянии..
Несмотря на то, что в принципе при искусственном осеменении противопоказано применение дезинфицирующих средств, все же для обеззараживания инструментов необходимо пользоваться ими. Наиболее приемлем для этого этиловый спирт (этанол). По сравнению с другими дезинфицирующими средствами он легче удаляется с инструментов (быстро испаряется), кроме того, он хорошо растворяется в воде. Однако нужно иметь ввиду, что 0,5% раствор спирта очень быстро убивает спермиев. Спирт-сырец денатурированный, недостаточно очищенный от сивушного масла и других примесей, совершенно непригоден в работе по искусственному осеменению животных. При нанесении в сперму 70%-го спирта, 10%-ных растворов кислоты и щелочи, марганцовокислого калия, фурацилина наступает гибель сперматозоидов через 1-2 минуты. Раствор кислоты малой концентрации вызывает замедление движения спермиев (кислотный анабиоз). При слабо щелочной реакции среды активность спермиев повышается.
Чрезвычайно сильно действуют на спермиев детергенты (моющие средства),неорганические кислоты (серная, соляная, азотная), ряд органических кислот (уксусная, молочная, масляная), окислители (йод, хлор, калия перманганат, перекись водорода).Даже следы мыла на руках или посуде губительно действует на спермии. Поэтому следует тщательно прополаскивать дистиллированной водой посуду и инструменты после мойки и дезинфекции.
В помещении пункта искусственного осеменения запрещается хранить медикаменты и дезинфицирующие средства, а также курить.
При работе со спермой в лабораториях станций и пунктов искусственного осеменения необходимо соблюдать условия, обеспечивающие длительный срок хранения спермы с сохранением оплодотворяющей способности спермиев.
В связи с этим, при массовом внедрении искусственного осеменения сельскохозяйственных животных вопрос о действии различных факторов на спермии имеет многогранное значение.
Во-первых, важно знать их действие, чтобы уберечь живчиков от вредного влияния случайного присутствия этих факторов, в помещении, где работаешь со спермой, на используемых инструментах, материалах, теле животного.
Во-вторых, необходимо выбирать способы, как избежать вредного воздействия внешних факторов на спермии или свести их к минимуму.
В - третьих, необходимо выбирать антисептики и способы их применения для обеззараживания помещений, тела животного и принадлежностей для искусственного осеменения. При этом должны быть избраны такие антисептики и в таких дозах, чтобы с одной стороны проявилось их бактерицидное (убивающее), либо бактериостатическое (останавливающее размножение микробов) действие, а с другой – остались бы неповрежденными, жизнеспособными живчики.
В своей работе мы поставили цель изучить влияние факторов внешней среды (света, температуры и осмотического давления) на жизнеспособность спермиев и дать более или менее систематизированные сведения о возможности применения в практике искусственного осеменения следующих антисептиков: гипертонического раствора хлорида натрия (NaCl), йода, креолина, этилового спирта.
1. Материал и методика исследований.
Для опыта использовали сперму быка, замороженную в жидком азоте при температуре -196 градусов, которую оттаивали в цитратном разбавителе, рассматривали под микроскопом .по следующей методике:
1. Оттаять сперму в цитратном разбавителе. Ампулу с цитратым разбавителем протереть спиртовым тампоном, вскрыть ее и содержимое, вылить в стерильный флакон, помещенный в водяную баню (температура 43-45 градусов). 1 гранулу спермы для размораживания опускают во флакон, после того как разбавитель нагреется до температуры 40 градусов, оттаивать сперму быстро (20-30 сек.).
2.Далее каплю спермы нанести чистой стеклянной палочкой на чистое предметное стекло, сверху положить покровное. Стекло положить на предметный столик микроскопа. Работая макро- и микровинтами, рассмотреть движение спермиев и их концентрацию в поле зрения.
3.После оценки активности, выявляют влияние различных антисептиков на спермии. Для этого каждый раз на чистое предметное стекло наносят новую каплю спермы и действуют на нее тем или иным испытуемым раствором. Капли перемешивают, накрывают покровным стеклом и просматривают под микроскопом при малом увеличении. Устанавливают время, через которое прекращается движение спермиев. Для изучения влияния йода вокруг капли спермы нанести настойку в виде кольца и , не покрывая покровным стеклом, просматривать под микроскопом.
Показателем резистентности живчиков к исследуемому фактору является их поступательное движение .
2. Схема опыта:
1. Изучить действие естественного и искусственного света на спермиев.
1.1. Рассмотреть каплю семени под микроскопом при ослабленном свете.
1.2. Рассмотреть каплю семени под микроскопом при естественном сильном свете (прямые солнечные лучи).
1.3. Рассмотреть каплю спермы под микроскопом при искусственном свете.
2. Изучить влияние на спермиев температурного фактора.
2.1. Рассмотреть каплю спермы под микроскопом при температуре 40 градусов.
2.3. Рассмотреть каплю спермы под микроскопом при температуре 48 градусов.
3. Изучить влияние осмотического давления на спермиев в следующих вариантах разбавления.
3.1. К капле спермы добавить 2-3 капли 1%- ного NaCl.
3.2. К капле спермы добавить 2-3 капли 3%- ного NaCl.
3.3. К капле спермы добавить 2-3 капли дистиллированной воды.
4. Изучить влияние антисептиков на спермиев
4.1. К капле спермы добавить 2 – 3 капли 3%- ного раствора NaCl.
4.2. Вокруг капли спермы нанести настойку йода в виде кольца и не покрывать покровным стеклом.
4.3. Рядом с каплей спермы на предметном стекле поместить каплю креолина.
4.4 Каплю спермы набрать стеклянной пипеткой, обработанной 70%ным этиловым спиртом.
4.5. Каплю спермы набрать стеклянной палочкой, обработанной 96% этиловым спиртом
5. Сделать вывод об активности спермиев при воздействии на них всех исследуемых факторов.
3. Результаты исследований .
3.1. Влияние света на спермиев.
В ходе проведения работы мы получили следующие результаты.
Жизнеспособность спермиев лучше всего сохраняется при ослабленном, рассеянном свете. Как естественный сильный свет (прямые солнечные лучи),так и искусственный более или менее быстро убивает спермиев в течение 20-40 минут (табл.1). Причиной гибели так же могло быть побочное тепловое действие света.
Как действуют на жизнеспособность сперматозоидов соли тяжелых металлов
Морфология и жизнеспособность сперматозоидов
Анализ морфологии сперматозоидов предоставляет важные сведения о качестве сперматогенеза и потенциале фертильности. Многие нарушения структуры сперматозоидов связаны с бесплодием. Точная морфологическая характеристика образца спермы — важный компонент анализа. В настоящее время применяют многочисленные системы категоризации спермы по морфологии. Недостаток многих из них заключается в субъективной интерпретации отклонений, варьирующей у разных исследователей. В более новых методах предприняты попытки стандартизации интерпретаций.
В 1986 г. Kruger и соавторы предложили строгий критерий классификации морфологии спермы. В эту систему включены объективные параметры отдельных компонентов сперматозоидов (Тайгербергские критерии или строгие критерии Крюгера). Согласно этой системе, сперматозоид считают нормальным, если он обладает следующими признаками:
• размеры головки составляют 5-6 мкм в длину и 2,5-3,5 мкм в ширину;
• акросомальное окрашивание охватывает 40-70% внешней части головки сперматозоида;
• длина среднего отдела в 1,5 раза превышает длину головки, а ширина его составляет менее 1 мкм;
• хвост составляет приблизительно 45 мкм в длину, однородной структуры, несвернутый и без перегибов;
• цитоплазматические капли по размеру не превышают половины головки сперматозоида и встречаются только в среднем отделе.
Данная классификационная схема считает промежуточные формы аномальными.
У мужчин с концентрацией спермы более 20 млн/мл и подвижностью более 30% показатели оплодотворений при ЭКО составляли 91% при количестве нормальных сперматозоидов по строгому критерию Крюгера более 14%; при количестве нормальных сперматозоидов менее 14% показатели составляли 37%. Данное исследование выявило рекомендуемое для нормальной морфологии значение — 15% или более.
В 1992 г. ВОЗ утвердила систему оценок Тайгерберга, основанную на строгой характеристике отдельных компонентов сперматозоида. Данная система рекомендует считать сперматозоид нормальным, если он обладает следующими признаками:
• длина головки составляет 4-5,5 мкм, ширина 2,5-3,5 мкм;
• акросомальное окрашивание охватывает 40-70% внешней поверхности головки;
• отсутствуют дефекты шейки, среднего отдела и хвоста;
• размер цитоплазматических капель не превышает трети размера головки.
Хотя эти параметры на первый взгляд очень похожи на критерий Крюгера, несколько смягченные стандарты увеличивают рекомендуемое значение нормальной морфологии до 30%. Выбор оценочной системы варьирует в разных лабораториях.
Жизнеспособность сперматозоидов
Жизнеспособность тестируют проверкой способности мембраны сперматозоида не пропускать красители или другие вещества. Этот тест проводят только при показателе подвижности менее 40%, так как процент жизнеспособных сперматозоидов обычно немного превышает процент подвижных сперматозоидов.
Для определения жизнеспособности сперматозоидов обычно применяют окрашивание в смеси эозина и нигрозина. Интактные клетки не пропускают краситель эозин (красный), а нежизнеспособные клетки окрашиваются в красный цвет. Нигрозин функционирует как контрастный краситель, визуализирующий неокрашенные живые клетки. Равное количество разжиженной спермы и красителя (эозин + нигрозин) смешивают на чистом и сухом предметном стекле микроскопа. Общее количество неокрасившихся сперматозоидов отмечают в качестве процента жизнеспособных сперматозоидов в образце.
Другим методом оценки жизнеспособности сперматозоидов служит тест гипоосмотического набухания. Исследование основано на способности живых сперматозоидов выдерживать умеренное гипоосмотическое давление, что доказано контролируемым набуханием. Мертвые сперматозоиды не набухают при гипоосмотических условиях, тогда как у жизнеспособных происходит характерное закручивание хвоста.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Движение спермы по женским половым путям. Длительность жизни сперматозоидов
Сперматозоиды активно перемещаются из влагалища через цервикальный канал и полость матки к ампуле фаллопиевой трубы, где и происходит оплодотворение. Во влагалище женщины эякулят достигает наружного отверстия цервикального канала, где среда обладает кислой реакцией за счет молочной кислоты, являясь агрессивной по отношению к сперматозоидам. Щелочная среда эякулята предохраняет сперматозоиды от разрушения в кислой среде.
Такого рода защита, однако, бывает временной, и большинство сперматозоидов сохраняют подвижность во влагалище в течение всего нескольких часов. Иными словами, влагалище женщины ни в коем случае не выступает в качестве резервуара спермы, и его роль в транспортировке спермы сводится, в лучшем случае, к роли проводника. Во влагалище происходит существенная потеря сперматозоидов; их доля, проходящая через шеечную слизь in vivo, неизвестна.
Сперматозоиды проникают в цервикальный канал за счет градиента внутривлагалищного давления, возникающего во время женского оргазма, в сочетании с нормальной подвижностью сперматозоидов. Скорость миграции сперматозоидов по цервикальному каналу, полагается, зависит в какой-то степени от их концентрации, подвижности и морфологических особенностей и модулируется физиологическими и биохимическими характеристиками цервикальной слизи. Изменение состава цервикальной слизи в середине менструального цикла также оказывает влияние на прохождение спермы.
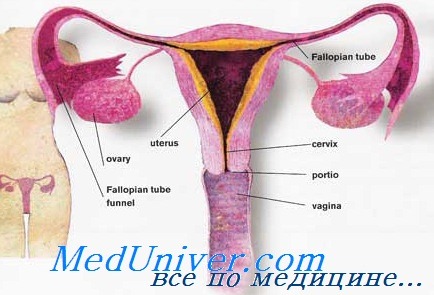
Во время овуляции проникновение сперматозоидов в слизь и их продвижение вперед осуществляется наиболее эффективно и направленно. Во время овуляции молекулы муцина располагаются параллельно друг другу, направляя сперматозоиды к матке и цервикальным криптам, где они могут сохраняться.
До сих пор неясно, может ли репродуктивный тракт женщины выполнять функции резервуара спермы, как это бывает у остальных млекопитающих. Тем не менее показано, что высвобождение сперматозоидов из цервикальных крипт может происходить в течение нескольких дней. У небольшого процента женщин подвижные сперматозоиды, не обнаруживаясь в цервикальной слизи, встречаются в полости матки. Матка, по-видимому, выступает в качестве канала для транспортировки сперматозоидов. Продвижение сперматозоидов от шейки к маточно-трубному соустью главным образом происходит благодаря сократительной активности миометрия, движениям ресничек клеток эндометрия и собственной подвижности сперматозоидов, хотя последняя, как оказалось, не столь важна.
Человеческий эндометрий подготавливается к овуляции, синтезируя уникальный секрет в просвет матки. Он характеризуется протеиновым и ионным составом, а также объемом, отличными от таковых в других стадиях цикла. Этот секрет предназначен для поддержания сперматозоидной взвеси и сохранения жизнеспособности сперматозоидов в процессе их передвижения, а также способствует удалению оболочки с поверхности сперматозоидов, что является одним из этапов капацитации. Кроме того, в нем содержатся макрофаги, фагоцитирующие мертвые и нежизнеспособные сперматозоиды. У мышей, например, это важнейший механизм удаления сперматозоидов из матки.
Прохождение сперматозоидов из полости матки в фаллопиевы трубы регулируется маточно-трубными соустьями. Эти структуры препятствуют проникновению неподвижных сперматозоидов, выступая таким образом в качестве барьера. Перешеек функционирует как резервуар спермы, и лишь ее небольшое количество в каждый отдельный момент проходит по маточной трубе к месту оплодотворения. Ампула маточной трубы и служит таким местом: здесь подвижные сперматозоиды обнаруживают в течение 85 ч после полового сношения. Передвижение сперматозоидов по маточным трубам происходит за счет сочетания их подвижности, тока жидкости и сократительных движений стенок труб.
Регуляция сперматогенеза. Факторы влияющие на формирование сперматозоидов
Процесс сперматогенеза регулируется различными внутренними и внешними механизмами.
Внутренняя регуляция сперматогенеза. Клетки Лейдига секретируют гормон (тестостерон), нейротрансмиттеры (нейроэндокринные субстанции) и факторы роста, которые попадают в соседние клетки Лейдига, кровеносные сосуды, собственную пластинку семенного канальца и клетки Сертоли. Они участвуют в обеспечении трофики клеток Сертоли и клеток периканаликулярной ткани, сократительной способности миофибробластов, регулируя таким образом перистальтические движения семенных канальцев и транспорт сперматозоидов.
Кроме того, клетки Лейдига участвуют в регуляции кровотока в межканальцевом микрососудистом русле. В дополнение к этому клетки Сертоли и сперматогенные клетки поставляют различные факторы роста, участвующие в сложной регуляции клеточных функций и процесса развития сперматогенных клеток. Все вышеописанное составляет независимую интратестикулярную систему регуляции сперматогенеза.
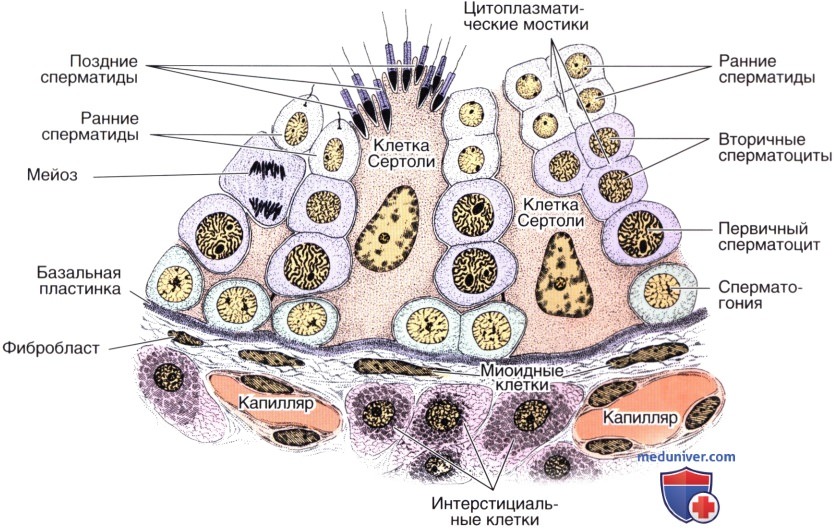
Участок семенного канальца с окружающими его тканями. Сперматогенный эпителий образован двумя клеточными популяциями: клетками сперматогенной линии и поддерживающими клетками, или клетками Сертоли.
Внешняя регуляция сперматогенеза. Локальную регуляцию сперматогенеза контролируют гипоталамус и гипофиз. Импульсная секреция ГнРГ гипоталамусом инициирует высвобождение ЛГ гипофизом. В ответ на воздействие ЛГ клетки Лейдига секретируют тестостерон. Последний не только влияет на процессы сперматогенеза, но и действует по всему организму.
Таким образом, он обеспечивает обратную связь с гипофизом, по механизму которой регулируется секреторная деятельность клеток Лейдига. Стимуляция ФСГ клеток Сертоли необходима для созревания сперматогенных клеток. Полноценный, качественный сперматогенез требует наличия как ФСГ, так и ЛГ. Взаимодействие эндокринных и паракринных влияний определяет функционирование яичка.
Ингибин, секретируемый клетками Сертоли, участвует в механизме обратной связи с гипофизом. Подобные экстратестикулярные влияния важны для регуляции функций яичек; иначе говоря, рост и дифференцировка тестикулярных сперматогенных клеток регулируются за счет комплексного взаимодействия как соматических, так и терминальных элементов.
Влияние иммунитета на яичко. Сперматозоиды, сперматоциты в поздней пахитене, а также сперматиды экспрессируют специфические антигены. До периода полового созревания эти антигены не образуются, поэтому иммунная толерантность в это время не развивается. Гематотестикулярный барьер формируется, как только начинают образовываться аутоантигены. Яичко является зоной иммунной толерантности (т.е. пересаженная сюда чужеродная ткань может какое-то время сохранять жизнеспособность без иммунного отторжения).
Иммунный надзор присутствует в яичке и придатке яичка, что свидетельствует об активной иммунорегуляции, предотвращающей развитие аутоиммунной реакции.
Возможны нарушения как пролиферации и дифференцировки сперматогенных клеток, так и интра- и экстратестикулярных механизмов регуляции. Эти нарушения могут развиваться вследствие влияния факторов окружающей среды или болезней, прямо или косвенно вмешивающихся в процесс сперматогенеза. К снижению или прекращению сперматогенеза могут приводить продукты питания, лекарственные средства, гормоны и их метаболиты, повышение температуры мошонки, токсичные вещества, рентгеновское облучение.
Видео сперматогенез и его регуляция
Редактор: Искандер Милевски. Дата обновления публикации: 24.12.2021
Читайте также:
