Как рассчитать эффективный радиус атома металла
Обновлено: 05.07.2024
Так как электронное строение элементов изменяется периодически, то соответственно периодически изменяются и свойства элементов, определяемые их электронным строением, такие, как атомный радиус, энергия ионизации, энергия сродства к электрону, электроотрицательность.
Атомный радиус. Атомы и ионы не имеют строго определенных границ вследствие волновой природы электронов. Поэтому введены два условных понятия атомных радиусов:
Эффективный атомный радиус определяется экспериментально (из спектрографических данных) как ½ расстояния между центрами ядер двух соседних атомов в молекуле или кристалле.
Орбитальный атомный радиус – это расстояние от ядра атома до наиболее удаленного максимума электронной плотности.
Атомные радиусы элементов периодически изменяются в зависимости от величины заряда ядра (рис. 2.5):
1. В периоде атомные радиусы с ростом порядкового номера уменьшаются (от щелочного металла к инертному газу). Атом Na имеет радиус 1,8, Mg – 1,6, Сl – 0,73.Объяснить это можно тем, что с увеличением заряда ядра увеличивается сила кулоновского притяжения электронов к ядру, которая превалирует над силами взаимного отталкивания электронов.
Наибольшее уменьшение радиусов наблюдается у элементов малых периодов, у которых происходит заполнение электронами внешнего энергетического уровня. В больших периодах у d – и f – элементов наблюдается более плавное уменьшение радиусов при увеличении заряда ядра атома. Это уменьшение называется соответственно d – и f – сжатием.
2. В пределах каждой подгруппы элементов радиусы, как правило, увеличиваются при увеличении номера периода (или Z), так как возрастает число энергетических уровней.
У элементов III группы наблюдается исключение из этого правила – радиус атома галлия Ga (1,22) меньше радиуса атома алюминия Al (1,26). Причина кроется в том, что в 4-м периоде между s – и p – элементами расположены десять d – элементов, поэтому свойства галлия не укладываются в ряд B – Al – Ga, зато для триады B – Al – Sс атомные радиусы возрастают в соответствии с общим правилом, хотя B и Al p – элементы, а Sc d – элемент. Однако увеличение радиусов при том же возрастании заряда ядра в подгруппах s – и p – элементов больше такового в подгруппах d – элементов, например в V группе1:
p – элементы d - элементы
As……….33 0,148 V………..23 0,134
Sb……….51 0,161 Nb……….41 0,145
Bi……….83 0,182 Ta……….73 0,146
Как видно, в подгруппе мышьяка при переходе от As к Bi атомный радиус увеличивается на 0,034 нм, а в подгруппе ванадия при переходе от V к Ta – всего на 0,012 нм.
Существенно подчеркнуть еще одну особенность для подгрупп d – элементов. Увеличение атомных радиусов в подгруппах d – элементов в основном отвечает переходу от элемента 4-го к элементу 5-го периода. Соответствующие же радиусы d – элементов 5-го и 6-го периодов данной подгруппы примерно одинаковы. Это объясняется тем, что увеличение радиусов за счет возрастания числа электронных слоев при переходе от 5-го к 6-му периоду компенсируется f – сжатием2, вызванным заполнением 4f – подуровня у f – элементов 6-го периода. При аналогичных электронных конфигурациях внешних слоев и примерно одинаковых размерах атомов для d – элементов 5-го и 6-го периодов данной подгруппы характерна особая близость свойств.
Радиусы ионов отличаются от радиусов атомов, т. к. они или лишились нескольких электронов, или присоединили последние. Поэтому радиусы положительно заряженных ионов меньше, а радиусы отрицательно заряженных ионов больше радиусов соответствующих атомов.
Энергия ионизации. Энергия, необходимая для отрыва электрона от невозбужденного атома, называется первой энергией ионизации I1:
В результате ионизации атомы превращаются в положительно заряженные ионы. Энергию ионизации выражают либо в кДж/моль, либо в эВ/атом (1эВ = 1,6∙10 -19 Дж).
Энергия ионизации характеризует восстановительную способность элемента или его металлические свойства. Первая энергия ионизации (рис. 2.6) определяется электронным строением элементов и ее изменение имеет периодический характер:
1. Первая энергия ионизации и восстановительные свойства элементов в периоде возрастают слева направо. Наименьшие значения энергии ионизации имеют щелочные элементы, находящиеся в начале периода, наибольшими значениями энергии ионизации характеризуются благородные газы, находящиеся в конце периода, что обусловлено возрастанием заряда ядра и уменьшением размеров атомов.
Наряду с резко выраженными максимумами и минимумами на кривой энергии ионизации наблюдаются слабо выраженные, что можно объяснить с помощью двух взаимосвязанных представлений: об экранировании заряда ядра и о проникновении электронов к ядру.
Эффект экранирования заряда ядра обусловлен наличием в атоме между данным электроном и ядром других электронов, которые экранируют, ослабляют воздействие на этот электрон положительного заряда ядра и тем самым ослабляют связь его с ядром. Понятно, что экранирование возрастает с увеличением внутренних электронных слоев.
Эффект проникновения электронов к ядру обусловлен тем, что, согласно квантовой механике, все электроны (даже внешние) определенное время находятся в области, близкой к ядру. Поэтому можно сказать, что внешние электроны проникают к ядру через слои внутренних электронов.
Концентрация электронной плотности у ядра (степень проникновения электронов) при одном и том же главном квантовом числе наибольшая для s - электрона, меньше – для р – электрона, еще меньше для d – электрона и т. д. Например, при n = 3 степень проникновения убывает в последовательности 3s>3p>3d.
Понятно, что эффект проникновения увеличивает прочность связи внешних электронов с ядром. Этим, в частности, определяется порядок заполнения в многоэлектронных атомах s - , p - , d - , f - …орбиталей при данном n.
Можно также сделать вывод, что вследствие более глубокого проникновения s – электроны в большей степени экранируют ядро, чем р – электроны, а последние – сильнее, чем d – электроны, и т. д.
Влияние на прочность связи электронов с ядром оказывает также взаимное отталкивание электронов одного и того же уровня и в особенности одной и той же орбитали.
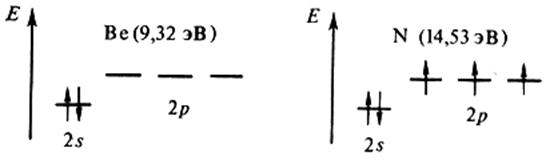 |
Воспользуемся сказанным для объяснения рис. 2.6. Как видно, внутренние максимумы на кривой первой энергии ионизации соответствуют элементам, у которых внешние уровни завершены – (Be, Mg, Zn) или заполнены наполовину – p 3 (N,P,As), что свидетельствует о повышенной устойчивости подобных конфигураций:
Следующий непосредственно затем минимум отвечает появлению электрона в новом, более далеком от ядра р – подуровне (B, Al, Ga), экранированном от ядра конфигурацией s 2 , либо взаимным отталкиванием двух электронов одной и той же р – орбитали (O, S, Se):
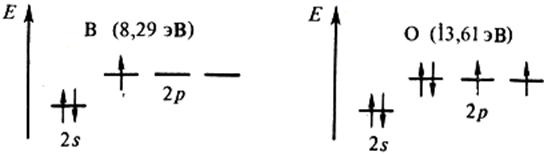
В соответствии с особенностями электронных структур у элементов d(f) – семейства энергии ионизации близки.
2. В главных подгруппах с увеличением порядкового номера энергия ионизации уменьшается, что обусловлено увеличением размеров атомов и усиливающимся (по мере увеличения числа электронных слоев) экранированием заряда ядра электронами, предшествующими внешним электронам.
3. В подгруппах d – элементов при переходе от 3d – к 5d – элементу энергии ионизации увеличиваются, что видно, например, на элементах V группы.
| р – элементы | d – элементы | ||
| Z | I1, эВ | Z | I1, эВ |
| As………. | 9,82 | V………. | 6,74 |
| Sb………. | 8,64 | Nb……….. | 6,88 |
| Bi………. | 7,29 | Ta………. | 7,89 |
Повышение энергии ионизации в подгруппах d – элементов можно объяснить эффектом проникновения электронов к ядру. Так, если у d – элементов 4-го периода 4s – электроны попадают под экран 3d – электронов, то у элементов 6-го периода 6s – электроны попадают уже под двойной экран 5d – и 4f – электронов. Отсюда при переходе от 4-го к 6-му периоду прочность связи внешних s – электронов с ядрам повышается, а поэтому и энергия ионизации d – элементов возрастает.
Кроме первой энергии ионизации, элементы с многоэлектронными атомами могут характеризоваться второй I2, третьей I3 и более высокой энергией ионизации, поскольку можно удалить 1, 2, 3… - электрона из атома.
Энергия ионизации увеличивается в следующем порядке:I1< I2< I3n , т. к. удаление электрона от электронейтрального атома происходит легче, чем от иона.
Энергия сродства к электрону(сродство к электрону). Энергетический эффект присоединения электрона к нейтральному атому называется сродством к электрону E. Сродство к электрону выражается в кДж/моль или эВ/атом. Сродство к электрону характеризует окислительные или неметаллические свойства атома элемента. Принимая электроны, атом превращается в отрицательно заряженный ион по схеме:
Надежные значения сродства к электрону найдены лишь для небольшого числа элементов. Понятно, что сродство к электрону зависит от электронной конфигурации атома, и в характере его изменения с увеличением порядкового номера элемента наблюдается отчетливо выраженная периодичность (рис. 2.7). Сравнение с изменением энергии ионизации показывает, что максимумы и минимумы на кривой сродства к электрону смещены по сравнению с кривой энергии ионизации на один элемент влево.
В периодах слева направо сродство к электрону и окислительные свойства элементов возрастают (исключение для N и P). В группах сверху вниз сродство к электрону, как правило, уменьшается.
Как следует из данных табл. 2.3 и рис. 2.7, наибольшим сродством к электрону обладают р – элементы VII группы. Наименьшее и даже отрицательное сродство к электрону имеют атомы с конфигурацией s 2 (Be, Mg, Zn) и s 2 p 6 (Ne, Ar, Kr) или с наполовину заполненным р – подуровнем (N, P, As). Это служит дополнительным доказательством повышенной устойчивости указанных электронных конфигураций.
Выделением энергии сопровождается присоединение одного электрона к атомам кислорода, серы, углерода и некоторым другим. Таким образом, для указанных элементов силы притяжения к ядру дополнительного электрона оказываются большими, чем силы отталкивания между дополнительным электроном и электронной оболочкой атома.
Сродство к электрону (Е) атомов некоторых элементов
| Элемент | Е, эВ | Элемент | Е, эВ | Элемент | Е,эВ |
| H | 0,754 | N | -0,21 | Al | 0,52 |
| He | -0,22 | O | 1,467 | Cl | 3,61 |
| Li | 0,59 | F | 3,45 | K | 0,52 |
| Be | -0,19 | Ne | -0,57 | Br | 3,54 |
| B | 0,3 | Na | 0,34 | I | 3,29 |
| C | 1,27 | Mg | -0,22 |
Присоединение последующих электронов, т. е. двух, трех электронов и более к атому, согласно квантово-механическим расчетам, невозможно. Поэтому одноатомные (простые) многозарядные анионы (О 2- , S 2- , N 3- ) в свободном состоянии существовать не могут.

Электроотрицательность.Понятие электроотрицательности (ЭО) позволяет оценить способность атома данного элемента к оттягиванию на себя электронной плотности по сравнению с другими элементами соединения. Очевидно, что эта способность зависит от энергии ионизации атома и его сродства к электрону. Согласно одному из определений (Малликен), электроотрицательность атома ЭО может быть выражена как полусумма его энергии ионизации и сродства к электрону: . Имеется около 20 шкал электроотрицательностей, в основу расчета значений которых положены разные свойства вещества. Значения электроотрицательностей разных шкал отличаются, но относительное расположение элементов в ряду электроотрицательностей примерно одинаково. В шкале относительных электроотрицательностей (ОЭО) по Полингу (рис. 2.8) электроотрицательность фтора принята равной 4,0.
Как видно из приведенных данных, в периодах наблюдается общая тенденция роста величины электроотрицательности, а в подгруппах - ее падения. Наименьшими значениями электроотрицательности характеризуются s – элементы I группы, а наибольшими – р – элементы VII группы.
Типы химической связи в кристаллах
Деление химической связи на виды носит условный характер.
Для металлической связи, обусловленной притяжением электронов и ионов металлов, характерны некоторые признаки ковалентной, если принять во внимание перекрывание атомных орбиталей атомов. В образовании водородной связи, помимо электростатического взаимодействия, не последнюю роль играет донорно-акцепторный характер взаимодействия.
Резкую границу между ионной и ковалентной полярной связью также провести невозможно. Отнести любую связь металл-неметалл к ионному типу нельзя. Принято считать ионной связь между атомами, разность электроотрицательности которых больше или равна 2 (по шкале Полинга). Например, в оксиде натрия связь Na2O (3,44 – 0,93 = 2,51) связь ионная, а в бромиде магния MgBr ковалентная полярная связь (2,96 – 1,31 = 1,65).
В реальных веществах все типы химической связи в чистом виде не встречаются. У большинства соединений тип связи носит промежуточный характер. Это возможно, так как природа химической связи едина – это электростатическое взаимодействие электронов и ядер внутри и между атомами, сближенными на расстояние, когда возникает эффективное перекрывание электронных оболочек.
Поэтому возможен непрерывный переход между всеми предельными случаями: ионной, ковалентной, металлической и остаточной связью. Наглядно переход может быть представлен в виде тетраэдра, в вершинах которого помещены крайние представители, по ребрам переходы между двумя типами, а на гранях и внутри объема тетраэдра – сложные смешанные типы связи.
Эффективные радиусы атомов и ионов
Под эффективными радиусами атомов и ионов понимают радиусы действия сфер атомов или ионов, то есть минимальные расстояния, на которых центры сфер атомов или ионов могут приблизиться к поверхности соседних атомов.
Для определения эффективного радиуса атома или иона структуру кристалла представляют в виде соприкасающихся шаров, расстояние между которыми равно сумме их радиусов. В зависимости от типа химической связи между структурными единицами кристалла различают: металлические радиусы, ионные радиусы, ковалентные радиусы и Ван-дер-ваальсовы радиусы.
Металлические радиусы
Определяется как половина расстояния между соседними атомами, полученного в результате рентгеноструктурного анализа:
Ионные радиусы
Для вычисления радиусов ионов исходят из предположения, что при достаточно большой разнице в размерах катионов и анионов большие по размеру анионы будут соприкасаться, а меньшие по размеру катионы будут располагаться в пустотах между анионами, тогда радиус аниона будет равен: ,
радиус катиона равен: .
Ковалентные радиусы
Ковалентные радиусы определяются как половина межатомного расстояния (длины связи): .
Кроме того, при расчете ковалентного радиуса учитывается способность некоторых элементов образовывать кратные связи, уменьшающие расстояния между атомами и тип гибридизации центрального атома.
Ван-дер-ваальсовы радиусы рассчитываются для атомов, которые связаны друг с другом только силами межмолекулярного взаимодействия. Рассчитываются как половина расстояния между центрами атомов: .
Поскольку методики расчета атомных и ионных радиусов различны, существует большое число таблиц радиусов.
Ионные кристаллы
Объединение катионов и анионов в кристалл осуществляется благодаря кулоновскому притяжению электрических зарядов. В молекуле заряды взаимодействуют с силой . Величина R – расстояние между двумя ионами. Если это расстояние будет бесконечно далеко, то сила равна нулю. На конечном расстоянии сила взаимодействия двух противоположно заряженных ионов отрицательна, что соответствует притяжению, ионы стремятся сблизиться на минимально допустимое расстояние, которое соответствует устойчивому связанному состоянию. Сила взаимодействия двух одинаково заряженных ионов положительна, что соответствует отталкиванию. Ионы стремятся разлететься и на любом расстоянии не образуют устойчивого соединения. Таким образом, энергия образования кристалла должна быть отрицательной. Такое условие реализуется при образовании ионного кристалла.
В ионных кристаллах нет молекул, поэтому не существует границ между структурными единицами. Ионы можно представить как заряженные шары, силовые поля которых равномерно распределяются во всех направлениях в пространстве. Поэтому каждый ион может притягивать к себе ионы противоположного знака в любом направлении, поэтому ионная связь не обладает направленностью.
Взаимодействие двух ионов противоположного знака не может привести к полной взаимной компенсации их силовых полей. В силу этого у них сохраняется способность притягивать ионы противоположного знака и по другим направлениям. Следовательно, ионная связь не является насыщенной.
Катионы стремятся себя окружить как можно большим числом анионов так, что кулоновское отталкивание ионов одного знака друг от друга компенсируется взаимным кулоновским притяжением катионов и анионов. Поэтому для структур с ионным типом химической связи характерны высокие координационные числа и плотнейшие шаровые упаковки. Симметрия ионных кристаллов обычно высокая.
Кристаллические вещества с ионным типом химической связи характеризуют диэлектрические свойства, хрупкость, средние значения твердости и плотности, низкая тепло- и электропроводность.
Энергия кристаллической решетки ионного кристалла – это энергия взаимодействия между всеми её ионами, она равна по величине и обратна по знаку энергии, которую необходимо затратить, чтобы разрушить кристаллическую структуру, то есть развести ионы на бесконечные расстояния.
| Рис. 2.2. Схема структуры хлорида натрия |
Энергия решетки равна работе, которая совершается при сведении ионов из бесконечности в кристаллическую структуру:
Расчет энергии решетки рассмотрим на примере. В ионном кристалле со структурой типа NaCl каждый ион окружен шестью ионами противоположного знака на расстоянии , затем окружен 12 ионами того же знака расстоянии . Затем - 8 ионами противоположного знака на расстоянии , затем - 6 ионами того знака на расстоянии , затем - 24 ионами противоположного знака на расстоянии и так далее. Кулоновское взаимодействие данного иона со всем его окружением будет определяться суммой вида:
Большая Энциклопедия Нефти и Газа
Эффективные радиусы атомов и ионов в соединениях определяют по разности межъядерного расстояния d и известного эффективного радиуса одной из частиц. Так, разными методами установлено, что радиус иона F составляет 0 133 нм. Расшифровка же рентгенограмм кристалла NaF дает значение d - 0 231 нм. Следовательно, радиус иона Na равен 0 098 нм. [1]
Эффективные радиусы атомов и ионов в соединениях определяют по разности межъядерного расстояния и известного эффективного радиуса одной из частиц. Так, разными методами установлено, что ионный радиус иона F составляет 0 133 нм. С другой стороны, расшифровка рентгенограмм кристалла NaF дает значение d 0 231 нм. Следовательно, радиус иона Na равен 0 098 нм. [3]
Эффективный радиус атома в направлении, которое образует лишь небольшой угол с направлением ковалентной связи данного атома, меньше вандерваальсова радиуса ов противоположном направлении от данной связи. Так, в молекуле ССЦ атомы хлора находятся на расстоянии только 290 пм; и все же свойства данного вещества свидетельствуют о том, что в этом случае не наблюдается значительного напряжения, хотя данное расстояние много ( меньше вандерваальсова диаметра, равного 360 пм. [4]
Эффективный радиус атома в направлении, составляющем небольшой угод с направлением образуемой атомом ковалентной связи, меньше ван-дер-ваальсова радиуса в направлении, противоположном к связи. [6]
Эффективные радиусы атомов и ионов в соединениях определяют по разности межъядерного расстояния и известного эффективного радиуса одной из частиц. Так, разными методами установлено, что ионный радиус иона F составляет 0 133 нм. С другой стороны, расшифровка рентгенограмм кристалла NaF дает значение d - 0 231 нм. Следовательно, радиус иона Na равен 0 098 нм. [8]
Эффективным радиусом атома мы считаем радиус шара, касающегося другого в элементарной ячейке кристалла. [9]
Размер эффективного радиуса атомов и ионов зависит также от характерной для данной структуры координационного числа ( к. [10]
Величина эффективного радиуса атома в металле зависит от числа соседей атома в кристаллической структуре. Это вытекает из рассмотрения большого количества данных по структурам элементов и интерметаллических соединений, в особенности тех элементов, которые способны кристаллизоваться в нескольких модификациях ( ср. Отсюда следует, что значения величин эффективных радиусов металлов, приведенных в табл. 13, 14 и 15, сопоставимы лишь в пределах каждой таблицы. [11]
Уменьшение эффективного радиуса атома платины в ряду изученных соединений авторы [262] приписывают увеличению кратности связи Pt-С вследствие образования я-дативной связи. На основании всего сказанного сделан вывод, что трансвлияние углеродного донорного атома зависит от я-дативной составляющей в связи Pt-С. [13]
Под эффективным радиусом атома понимается гп ловина расстояния между ближайшими Друг к другу ато-маии в решетке. [14]
Под эффективным радиусом атома или иона понимается радиус сферы его действия, причем атом ( ион) считается несжимаемым шаром. Используя планетарную модель атома, атом представляют как ядро, вокруг которого по орбитам вращаются электроны. Последовательность элементов в периодической системе Менделеева соответствует последовательности заполнения электронных оболочек. Эффективный радиус иона зависит от заполненности электронных оболочек, но он не равен радиусу наружной орбиты. Для определения эффективного радиуса представляют атомы ( ионы) в структуре кристалла как соприкасающиеся жесткие шары, так что расстояние между их центрами равно сумме их радиусов. Атомные и ионные радиусы определены экспериментально по рентгеновским измерениям межатомных расстояний и вычислены теоретически на основе квантовомеханических представлений. [15]
Одной из численных характеристик атома или иона, предопределяющих их свойства, является эффективный радиус атома или иона. Не следует думать, что атомы или ионы в молекулах или кристаллах резко отграничены друг от друга. Тем не менее во многих случаях, в частности при сочетании в кристаллическую решетку, атомы ионы ведут себя так, как если бы они были шариками определенного размера. [31]
Одной из численных характеристик атома или иона, предопределяющих их свойства, является эффективный радиус атома или иона ( см. таблицу, стр. Не следует думать, что атомы или ионы в молекулах или кристаллах резко отграничены друг от друга. Тем не менее во многих случаях, в частности при сочетании в кристаллическую решетку, атомы и ионы ведут себя так, как если бы они были жесткими шариками определенного размера. [32]
Меж-ядерное расстояние для катиона и кислорода принято равным сумме кристаллографического радиуса катиона и некоторого характерного для атома кислорода радиуса. Аналогично, расстояние между центром аниона и протоном приравнено сумме кристаллографического радиуса аниона и эффективного радиуса атома водорода . Соответствующая обработка данных показала, что характерный радиус для атома кислорода ( 0 68 А) в пределах погрешности неотличим от его ковалентного радиуса ( 0 66А), а эффективный радиус атома водорода равен нулю. [33]
Наибольшее уменьшение характерно для s - и р-элементов. В больших периодах для d - и / - элементов наблюдается более плавное уменьшение эффективных радиусов, называемое соответственно d - и [ - сжатием. Эффективные радиусы атомов благородных газов , которыми заканчиваются периоды Системы. Значения эффективных радиусов благородных газов ( см. табл. 5) получены из межъядерных расстояний в кристаллах этих веществ, существующих при низких температурах. А в кристаллах благородных газов действуют слабые силы Ван-дер - Вааль-са в отличие, например, от молекул галогенов, в которых имеются прочные ковалентные связи. [34]
Но такое допущение корректно лишь в предельном случае, когда два сорта атомов могут взаимозаменяться, не внося при этом никаких возмущений в положения атомов, т.е. когда атомы имеют строго одинаковые размеры. Например, для сплавов Си - Аи, хотя эффективный радиус атомов в сплавах не обязательно совпадает с их радиусом в одноатомных кристаллах, разница между постоя н-ными решетки Си и Аи примерно в 10 % ( 3 65 и 4 07 А) предполагает значительную разницу эффективных размеров атомов в сплавах. [35]
Соединения, в которых бром и иод электроотрицательны. Строчки III и IV выражают основные характеристики строения их атомов: распределение электронов по оболочкам или уровням и эффективные радиусы атомов . Общее в свойствах у галогенов; зависит от одинакового числа электронов ( 7) во внешней оболочке, а ( индивидуальное - главным образом от нарастающей с атомным номером удаленности этой оболочки от ядра ( от атомного радиуса), наиболее непосредственным результатом чего является ослабление связи внешних электронов с атомом. [36]
Меж-ядерное расстояние для катиона и кислорода принято равным сумме кристаллографического радиуса катиона и некоторого характерного для атома кислорода радиуса. Аналогично, расстояние между центром аниона и протоном приравнено сумме кристаллографического радиуса аниона и эффективного радиуса атома водорода. Соответствующая обработка данных показала, что характерный радиус для атома кислорода ( 0 68 А) в пределах погрешности неотличим от его ковалентного радиуса ( 0 66А), а эффективный радиус атома водорода равен нулю. [37]
Пенкали Очерки кристаллохимии в значительной степени ограничена материалом классической кристаллохимии и не содержит в должном объеме обобщений по, последним достижениям структурных исследований. Следует отметить, чте представления о радиусах атомов ( ионов) в современной кристаллохимии не имеют существенного значения. Им на смену пришла концепция координационных связей, их анизотропии и индивидуальности в различных кристаллических структурах. Разумное использование концепции эффективных радиусов атомов , ионов, молекул в основном для приближенных построений может быть перспективным только в том случае, когда исследователь четко понимает всю искусственность применения изотропной концепции радиусов в анизотропном кристаллическом пространстве, понимает все ее недостатки и не возводит ее в абсолют. Пенкаля в данной книге именно в таком смысле гольдшмидтовская концепция эффективных радиусов себя не дискредитировала: с незначительными уточнениями она и теперь обычно используется в кристаллохимии. [38]
Если кристаллическая решетка построена из ионов, то R и г - эффективные радиусы ионов. Ионные эффективные радиусы не равны радиусам ионов R1 и гг, так как ионы, находясь под действием сил притяжения и отталкивания, не соприкасаются друг с другом и находятся на некотором расстоянии один от другого. Однако с некоторым приближением можно считать, что эффективные радиусы пропорциональны истинным, и это может служить для объяснения некоторых свойств ионов. Когда кристалл состоит из нейтральных атомов, подобным образом можно определить эффективные радиусы атомов . [39]
Результаты исследований многих физиков свидетельствуют о том, что эта картина правильна лишь приближенно. Электрон не движется по некоторой определенной орбите, а совершает в известной мере неупорядоченное движение - иногда он оказывается очень близко к ядру, иногда значительно удаляется от него. Более того, он движется главным образом в направлении к ядру или от него и - перемещается во всех направлениях относительно ядра, а не находится в одной плоскости. Хотя он и не остается точно на расстоянии 53 пм от ядра, все же это расстояние определяет его наиболее вероятное положение относительно ядра. Благодаря быстрому движению вокруг ядра он эффективно занимает все пространство в радиусе примерно 100 пм от ядра и таким образом предопределяет величину эффективного радиуса атома водорода , равную примерно 100 пм. [40]
Вандерваальсов радиус и ионный радиус данного атома в состоянии отрицательного иона по существу один и тот же. Так, вандерваальсов радиус хлора равен 1 80 А, а ионный радиус хлорид-иона равен 1 81 А. Ковалентные радиусы имеют другой смысл и иное применение. Сумма ковалентных радиусов при одинарной связи для двух атомов равна расстоянию между атомами, когда они связаны одинарной ковалентной связью. Ковалентный радиус атома при одинарной связи можно принять за расстояние от ядра до среднего положения поделенной электронной пары, тогда как вандерваальсов радиус простирается до внешней части области, занятой электронами данного атома, как показано на рис. 6.29. Эффективный радиус атома в направлении, которое образует небольшой угол с направлением ковалентной связи, образованной данным атомом, меньше вандерваальсова радиуса в противоположном направлении от данной связи. [42]
Первоначально сложилось представление об эффективных радиусах атомов, проявляющихся в их действиях, т.е. в химических соединениях. При этом предполагалось, что атомы представляют собой несжимаемые шары, которые соприкасаются своими поверхностями в соединениях. Наконец, эффективные радиусы, рассчитанные для кристаллов с преимущественно ионной связью, назывались ионными радиусами. Для этого определяли радиус какого-нибудь иона, а затем вычисляли ионные радиусы других элементов из экспериментальных данных по межъядерным расстояниям в кристаллических решетках. Так, с помощью оптических методов, а затем расчетом был определен радиус аниона фтора, равный 0 113 нм. А расстояние между атомами Na и F в решетке NaF было установлено равным 0 231 нм. Отсюда радиус иона Na равен 0 231 - 0 113 0 118 нм. Металлические радиусы получены делением пополам расстояния между центрами двух смежных атомов в кристаллических решетках металлов. Ковалентные радиусы неметаллов также вычислены как половина межъядерного расстояния в молекулах или кристаллах соответствующих простых веществ. Для одного и того же элемента, эффективные радиусы ( ковалентный, ионный, металлический) не совпадают между собой. Наибольшее уменьшение характерно для s - и р-элементов. В больших периодах для d - и / - элементов наблюдается более плавное уменьшение эффективных радиусов, называемое соответственно dr - и / сжатием. Эффективные радиусы атомов благородных газов , которыми заканчиваются периоды системы, значительно больше эффективных радиусов предшествующих им р-элементов. Значения эффективных радиусов благородных газов ( см. табл. 4) получены из межъядерных расстояний в кристаллах этих веществ, существующих при низких температурах. А в кристаллах благородных газов действуют слабые силы Ван-дер - Ваальса в отличие, например, от молекул галогенов, в которых имеются прочные ковалентные связи. [43]
Первоначально сложилось представление об эффективных радиусах атомов, проявляющихся в их действиях, т.е. в химических соединениях. При этом предполагалось, что атомы представляют собой несжимаемые шары, которые соприкасаются своими поверхностями в соединениях. Наконец, эффективные радиусы, рассчитанные для кристаллов с преимущественно ионной связью, назывались ионными радиусами. Для этого определяли радиус какого-нибудь иона, а затем вычисляли ионные радиусы других элементов из экспериментальных данных по межъядерным расстояниям в кристаллических решетках. Так, с помощью оптических методов, а затем расчетом был определен радиус аниона фтора, равный 0 113 нм. А расстояние между атомами Na и F в решетке NaF было установлено равным 0 231 нм. Отсюда радиус иона Na равен 0 231 - 0 113 0 118 нм. Металлические радиусы получены делением пополам расстояния между центрами двух смежных атомов в кристаллических решетках металлов. Ковалентные радиусы неметаллов также вычислены как половина межъядерного расстояния в молекулах или кристаллах соответствующих простых веществ. Для одного и того же элемента эффективные радиусы ( ковалентный, ионный, металлический) не совпадают между собой. Наибольшее уменьшение характерно для s - и р-элементов. В больших периодах для d - и / - элементов наблюдается более плавное уменьшение эффективных радиусов, называемое соответственно d - и / сжатием. Эффективные радиусы атомов благородных газов , которыми заканчиваются периоды системы, значительно больше эффективных радиусов предшествующих им jp - элементов. Значения эффективных радиусов благородных газов ( см. табл. 4) получены из межъядерных расстояний в кристаллах этих веществ, существующих при низких температурах. А в кристаллах благородных газов действуют слабые силы Ван-дер - Ваальса в отличие, например, от молекул галогенов, в которых имеются прочные ковалентные связи. [44]
Величины эффективных радиусов помогают объяснить и предсказать длины связей в других ковалентных соединениях галогенов. Например, если атом хлора образует связь с атомом углерода ( как в четыреххло-ристом углероде СС14), то длину связи С - С1 можно представить суммой ковалентных радиусов атома хлора и атома углерода. Ковалент-ный радиус углерода, определенный в алмазе, равен 0 77 А, поэтому длина связи С - С1 приблизительно будет равна ( 0 77 0 99) 1 76 А. Длина связи углерод - хлор, определенная экспериментально, равна 1 77 А. [1]
Величины эффективных радиусов зависят от типа связи и довольно резко меняются при его изменении. В пределах одного типа связи на величину эффективного радиуса частицы влияют координационное число, структура решетки и химическая природа частиц. Исходя из максимально плотной упаковки, отрицательные ионы, имеющие большие размеры, чем положительные, должны возможно теснее группироваться вокруг последних. Число, показывающее, сколько атомов или ионов окружают каждый данный атом или ион в кристалле, называется координационным числом. [2]
Величины эффективных радиусов зависят от типа связи и довольно резко меняются при изменении типа связи. В пределах же одного типа связи на величину эффективного радиуса частицы несколько влияют координационное число данного типа, структура и химическая природа частиц, окружающих данную частицу. Действительные радиусы ионов всегда несколько меньше эффективных, так как на величине последних всегда сказывается колебательное движение иона. Действительные радиусы атомов всегда больше эффективных, так как при образовании ковалент-ных связей атомы несколько сжимаются. [4]
Величина эффективного радиуса атома в металле зависит от числа соседей атома в кристаллической структуре. Это вытекает из рассмотрения большого количества данных по структурам элементов и интерметаллических соединений, в особенности тех элементов, которые способны кристаллизоваться в нескольких модификациях ( ср. Отсюда следует, что значения величин эффективных радиусов металлов, приведенных в табл. 13, 14 и 15, сопоставимы лишь в пределах каждой таблицы. [5]
Величины эффективных радиусов зависят прежде всего от типа связи в кристалле и довольно резко меняются при его изменении. [7]
Тейлакером [28] величина эффективного радиуса фтора ( 1 12А), невидимому, существенно преувеличена. [9]
Указанные в этой таблице величины эффективных радиусов ионов в водных растворах г рассчитаны методом, предложенным в 1920 г. Максом Борном. Это радиус заряженной сферы, причем энтальпия гидратации равна разности энергии электрического поля для вакуума ( диэлектрическая проницаемость D 1) и однородной среды, имеющей диэлектрическую проницаемость 80 ( макроскопическое значение для воды), и окружающей данную сферу. [10]
Неопределенность связана в основном с экспериментальной погрешностью в величине синглетного эффективного радиуса ros. [11]
Чтобы иметь возможность воспользоваться указанным соотношением, необходимо знать величину эффективного радиуса одного из двух связанных между собой ионов. [12]
Кривые распределения объема пор ( рис. 8) по величинам эффективных радиусов обладают резким максимумом. Величины поверхности пленки ( S) практически равны величине поверхности скелета геля ( S), что свидетельствует об отсутствии в этих образцах мелких пор, плотно заполняющихся в первичном адсорбционном процессе. [13]
Для того чтобы иметь возможность воспользоваться указанным соотношением, необходимо знать величину эффективного радиуса одного из двух связанных между собой ионов. [14]
Применимость соотношения (45.1) или его квантовомеханического аналога связана с некоторыми предположениями о величине эффективного радиуса ядра . [15]
Читайте также:
