Как ртуть растворяет металлы
Обновлено: 09.05.2024
Aт. вес 200,61. Ртуть мало распространена в природе; содержание ее в земной коре составляет всего 5• 10 -6 весовых процента. Изредка ртуть встречается в самородном виде, вкрапленная в горные породы, но главным образом она находится в природе в виде сульфида ртути HgS, или киновари. Этот минерал имеет яркокрасный цвет и применяется как красная краска.
Наиболее богатые месторождения киновари имеются в Испании (Альмаден), на долю которой приходится около 80% мировых запасов ртути. На руднике Альмаден добыча ртути производилась еще за 300 лет до нашей эры.
Добыча ртути в капиталистических странах в 1952 г. составила 5 тыс. т. Из этого количества более двух третей приходилось на долю Италии и Испании. В СНГ ртутные руды имеются в Донбассе, где издавна производится их разработка.
Из киновари металлическая ртуть получается простым обжиганием в специальных печах. При этом сера сгорает, образуя сернистый газ, а ртуть выделяется в виде паров и сгущается в охлаждаемом приемнике:
HgS + О2 = Hg + SO2
Ртуть — единственный металл, жидкий при обыкновенной температуре. Она замерзает при —38,87°, а кипит при 356,9°; уд. вес ртути 13,55.
Металлическая ртуть имеет значительное применение. Она служит для наполнения различных физических приборов — барометров, термометров ич т. п. Благодаря очень большому удельному весу ртуть совершенно незаменима при многих опытах с газами. Большие количества ртути идут на приготовление гремучей ртути — взрывчатого вещества, входящего в так называемые ударные составы, которыми пользуются для снаряжения капсюлей-воспламенителей, в том числе обыкновенных пистонов. Ртутью пользуются также для отделения самородного золота от неметаллических примесей.
Ртуть обладает способностью растворять в себе многие металлы, образуя с ними частью жидкие, частью твердые сплавы, называемые амальгамами. При этом нередко получаются различные химические соединения ртути с металлами.
Амальгама натрия широко применяется в качестве восстановителя. Амальгамы олова и серебра применяются при пломбировании зубов.
Особенно легко образуется амальгама золота, вследствие чего золотые изделия никогда не должны соприкасаться с ртутью. Железо не образует амальгамы, поэтому ртуть можно перевозить в железных сосудах.
Продажная ртуть обыкновенно содержит примеси других металлов. Большую часть примесей можно удалить, взбалтывая ртуть с раствором нитрата ртути; при этом все металлы, стоящие в ряду напряжений левее ртути (а к таковым относится большинство металлов), переходят в раствор, вытесняя из него эквивалентное количество ртути. Полная очистка ртути достигается путем ее перегонки, лучше всего под уменьшенным давлением.
Пары ртути очень ядовиты и могут вызвать тяжелое отравление. Для этого достаточно даже того ничтожного количества паров, которое образуется при обыкновенной температуре. Поэтому при всех работах с ртутью надо тщательно следить за тем, чтобы не пролить ее на пол.
Из металлов подгруппы цинка ртуть наименее активна, труднее других отдает свои электроны. Разбавленные серная и соляная кислоты, а также щелочи не действуют на ртуть. Легко растворяется ртуть в азотной кислоте. Концентрированная серная кислота растворяет ртуть при нагревании.
На воздухе ртуть при обыкновенной температуре не окисляется. При продолжительном нагревании до температуры, близкой к температуре кипения, ртуть соединяется с кислородом воздуха, образуя красную окись ртути HgO, которая при более сильном нагревании снова распадается на ртуть и кислород. Известно также другое кислородное соединение ртути —закись ртути Hg 2O черного цвета. Таким образом, ртуть может быть двухвалентной и одновалентной и соответственно этому образует два ряда солей. Соли, в которых ртуть двухвалентна, называются
солями окиси ртути, а соли одновалентной ртути — солями закиси ртути.
Хотя в закисных соединениях (например, Hg2O) ртуть проявляет себя как одновалентный металл, однако в настоящее время можно считать доказанным, что во всех таких соединениях атомы ртути связаны между собой, образуя двухвалентные группы —Hg2— или —Hg—Hg—. Следовательно, ртуть двухвалентна и в закисных соединениях, но одна валентность каждого атома ртути затрачивается на связь с другим атомом ртути. Эта связь сохраняется и в.растворах солей закиси ртути, которые содержат ионы Hg2 •• , а не ионы Hg • .
Таким образом, состав солей закиси ртути, содержащих одновалентный кислотный остаток R, следует изображать не эмпирической формулой HgR, а формулой Hg2R2 (например, Hg2Cl2, а не HgCl).
Одна из особенностей ртути заключается в том, что для нее неизвестны гидраты окислов. В тех случаях, когда можно было бы ожидать их образования, получаются безводные окислы. Так, при действии щелочей на растворы солей закиси ртути получается буровато-черный осадок закиси ртути:
Точно так же из растворов окисных солей ртути щелочи, осаждают не гидрат окиси ртути, а окись ртути:
Hg •• + 2OН’ = ↓HgO + Н2O
Образующийся осадок имеет желтый цвет, но при нагревании переходит в красную окись ртути.
Из солей ртути наибольшее значение имеют следующие:
1. Нитрат ртути (I), или азотнокислая закись ртути, Hg2(NO3)2—одна из немногих растворимых солей «одновалентной» ртути. Получается при действии разбавленной холодной азотной кислоты на избыток ртути;
2. Хлорид ртути (1),или хлористая ртуть, Hg2Cl2, называемая также каломелью, представляет собой белый, нерастворимый в воде порошок. Ее приготовляют, нагревая смесь сулемы с ртутью:
Каломель может быть получена также действием соляной кислоты или поваренной соли на растворимые соли закиси ртути:
Каломель применяется в медицине в качестве слабительного,
3. Нитрат ртути (II), или азотнокислая окись ртути, Hg (NO3)2 получается при действии избытка горячей азотной кислоты на ртуть. Хорошо растворим в воде. В разбавленных растворах при отсутствии свободной кислоты легко гидролизуется с образованием белого осадка основной соли HgO• Нg(NO3)2 . При нагревании с большим количеством воды основная соль также разлагается и в результате получается окись ртути.
4. Хлорид ртути (II), хлорная ртуть HgCl2, или сулема, может быть получена непосредственным соединением ртути с хлором. Это бесцветное вещество, довольно трудно растворимое в холодной воде. Из раствора сулема выкристаллизовывается в виде длинных блестящих призм. Обычно ее приготовляют, нагревая сульфат ртути (II) с поваренной солью:
Образующаяся сулема возгоняется, или сублимирует; от последнего слова она и получила свое название.
Водный раствор сулемы практически не проводит электрического тока. Таким образом, сулема является одной из немногих солей, которые почти не диссоциируют в растворе на ионы.
Сулема, как и все растворимые соли ртути, — сильный яд. Очень разбавленные растворы сулемы (1: 1000) применяются в медицине для дезинфекции.
5. Иодид ртути (II), или йодная ртуть, HgJ2 выпадает в виде красивого оранжево-красного осадка при действии раствора йодистого калия на соли двухвалентной ртути:
В избытке йодистого калия соль легко растворяется, образуя бесцветный раствор комплексной соли K2[HgJ4]
6. Сульфид ртути (II), или сернистая ртуть, HgS, как уже упоминалось, встречается в природе (киноварь). Искусственно сульфид ртути (II) может быть получен в виде черного аморфного вещества или прямым соединением серы с ртутью или действием сероводорода на растворы ртутных солей:
При нагревании без доступа воздуха черный сульфид ртути (II) превращается в красное кристаллическое видоизменение — киноварь.
Вы читаете, статья на тему Ртуть (Hydrargyrum)
Похожие страницы:
КАК ОЧИСТИТЬ РТУТЬ В химических лабораториях часто возникает необходимость очистить жидкий металл. Метод, описанный в этой заметке, пожалуй, самый простой.
Ртуть это металл с уникальными свойствами который в нормальных условиях остается в жидком состоянии (расплавленном). Известен с давних времен так.
РТУТЬ ЖИДКИЙ МЕТАЛЛ Ртуть оказала науке огромные услуги. Как знать, насколько задержался бы прогресс техники и естественных наук без измерительных.
Содержание статьи1 РТУТЬ анализ Hg, Качественная реакция на Ртуть1.1 Диэтилдитиокарбаминат меди1.2 Сульфарсазен1.3 Тиокетон Михлера1.4 Тиурамат меди1.5 Тиосалициловая кислота (ТСК) РТУТЬ анализ.
Кобальт (Cobaltum) Aт. вес 58,94. В природе кобальт мало распространен; содержание его в земной коре составляет 0,002 весовых процента. Обычно.
Соли аммония При выпаривании нейтрализованных растворов аммиака ионы аммония соединяются с анионами взятых кислот, образуя твердые кристаллические вещества, обладающие ионной.
СОЕДИНЕНИЯ РТУТИ
Первым из них, несомненно, следует назвать киноварь HgS. Благодаря ей человек познакомился с ртутью много веков назад. Способствовали этому и ее ярко-красный цвет, и простота получения ртути из киновари. Кристаллы киновари иногда бывают покрыты тонкой свинцово-серой пленкой. Это — метациннабирит, о нем ниже. Достаточно, однако, провести по пленке ножом, и появится ярко-красная черта. В природе сернистая ртуть встречается в трех модификациях, отличающихся кристаллической структурой.
Помимо общеизвестной киновари с плотностью 8,18, существуют еще и черный метациннабарит с плотностью 7,7 и так называемая бета-киноварь (ее плотность 7,2). Русские мастера, приготовляя в старину из киноварной руды красную краску, особое внимание обращали на удаление из руды «искр» и «звездочек». Они не знали, что это аллотропические изменения той же самой сернистой ртути; при нагревании без доступа воздуха до 386° С эти модификации превращаются в «настоящую» киноварь. Некоторые соединения ртути меняют окраску при изменении температуры.
Таковы красная окись ртути HgO и медно-ртутный иодид HgI2 • 2CuI.Все соли ртути ядовиты, и это требует большой осторожности при работе с ними. Сталкиваться же с соединениями ртути приходится людям разных профессий. Ртутная соль хромовой кислоты, например,— замечательная зеленая краска по керамике. Сильный яд сулема HgCl2но она крайне нужна в гальванопластике, в производстве оловянных и цинковых сплавов тонкой структуры, в процессах гравирования и литографии, даже в фотография. Некоторые соли ртути, в том числе и сулема, применяются в сухих электрических батареях.Промышленный катализ тоже не обходится без соединений ртути. Один из способов получения уксусной кислоты и этилового спирта основан на реакции, открытойрусским ученым М. Г. Кучеровым.
Сырьем служит ацетилен. В присутствии катализаторов — солей двухвалент-ной ртути — он реагирует с водяным паром и превращается в уксусный альдегид. Окисляя это вещество, получают уксусную кислоту, восстанавливая — спирт. Те же соли помогают получать из нафталина фталевую кислоту — — важный продукт основного органического синтеза.Резко возрастает потребление ртути в годы войны. Жидкий металл необходим для производства «гремучей ртути» Hg (ONC) 2 первого известного технике инициирующего взрывчатого вещества.
Хотя сейчас на вооружении имеются и другие подобные ВВ (азид свинца, например), «гремучая ртуть» продолжает оставаться одним из важнейших материалов для заполнения капсюлей детонаторов.Ядовитость соединений ртути ограничивает их применение, но иногда это свойство может оказаться полезным. Ртутными красками покрывают днища кораблей, чтобы они не обрастали ракушками. Иначе корабль снижает скорость, перерасходуется топливо. Самая известная из красок такого типа делается на основе кислой ртутной соли мышьяковистой кислоты HgHAsO4. Правда, в последнее время для этой цели применяют и синтетические красители, в составе которых ртути нет.
Хотя все ртутные соли ядовиты, многие из них используются медициной, и, пожалуй, это одно из самых древних их применений. Сулема — яд, но и одно из первых антисептических средств. Цианид ртути использовали в производстве антисептического мыла. Желтую окись ртути *до сих пор применяют при лечении глазных и кожных заболеваний. Каломель Hg2Gl2, в молекуле которой по сравнению с молекулой сулемы есть один «лишний» атом ртути,— общеизвестное слабительное средство.
Медицина использует также фосфорнокислые соли ртути, ее сульфат, иодид и другие. В наше время большинство неорганических соединений ртути постепенно вытесняются из медицины ртутными же органическими соединениями, неспособными к легкой ионизации и поэтому не столь токсичными и меньше раздражающими ткани. Органические антисептики на основе соединений ртути пригодны даже для обработки слизистых оболочек. Они дают не меньший лечебный эффект, чем неорганические соединения. Медицина применяет не только соединения, но и самую ртуть и ее пары. Начиная обследование, врач в первую очередь использует «градусник» — ртутный термометр.
Ртутные манометры работают в аппаратах для измерения кровяного давления. В каждой больнице, в физиотерапевтических кабинетах поликлиник ультрафиолетовые лучи, полученные от ртутно-кварцевых ламп, глубоко прогревают ткани, помогают лечить катары, воспаления, даже туберкулез — ведь ультрафиолет губителен для многих микроорганизмов. Ртуть — древнейший, удивительный и, можно сказать, «нестареющий» металл. Известный с незапамятных времен, он и в современной технике, в медицине, в быту находит все новые применения.
У ДРЕВНИХ НАРОДОВ. История не сохранила имени древнего металлурга, первым получившего ртуть,— это было слишком давно, за много веков до нашей эры. Известно только, что в Древнем Египте металлическую ртуть и ее главный минерал, киноварь, использовали еще в III тысячелетии до н. э. Индусы узнали ртуть во II—I вв. до н. э. У древних китайцев киноварь пользовалась особой славой, и не только как краска, но и как лекарственное средство. Ртуть и киноварь упоминаются в «Естественной истории» Плиния Старшего: значит, о них знали и римляне. Плиний свидетельствует также, что римляне умели превращать киноварь в ртуть. Все металлы — из ртути… В этом были убеждены алхимики древности и средневековья. Разницу в свойствах металлов ониобъясняли присутствием в металле одного из четырех элементов Аристотеля. (Напомним, что этими элементами были; огонь, воздух, вода и земля.) Характерно, что подобных взглядов придерживались и многие видные ученые далекого прошлого. Так, великий таджикский врач и химик Авиценна (980—1037 гг. н. э.) тоже считал, что все металлы произошли от ртути и серы.
РАССКАЗЫВАЕТ ЛАВУАЗЬЕ. «В эту реторту я ввел 4 унции очень чистой ртути, затем путем всасывания посредством сифона, который я ввел под колокол, я поднял ртуть до определенного уровня и тщательно отмерил этот уровень полоской приклеенной бумаги, точно наблюдая при этом показания барометра и термометра. Закончив таким образом все приготовления, я зажег огонь в печке и поддерживал его почти без перерыва 12 дней, причемртуть нагревалась до температуры, необходимой для ее кипения.В течение всего первого дня не произошло ничего примечательного: ртуть, хотя и кипевшая, находилась в состоянии непрерывного испарения и покрывала внутренние стенки реторты капельками, сначала очень мелкими, но постепенно увеличивающимися при достижении известного объема падавшими от собственной тяжести на дно реторты и соединявшимися с остальной ртутью. На второй день я начал замечать плавающие на поверхности ртути небольшие красные частички, которые в течение четырех или пяти дней увеличивались в количестве и объеме, после чего перестали увеличиваться и остались в абсолютно неизменном виде.
По прошествии 12 дней, видя, что окаливание ртути нисколько больше не прогрессирует, я потушил огонь и дал остыть прибору. Объем воздуха, содержащегося как в реторте, так и в ее шейке и в свободной части колокола… был до опыта равен приблизительно 50 куб. дюймам. По окончании операции тот же объем при том же давлении и той же температуре оказался равным всего лишь 42—43 дюймам; следовательно, произошло уменьшение приблизительно на одну шестую. С другой стороны, тщательно собрав образовавшиеся на поверхности красные частицы и отделив их, насколько было возможно, от жидкой ртути, в которой они плавали, я нашел их вес равным 45 гранам… Воздух, оставшийся после этой операции и уменьшавшийся вследствие прокаливания в нем ртути до пяти шестых своего объема, не был годен больше ни для дыхания, ни для горения; животные, вводимые в него, умирали в короткое время, горящие же предметы потухали в одно мгновение, как если бы их погружали в воду.
С другой стороны, я взял 45 гранов образовавшегося вовремя опыта красного вещества и поместил его в маленькую стек-лянную реторту, к которой был присоединен прибор, приспособленный для приема могущих выделиться жидких и воздухообразных продуктов; зажегши огонь в печке, я заметил, что по мере того как красное вещество нагревалось, его цвет становился все более интенсивным. Когда затем реторта начала накаляться, красное вещество начало мало-помалу уменьшаться в объеме и через несколько минут оно совершенно исчезло; в то же время в небольшом приемнике собралось 41 1 /2 грана жидкой ртути, а под колокол прошло 7—8 куб. дюймов упругой жидкости , гораздо более способной поддерживать горение и дыхание животных, чем атмосферный возду..Я дал ему сначала название в высшей степени легко вдыхаемого или весьма удобовдыхаемого воздуха: впоследствии это название было заменено названием «жизненный» или «живительный воздух».Антуан Лоран Лавуазье.«Анализ атмосферного воздуха». «Записки Французской академии наук», 1775.
РТУТЬ И ОТКРЫТИЯ ДЖОЗЕФА ПРИСТЛИ. Но не Лавуазье был первым ученым, получившим кислород из красной окиси ртути. Карл Шееле еще в 1771 г. разложил это вещество на ртуть и «огненный воздух», а выдающийся английский химик Джозеф Пристли первым в мире исследовал кислород. 1 августа 1774 г., разложив окисел нагреванием, Пристли внес в полученный «воздух» горящую свечу и увидел, что пламя приобрело необычную яркость. В этом воздухе свеча сгорала быстрее. Ярко вспыхнув, сгорали в нем и раскаленные кусочки каменного угля, и железные проволочки… За этим опытом последовали другие, и в итоге Пристли определил важнейшие качества «дефлогистонированного воздуха».Джозеф Пристли сделал еще много важных открытий, и почти во всех его работах использовалась ртуть. Это она помогла Пристли открыть газообразный хлористый водород. Взаимодействие поваренной соли с серной кислотой и до Пристли наблюдали многие химики. Но все они пытались собрать образующийся газ над водой, и получалась соляная кислота. Пристли заменил воду ртугью.. Таким же образом он получил чистый газообразный аммиак из нашатырного спирта. Затем оказалось, что два открытых им газа — NH3 и НСl — способны вступать в реакцию между собой и превра-щаться в белые мелкие кристаллы. Так впервые в лабораторныхусловиях был получен хлористый аммоний. Сернистый газ тожебыл открыт Пристли и тоже был собран над ртутью.
ВЫРУЧИЛ РТУТНЫЙ КАТОД. В 1807 г., разлагая щелочи электрическим током, выдающийся английский ученый Дэви впервыеполучил элементарные натрий и калий. Его опыты повторил крупнейший шведский химик Берцелиус, но источник тока — вольтовстолб, которым он располагал, был слишком слаб, и воспроизвести результаты Дэви Берцелиусу поначалу не удалось. Тогда он решил в качестве катода использовать ртуть и… получил щелочные металлы с меньшими затратами энергии. А тем временем Дэви пытался выделить с помощью электричества и щелочноземельные металлы. При этом он пережег свою огромную батарею и об этой неудаче написал Берцелиусу. Тот посоветовал ему воспользоваться ртутным катодом, и в 1808 г. Дэви получил амальгаму кальция, из которой выделить металл уже не составляло труда. В том же году (и тем же способом) Дэви выделил в элементарном виде барий, стронций и магний.
ПЕРВЫЙ СВЕРХПРОВОДНИК. Спустя почти полтора столетия после опытов Пристли и Лавуазье ртуть оказалась сопричастна еще к одному выдающемуся открытию, на этот раз в области физики. В 1911 г. голландский ученый Гейке Камерлинг-Оннес исследовал электропроводность ртути при низкой температуре. С каждым опытом он уменьшал температуру, и когда она достигла 4,12° К, сопротивление ртути, до этого последовательно уменьшавшееся, вдруг исчезло совсем: электрический ток проходил по ртутному кольцу, не затухая. Так было открыто явление сверхпроводимости, и ртуть стала первым сверхпроводником. Сейчас известны десятки сплавов и чистых металлов, приобретающих это свойство при температуре, близкой к абсолютному нулю.
ЧЕМ -ТО ПОХОЖА НА ВОДУ. Не только жидкое состояние «роднит» ртуть с водой. Теплоемкость ртути, как и воды, с ростом температуры (от точки плавления до +80° С) последовательно уменьшается и лишь после определенного температурного «порога» (после 80° С) начинает медленно расти. Если охлаждать ртуть очень медленно, ее, как и воду, можно переохладить. В переохлажденном состоянии жидкая ртуть существует при температуре ниже —50° С, обычно же она замерзает при -38,9° С. Кстати, впервые ртуть была заморожена в 1759 г. петербургским академиком И. А. Брауном.
ОДНОВАЛЕНТНОЙ РТУТИ НЕТ! Это утверждение многим покажется неверным. Ведь еще в школе учат, что, подобно меди, ртуть может проявлять валентности 2+ и 1+. Широко известны такие соединения, как черная закись Hg2O или каломель Hg2Cl2. Но ртуть здесь лишь формально одновалентна. Как показали исследования, во всех подобных соединениях содержится группировка из двух атомов ртути: —Hg2— или —Hg—Hg—. Оба атома двухвалентны, но одна валентность каждого из них затрачена на образование цепочки, подобной углеродным цепям многих органических соединений. Ион Hg 2+ 2 нестоек, нестойки и соединения, в которые он входит, особенно гидроокись и карбонат закисной ртути. Последние быстро разлагаются на Hg и HgO и соответственно Н 2O или СО2.
ЯД И ПРОТИВОЯДИЕ. Пары ртути и ее соединения действительно весьма ядовиты. Жидкая ртуть опасна прежде всего своей летучестью: если хранить ее открытой в лабораторном помещении, то в воздухе соз- дастся парциальное давление ртути 0,001 мм. Это много, тем болел что предельно допустимая концентрация ртути в промышленных помещениях 0,01 мг на кубический метр воздуха. Степень токсического действия металлической ртути определяется прежде всего тем, какое количество ее успело прореагироватьв организме, прежде чем ее вывели оттуда, т. е. опасна не сама ртуть, а ее соединения.Острое отравление солями ртути проявляется в расстройстве кишечника, рвоте, набухании десен. Характерен упадок сердечнойдеятельности, пульс становится редким и слабым, возможны обмороки. Первое, что необходимо сделать в такой ситуации, это вызвать у больного рвоту. Затем дать ему молока и яичных белков. Ртуть выводится из организма в основном почками.При хроническом отравлении ртутью и ее соединениями появляются металлический привкус во рту, рыхлость десен, сильное слюнотечение, легкая возбудимость, ослабление памяти. Опасность такого отравления есть во всех помещениях, где ртуть находится в контакте с воздухом. Особенно опасны мельчайшие капли разлитой ртути, забившиеся под плинтусы, линолеум, мебель, в щели пола. Общая поверхность маленьких ртутных шариков велика, и испарение идет интенсивнее. Поэтому случайно разлитую ртуть необходимо тщательно собрать. Все места, в которых могли задержаться малейшие капельки жидкого металла, необходимо обработать раствором FeCl3, чтобы связать ртуть химически.
РТУТЬ В КОСМОСЕ. Космические аппараты нашего времени требуют значительных количеств электроэнергии. Регулировка работы двигателей, связь, научные исследования, работа системы жизнеобеспечения — все это требует электричества… Пока основными источниками тока служат аккумуляторы и солнечные батареи. Энергетические потребности космических аппаратов растут и будут расти. Космическим кораблям недалекого будущего понадобятся электростанции на борту. В основе одного из вариантов таких станций — ядерный турбинный генератор. Во многом он подобен обычной тепловой электростанции, но рабочим телом в нем служит не водяной пар, а ртутный. Разогревает его радиоизотопное горючее. Цикл работы такой установки замкнутый: ртутный пар, пройдя турбину, конденсируется и возвращается в бойлер, где опять нагревается и вновь отправляется вращать турбину.
ИЗОТОПЫ РТУТИ. Природная ртуть состоит из смеси семи стабильных изотопов с массовыми числами 196, 198, 199, 200, 201, 202 и 204. Наиболее распространен самый тяжелый изотоп: его доля — почти 30%, точнее, 29,8. Второй по распространенности—изотопртуть -200 (23,13%). А меньше всего в природной смеси ртути-196 — всего 0,146%. Из радиоактивных изотопов элемента № 80, а их известно 11, практическое значение приобрели только ртуть -203 (период полураспада 46,9 суток) и ртуть-205 (5,5 минуты). Их применяют при аналитических определениях ртути и изучении ее поведения в технологических процессах.
САМЫЕ КРУПНЫЕ МЕСТОРОЖДЕНИЯ — В ЕВРОПЕ. Ртуть — один из немногих металлов, крупнейшие месторождения которых находятся на европейском материке. Наиболее крупными месторождениями ртути считаются Альмаден (Испания), Монте-Амья-та (Италия) и Идрия (Югославия).
Статья на тему Соединения ртути
АМАЛЬГАМА (франц. amalgame, — приспособление для смягчения ударов) — металлическая система, одним из компонентов которой является ртуть. Один из древнейших.
HYDRARGYRUM AMIDАТОСHLОRATUM РТУТИ АМИДОХЛОРИД Ртуть белая осадочная Действие: антисептическое, противовоспалительное и противопаразитарное. Показания: заболевания кожи (пиодермия и др.).
HYDRARGYRUM CHLORATUM (MITE) РТУТИ МОНОХЛОРИД Каломель Действие: дезинфицирующее, слабительное, желчегонное, а также мочегонное. Показания: ввиду токсичности в настоящее.
HYDRARGYRUM OXYCYANATUM РТУТИ ОКСИЦИАНИД Показания: конъюнктивиты, гонорея, бленнорея, дакриоциститы, циститы. Способ применения и дозы: в растворах 1 ; 5000—.
Ртуть

Склонность ртути переходить из одной формы в другую и способность к кумулятивному накоплению имеет особенно важное значение в её техногенезе. Кроме того, ртуть вездесуща, сульфофильна, гидрофильна, многолика и присутствует во всех средах и типах окружающей среды, имеет много форм нахождения, что существенно затрудняет ее изучение. Она супертоксична и суперпатологична даже в очень низких концентрациях. Ртуть находится в литосфере и биосфере в виде твердых соединений, различных газообразных фазах и в растворенной форме, каждая из которых преобладает при конкретных физико-химических условиях, но легко переходят друг в друга. В техногенезе ртуть накапливается в отходах многих производств, обладая высокими показателями и деструктивной биологической активностью, способна давать скрытые антропогенные скопления, но человечество не может существовать без этого удивительного металла. Как осуществляется мониторинг и контроль ртути, какие методы и приборы её контроля существуют — предлагаю познакомиться под катом.
Из чего производят ртуть?
Взгляните на этот удивительно красивый минерал, который издревле интересовал людей. До сих пор он является популярным не только для главного его предназначения (получения ртути), но я для ювелиров.

Это киноварь — сульфид ртути (II). Минерал для производства ртути. Содержит порядка 85 процентов ртути, хрупкий материал с характерно красной окраской. Киноварь с древности применялась в качестве красной краски, как источник для получения ртути и как единственное существовавшее до изобретения антибиотиков надёжное (хотя и небезопасное) средство лечения инфекционных заболеваний. Как незаменимый ярко-алый минеральный пигмент киноварь применяли уже в Древнем Египте и в ранней Византии. Повсеместно с тех пор, как и в наши дни, натуральная киноварь широко используется в канонической иконописи. Но, конечно, самое главное применение этого минерала — промышленное получение ртути.
Ртуть, безусловно, удивительный материал. Это единственный металл, способный существовать в жидком виде при нормальных условиях. Это металл, поэтому электропроводен. Но если ртуть охладить до минус 39 гр.С — она становиться твердой и ничем уже особо не отличается от других металлов. Её можно даже ковать и точить. В сети есть интересное видео с рассказом об этом замечательном веществе. Ртуть применяется в самых разных технологических процессах, а также в производстве газоразрядных ламп, в микроэлектронике и приборостроении. Ртуть чрезвычайно технологически востребованное вещество и если бы ртуть не была бы так токсична — сферы её использования были бы даже шире. Надо сказать, что сама по себе ртуть не очень опасна — куда опасней её соединения и пары. Вот они и являются источниками основной опасности.
Ртуть под контролем
Ртуть способна накапливаться в почве, воде, пищевых продуктах, в организме человека и животных. Ртуть в виде паров всегда присутствует в окружающем воздухе, но её «фоновые» концентрации не велики. Кстати, какие? Достаточно жесткие российские стандарты для этого случая регламентируют концентрацию ртути в воздухе не более 0,0003 мг/м 3 . Конечно, регистрировать и контролировать такие концентрации не простая задача и для этого существуют более 25 методов регистрации.
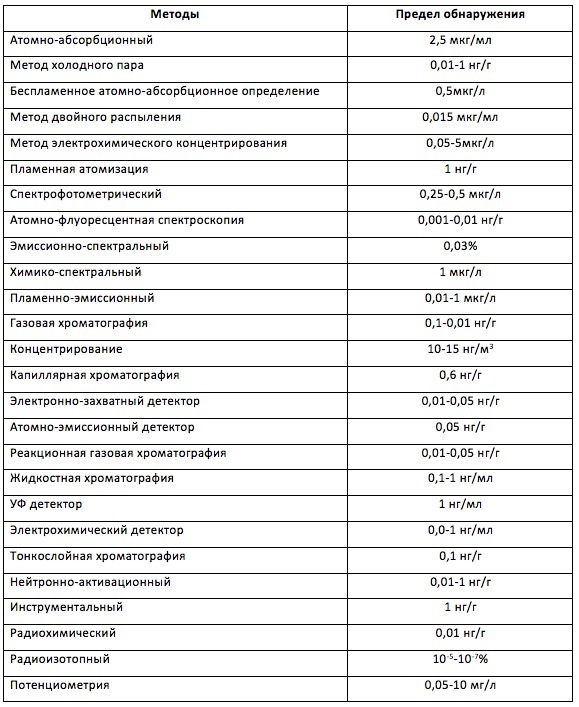
К примеру, хроматография. В этом методе осуществляется процесс разделения, в котором исследуемое соединение распределяется между подвижной фазой (жидкой или газовой) и неподвижной (твердой или жидкой). Этот метод обеспечивает получение особо ценной информации о качественном и количественном содержании неорганических и органических форм ртути. При анализе ртути в природных объектах возможно определение галогенидов метил-, этил- и фенилртути, а также фенилртути, диметил- и диэтилртути, а также некоторых других менее распространенных органических форм ртути. Минусом данного метода анализа является технически сложное лабораторное оборудование и используется метод в основном для определения содержания ртути в промышленных и природных объектах с высоким содержанием ртути, а также в почве.

Существует ряд методов, связанных с применением радиоизотопов. Не смотря на грозное название, такие методы вполне безопасны, так как используются радиоизотопы в ничтожных концентрациях. Для проведения анализа к исследуемой пробе добавляется точно известное количество определяемого компонента, меченное радиоактивным изотопом с известной радиоактивностью. После гомогенизации пробы и прохождения изотопного обмена производится выделение ртути из среды (как правило химическим способом) и определяется её радиоактивность, по которой затем рассчитывается первоначальное количество ртути в исследуемой среде.

Данный метод обладает достаточно высокой чувствительностью, не требует дорогостоящей аппаратуры и позволяет работать с низкими концентрациями ртути.
Радиоиндикаторные методы анализа позволяют решать такие задачи, как определение следовых количеств ртути в веществах, мониторинг загрязнений окружающей среды при анализе состава атмосферных аэрозолей, выпадений природных и сточных вод, производить анализ почв, а также растительных и животных объектов. Радиационные методы надежно гарантируют идентификацию ртути, обладают достаточно высокой чувствительностью и позволяют повысить правильность и воспроизводилось результатов анализа. Кроме того, такие методы не требуют дорогостоящей аппаратуры, позволяют работать с низким уровнем радиоактивности, что делает их незаменимыми для использования в малых лабораториях, на научно-исследовательских судах, в условиях высокогорных станций, в экспедиционных и полевых условиях. Предел обнаружения методов — до 10 -6 – 10 -8 %
Если для определения ртути в жидких и твердых средах накоплен хороший арсенал методов контроля, то для анализа концентрации паров ртути в воздухе всё значительно сложнее. В первую очередь из-за малых концентраций паров в воздухе и из-за отсутствия достаточно простых методов регистрации. Наиболее перспективным является метод регистрации, основанный на Зеемановском методе. Рассмотрим его подробнее.
Ртуть в воздухе
Эффект Зеемана — расщепление линий атомных спектров в сильном магнитном поле. Так как любому веществу соответствует свой спектр, то если использовать спектр специальной ртутной лампы, но в присутствие сильного магнитного поля такой спектр исказится. В спектре появятся дополнительные компоненты, которые будут зеркально отстоять от основного спектра. Выглядит это примерно так

Изначальный спектр (черная кривая) при включении магнитного поля искажается на три. Центральный спектр (синий цвет) и два симметричных боковых спектра (показано красным цветом). Индукция магнитного поля в данном случае составляет 1,56 Тл. Этот эффект принципиально позволяет реализовать удобный метод регистрации ртути. Для этого необходимо проанализировать изменение амплитуд разделенных и основной компоненты, при этом чем больше концентрации ртути в исследуемом воздухе — тем выше будет одна из компонент расщепленного спектра и, одновременно — меньше другая. Конечно, воздух также имеет свой спектр поглощения на длине волны 254 нм (именно на этой длине волны светится ртутная лампа). Этот (в данном случае «паразитный») спектр необходимо убрать. Для этого используется «опорный» канал и специальные фильтры.

Опорный канал либо вовсе не содержит ртути, т.е. демеркуризирован, либо там находится точно известное значение концентрация ртути в виде эталонной. Излучение ртутной лампы с расщепленным спектром проходит через опорную и измерительную кювету, попадает на фильтр, который фильтрует паразитные спектры других молекул воздуха на длине волны 254 нм и поступает на спектрометр. После спектрометра опорный и исследуемые спектры поступают на матрицу, которая часто подвергается охлаждению с целью увеличения чувствительности и для температурной стабилизации. Результирующие спектры анализируются и окончательно определяется концентрация ртути в исследуемом воздухе.
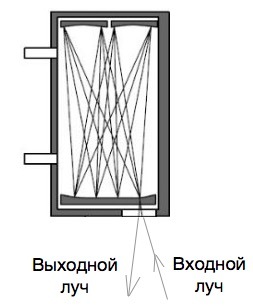
Конечно, это самое общее представление схемы подобного прибора, на самом деле из-за крайне низкой концентрации ртути в образце, необходимо, чтобы оптическое излучение прошло по протяженному пути в измерительной кювете, для чего используются различные оптические схемы многократного прохождения оптического излучения. Это делается для того, чтобы с сохранением относительно небольших размеров прибора добиться значительного увеличения чувствительности за счет многократного прохождения светового луча. Это, в свою очередь, значительно усложняет и удорожает конструкцию из-за необходимость «тонкой» настройки прибора. Использование многопроходных кювет ужесточает требования по вибрации, также имеются уже значительные влияния температурные перепады. Однако, эти недостатки компенсируются значительным увеличением чувствительности, ведь луч в многопроходной кювете может «набежать» значительный путь. Иногда в десятки метров. В большинстве современных приборов используются именно многопроходные кюветы.

Конвенция по ртути
Не смотря на безусловную востребованность ртути для современных технологий, рассматриваются вопросы резкого сокращения её использования в ближайшем будущем. В 2013 году в ООН была принята достаточно жесткая и очень спорная Минаматская конвенция по ртути, которую поддержали многие страны. Согласно конвенции должно регулироваться использование ртути, сокращаться производство некоторых ртуть-содержащих приборов (медицинских, люминесцентных ламп). Также ограничивается ряд промышленных процессов и отраслей, в том числе горнодобывающая (особенно добыча золота) и производство цемента.

С 2020 года конвенция запрещает производство, экспорт и импорт нескольких различных видов ртутьсодержащих продукции, в том числе электрических батарей, электрических выключателей и реле, некоторых видов компактных люминесцентных ламп, люминесцентных ламп с холодным катодом или с внешним электродом, ртутных термометров и приборов измерения давления.
Инициаторы конвенции объясняют намеренье серьезно ограничить использование ртути с целью активизировать развитие современных технологий в условиях, когда использовать ртуть будет уже невозможно и тем самым значительно улучшить экологическую обстановку. Однако, некоторые критики конвенции высказывают мнение, что это лишь повод пересмотреть глобальные рынки производителей ртути и вытеснить с этого рынка многих игроков. Ведь при вступлении конвенции в силу в 2020 году цена на этот металл может неожиданно значительно вырасти, ведь от полного использования ртути человечество пока отказаться не может.
Разбитый ртутный градусник и процедура демеркуризации
Я узнал о том, что такое Демеркуриза́ция после того, как разбил ртутный градусник дома. Дело было несколько лет назад. У нас с супругой родился сын. Хороший градусник в семье с новорожденным ребёнком - дело необходимое. После недолгих поисков, выбор пал на современный инфракрасный термометр. После распаковки термометра и пробного замера, у меня закрались сомнения в точности измерений, а так как в данном устройстве предусмотренна процедура калибровки, то почему бы не откалибровать его на старом добром ртутном градуснике, подумал я.
Новый в карман, ртутный в руку и, пытаясь скатить ртуть в исходное положение, разбиваю благополучно ртутный градусник со всей дури о новый инфракрасный в кармане. Секундный ступор и быстрая оценка ситуации. Ртуть везде: на штанах, на ковре, на полу, на кровати, на белье, частично под кроватью. От того, что сила удара была большой - размер шариков чуть больше пыли. Так как у меня, как у новоиспеченного отца, повышенное чувство тревожности за благополучие новорожденного ребёнка, я начинаю очень быстро анализировать ситуацию и вспоминать всё, что я знаю про ртуть. Первое - закрыл дверь в комнату, сказал жене о произошедшем. Пока я пытался аккуратно на месте раздеться и собрать, для начала, всё "запачканное" в кучу, супруга уже прочитала первые несколько ссылок по запросу "разбился градусник что делать". Во-первых, ртуть жутко опасный металл, вред здоровью колосальный, особенно если речь идёт о маленьких детях, сложно собрать, может оставаться в щелях, испаряется при температуре выше +18, вызывает рак при накоплении и прочие похожие факты.
Дальше пошли советы из раздела "Что делать?". Самый первый - собрать ртуть скотчем. Скотч в комнате был и я первым делом опечатал комнату, чтобы возможные пары ртути не вышли за пределы комнаты к ребёнку. Дальше открываю все окна нараспашку, чтобы морозный декабрьский воздух поскорее снизил температуру ниже +18. Скотч для сбора хорош для идеальных условий - ровный гладкий пол без трещин и зазоров. В моём случае он оказался абсолютно бесполезным. На часах 21:30, я полуголый, температура быстро опустилась ниже необходимой и решать что делать надо было побыстрее. Супруга уже успела дозвониться в СЭС, но кроме советов по сбору скотчем ей ничего нового не предложили. Пылесос? Нет, он нагревается и всё разнесёт ещё больше. Всё утилизировать? Да. Всё, что имело контакт с ртутью аккуратно собираю в мусорные пакеты, включая одежду, ковёр, постельное бельё и прочее. Остаётся пол. Супруга вычитала про хлорку, что она нейтрализует. Начинаю мыть пол с огромной порцией средства для мытья унитаза. Комната выглядит как после аппокалипсиса. Пока выполняю последние штрихи "влажной уборки" приходят новые инструкции: проветривать не менее 12 часов, повторная влажная уборка после. Закончил, опечатал комнату уже снаружи и наконец-то выдохнул.
На часах полночь. В квартире холодно, ребёнок спит в уличном комбинезоне, жена в шапке. На мои предложения переночевать в гостинице отказ по понятным причинам. Я сел уже сам что-то почитать на данную тему и натыкаюсь на серьёзный источник, где написано следующее: ртуть полностью можно убрать только при помощи процедуры демеркуризации, в противном случае мелкие частицы в трещинах и других труднодоступных местах будут испаряться n-ое количество лет и отравлять всем здоровье. Ну и как бонус - мыть пол нельзя, всё разносится ещё больше. Степень тревожности зашкаливает, начинаются ночные поиски службы, которая бы смогла выполнить данную демеркуриза́цию. Благо в большом городе можно найти всё что угодно, даже ночью.
На часах 3 часа ночи и в дверях уже стоит молодой парень в противогазе, в полной экипировке, с огромным прибором в руке и чемоданом с какими-то бутылками. Дальше диалог складывается примерно таким образом:
- Мне нужно замерить содержание паров ртути в помещении.
* включает свой огромный анализатор прямо при входе в квартиру. После недолгих гудков и шумов он начинает громко сигналить и мигать красным.
- Содержание ртути в воздухе превышено в 30 раз. Находится в помещении опасно. Дайти туалетную бумагу.
* Даю ему туалетную бумагу. Он пошёл к "очагу" заражения, чтобы потереть бумажкой по разным участкам, а потом засунуть образец в анализатор для проверки.
- Содержание ртути превышает в десятки раз допустимые значения. Приступаю к процедуре демеркуризации.
- Постойте, что она из себя представляет? Это опасно?
- Нет, я просто распылю реагент на поражённые участки. В комнате нужно будет оставить открытыми окна и дверь лучше обратно запечатать скотчем. После распыления, в течении 6 часов, ртуть будет полностью нейтрализована.
После смешивания реагентов в каких-то бутылках, он приступил к распылению фиолетового раствора под давлением, похожего на марганцовку, в комнате. Я не буду говорить, что фиолетовым было всё. Ощущение, что пустили газ - запах отвратительный и удушающий. Весь процесс занял не больше 5 минут, после чего парень сделал контрольный замер. Цифры были уже значительно ниже. Он посоветовал утром вымыть пол Доместосом и быстро ушёл.
После нескольких часов сна в квартире с открытыми окнами зимой, я поехал в магазин искать доместос и приступил к уборке. К счастью, фиолетовый раствор удалось отмыть и комнату удалось вернуть почти к исходному состоянию к 9 утра. Супруга с ребёнком тоже проснулись, и можно было возвращаться к нормальной жизни.
Как итог: 6 тысяч рублей за процедуру демеркуризации (с наценкой за ночной вызов), много выброшенных вещей (одежда, вёдра, постельное бельё, ковёр).
Если бы не ребёнок, то я, наверное, как и все собрал бы ртуть скотчем, шарики на листок бумаги и на следующий день забыл бы об инцинденте. Всем советую заменить градусники хотя бы на простые электронные. Ртуть дома храниться не должна, это пережиток прошлого.
Читайте также:
