Как узнать металл или нет
Обновлено: 17.05.2024
Боязнь быть обманутыми преследует многих людей, и это опасение не лишено оснований. По статистике, за последние 10 лет добыча благородных металлов практически не увеличивается, но при этом количество ювелирных магазинов растет неимоверными темпами. Увы, даже при покупке украшений в ювелирном магазине есть вероятность нарваться на низкокачественную подделку. Одолевают сомнения? Проверка подлинности драгоценных металлов доступна не только специалистам, но и каждому из нас. Для этого существует немало способов, осуществление которых возможно в домашних условиях.
Не все золото, что блестит
Проверить золотое изделие и выдать достоверное заключение на принадлежность к благородному металлу может лишь ювелир, в распоряжении которого имеется все необходимое аналитическое оборудование. Профессиональную проверку осуществляет Пробирная Палата. Экспертиза золотых украшений — удовольствие не из дешевых, цена услуги колеблется в пределах от 10 до 20% от оценочной стоимости изделия. Золото подделывают все чаще, а тратить деньги впустую не хочется никому. Кстати, необходимость проверки золота на подлинность может возникнуть не только в отношении ювелирных изделий, но и, например, при покупке слитков или самородков.

Серебряные серьги с фианитом, SL; (цена по ссылке)
Самая сложный вид подделки для самостоятельного определения золота – болванка украшения, на которую нанесен тончайший слой драгметалла. Определить подлинность такой работы в домашних условиях без причинения вреда изделию крайне сложно.
Самые распространенные методы подделки золотых изделий:
- поверхностная позолота;
- замена медью;
- сплавы алюминия и других металлов;
- сплав титана и золота.
Поддельные украшения из сплавов, по цвету близких к золоту, оставляют на коже пятна с зеленым оттенком, особенно при длительном ношении кольца. Подмену золота на менее ценные сплавы металлов другими или похожее напыление можно определить, используя широко известные методы.
Первый этап — проверка золота путем сравнения. Наверняка у вас есть ювелирное украшение, в подлинности которого вы не сомневаетесь. На жестком предмете следует начертить линию двумя этими украшениями. Золотые изделия оставят одинаковый след, если же есть различия — это прямой повод усомниться в качестве.
С помощью лупы всмотритесь в клеймо, на котором должна отражаться проба золота. Оно должно быть четким, без повреждений.
Стоимость грамма золота ежедневно меняется, однако, на нее следует опираться при покупке украшений, даже если они приобретаются не в магазине.

Золотое кольцо c бриллиантами и цитринами, SL; золотые серьги c бриллиантами и цитринами, SL; (цена по ссылке)
Так же бытует мнение о том, что звук помогает вычислить копию. Хрустальный звон при ударе о твердую поверхность издают золотые изделия. Глухой или любой другой звук – повод для беспокойства.
Проверка йодом
Йод способен менять цвет большинства компонентов, которые используются для фальсификации драгоценного металла, но при этом такая проба совершенно безобидна для ювелирных украшения с пробой выше 500 (т. е. в которых содержится более 50 массовых процентов золота).
На изделие, вызывающее сомнение, следует нанести каплю аптечного спиртового раствора йода, и через 10-15 секунд удалить его остатки салфеткой. Если след от йода остался, то перед вами не золотое изделие. Не измененный цвет металла может свидетельствовать о подлинности.
Проверка магнитом
Драгоценные металлы не подвергаются воздействию магнита. Изделия из стали, покрытые тонким слоем позолоты, мгновенно притянутся к поверхности магнита, настоящее золотое украшение на магнит не отреагирует.
Многие производители используют конструкции замков для цепочек и браслетов, в которые входит стальная пружинка — в этом случае магнит притянет только замок.
Индифферентность к магниту — условие обязательное, но не достаточное. К примеру, немагнитными являются большинство сплавов меди и олова. Однако, такие изделия значительно легче: разницу в весе можно почувствовать даже без аналитических весов.
Проверка уксусом
Дешевая подделка почернеет под действием уксусной кислоты. Если вы спустите в нее золото с пробой выше 500, то с ним ничего не случится. Это еще один верный метод распознавания подлинности. 3-5 минут хватит для того, чтобы провести эксперимент.
На зубок
Вы наверняка видели в фильмах, как золотую монету главные герои пробовали «на зубок». Данный метод подходит лишь для высокопробного золота (белее 900), которое является относительно мягким. На таком золоте след от зубов обязательно останется, так как его твердость значительно ниже, чем у других металлов.
Определение подлинности золота с помощью аналитических приборов
Моментальное распознавание компонентов металла на дому возможно при помощи специального прибора под названием анализатор металлов. Результат выводится на экран в течение 2-3 секунд. Для его получения необходимо навести прибор на исследуемый объект. Анализатор широко используется добытчиками драгоценных металлов.

Золотые серьги с бриллиантами и сапфирами, SL; (цена по ссылке)
Для того чтобы не сомневаться в подлинности золотого украшения следует правильно выбирать место его приобретения. Ювелирные салоны и ломбарды – точки реализации настоящего благородного металла. Покупка с рук — всегда риск.
Проверка подлинности украшений из платины: сам себе эксперт
Платина – это драгоценный металл, используемый в производстве ювелирных изделий. Свою известность серебристо-белый металл получил еще в XVIII веке, но только в наше время стал широко использоваться ювелирами. Как правило, из платины изготавливают только мелкие украшения, такие как кольца, сережки и цепочки. Это объясняется высокой стоимостью материала.
С распространением интернета приобрести ювелирные украшения стало намного проще. Однако у вас не будет возможности рассмотреть изделие до покупки, а значит, вы можете столкнуться с подделкой. Многие люди предпочитают не рисковать, приобретая драгоценности в специализированных магазинах, но и в этом случае вы не застрахованы от подделки. Так как же самостоятельно проверить подлинность украшений, выполненных из платины?
Определение веса и плотности изделия
Платина – тяжелый металл, вес которого сравним только с иридием, осмием, рением и ураном. Все остальные элементы легче. К тому же при производстве драгоценностей удельный вес платины составляет от 85% до 95% в общем весе изделия. То есть, украшения почти на 100% состоят из этого благородного металла. Изделия из золота и серебра, например, имеют в своем составе гораздо меньший вес драгоценного металла.
Использование иридия, осмия и рения с целью утяжеления украшения нецелесообразно, так как эти элементы имеют такую же стоимость что и платина, к тому же они редко встречаются в природе. Возьмите в руки кольцо из платины и похожее по размеру кольцо из другого металла. Изделие из платины будет тяжелее аналогичного украшения, выполненного из другого сплава.
Если у вас есть подходящий мерный сосуд, то можно измерить плотность изделия. Для этого необходимо взвесить драгоценный аксессуар, а затем поместить его в чашу с водой и определить объем вытесненной жидкости в кубических сантиметрах. После этого вес украшения в граммах следует разделить на значение вытесненной им воды в кубических сантиметрах. Полученное значение должно быть рядом с цифрой 21,45. В этом случае можно с полной уверенностью утверждать, что драгоценность из платины подлинная.
Использование химических веществ
- Йод. Возьмите обычный медицинский йод и капните на изделие из платины. Капля должна иметь темный цвет, только в этом случае можно говорить о подлинности благородного металла. Чем она темнее, тем выше проба украшения. Никаких разводов на аксессуаре не должно остаться. Также никаких пятен не останется от уксусной кислоты и перекиси водорода.
- Аммиак. На воздействие этого вещества реагируют все драгоценные металлы, кроме платины. Лишь она не чернеет и не вступает в реакцию с аммиаком.
- Азотная и соляная кислота. Эти химические вещества следует смешать в пропорции 1:3 для получения «царской водки». В нагретом виде эта смесь будет медленно растворять платиновое изделие. В холодном состоянии никаких изменений не произойдет.
Как отличить платину от серебра
Серебро намного дешевле платины, поэтому некоторые нерадивые производители под видом дорогостоящего благородного металла продают изделия из серебра. Чтобы отличить подделку в первую очередь необходимо рассмотреть цвет драгоценного украшения. Платина более светлый металл, а серебро имеет серый оттенок. К тому же из-за высокой стоимости платины из нее не изготавливают крупные изделия. Если вам предлагают массивную цепочку и по выгодной цене, то, скорее всего вас пытаются обмануть, продав серебряный аксессуар.
Можно попытаться попробовать оба изделия на зуб. На платине не останется ничего, в то время как на серебре останется легкий след. Это обусловлено тем, что у платины более высокая плотность. К тому же эти элементы по-разному вступают в химические реакции, например с сероводородом. В домашних условиях можно воспользоваться протухшим яйцом, на которое следует по очереди положить украшения из двух металлов. Серебро почернеет под действием сероводорода, а с платиной ничего не произойдет.
Нагревание изделия
Платина относится к тугоплавким металлам, поэтому ее невозможно расплавить обычной зажигалкой, пламенем плиты или газовой горелки. Платиновые украшения не поменяют цвет даже при сильном нагревании. Кстати, у платины довольно низкая теплопроводность, а значит, изделие из нее будет нагреваться дольше, чем например, из серебра и золота, однако сделать какие-либо выводы на основании этого свойства очень проблематично.

Запонки из серебра, Okami; (цена по ссылке)
Если вы все еще сомневаетесь в подлинности украшения из платины, то лучший вариант – обратиться к профессионалу. Тогда у вас не останется сомнений, и вы будете уверены, что ваши драгоценности изготовлены из благородного металла.
Самостоятельная проверка подлинности ювелирных изделий из серебра
Серебро – благородный металл, свойства которого по достоинству оценены еще много веков назад. Чистое серебро и сплавы на его основе широко используются при изготовлении ювелирных изделий, посуды, столовых приборов, в приборостроении.
Проба
Стоимость серебра достаточно высока, и,кстати, в последнее время цены на этот металл на мировых биржах постоянно растут. Не удивительно, что и количество подделок и фальсификаций также увеличивается. При покупке серебряных вещей прежде всего нужно обращать внимание на пробу. Ее подделать достаточно сложно: изготовить клише под силу лишь специалистам экстра-класса. На поверхности изделия проба должно быть хорошо читаемой, с ровными, четкими очертаниями. Пробирное клеймо на серебряных изделиях российского производства имеет вид прямоугольника, внутри которого пропечатана трехзначная цифра, показывающая долю химически чистого серебра в изделии.
Количество примесей определяет качество металла. Наиболее распространены следующие пробы: 720, 750, 800, 875, 916, 925, 960. Проба 720 означает, что в ювелирном сплаве содержится 72% серебра, 750 – 75% и так далее. Из этой зависимости следует, что чем выше проба, тем более высокой будет стоимость изделия.
Сплавы 750 и 800 содержат много меди, поэтому они желтоватые на вид. Из них обычно изготавливают столовые приборы. Серебро этой пробы подвержено окислению, поэтому чистить ложки и вилки придется достаточно часто.
Качественное серебро, используемое для производства ювелирных украшений, имеет пробу 925 и выше.

Серебряное кольцо с фианитом, SL; (цена по ссылке)
Проверка подлинности
Если на изделии, выдаваемом за серебряное, нет пробы, можно обратиться за определением к ювелиру, например, отнести в ломбард и попросить оценить. Кроме того, существует много способов проверить подлинность вещи самостоятельно.
Экспресс-способы определения подлинности серебра в домашних условиях
- Один из верных способов – магнит: серебро не должно притягиваться. Однако, одного этого теста не достаточно: очень много сплавов, имитирующих серебро, также не обладают магнитными свойствами.
- Для определения пользуются серной мазью, которую можно купить в любой аптеке. Изделие надо намазать толстым слоем и дать полежать пару часов. Подлинное серебро или сплав с высоким содержанием этого драгоценного металла обязательно почернеет.
- Тест с помощью йода. Под капелькой спиртового раствора йода серебро тоже чернеет, причем, чем выше его качество, тем сильнее. Но здесь надо действовать осторожно, эти манипуляции могут привести к порче вещи, поскольку удалить пятно будет очень трудно.
- Часто за серебро выдают посеребренную латунь или медь. Можно сделать царапинку в неприметном месте: если на краях надпила появится красноватый или рыжий оттенок, это — подделка.
- Серебро достаточно легко гнется, а после прекращения воздействия не восстанавливает форму (посеребренные медт и латунь слабо пружинят, т. к. обладают высокой упругостью).
- Серебро обладает высокой теплопроводностью. Вещь, опущенная в горячую воду, моментально нагревается. Также она быстро принимает температуру человеческого тела.
- При ношении поддельного украшения на коже остаются темные полосы. Это указывает на добавку значительно более дешевого цинка. Украшения из таких сплавов очень хрупкие, часто ломаются.
- У серебра есть специфический запах, люди с чувствительным обонянием могут определить подлинность изделия.
Все эти способы проверки достоточно поверхностные, и могут быть использованы лишь для предварительной оценки. Гарантию, что изделие изготовлено из серебра, а не просто посеребренное, может дать только эксперт-ювелир. Чтобы удостовериться в подлинности на 100%, придется делать надпил или проводить расчеты с удельным весом.
Настоящее серебро со временем темнеет. Но на это нужны годы, кроме того, его блеск можно легко вернуть. Для этого пользуются специальным кремом или нашатырным спиртом. Блеск низкокачественных изделий пропадает навсегда.
Тест на серебро
Один из самых точных методов определения подлинности серебра в домашних условиях — тест на серебро, который можно купить в специализированных магазинах или через интернет. Следуя простой инструкции, с большой долей вероятности можно определить не только подлинность изделия, но и примерную пробу.
Существуют электронные приборы, способные отличить серебро, золото, белое золото, платину. Однако стоимость их настолько высока, что покупка с целью разового определения драгоценных металлов в домашних условиях экономически не оправдана.
Напоследок
Подделка драгоценных металлов – один из самых распространенных способов мошенничества. Рост количества фальсификаций объясняется высоким доходом мошенников и сложностью пресечения деятельности подобного рода. Именно поэтому к покупке надо подходить серьезно. Гарантировать безопасность и качество изделий из драгоценных металлов могут лишь специализированные магазины, напрямую работающие с производителями.
*Meta Platforms Inc (владелец Facebook и Instagram) — организация признана экстремистской, её деятельность запрещена на территории России по решению Тверского суда Москвы от 21.03.2022.
Что такое группа в химии: таблица металлов и неметаллов в периодической системе
Свойства химических элементов позволяют объединять их в соответствующие группы. На этом принципе была создана периодическая система, изменившая представление о существующих веществах и позволившая предположить существование новых, ранее неизвестных элементов….
Периодическая система Менделеева
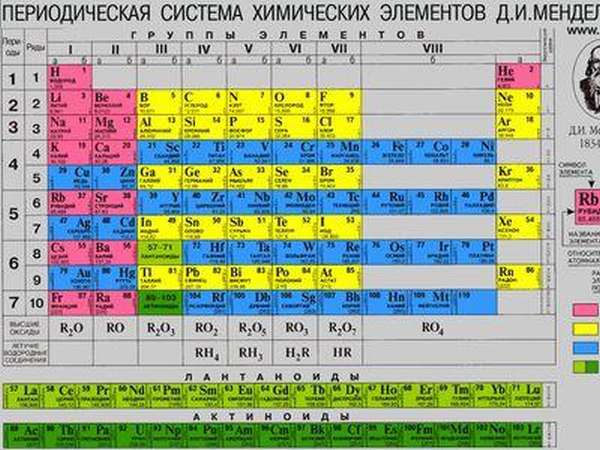
Периодическая таблица химических элементов была составлена Д. И. Менделеевым во второй половине XIX века. Что такое это, и для чего она нужна? Она объединяет все химические элементы по возрастанию атомного веса, причем, все они расставлены так, что их свойства изменяются периодическим образом.
Периодическая система Менделеева в химии свела в единую систему все существующие элементы, прежде считавшиеся просто отдельными веществами.
На основании ее изучения были предсказаны, а впоследствии — синтезированы новые химические вещества. Значение этого открытия для науки невозможно переоценить, оно значительно опередило свое время и дало толчок к развитию химии на многие десятилетия.
Существует три наиболее распространенных варианта таблицы, которые условно именуются «короткая», «длинная» и «сверхдлинная». Основной считается длинная таблица, она утверждена официально. Отличием между ними является компоновка элементов и длина периодов.
Что такое период
Система содержит 7 периодов. Они представлены графически в виде горизонтальных строк. При этом, период может иметь одну или две строки, называемые рядами. Каждый последующий элемент отличается от предыдущего возрастанием заряда ядра (количества электронов) на единицу.
Если не усложнять, период — это горизонтальная строка периодической таблицы. Каждый из них начинается металлом и заканчивается инертным газом. Собственно, это и создает периодичность — свойства элементов изменяются внутри одного периода, вновь повторяясь в следующем. Первый, второй и третий периоды — неполные, они называются малыми и содержат соответственно 2, 8 и 8 элементов. Остальные — полные, они имеют по 18 элементов.
Что такое группа
Группа — это вертикальный столбец, содержащий элементы с одинаковым электронным строением или, говоря проще, с одинаковой высшей валентностью. Официально утвержденная длинная таблица содержит 18 групп, которые начинаются со щелочных металлов и заканчиваются инертными газами.
Каждая группа имеет свое название, облегчающее поиск или классификацию элементов. Усиливаются металлические свойства в независимости от элемента по направлению сверху-вниз. Это связано с увеличением количества атомных орбит чем их больше, тем слабее электронные связи, что делает более ярко выраженной кристаллическую решетку.
Металлы в периодической таблице
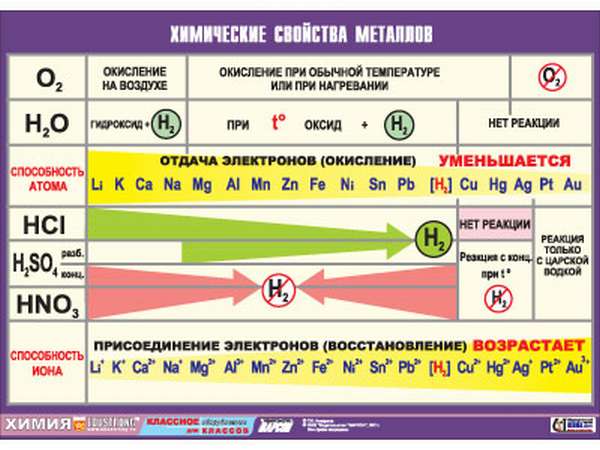
Металлы в таблице Менделеева имеют преобладающее количество, список их достаточно обширен. Они характеризуются общими признаками, по свойствам они неоднородны и делятся на группы. Некоторые из них имеют мало общего с металлами в физическом смысле, а иные могут существовать только доли секунды и в природе абсолютно не встречаются (по крайней мере, на планете Земля), поскольку созданы, точнее, вычислены и подтверждены в лабораторных условиях, искусственно. Каждая группа имеет собственные признаки, название и довольно заметно отличается от других. Особенно это различие выражено у первой группы.
Положение металлов
Какого положение металлов в периодической системе? Элементы расположены по увеличению атомной массы или количества электронов и протонов. Их свойства изменяются периодически, поэтому аккуратного размещения по принципу «один к одному» в таблице нет. Как определить металлы, и возможно ли это сделать по таблице Менделеева? Для того, чтобы упростить вопрос, придуман специальный прием: условно по местам соединения элементов проводится диагональная линия от Бора до Полония (или до Астата). Те, что оказываются слева — металлы, справа — неметаллы. Это было бы очень просто и здорово, но есть исключения — Германий и Сурьма.
Важно! Это работает только в длинной системе, на коротком варианте таблицы Менделеева многие металлы оказываются справа.
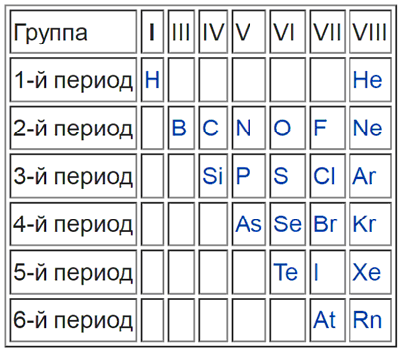
Такая «методика» — своего рода шпаргалка, она придумана лишь для упрощения процесса запоминания. Для более точного представления следует запомнить, что список неметаллов составляет всего 22 элемента, поэтому отвечая на вопрос, сколько всего металлов всего содержится в таблице Менделеева
На рисунке можно наглядно увидеть, какие элементы являются неметаллами и как они располагаются в таблице по группам и периодам.
Это интересно! Каково содержание кислорода в воздухе: процентный состав и норма
Общие физические свойства
Существуют общие физические свойства металлов. К ним относятся:
- Пластичность.
- Характерный блеск.
- Электропроводность.
- Высокая теплопроводность.
- Все, кроме ртути, находятся в твердом состоянии.
Следует понимать, что свойства металлов очень различаются относительно их химической или физической сути. Некоторые из них мало похожи на металлы в обыденном понимании этого термина. Например, ртуть занимает особенное положение. Она при обычных условиях находится в жидком состоянии, не имеет кристаллической решетки, наличию которой обязаны своими свойствами другие металлы. Свойства последних в этом случае условны, с ними ртуть роднят в большей степени химические характеристики.
Интересно! Элементы первой группы, щелочные металлы, в чистом виде не встречаются, находясь в составе различных соединений.
Самый мягкий металл, существующий в природе — цезий — относится к этой группе. Он, как и другие щелочные подобные вещества, мало общего имеет с более типичными металлами. Некоторые источники утверждают, что на самом деле, самый мягкий металл калий, что сложно оспорить или подтвердить, поскольку ни тот, ни другой элемент не существует сам по себе будучи выделенным в результате химической реакци они быстро окисляются или вступают в реакцию.
Вторая группа металлов — щелочноземельные — намного ближе к основным группам. Название «щелочноземельные» происходит из древних времен, когда окислы назывались «землями», поскольку они имеют рыхлую рассыпчатую структуру. Более-менее привычными (в обиходном смысле) свойствами обладают металлы начиная с 3 группы. С увеличением номера группы количество металлов убывает, замещаясь неметаллическими элементами. Последняя группа состоит из инертных (или благородных) газов.
Определение металлов и неметаллов в таблице Менделеева. Простые и сложные вещества.
Простые вещества (металлы и неметаллы)
Вывод
Соотношение металлов и неметаллов в таблице Менделеева явно перевешивает в пользу первых. Такое положение свидетельствует о том, что группа металлов объединена слишком широко и требует более подробной классификации, что признается научным сообществом.
Это интересно! Основной закон Гесса и следствия из него
Как самостоятельно определить валентность по таблице Менделеева
Различные химические элементы отличаются по своей способности создавать химические связи, то есть соединяться с другими атомами. Поэтому в сложных веществах они могут находиться только в определенных соотношениях. Разберемся, как определить валентность по таблице Менделеева.
Что такое валентность?
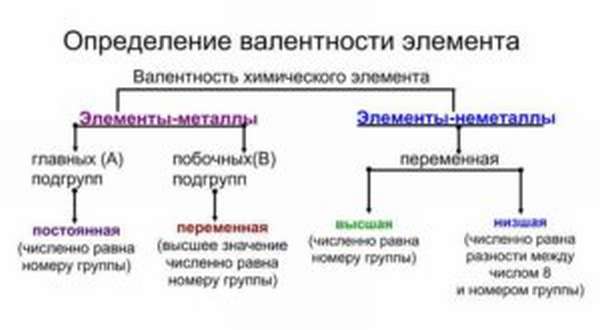
Существует такое определение валентности: это способность атома к образованию определенного числа химических связей. В отличие от степени окисления, эта величина всегда только положительная и обозначается римскими цифрами.
В качестве единицы используется эта характеристика для водорода, которая принята равной I. Это свойство показывает, с каким числом одновалентных атомов может соединиться данный элемент. Для кислорода эта величина всегда равна II.
Знать эту характеристику необходимо, чтобы верно записывать химические формулы веществ и уравнения реакций. Знание этой величины поможет установить соотношение между числом атомов различных типов в молекуле.
Данное понятие возникло в химии в XIX веке. Начало теории, объясняющей соединение атомов в различных соотношениях, положил Франкленд, но его идеи о «связывающей силе» не были очень распространены. Решающая роль в развитии теории принадлежала Кекуле. Он называл свойство образовывать некоторое количество связей основностью. Кекуле считал, что это фундаментальное и неизменное свойство каждого вида атомов. Важные дополнения к теории сделал Бутлеров. С развитием этой теории стало возможным наглядно изображать молекулы. Это очень помогло в изучении строения различных веществ.
Чем поможет периодическая таблица?

Находить валентность можно, посмотрев на номер группы в короткопериодном варианте. Для большинства элементов, у которых эта характеристика постоянная (принимает только одно значение), она совпадает с номером группы.
Такие свойства имеют металлы главных подгрупп. Почему? Номер группы соответствует числу электронов на внешней оболочке. Эти электроны называются валентными. Именно они отвечают за возможность соединяться с другими атомами.
Группу составляют элементы с похожим устройством электронной оболочки, а сверху вниз возрастает заряд ядра. В короткопериодной форме каждая группа делится на главную и побочную подгруппы. Представители главных подгрупп — это s и p-элементы, представители побочных подгрупп имеют электроны на d и f-орбиталях.
Как определить валентность химических элементов, если она меняется? Она может совпадать с номером группы или равняться номеру группы минус восемь, а также принимать другие значения.
Важно! Чем выше и правее элемент, тем его свойство образовывать взаимосвязи меньше. Чем он более смещен вниз и влево, тем она больше.

То, как изменяется валентность в таблице Менделеева для конкретного вида атома, зависит от структуры его электронной оболочки. Сера, например, может быть двух-, четырех- и шестивалентной.
В основном (невозбужденном) состоянии у серы два неспаренных электрона находятся на подуровне 3р. В таком состоянии она может соединиться с двумя атомами водорода и образовать сероводород. Если сера перейдет в более возбужденное состояние, то один электрон перейдет на свободный 3d-подуровень, и неспаренных электронов станет 4.
Сера станет четырехвалентной. Если сообщить ей еще больше энергии, то еще один электрон перейдет с подуровня 3s на 3d. Сера перейдет в еще более возбужденное состояние и станет шестивалентной.
Постоянная и переменная
Иногда способность к образованию химических связей может меняться. Она зависит от того, в какое соединение входит элемент. Например, сера в составе H2S двухвалентна, в составе SO2 четырехвалентна, а в SO3 — шестивалентна. Наибольшее из этих значений называется высшим, а наименьшая — низшим. Высшую и низшую валентности по таблице Менделеева можно установить так: высшая совпадает с номером группы, а низшая равняется 8 минус номер группы.

Как определить валентность химических элементов и то, изменяется ли она? Нужно установить, имеем мы дело с металлом или неметаллом. Если это металл, нужно установить, относится он к главной или побочной подгруппе.
- У металлов главных подгрупп способность к образованию химических взаимосвязей постоянная.
- У металлов побочных подгрупп — переменная.
- У неметаллов — также переменная. В большинстве случаев она принимает два значения — высшее и низшее, но иногда может быть и большее число вариантов. Примеры — сера, хлор, бром, йод, хром и другие.
Это интересно! Что такое алканы: строение и химические свойства
В соединениях низшую валентность проявляет тот элемент, который находится выше и правее в периодической таблице, соответственно, высшую — тот, который левее и ниже.
Часто способность образовывать химические связи принимает больше двух значений. Тогда по таблице узнать их не получится, а нужно будет выучить. Примеры таких веществ:
Как определить валентность элемента в формуле соединения? Если она известна для других составляющих вещества, это несложно. Например, требуется рассчитать это свойство для хлора в NaCl. Натрий — элемент главной подгруппы первой группы, поэтому он одновалентен. Следовательно, хлор в этом веществе тоже может создать только одну связь и тоже одновалентен.
Важно! Однако так не всегда можно узнать это свойство для всех атомов в сложном веществе. Для примера возьмем HClO4. Зная свойства водорода, можно только установить, что ClO4 — одновалентный остаток.
Как еще узнать эту величину?
Способность образовывать определенное количество связей не всегда совпадает с номером группы, и в некоторых случаях ее придется просто заучить. Здесь на помощь придет таблица валентности химических элементов, где приведены значения этой величины. В учебнике химии за 8 класс приведены значения способности соединяться с другими атомами наиболее распространенных видов атомов.
| Н, F, Li, Na, K | 1 |
| O, Mg, Ca, Ba, Sr, Zn | 2 |
| B, Al | 3 |
| C, Si | 4 |
| Cu | 1, 2 |
| Fe | 2, 3 |
| Cr | 2, 3, 6 |
| S | 2, 4, 6 |
| N | 3, 4 |
| P | 3, 5 |
| Sn, Pb | 2, 4 |
| Cl, Br, I | 1, 3, 5, 7 |
Применение

Стоит сказать, что ученые-химики в настоящее время понятие валентности по таблице Менделеева почти не используют. Вместо него для способности вещества образовывать определенное число взаимосвязей применяют понятие степени окисления, для веществ с ковалентной структурой — ковалентность, а для веществ ионного строения — заряд иона.
Однако рассматриваемое понятие применяют в методических целях. С его помощью легко объяснить, почему атомы разных видов соединяются в тех соотношениях, которые мы наблюдаем, и почему эти соотношения для разных соединений различны.
На данный момент подход, согласно которому соединение элементов в новые вещества всегда объяснялось с помощью валентности по таблице Менделеева независимо от типа связи в соединении, устарел. Сейчас мы знаем, что для ионной, ковалентной, металлической связей существуют разные механизмы объединения атомов в молекулы.
Полезное видео
Подведем итоги
По таблице Менделеева определить способность к образованию химических связей возможно не для всех элементов. Для тех, которые проявляют одну валентность по таблице Менделеева, она в большинстве случаев равна номеру группы. Если есть два варианта этой величины, то она может быть равна номеру группы или восемь минус номер группы. Существуют также специальные таблицы, по которым можно узнать эту характеристику.
Как узнать металл или нет
Выдающийся русский учёный, химик, физик и энергетик. Самым значимым его вкладом в науку стало открытие периодического закона, графическое выражение которого получило название Периодической системы химических элементов.
Периодический закон
К середине XIX века учёные располагали множеством сведений о физических и химических свойствах разных элементов и их соединений. Появилась необходимость упорядочить эти знания и представить их в наглядном виде. Исследователи из разных стран пытались создать классификацию, объединяя элементы по сходству состава и свойств веществ, которые они образуют. Однако ни одна из предложенных систем не охватывала все известные элементы.
Пытался решить эту задачу и молодой русский профессор Д.И. Менделеев. Он собирал и классифицировал информацию о свойствах элементов и их соединений, а затем уточнял её в ходе многочисленных экспериментов. Собрав данные, Дмитрий Иванович записал сведения о каждом элементе на карточки, раскладывал их на столе и многократно перемещал, пытаясь выстроить логическую систему. Долгие научные изыскания привели его к выводу, что свойства элементов и их соединений изменяются с возрастанием атомной массы, однако не монотонно, а периодически.
Так был открыт периодический закон, который учёный сформулировал следующим образом: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».

Своё открытие Менделеев совершил почти за 30 лет до того, как учёным удалось понять структуру атома. Открытия в области атомной физики позволили установить, что свойства элементов определяются не атомной массой, а зависят от количества электронов, содержащихся в нём. Поэтому современная формулировка закона звучит так:
Свойства химических элементов, а также формы и свойства образуемых ими веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов.
Этот принцип Менделеев проиллюстрировал в таблице, в которой были представлены все 63 известных на тот момент химических элемента. При её создании учёный предпринял ряд весьма смелых шагов.
Во-первых, многочисленные эксперименты позволили Менделееву сделать вывод, что атомные массы некоторых элементов ранее были вычислены неправильно, и он изменил их в соответствии со своей системой.
Во-вторых, в таблице были оставлены места для новых элементов, открытие которых учёный предсказал, подробно описав их свойства.
.jpg)
Мировое научное сообщество поначалу скептически отнеслось к открытию русского химика. Однако вскоре были открыты предсказанные им химические элементы: галлий, скандий и германий. Это разрушило сомнения в правильности системы Менделеева, которая навсегда изменила науку. Там, где раньше учёному требовалось провести ряд сложнейших (и даже не всегда возможных в реальности) опытов — теперь стало достаточно одного взгляда в таблицу.
Существует легенда, якобы знаменитая таблица явилась Менделееву во сне. Но сам Дмитрий Иванович эту информацию не подтвердил. Он действительно нередко засиживался над работой до поздней ночи и засыпал, продолжая размышлять над решением задачи, однако факт мистического озарения во сне учёный отрицал: «Я над ней, может быть, двадцать лет думал, а вы думаете, сел и вдруг — готово!».
Теперь расскажем, как устроена Периодическая таблица элементов Менделеева и как ею пользоваться.
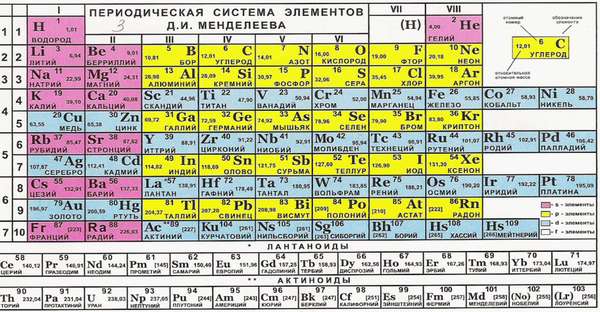
Структура Периодической системы элементов

На настоящий момент Периодическая таблица Менделеева содержит 118 химических элементов. Каждый из них занимает своё место в зависимости от атомного числа. Оно показывает, сколько протонов содержит ядро атома элемента и сколько электронов в атоме находятся вокруг него. Атом каждого последующего элемента содержит на один протон больше, чем предыдущий.
Периоды — это строки таблицы. На данный момент их семь. У всех элементов одного периода одинаковое количество заполненных электронами энергетических уровней.
Группы — это столбцы. В группы в Периодической таблице объединяются элементы с одинаковым числом электронов на внешнем энергетическом уровне их атомов. В кратком варианте таблицы, используемой в школьных учебниках, элементы разделены на восемь групп. Каждая из них делится на главную (A) и побочную (B) подгруппы, которые объединяют элементы со сходными химическими свойствами.
.jpg)
Каждый элемент обозначается одной или двумя латинскими буквами. Порядковый номер элемента (число протонов в его ядре) обычно пишется в левом верхнем углу. Также в ячейке элемента указана его относительная атомная масса (сумма масс протонов и нейтронов). Это усреднённая величина, для расчёта которой используются атомные массы всех изотопов элемента с учётом их содержания в природе. Поэтому обычно она является дробным числом.
Чтобы узнать количество нейтронов в ядре элемента, необходимо вычесть его порядковый номер из относительной атомной массы (массового числа).
Свойства Периодической системы элементов
Расположение химических элементов в таблице Менделеева позволяет сопоставлять не только их атомные массы, но и химические свойства.
Вот как они изменяются в пределах группы (сверху вниз):
- Металлические свойства усиливаются, неметаллические ослабевают.
- Увеличивается атомный радиус.
- Усиливаются основные свойства гидроксидов и кислотные свойства водородных соединений неметаллов.
В пределах периодов (слева направо) свойства элементов меняются следующим образом:
- Металлические свойства ослабевают, неметаллические усиливаются.
- Уменьшается атомный радиус.
- Возрастает электроотрицательность.

Элементы Периодической таблицы Менделеева
По положению элемента в периоде можно определить его принадлежность к металлам или неметаллам. Металлы расположены в левом нижнем углу таблицы, неметаллы — в правом верхнем углу. Между ними находятся полуметаллы. Все периоды, кроме первого, начинается щелочным металлом. Каждый период заканчивается инертным газом.
Щелочные металлы
.jpg)
Первая группа главная подгруппа элементов (IA) — щелочные металлы. Это серебристые вещества (кроме цезия, он золотистый), настолько мягкие, что их можно резать ножом. Поскольку на их внешнем электронном слое находится только один электрон, они очень легко вступают в реакции. Плотность щелочных металлов меньше плотности воды, поэтому они в ней не тонут, а бурно реагируют с образованием щёлочи и водорода. Реакция идёт настолько энергично, что водород может даже загореться или взорваться. Эти металлы настолько активно реагируют с кислородом в воздухе, что их приходится хранить под слоем керосина (а литий — под слоем вазелина).
Учите химию вместе с домашней онлайн-школой «Фоксфорда»! По промокоду CHEMISTRY892021 вы получите бесплатный недельный доступ к курсам химии за 8 класс и 9 класс.
Щелочноземельные металлы
.jpg)
Вторая группа главная подгруппа (IIА) представлена щелочноземельными металлами с двумя электронами на внешнем энергетическом уровне атома. Бериллий и магний часто не относят к щелочноземельным металлам. Они тоже имеют серебристый оттенок и легко взаимодействуют с другими элементами, хотя и не так охотно, как металлы из первой группы главной подгруппы. Температура плавления щелочноземельных металлов выше, чем у щелочных. Ионы магния и кальция обусловливают жёсткость воды.
Лантаноиды и актиноиды
В третьей группе побочной подгруппе (IIIB) шестого и седьмого периодов находятся сразу несколько металлов, сходных по строению внешнего энергетического уровня и близких по химическим свойствам. У этих элементов электроны начинают заполнять третий по счёту от внешнего электронного слоя уровень. Это лантаноиды и актиноиды. Для удобства их помещают под основной таблицей.
.jpg)
Лантаноиды иногда называют «редкоземельными элементами», поскольку они были обнаружены в небольшом количестве в составе редких минералов и не образуют собственных руд.
.jpg)
Актиноиды имеют одно важное общее свойство — радиоактивность. Все они, кроме урана, практически не встречаются в природе и синтезируются искусственно.
Переходные металлы
.jpg)
Элементы побочных подгрупп, кроме лантаноидов и актиноидов, называют переходными металлами. Они вполне укладываются в привычные представления о металлах — твёрдые (за исключением жидкой ртути), плотные, обладают характерным блеском, хорошо проводят тепло и электричество. Валентные электроны их атомов находятся на внешнем и предвнешнем энергетических уровнях.
Неметаллы
.jpg)
Правый верхний угол таблицы до инертных газов занимают неметаллы. Неметаллы плохо проводят тепло и электричество и могут существовать в трёх агрегатных состояниях: твёрдом (как углерод или кремний), жидком (как бром) и газообразном (как кислород и азот). Водород может проявлять как металлические, так и неметаллические свойства, поэтому его относят как к первой, так и к седьмой группе Периодической системы.
Подгруппа углерода

Четвёртую группу главную подгруппу (IVА) называют подгруппой углерода. Углерод и кремний обладают всеми свойствами неметаллов, германий и олово занимают промежуточную позицию, а свинец имеет выраженные металлические свойства. Углерод образует несколько аллотропных модификаций — вариантов простых веществ, отличающихся по своему строению, а именно: графит, алмаз, фуллерит и другие.
Большинство элементов подгруппы углерода — полупроводники (проводят электричество за счёт примесей, но хуже, чем металлы). Графит, германий и кремний используют при изготовлении полупроводниковых элементов (транзисторы, диоды, процессоры и так далее).
Подгруппа азота

Пятую группу главную подгруппу (VA) называют пниктогенами или подгруппой азота. В ходе реакций эти элементы могут как отдавать электроны, так и принимать их, завершая внешний энергетический уровень.
Физические свойства элементов подгруппы азота различны. Азот является бесцветным газом. Фосфор, мягкое вещество, образует несколько вариантов аллотропных модификаций — белый, красный и чёрный фосфор. Мышьяк — твёрдый полуметалл, способный проводить электрический ток. Висмут — блестящий серебристо-белый металл с радужным отливом.
Азот — основное вещество в составе атмосферы нашей планеты. Некоторые элементы подгруппы азота токсичны для человека (фосфор, мышьяк, висмут). При этом азот и фосфор являются важными элементами почвенного питания растений, поэтому они входят в состав большинства удобрений. Азот и фосфор также участвуют в формировании важнейших молекул живых организмов — белков и нуклеиновых кислот.
Подгруппа кислорода

Халькогены или подгруппа кислорода — элементы шестой группы главной подгруппы (VIA). Для завершения внешнего электронного уровня атомам этих элементов не хватает лишь двух электронов, поэтому они проявляют сильные окислительные (неметаллические) свойства. Однако, по мере продвижения от кислорода к полонию они ослабевают.
Кислород образует две аллотропные модификации — кислород и озон — тот самый газ, который образует экран в атмосфере планеты, защищающий живые организмы от жёсткого космического излучения.
Кислород и сера легко образуют прочные соединения с металлами — оксиды и сульфиды. В виде этих соединений металлы часто входят в состав руд.
Галогены

Седьмая группа главная подгруппа (VIIA) представлена галогенами — неметаллами с семью электронами на внешнем электронном слое атома. Это сильнейшие окислители, легко вступающие в реакции. Галогены («рождающие соли») назвали так потому, что они реагируют со многими металлами с образованием солей. Например, хлор входит в состав обычной поваренной соли.
Самый активный из галогенов — фтор. Он способен разрушать даже молекулы воды, за что и получил своё грозное имя (слово «фтор» переводится на русский язык как «разрушительный»). А его «близкий родственник» — иод — используется в медицине в виде спиртового раствора для обработки ран.
Инертные газы

Инертные газы, расположенные в последней, восьмой группе главной подгруппе (VIIIA) — элементы с полностью заполненным внешним электронным уровнем. Они практически не способны участвовать в реакциях. Поэтому их иногда называют «благородными», проводя параллель с представителями высшего общества, которые брезгуют контактировать с посторонними.
У инертных газов есть удивительная способность: они светятся под действием электромагнитного излучения, поэтому используются для создания ламп. Так, неон используется для создания светящихся вывесок и реклам, а ксенон — в автомобильных фарах и фотовспышках.
Гелий обладает массой всего в два раза больше массы молекулы водорода, но, в отличие от последнего, не взрывоопасен и используется для заполнения воздушных шаров.
Записали!
Скоро с вами свяжется консультант, расскажет об обучении в нашей онлайн-школе.
Проверьте вашу электронную почту — там письмо о том, что стоит сделать перед консультацией.

У нас вы сможете учиться в удобном темпе, делать упор на любимые предметы и общаться со сверстниками по всему миру.
Попробовать бесплатно
Читайте также:
