Как выглядит уран металл
Обновлено: 19.09.2024
Открытие планетарного масштаба. Так можно назвать обнаружение учеными Урана. Планета открыта в 1781-ом году.
Ее обнаружение стало поводом для наречения одного из элементов таблицы Менделеева. Уран металлический выделили из смоляной обманки в 1789-ом.
Шумиха вокруг новой планеты еще не улеглась, поэтому, идея о названии нового вещества лежала на поверхности.
Ученые, работавшие с ним, облучались, сами того не зная. Кто был первопроходцем, и каковы другие свойства элемента, расскажем далее.
Свойства урана
Уран – элемент, открытый Мартином Клапротом. Он сплавил смоляную обманку с едким калием . Продукт сплавления был неполностью растворим.
Клапрот понял, что предполагаемых цинка , молибдена и вольфрама в составе минерала нет. Тогда, ученый растворил обманку в царской водке .
Из раствора выпали шестигранные кристаллы зеленого цвета. На них химик воздействовал желтой кровяной солью , то есть, гексацианоферратом калия.
Из раствора выпал бурый осадок. Этот окисел Клапрот восстановил льняным маслом, прокалил. Получился черный порошок.
Пришлось прокаливать уже его, смешав с бурым углем . В спекшейся массе обнаружились зерна нового металла.
Позже выяснилось, что это был не чистый уран, а его диоксид. Отдельно элемент получили лишь через 60 лет, в 1841-ом году. А еще через 55 Антуан Беккерель открыл явление радиоактивности.
Радиоактивность урана обусловлена способностью ядра элемента захватывать нейтроны и дробиться. При этом, выделяется внушительная энергия.
Она обусловлена кинетическими данными излучения и осколков. Есть возможность обеспечить непрерывное деление ядер.
Цепная реакция запускается при обогащении природного урана его 235-ым изотопом. Его не то, чтобы добавляют в металл.
Их смесь именуют обедненной, а оставшийся уран называют обогащенным. Именно такой нужен промышленникам. Но, об этом поговорим в отдельной главе.
Уран излучает, как альфа-, так и бета- с гамма-лучами. Их обнаружили, увидев влияние соли металла на фотографическую пластину, обернутую черной бумагой .
Стало понятно, что новый элемент что-то излучает. Пока супруги Кюри исследовали, что именно, Мария получила дозу радиации, ставшей причиной развития у химика рака крови, от которого женщина умерла в 1934-ом году.
Бета-излучение способно разрушить не только человеческий организм, но и сам металл. Какой элемент образуется из урана? Ответ: — бревий.
Иначе его называют протактинием. Обнаружен в 1913-ом, как раз при изучении урана.
Последний превращается в бревий без сторонних воздействий и реактивов, лишь от бета-распада.
Внешне уран – химический элемент серебристо — белого цвета с металлическим блеском.
Так выглядят все актиноиды, к коим и относится 92-ое вещество. Начинается группа с 90-го номера, а заканчивается 103-им.
Стоя в начале списка, радиоактивный элемент уран, проявляет себя, как окислитель. Степени окисления могут быть 2-ой, 3-ей, 4-ой, 5-ой, 6-ой.
То есть, химически 92-ой металл активен. Если истереть уран в порошок, он самовоспламениться на воздухе.
В обычном виде вещество окислится при контакте с кислородом, покрывшись радужной пленкой.
Если довести температуру до 1000 градусов Цельсия, хим. элемент уран соединиться с азотом . Образуется нитрид металла. Это вещество желтого цвета.
Брось его в воду, — раствориться, как и чистый уран. Разъедают его и все кислоты. Из органических элемент вытесняет водород.
Выталкивает его уран, так же, из соляных растворов серебра , меди , олова , ртути , золота . Если такой раствор встряхнуть, частицы 92-го металла начнут светиться.
Урановые соли нестабильны, распадаются на свету, или в присутствии органики.
Индифферентен элемент, пожалуй, лишь к щелочам. С ними в реакцию металл не вступает.
Открытие урана – это обнаружение сверхтяжелого элемента. Его масса позволяет выделить металл, точнее, минералы с ним, из руды.
Достаточно раздробить ее и засыпать в воду. Урановые частицы осядут первыми. С этого начинается добыча металла. Подробности, в следующей главе.
Добыча урана
Получив тяжелый осадок, промышленники выщелачивают концентрат. Цель – перевести уран в раствор. Используют серную кислоту.
Исключение делают для смолки. Этот минерал в кислоте не растворим, поэтому, используют щелочи. Секрет трудностей в 4-валентном состоянии урана.
Не проходит кислотное выщелачивание и с доломитом , магнезитом . В этих минералах 92-ой металл тоже 4-валентный.
На такой воздействуют гидроксидом натрия , известным, как едкий натр. В остальных случаях хороша кислородная продувка. Не надо отдельно запасаться серной кислотой.
Химический элемент и его применение связаны с чистыми формами металла. Дабы убрать примеси, используют сорбцию.
Ее проводят на ионообменных смолах. Подходит, так же, экстракция органическими растворителями.
Остается добавить в раствор щелочь, чтобы осадить уранаты аммония, растворить их в азотной кислоте и подвергнуть аффинажу .
Итогом станут оксиды 92-го элемента. Их нагревают до 800-от градусов и восстанавливают водородом.
Итоговый оксид переводят во фторид урана, из которого кальциетермическим восстановлением и получают чистый металл. Цепочка , как видно, не из простых. Зачем же так стараться?
Применение урана
92-ой металл – основное топливо ядерных реакторов. Обедненная смесь подходит для стационарных, а для силовых установок используют обогащенный элемент.
235-ый изотоп, так же, — основа ядерного оружия. Из 92-го металла можно получить и вторичное ядерное топливо.
Если рассматривать применение соединений урана, пригождаются его оксиды. Их используют в стекольной промышленности.
Оксиды выступают красителями. Можно получить стекла от бледно-желтых до темно-зеленых. В ультрафиолетовых лучах материал флуоресцирует.
Это свойство используют не только в стеклах, но и урановых глазурях для фарфора . Оксидов урана в них от 0,3 до 6%.
В итоге, фон изделий безопасен, не превышает 30-ти микрон в час. Фото элементов урана, точнее, изделий с его участием, весьма красочны. Свечение стекол и посуды притягивает взоры.
Цена урана
За килограмм необогащенной окиси урана дают около 150-ти долларов. Пиковые значения наблюдались в 2007-ом.
Тогда стоимость достигала 300-от долларов за кило. Разработки урановых руд останутся рентабельными и при цене в 90-100 условных единиц.
Кто открыл элемент уран, не знал, каковы его запасы в земной коре. Теперь, они подсчитаны.
Крупные месторождения с рентабельной ценой добычи истощатся к 2030-му году.
Если не откроют новых залежей, или не найдут альтернативы металлу, его стоимость поползет вверх.
Как выглядит уран металл


Что происходит на перерабатывающем комплексе? Данную схему можно считать классической, хотя она отнюдь не единственная и имеет много нюансов. Породу измельчают, смешивают с водой и удаляют ненужные примеси. Дальше проводят выщелачивание концентрата, обычно с помощью серной кислоты. Из раствора с помощью ионно-обменных смол выделяется осадок солей урана, имеющих характерный желтый цвет, за что они получили название желтый кек (от англ. yellow cake). Желтый кек еще содержит достаточно много примесей, от которых его надо очищают на аффинажном произвосдтве и после прокаливанием получают закись-окись урана (U3O8) - конечный продукт, которым даже торгуют на бирже.

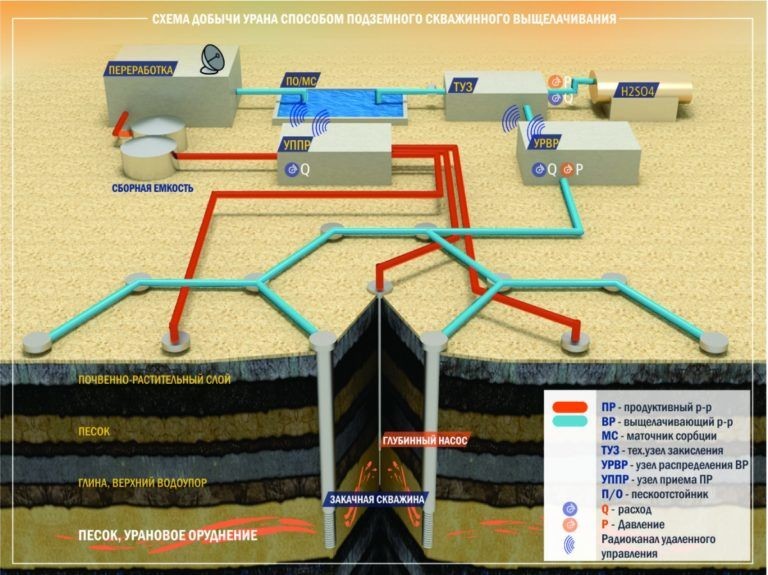
Я специально рассказал про переработку, но ничего не сказав про третий способ добычи. Он кардинально отличается от первых двух и называется скважинное подземное выщелачивание (СПВ). При СПВ бурят 6 скважин по углам шестиугольника, через которые в рудное тело закачивают серную кислоту. В центре шестиугольника бурят еще одну скважину и через нее выкачивают на поверхность раствор, насыщенный солями урана. Продуктивный раствор пропускают через сорбционные колонны, в которых соли урана собираются на специальной смоле. Смолу в свою очередь снова обрабатывают серной кислотой и так несколько раз, пока концентрация урана в растворе не станет достаточной. А дальше снова желтый кек, очистка и получение закиси окиси-урана
Опасности урановых рудников

Принято считать, что урановые рудники – это жутко опасная вещь, но в настоящее время урановые шахты при соблюдении техники безопасности не более опасны для здоровья шахтеров, нежели угольные. Наибольшую опасность там представляет скорее не радиация, а пыль, содержащая частицы урана и других тяжелых металлов, попадание которых в организм может привести к тяжелым заболеваниям внутренних органов.Также может быть опасно наличие в воздухе радиоактивного газа радона, но при работающей вентиляции его концентрации минимальны. При использовании же подземного выщелачивания вредность производства для рабочих становится не выше, чем для офисных работников - ни пыли, ни радона)) Шучу, конечно
Для экологии самым опасным является открытый способ добычи - это и огромная яма на месте рудника, и пыль с содержанием радиоактивных элементов, и хвостохранилища отработанной породы, которая за счет продуктов распада урана сохраняет около 85% радиационного фона извлекаемой руды. Опасно не только радиационное загрязнение продуктами распада урана, такими, как радон, радий, торий, но и общее загрязнение территории, в том числе солями тяжелых металлов (мышьяка, свинца, меди), ядовитыми для организма, и сульфидами, которые при взаимодействии с водой могут образовывать серную кислоту. Ну и никто не отменял всевозможные производственные аварии и разрушения вследствие стихийных бедствий, риск которых всегда присутствует.
При шахтном способе опасности в целом те же, что и при открытом, но отходов все-таки образуется меньше. Среди плюсов также отсутствие ямы.
Поэтому считается, что наименее вредным для экологии является подземное выщелачивание. Утверждается, что через 4-5 лет на месте выработки уже можно будет заниматься сельским хозяйством. Но не стоит забывать, что подземное выщелачивание может сильно ухудшить качество подземных вод, да и работа с серной кислотой вряд ли способствует повышению плодородия. Плюс применение подземного выщелачивания ограничено: его можно использовать только в песчанике и ниже уровня грунтовых вод

Уран вызвал глубочайший интерес, как химиков так и физиков. Сначала супруги Кюри, а затем и другие учёные продолжили исследования Беккереля. В результате были открыты радиоактивные элементы (радий, полоний и актиний) и плюс множество радиоактивных изотопов тяжёлых элементов. Так что в наше время открыты все члены ураново-радиевого ряда радиоактивного распада.

Теперь немного о самом Уране. Уран — очень тяжёлый, серебристо-белый глянцевый металл. В чистом виде он немного мягче стали, ковкий, гибкий, обладает небольшими парамагнитными свойствами. Температура плавления 1132,3 °C. Единственный природный металл, который используют, как топливо. Тот Уран о котором я занудничаю — это изотоп U-235, которого в природе всего 0,7204%. Его так мало, что требуется обогащение т.е. концентрировать этот изотоп - так просто работать реактор не будет. Кстати, раньше в природе U-235 было больше - просто со временем он распался.

Обеднённый уран (это когда 235-й забрали атомщики, а остался 238). U 238 - тяжёлый и твёрдый, напоминает чем-то по свойствам вольфрам, а потому используется там же где вольфрам, где надо бить(к примеру бронебойные снаряды с урановым бойком). Впервые уран в качестве сердечника для снарядов был применён в Третьем рейхе.
Во время первой мировой войны и вскоре после неё уран в виде карбида применяли в производстве инструментальных сталей, заменяли вольфрам, производство которого в то время было ограничено. Для получения инструментальных сталей в 1914–1926 ежегодно производили по нескольку тонн ферроурана. Однако такое применение урана продолжалось недолго.

Так же использование было сосредоточено в технологии керамики и в металлургии. Оксиды урана широко применяли для окраски стекла(Урановое стекло) в цвета от бледно-жёлтого до тёмно-зелёного, что способствовало развитию недорогих стекольных производств. Сегодня изделия этих производств идентифицируют как флуоресцирующие под ультрафиолетовыми лучами.


Дополнительные сферы применения урана.
Карбид урана-235 в сплаве с карбидом ниобия и карбидом циркония применяется в качестве топлива для ядерных реактивных двигателей.
Уранат натрия использовался как жёлтый пигмент в живописи. Соединения урана применялись как краски для живописи по фарфору и для керамических глазурей и эмалей (окрашивают в: жёлтый, бурый, зелёный и чёрный, в зависимости от степени окисления).
В начале XX века уранилнитрат широко применялся для усиления негативов и окрашивания (тонирования) позитивов (фотографических отпечатков) в бурый цвет.

Ну и в дополнение ещё два слова о обеднённом уране.
Такой уран используется для радиационной защиты и как балластная масса в аэрокосмических областях, таких как рулевые поверхности летательных аппаратов.
Для этого в самолёте "Боинг-747" содержится 1500 кг обеднённого урана.
Материал применяется в высокоскоростных роторах гироскопов, больших маховиках, как балласт в космических спускаемых аппаратах и гоночных яхтах, при бурении нефтяных скважин.
Обеднённый уран используется в современной танковой броне на "Абрамсе".
УРАН — металл для мира и войны
Уран — металл активный, в природе образует много ярко окрашенных соединений. Эти соединения с давних лет использовали для производства глазурей и эмалей. Ими покрывали керамику.
До 1944 года посуду линии Fiesta Dinnerware покрывали яркой оранжевой глазурью. В ее состав входили соединения металла.

Посуда красивая, но бомбы важнее
До Второй Мировой войны урансодержащие глазури применяли многие производители керамики. Но история сделала поворот, и в 1943 году правительство США конфисковало все запасы металла. Он понадобился для стратегических целей — изготовления ядерного оружия.

Свойства Урана

Уран (Uranium), 92-й элемент таблицы Менделеева, относится к металлам (семейство актиноидов).
- структура решетки орторомбическая;
- имеет 3 кристаллические модификации;
- металл тяжелый, с высокой плотностью;
- слабый парамагнетик;
- металл радиоактивный.
Природный уран состоит из трех изотопов: 234U, 235U, 238U.
Радиоактивные свойства некоторых изотопов урана (жирным выделены природные изотопы):
| Массовое число | Период полураспада | Основной тип распада |
|---|---|---|
| 233 | 1,59⋅105 лет | α |
| 234 | 2,45⋅105 лет | α |
| 235 | 7,13⋅108 лет | α |
| 236 | 2,39⋅107 лет | α |
| 237 | 6,75 сут. | β− |
| 238 | 4,47⋅109 лет | α |
| 239 | 23,54 минуты | β− |
| 240 | 14 часов | β− |
Стабильных изотопов нет.
| Степень окисления | Оксид | Гидроксид | Характер | Форма | Примечание |
|---|---|---|---|---|---|
| +3 | Не существует | Не существует | — | U3+, UH3 | Сильный восстановитель |
| +4 | UO2 | Не существует | Основный | UO2, галогениды | |
| +5 | Не существует | Не существует | — | Галогениды | В воде диспропорционирует |
| +6 | UO3 | UO2(OH)2 | Амфотерный | UO22+ (уранил) UO42- (уранат) U2O72- (диуранат) | Устойчив на воздухе и в воде |
- Степени окисления от +3 до +6;
- Реагирует со многими неметаллами.
- С кислородом образует оксиды.
- Растворяется в кислотах: быстро — в HCl, HNO3, медленно в H2SO4, H3PO4, HF (формулы кислот).
- Не реагирует со щелочами.
Познавательно: радиоактивность металла изучали супруги Кюри-Склодовские более 100 лет назад. Их рабочие журналы до сих пор «фонят» так, что хранятся в свинцовых коробках.
Ученые говорят, что открыть их можно будет только через 1600 лет.
| Свойства атома | |
|---|---|
| Название, символ, номер | Уран / Uranium (U), 92 |
| Атомная масса (молярная масса) | 238,02891(3)[1] а. е. м. (г/моль) |
| Электронная конфигурация | [Rn] 5f3 6d1 7s2 |
| Радиус атома | 138 пм |
| Химические свойства | |
| Ковалентный радиус | 142 пм |
| Радиус иона | (+6e) 80 (+4e) 97 пм |
| Электроотрицательность | 1,38 (шкала Полинга) |
| Электродный потенциал | U←U4+ -1,38В U←U3+ -1,66В U←U2+ -0,1В |
| Степени окисления | 6, 5, 4, 3 |
| Энергия ионизации (первый электрон) | 686,4(7,11) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 19,05 г/см³ |
| Температура плавления | 1405,5 K |
| Температура кипения | 4018 K |
| Уд. теплота плавления | 12,6 кДж/моль |
| Уд. теплота испарения | 417 кДж/моль |
| Молярная теплоёмкость | 27,67[2] Дж/(K·моль) |
| Молярный объём | 12,5 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | орторомбическая |
| Параметры решётки | a = 2,854 Å; b = 5,870 Å; c = 4,955 Å[3] |
| Прочие характеристики | |
| Теплопроводность | (300 K) 27,5 Вт/(м·К) |
| Номер CAS | 7440-61-1 |
Минералы, руды, добыча
В природе есть несколько урановых минералов:
- уранинит;
- настуран;
- карнотит;
- тюямунит.
Минералы можно отличить формами нахождения: в докембрийских, палеозойских, осадочных породах.
Основными месторождениями владеют Казахстан, Россия, Канада, Австралия.

Добыча руды происходит тремя способами:
- Открытое. При залегании рудного тела близко к поверхности.
- Подземное. Руда глубоко под землей, пробиваются шахты, руду поднимают вверх на лифтах.
- Подземное выщелачивание. Бурят скважины, закачивают в них серную кислоту. Полученный раствор выкачивают и концентрируют.
Уран входит в состав ториевых и редкоземельных минералов.

Получение
Основной задачей является производство продукта для ядерных реакторов. Это могут быть чистый металл, UO2, UF4.

Способ получения чистого урана:
- Концентрирование.
- Выщелачивание концентрата (перевод металла в раствор).
- Выделение урана методом экстракции или ионообменными смолами.
- Перевод продукта в оксид или тетрафторид.
- При надобности соединения переводят в UO2, UF4.
- Восстанавливают металлический уран.
Сплавы, соединения
В урановых сплавах применяют в качестве лигатуры:
Основными соединениями урана считают сплавы U-Al, U-Mg и U-Мо.
К сведению: оружейный уран легко превратить в топливный — просто «разбавить» обедненным (естественным).
Плюсы и минусы
Достоинств у урана много — он и на войне солдат, и в мирной жизни поможет, и вылечит.
Недостатком можно считать изменение механических свойств ТВЭЛов при работе в реакторе. Поэтому здесь применяется не чистый металл, а его сплавы с цирконием, алюминием, молибденом.
Применение
Изотоп 235U имеет широкое применение — от атомных электростанций до ядерного оружия.
- В Америке из обедненного урана делают танковую броню и сердечники бронебойных снарядов.
- Урановые катализаторы имеют большое будущее в энергетике.
- Тяжелый металл используют в качестве балласта для кораблей и противовесов в самолетах.
- В геохронологии, как метод радиоизотопного датирования.
- В изготовлении ТВЭЛов — стержней с ядерными «таблетками» для реакторов атомных станций.
- При работе ядерных реакторов синтезируется плутоний-239; его используют в ядерном оружии и ядерной энергетике.
Стоимость
Цена 1 фунта урана (453.59 грамма) на 23.09.2020 составляла $ 29.96.

Мне 42 года и я специалист в области минералогии. Здесь на сайте я делюсь информацией про камни и их свойства — задавайте вопросы и пишите комментарии!
Уран – полезные свойства, особенности и угроза металла
Первое, что приходит на ум при упоминании этого химического элемента, – ядерная бомба и атомные станции. Уран используют ученые, энергетики, стеклодувы.

Что представляет собой
Уран – это химический элемент, занимающий ячейку 92 в периодической системе Д.Менделеева.
Относится к металлам семейства актиноидов (сюда же причислен плутоний). Радиоактивен, блестит подобно глянцевой стали.
По составу это смесь из трех изотопов: 234, 235, 238. Доля последнего – 99,3%. Он же (вместе с U 234) создает радиоактивность.

Схема деления 235U
| Массовое число | Период полураспада | Основной тип распада |
|---|---|---|
| 233 | 1,59⋅105 лет | α |
| 234 | 2,45⋅105 лет | α |
| 235 | 7,13⋅108 лет | α |
| 236 | 2,39⋅107 лет | α |
| 237 | 6,75 сут. | β− |
| 238 | 4,47⋅109 лет | α |
| 239 | 23,54 минуты | β− |
| 240 | 14 часов | β− |
Создано 11 искусственных изотопов.
Международное обозначение – U (Uranium).
История открытия
Человек начал использовать вещество еще до новой эры. Первой продукцией стала глазурь для керамики: разновалентные соединения урана создавали желтый, бурый, зеленый, черный цвет.
18 век
Систематическое изучение характеристик элемента началось в 18 веке:
- Немецкий естествоиспытатель Генрих Клапрот исследовал золотисто-желтый концентрат, извлеченный из местной смоляной руды. Полученное вещество окрестил ураном – в честь обнаруженной незадолго до этого новой планеты Солнечной системы.
- Через полвека француз Эжен Пелиго установил, что это не моновещество, а окисел. Он получил чистый металл и «взвесил» его.
- В1874 году Дмитрий Менделеев отвел новому элементу последнюю ячейку таблицы, «вычислив» атомный вес – 240 (вдвое больше принятого тогда).
Предвидение Менделеева подтвердил экспериментально немец Циммерман.
19-20 века
История изучения вещества на новом уровне продолжилась на границе 19-20 веков:
- Французский химик Анри Беккерель открыл лучи (позже названные его именем).
- Мария Кюри назвала этот феномен радиоактивностью.
- Анри Муассан (творец ювелирных муассанитов) создал пошаговую инструкцию по получению урана в форме металла.
- Великий Эрнест Резерфорд выявил виды излучения урановых фрагментов – альфа- и бета-лучи. Поль Вийар пополнил список гамма-лучами.
- Французско-немецкая команда – Фредерик Лиза Мейтнер, Жолио-Кюри, Отто Фриш – открыла феномен и формулу ядерной реакции.
Резерфорд первым начал экспериментировать с урановым материалом, пытаясь установить возраст горных пород.
Прорыв сотворили советские физики-теоретики Юлий Харитон и Яков Зельдович. Они доказали: незначительное обогащение урана изотопом 235 делает возможным процесс ядерного синтеза.
Нахождение в природе
Уран не относится к редким элементам.
Тонна земной коры содержит 3 грамма урана.
Локации нахождения вещества в природе:
Собственные образования вещества: урановые руды (настуран, или урановая смолка; уранинит, карнотит).
| Минерал | Основной состав минерала | Содержание урана, % |
|---|---|---|
| Уранинит | UO2, UO3 + ThO2, CeO2 | 65-74 |
| Карнотит | K2(UO2)2(VO4)2·2H2O | ~50 |
| Казолит | PbO2·UO3·SiO2·H2O | ~40 |
| Самарскит | (Y, Er, Ce, U, Ca, Fe, Pb, Th)·(Nb, Ta, Ti, Sn)2O6 | 3,15-14 |
| Браннерит | (U, Ca, Fe, Y, Th)3Ti5O15 | 40 |
| Тюямунит | CaO·2UO3·V2O5·nH2O | 50-60 |
| Цейнерит | Cu(UO2)2(AsO4)2·nH2O | 50-53 |
| Отенит | Ca(UO2)2(PO4)2·nH2O | ~50 |
| Шрекингерит | Ca3NaUO2(CO3)3SO4(OH)·9H2O | 25 |
| Уранофан | CaO·UO2·2SiO2·6H2O | ~57 |
| Фергюсонит | (Y, Ce)(Fe, U)(Nb, Ta)O4 | 0,2-8 |
| Торбернит | Cu(UO2)2(PO4)2·nH2O | ~50 |
| Коффинит | U(SiO4)(OH)4 | ~50 |
В месторождениях урану сопутствуют кварц, молибденит, галенит, кальцит, другие минералы.
Месторождения
В литосфере вещество представлено массивами четырех видов.
Они рассредоточены по планете:
- Уранинитовые жилы. Богатый, но редкий вид. Ценность вещества повышается наличием радия. Канада, Заир, Чехия,Франция.
- Фосфатные руды, железоурановые сланцы. Швеция, Марокко, США, ЦАР, Ангола.
- Осадочные породы, богатые карнотитом (с ванадием в составе). США.
- Залежи ториево-урановой руды плюс золото,серебро, другие ценные компоненты минералов. Россия, Канада, Австралия, ЮАР.
В России главный поставщик сырья – Читинская область (93%).
Остальное дают рудники Курганской области и Бурятии.
Физико-химические характеристики
Чистый уран чуть мягче стали, пластичный, ковкий. Слабый парамагнетик. Структура кристаллической решетки вещества меняется при разных температурах.
Даже в обычных условиях металл химически активен:
- Быстро окисляясь, покрывается переливчатой оксидной пленкой.
- Измельченный до порошка спонтанно воспламеняется при 151°C.
- Разъедается водой: чем выше температура и мельче фракции, тем быстрее.
- Растворяется кислотами, устойчив к щелочам.
- Соли вещества распадаются на ярком свету либо под воздействием органики.
Энергичное встряхивание сосуда с урановой стружкой заставляет ее светиться. По этому признаку элемент легко отличить от других.
Химические свойства вещества также определяются валентностью.
| Свойства атома | |
|---|---|
| Название, символ, номер | Уран / Uranium (U), 92 |
| Атомная масса (молярная масса) | 238,02891(3) а. е. м. (г/моль) |
| Электронная конфигурация | [Rn] 5f3 6d1 7s2 |
| Радиус атома | 138 пм |
| Химические свойства | |
| Ковалентный радиус | 142 пм |
| Радиус иона | (+6e) 80 (+4e) 97 пм |
| Электроотрицательность | 1,38 (шкала Полинга) |
| Электродный потенциал | U←U4+ -1,38В U←U3+ -1,66В U←U2+ -0,1В |
| Степени окисления | 6, 5, 4, 3 |
| Энергия ионизации (первый электрон) | 686,4(7,11) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 19,05 г/см³ |
| Температура плавления | 1405,5 K |
| Температура кипения | 4018 K |
| Уд. теплота плавления | 12,6 кДж/моль |
| Уд. теплота испарения | 417 кДж/моль |
| Молярная теплоёмкость | 27,67 Дж/(K·моль) |
| Молярный объём | 12,5 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | орторомбическая |
| Параметры решётки | a = 2,854 Å; b = 5,870 Å; c = 4,955 Å |
| Прочие характеристики | |
| Теплопроводность | (300 K) 27,5 Вт/(м·К) |
| Номер CAS | 7440-61-1 |
Четырехвалентные образцы урана нестабильны, долго находясь на воздухе, становятся шестивалентными.
Главная характеристика урана – радиоактивность. Ее величина считается достоинством либо недостатком в зависимости от целей использования вещества.
Уран может проявлять степени окисления от +3 до +6.
| Степень окисления | Оксид | Гидроксид | Характер | Форма | Примечание |
|---|---|---|---|---|---|
| +3 | Не существует | Не существует | — | U3+, UH3 | Сильный восстановитель |
| +4 | UO2 | Не существует | Основный | UO2, галогениды | |
| +5 | Не существует | Не существует | — | Галогениды | В воде диспропорционирует |
| +6 | UO3 | UO2(OH)2 | Амфотерный | UO22+ (уранил), UO42- (уранат), U2O72- (диуранат) | Устойчив на воздухе и в воде |
Реакции металлического урана с другими неметаллами приведены ниже в таблице.
| Неметалл | Условия | Продукт |
|---|---|---|
| F2 | +20 o C, бурно | UF6 |
| Cl2 | 180 o C для измельчённого 500—600 o C для компактного | Смесь UCl4, UCl5, UCl6 |
| Br2 | 650 o C, спокойно | UBr4 |
| I2 | 350 o C, спокойно | UI3, UI4 |
| S | 250—300 o C спокойно 500 o C горит | US2, U2S3 |
| Se | 250—300 o C спокойно 500 o C горит | USe2, U2Se3 |
| N2 | 450—700 o C то же под давлением N 1300 o | U4N7 UN2 UN |
| P | 600—1000 o C | U3P4 |
| C | 800—1200 o C | UC, UC2 |
Технология получения
Микродозы урана в литосфере обусловили способ получения металлического вещества:
- Обогащение. Сырье измельчают, заливают водой. Тяжелые первичные минералы урана осаждаются первыми.
- Выщелачивание. На концентрат воздействуют серной кислотой либо щелочью. Из комплексных руд вещество выщелачивают продувкой при 150°C.
- Из полученного раствора выделяют уран – экстракцией либо ионообменом. Это многоступенчатая процедура.
- Для образования твердой формы вещества из него удаляют примеси. То есть технически чистое соединение вещества растворяют кислотой, кристаллизуют, прокаливают.
- На выходе образуется трехокись. Ее восстанавливают до диоксида водородом.
На него воздействуют обезвоженным фтористым водородом. Добавляют магний либо кальций, восстанавливают металлический уран.
Производство обеспечивает четыре пятых потребности – остальное достают из списанных ядерных боеприпасов.
Как используется
Сфера применения тяжелого металла зависит от его вида.

Тяжёлый серебристо-белый глянцеватый металл – уран
Обычный уран
Имеет специфичное и ограниченное применение:
- Главный потребитель вещества – атомная промышленность. Уран 235 – топливо в ядерных реакторах, начинка ядерных, термоядерных боеприпасов (как и плутоний).
Уран-233 исследуется как топливо будущего для ядерных ракетных двигателей.
- Мирная отрасль использования – геохимия. Вещество используют как маркер определения возраста минералов, горных пород и выяснения картины геологических процессов.
- Его применяют в нефтяной геологии при исследовании скважин.
Стекловары добавляют микродозы вещества, чтобы получить продукт с эффектом флуоресценции желто-зеленой гаммы.
Буроватый фон фотографий начала XX века – заслуга соединения урана уранилнитрата.
Обедненный уран
Гораздо популярнее обедненный уран.
«Обедненный уран» – это уран-238, из которого изъяли изотопы 234 и 235. Его радиоактивность вдвое меньше природного материала.
Ему нашлось применение в военном и гражданском сегменте:
- Сердечник бронебойных снарядов.
- Урановые сплавы – материал танковой брони, например, натовского танка «Абрамс».
- Балласт в ракетах, самолетах, яхтах.
- Компонент гироскопов, маховиков.
Вещество используют при бурении нефтяных скважин и для защиты от радиации.
Влияние на организм
Нанодозы вещества (максимум – стотысячные доли процента) зафиксированы во всех биологических организмах. У человека самые уязвимые места – почки, селезенка, кости, печень, бронхи, легкие.
Однако радиоактивный металл, его соединения (особенно в виде аэрозолей) токсичны:
- Организм поражается целиком до уровня клеток.
- Первыми страдают почки (в моче появляются белок и сахар).
- Угнетается деятельность ферментов.
Хроническая интоксикация влечет за собой сбои в нервной системе, кроветворении. Это недуг работников, занятых на добыче и переработке сырья.
Читайте также:
