Какая характеристика не относится к строению типичных металлов
Обновлено: 03.05.2024
Определение металлов можно дать с позиций химии, физики и техники.
В химии металлы — это химические элементы, находящиеся в левой части периодической системы элементов Д. И. Менделеева, которые обладают особым механизмом взаимодействия валентных электронов (ионов) с ядром как в самих металлах, так и при вступлении в химические реакции с другими элементами, в том числе с металлами.
Физика характеризует металлы как твердые тела, обладающие цветом, блеском, способностью к плавкости (расплавлению) и затвердеванию (кристаллизации), тепло- и электропроводностью, магнитными и другими свойствами.
В технике металлы — это конструкционные материалы, обладающие высокой обрабатываемостью (ковкостью, штампуемостью, обрабатываемостью резанием, паяемостью, свариваемостью и др.), прочностью, твердостью, ударной вязкостью и рядом других ценных свойств, благодаря которым они находят широкое применение.
Русский ученый М. В. Ломоносов (1711 — 1765), исследуя металлы и неметаллы в своем труде «Первые основания металлургии или рудных дел», дал металлам определение: «Металлом называется светлое тело, которое ковать можно. Таких тел находим только шесть: золото, серебро, медь, олово, железо и свинец». Это определение М. В. Ломоносов дал в 1773 г., когда известны были только шесть металлов.
Из металлов, добываемых из недр земли, получают большую группу конструкционных материалов, применяемых в различных отраслях промышленности. В природе одни металлы встречаются в чистом, самородном виде, другие — в виде оксидов (соединений металла с кислородом), нитридов и сульфидов, из которых состоят различные руды этих металлов.
Самыми распространенными металлами, применяемыми в качестве конструкционных материалов, являются железо, алюминий, медь и сплавы на основе этих металлов.
К металлам относятся более 80 элементов периодической системы Менделеева. Все эти металлы подразделяются на две большие группы: черные металлы и цветные металлы.
Характерными признаками черных металлов являются темно-серый цвет, блеск, высокие плотность и температура плавления, твердость, прочность, вязкость и полиморфизм (аллотропия). По физикохимическим свойствам черные металлы подразделяют на пять групп:
- железистые (железо, кобальт, никель, марганец);
- тугоплавкие (вольфрам, рений, тантал, молибден, ниобий, ванадий, хром, титан и др.);
- урановые — актиниды (уран, торий, плутоний и др.);
- редкоземельные — лантаниды (лантан, церий, иттрий, скандий и др.);
- щелочно-земельные (литий, натрий, калий, кальций и др.).
Из этих пяти групп черных металлов особенно широкое применение в промышленном производстве находят железистые и тугоплавкие металлы.
Железистые металлы, кроме марганца, называют еще ферромагнетиками. Ферромагнетики способны намагничиваться и притягивать металлы своей группы.
К тугоплавким относятся металлы, которые имеют температуру плавления выше температуры плавления железа (1 539 °С): титан — 1 667 °С, ванадий — 1 902 °С, хром — 1 903 °С, молибден — 2 615 °С, ниобий — 2 460 °С, тантал — 2 980 °С, вольфрам — 3 410 °С. Тугоплавкие металлы в основном применяются как легирующие элементы в производстве жаропрочных, жаростойких, теплостойких и специальных сплавов, в том числе твердых сплавов и высоколегированных сталей.
2. Строение металлов
Атомно-кристаллическая структура металлов. Как известно, все вещества состоят из атомов, в том числе и металлы. Каждый металл (химический элемент) может находиться в газообразном, жидком или твердом агрегатных состояниях. Каждое агрегатное состояние будет иметь свои особенности, отличные друг от друга. В газообразном металле расстояние между атомами велико, силы взаимодействия малы и атомы хаотично перемещаются в пространстве; газ стремится к расширению в сторону большего объема. При понижении температуры и давления вещество переходит в жидкое состояние. Свойства жидкого вещества резко отличаются от свойств газообразного. В жидком металле атомы сохраняют лишь так называемый ближний порядок атомов, т. е. в объеме расположено небольшое количество атомов, а не атомы всего объема. При понижении температуры жидкий металл переходит в твердое состояние, которое имеет строгую закономерность расположения атомов.
Если условно провести вертикальные и горизонтальные линии связи через центры атомов, можно увидеть, что у металлов в твердом состоянии атомы расположены в строго определенном порядке и представляют собой множество раз повторяющиеся элементарные геометрические фигуры — параллелепипеды (рис. 1). Наименьшую геометрическую фигуру называют элементарной ячейкой. Элементарные ячейки, расположенные на горизонтальных и вертикальных кристаллографических плоскостях (рис. 2), образуют пространственную кристаллическую решетку.
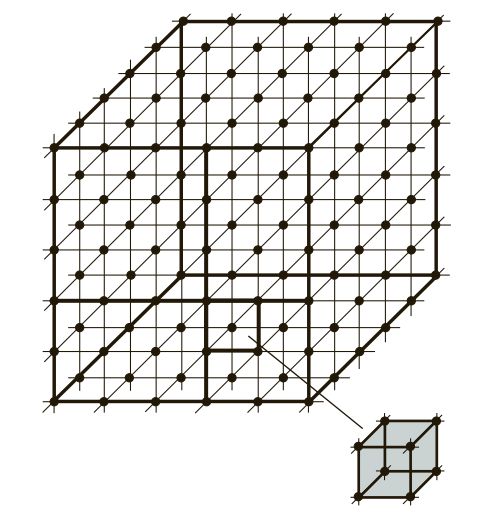
Рис. 1. Схема расположения элементарных геометрических ячеек в атомных решетках металлов и сплавов
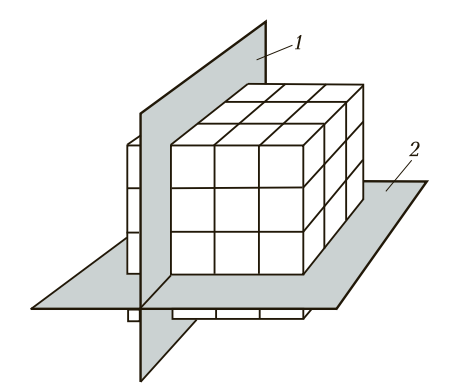
Рис. 2. Расположение кристаллографических плоскостей: 1 и 2 — соответственно горизонтальная и вертикальная кристаллографические плоскости
Элементарные кристаллические решетки характеризуют следующие основные параметры: расстояние между атомами по осям координат (по линиям связи), углы между линиями связи, координационное число — число атомов, находящихся на наиболее близком и равном расстоянии от любого атома в решетке. Форму элементарной ячейки рассматривают по кристаллографическим плоскостям в трех измерениях.
Таким образом, любой металл можно представить не как однородную цельную массу, а как массу, сложенную из множества элементарных ячеек. Блок элементарных атомных кристаллических ячеек образует атомно-кристаллическую ячейку (решетку). Если выделить эту элементарную ячейку, то в зависимости от металла получим следующие типы кристаллических ячеек (рис. 3): куб (К), объемно-центрированный куб (ОЦК), гранецентрированный куб (ГЦК), гексагональная плотноупакованная ячейка (ГПУ), гексагональная простая ячейка (Г) и др.
Простая кубическая ячейка (рис. 3, а) характерна для неметаллов, которые обладают наибольшими плотностью и удельным весом, и имеет восемь атомов, которые расположены в каждой вершине куба.
Объемно-центрированная кубическая ячейка (рис. 3, б ) состоит из восьми атомов, которые расположены по одному атому в каждой вершине куба, и одного, находящегося в центре куба на равных расстояниях от его граней. Эту форму атомной кристаллической ячейки имеют железо модификации Fe-α, ванадий, вольфрам, молибден, тантал и хром, т. е. в основном черные металлы.
Гранецентрированная кубическая ячейка (рис. 3, в) имеет 14 атомов — по одному атому в каждой вершине куба (восемь атомов) и по одному атому в центре каждой грани (шесть атомов). Гранецентрированную кубическую ячейку имеют алюминий, железо модификации Fe-γ, золото, кобальт, медь, никель, платина и серебро, в основном это цветные металлы и часть черных металлов.
Гексагональная плотноупакованная ячейка (рис. 3, г) состоит из 17 атомов. Форма геометрического тела, которую образуют эти атомы, является шестигранной призмой. При этом по шесть атомов расположены в каждой вершине верхнего и нижнего оснований, по одному атому в центре этих оснований и три атома в центре одной их трех граней (через грань). Гексагональную плотноупакованную ячейку имеют бериллий, кадмий, магний, ванадий, тантал.
Простая гексагональная ячейка (рис. 3, д) состоит из 12 атомов, которые расположены в вершинах верхнего и нижнего оснований шестигранной призмы. Такую кристаллическую ячейку имеют ртуть и цинк.
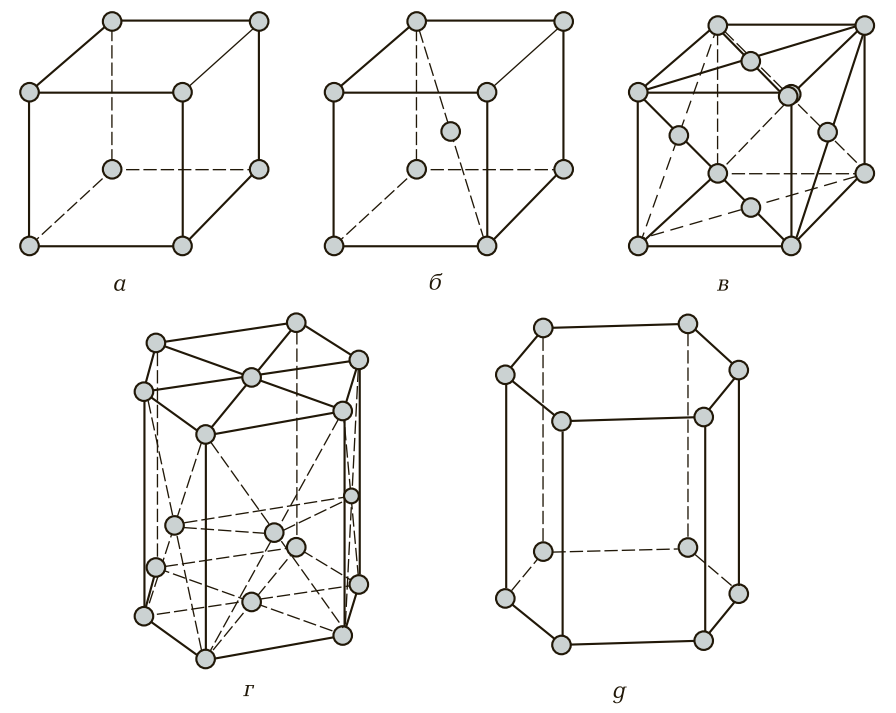
Рис. 3. Геометрические формы элементарных кристаллических ячеек: а — куб; б — объемно-центрированный куб; в — гранецентрированный куб; г — гексагональная плотноупакованная ячейка; д — гексагональная простая ячейка
Связь между атомами в кристаллической решетке и между решетками осуществляется за счет так называемой металлической связи. От прочности этой связи зависят прочность и твердость металлов. Чем выше эта связь, тем бо´льшую прочность и твердость имеют металлы. Механизм связи между атомами в решетке и между решетками имеет сложную физико-химическую природу.
В практике идеальное расположение кристаллических решеток обычно не наблюдается. Кристаллы, образуемые кристаллическими решетками, имеют искаженную геометрическую форму и различную величину.
Анизотропия металлов. Анизотропия (от гр. anisos — неравный и tropos — направление) — неодинаковость физических свойств среды (тела) в различных направлениях. Анизотропия предполагает зависимость свойств металлов от направления по плоскостям атомно-кристаллических решеток. Чем больше в плоскости атомов, тем выше свойства металлов. В горизонтальных плоскостях в любой форме атомно-кристаллических решеток больше, чем в вертикальных плоскостях. Следовательно, прочность металлов, испытанная в горизонтальном направлении, выше, чем в вертикальном. Анизотропия проявляется в процессе обработки конструкционных материалов давлением (проката, волочения, штамповки и других технологических способов получения заготовок и изделий).
На рис. 2 кристаллографические плоскости совпадают с линиями связи, проходящими через атомы металла. Форма элементарной кристаллической ячейки, расстояние между атомами и прочность металлической связи определяют физические, механические и технологические свойства металлов. Если исследуемый металл рассматривать по трем кристаллографическими плоскостям, по линиям связи между атомами, то можно заметить, что свойства по этим трем измерениям будут различны. Число атомов в этих плоскостях неодинаково. Металлическая связь между горизонтально и вертикально расположенными атомами также неодинакова. Это, в свою очередь, приводит к различной прочности металлов в продольном и поперечном направлениях. Например, предел прочности меди в продольном направлении будет в 2 раза больше, чем в поперечном.
Все металлы анизотропны, так как они состоят из кристаллов. Кристаллическое строение металлов обусловливает пластическую деформацию, т. е. изменение внешней формы и размеров под действием нагрузок без разрушения. Способность металлов и сплавов пластически деформироваться положена в основу их обработки давлением (прокатка, волочение, ковка, штамповка и прессование). При обработке давлением, например прокатке (рис. 4, а), происходит перемещение одного слоя атомных решеток по другому по кристаллографическим плоскостям (рис. 4, б).
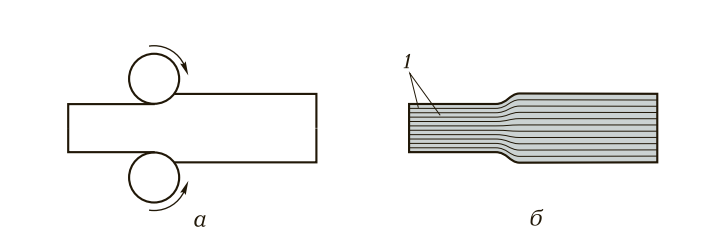
Рис. 4. Схема деформации металлов и сплавов (прокатка): а — деформация; б — скольжение металлов по кристаллографическим плоскостям в процессе деформации; 1 — кристаллографические плоскости
В процессе деформации металла при прокатке происходит не только изменение поперечных и продольных размеров заготовок, но и изменение микроструктуры металла.
Зерна под действием давления прокатных валков искажаются, приобретая продолговатую или пластинчатую форму, а затем преобразуются в волокна. Изменение микроструктуры металла в процессе деформации условно показано на рис. 5.
Процесс кристаллизации. Рассмотрим, как происходит образование кристаллов у чистых металлов. Установлено, что процесс кристаллизации металлов из жидкого состояния в твердое идет в две стадии:
- образование центров кристаллизации;
- рост кристаллов вокруг этих центров (рис. 6).
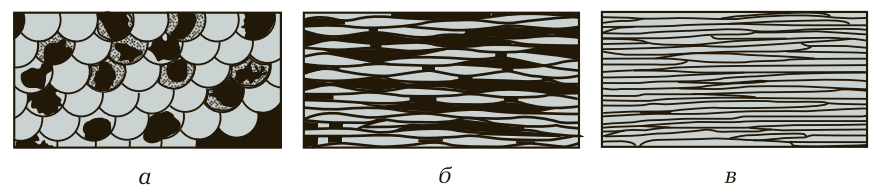
Рис. 5. Изменение микроструктуры металла в процессе деформации: а — микроструктура металла до деформации; б — микроструктура металла после первой операции деформации; в — микроструктура металла после окончательной деформации
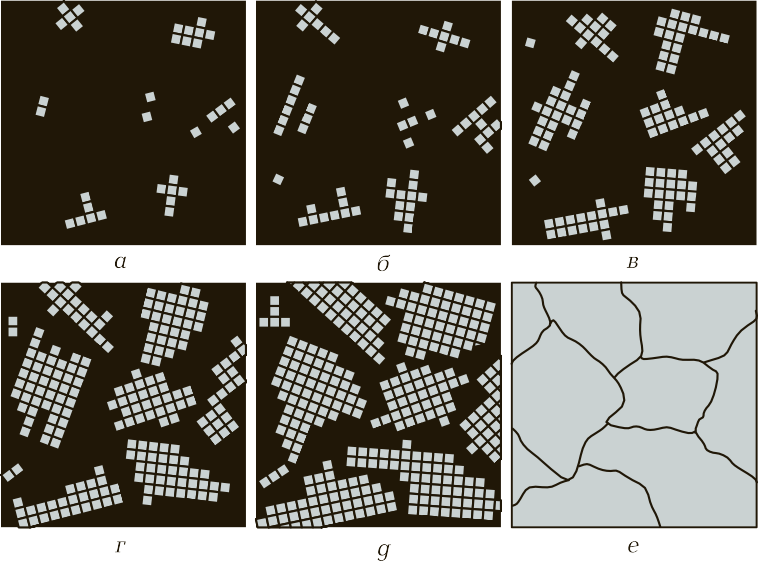
Рис. 6. Процесс кристаллизации металлов и сплавов: а — е — последовательные этапы процесса
Далее вновь появляются новые центры, и происходит рост твердой фазы вокруг первичных и вторичных центров. Процесс происходит до того момента, пока образованные таким образом кристаллы не будут соприкасаться друг с другом и не будет наличия жидкой фазы металла (см. рис. 6, г — е). Когда образование кристалла идет в жидкой фазе (в расплавленном металле), он будет иметь правильную форму, т. е. состоять из определенных геометрических фигур правильной формы. Когда кристаллы начинают соприкасаться друг с другом, а процесс затвердевания еще не закончен, тогда происходят искажения формы зерен. В практике замечено, что когда идет быстрое охлаждение, образуются мелкие зерна — мелкозернистая структура. При медленном охлаждении появление новых центров кристаллизации замедляется, но происходит рост зерна вокруг первичных центров кристаллизации. В этом случае металл будет иметь крупнозернистую структуру.
Процесс образования кристаллов в жидком состоянии и перехода металла в твердое состояние называется первичной кристаллизацией. Величина и форма зерна влияет на механические свойства металлов. Чем зерна мельче и чем правильнее их форма, тем большую твердость и прочность будет иметь металл. Чем зерна больше и чем искаженнее их форма, тем ниже твердость и прочность металла.
Аллотропия металлов. Такие металлы, как железо, кобальт, никель и др., обладают способностью изменять кристаллическую решетку при нагревании в твердом состоянии. Процесс изменения кристаллических решеток в твердом состоянии называется вторичной кристаллизацией, или аллотропией, а состояние вещества (металла) при наличии нескольких кристаллических решеток при изменении параметров (давления, температуры) — аллотропическими модификациями, или полиморфизмом. Такие металлы, как железо, молибден, вольфрам, литий в твердом состоянии при нормальной температуре имеют объемно-центрированную кубическую ячейку; алюминий, медь, серебро в твердом состоянии при нормальной температуре имеют форму гранецентрированной кубической ячейки.
На рис. 7 представлены кривые нагрева и охлаждения металла (на примере марганца). Аллотропные состояния (модификации), имеющие те или иные кубические ячейки, обозначаются греческими буквами. Первоначальное аллотропное состояние при нормальной температуре обозначается буквой α, при дальнейших повышении температуры и перекристаллизации металла — буквами β, γ, δ и т. д. При охлаждении металлов и сплавов процесс аллотропного превращения происходит в обратном порядке, как правило при тех же температурах.
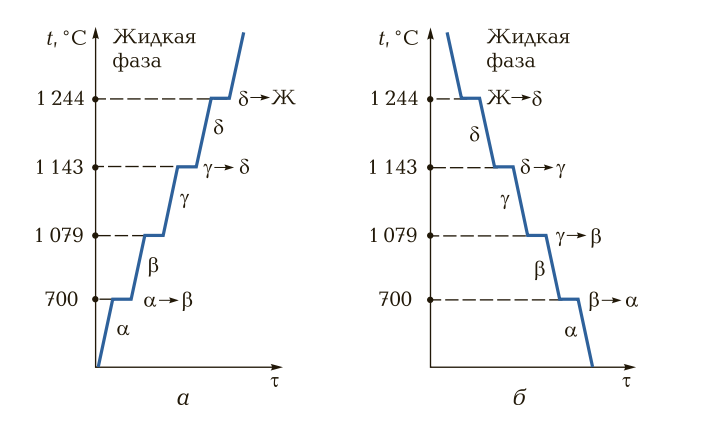
Рис. 7. Кривые нагрева (а) и охлаждения (б) марганца: t — температура; τ — время
Физические свойства металлов

Тест предназначен для проверки знаний учащихся по темам "Физические свойства металлов", "Сплавы". 19 заданий теста имеют различные формы ( тестовые с выбором ответа, задания на соотнесение, с открытой формой ответа), что позволяет оценить не только знания учащихся, но и их умения работать с различными типами заданий
Просмотр содержимого документа
«Физические свойства металлов»
1. К металлам не относятся элементы ряда:
А)B, As, Te; б). Ca, Na, Mg
В)Cu, Zn, Au; г). W, Ag, Os
Как изменяются металлические свойства в ряду элементов
Si Al Mg Na:
а) изменяются периодически б) не изменяются
в) ослабевают г) усиливаются
3. Наименьшее число электронов на наружном энергетическом уровне содержит:
а) Ca б) Сr в) Na г) Al
4. Какой металл не относится к щелочным?
Какой элемент не входит в условную границу между металлами и неметаллами?
Какие частицы находятся в узлах кристаллической решетки металлов:
а. только катионы металлов б. нейтральные атомы
в. катионы и нейтральные атомы г. анионы и катионы
С каким космическим телом ассоциировалось в древности золото:
в. Солнце г. Марс
8.Какой металл наименее электропроводен:
Вольфрам 2. Цинк 3. Хром 4. Серебро
Для металлов характерен вид связи:
А) ковалентная Б) металлическая В) донорно-акцепторная.
10. К физическим свойствам металлов не относят
а) пластичность б) электропроводность
в) металлический блеск г) растворимость в воде
Металл, находящийся в жидком агрегатном состоянии при н.у. – это
12. Все металлы и их сплавы делятся на
А)Чёрные, цветные и драгоценные Б) Железо и цветные
В) Железо и драгоценные Г) Чёрные и цветные
13. За счёт чего металлы проводят электрический ток?
14. Выберите из предложенных металлов легкий металл.
а) Mg (ρ = 1,74 г/см 3 ) б) V (ρ = 5,7 г/см 3 )
в) Hg (ρ = 13,54 г/см 3 ) г) Ag (ρ = 10,5 г/см 3 )
15. Сплав меди и олова
1) бронза 2) чугун 3) сталь 4) дюралюминий
16. Содержание углерода в чугуне
1) 1 - 1,5% 2) 1 - 3% 3) 2 - 4,5% 4) 3 – 6%
17. К черным сплавам относится
1) латунь 2) мельхиор 3) дюралюминий 4) сталь
18. Используется при производстве литых деталей
1) цементит 2) серый чугун 3) белый чугун 4) все выше перечисленные
Два электрона на внешнем энергетическом уровне содержит
а) Ca б) Li в) Al г) K
Выберите строку, содержащую только типичные металлы:
a) Na, Sc, N б) Mg, Ba, K в) O, Al, Mn г) F, O, Cl
Какая характеристика не относится к строению типичных металлов?
а) на внешнем энергетическом уровне 1-3 ē б) относительно большой радиус атома
в) заряд ядра положительный г) заряд образованного им иона отрицательный
3. Сколько электронов находится на внешней энергетической орбитали у металлов:
А) от 2 до 4 В)от1 до З С) от 1 до 8 Д) от 4 до 8
4. Какое место занимают металлы в ПСХЭ:
а) слева в нижней части; б) справа в верхней части в) по центру; г) слева в верхней части
5. Металлическая кристаллическая решетка содержит а) только ионы металлов б) атомы и ионы металлов в) электроны, атомы и ионы металлов г) электроны и атомы металлов.
Сколько электронов содержит на внешнем энергетическом уровне атом магния:
Один 2. Два 3. Три 4. Четыре
Какова электронная конфигурация атома калия?
2.
3. 4.
8. Самый тугоплавкий металл:
А) осмий В) вольфрам С) железо Д) литий
9.Самый пластичный металл:
А) платина С) Алюминий Д) никель
Для всех металлов характерны:
а) мет.блеск, ковкость, пластичность; б) легкоплавкость, сверхпроводимость, твердость
в)электропроводность, хрупкость, тугоплавкость; г)теплопроводность, высокая электропроводимость, твердость
Назовите самый легкоплавкий металл.
а) W б) Al в) Hg г) Ga
12. Чугун это:
А) Сплав железа с углеродом, содержащий более 2% углерода
б) Сплав железа с углеродом, содержащий менее 2%
в)сплав железа с углеродом с добавлением хрома, никеля, вольфрама
13. Укажите, чем объясняется электропроводность металлов.
а) движением «электронного газа» б) притяжением электронов к ядру;
в) способностью отражать световые лучи; г) смещением слоев атомов и ионов.
14. Выберите из ниже предложенного перечня- физические свойства меди.
а) жидкость; б) плотность выше 5,0 г/см 3 ; в) красный цвет; г)электропроводность.
15. Укажите, чем объясняется ковкость металлов.
а) притяжением электронов к ядру; б) смещением слоев атомов и ионов; в) наличием «свободных» электронов; г) способностью отражать световые лучи.
16. Как изменяются металлические свойства атомов элементов главных групп с ростом порядкового номера?
а) усиливаются; б) не изменяются; в) вначале усиливаются, а затем ослабевают; г) ослабевают.
Выберите металл, обладающий наименьшей электропроводностью.
а) W б) Ag в) Cu г) Al
Какой металл не относится к щелочным?
19. В каких сплавах основным компонентом является медь? а) латунь ; б) бронза; в) мельхиор; г) дюралюминий

-82%
Презентация по химии на тему "Металлы"

Физические свойства металлов
Металлический блеск
Способность металлов отражать падающий на них
свет является причиной наличия у них особого металлического блеска.
Капельки ртути Hg

Ковкость
КОВКОСТЬ, свойство металлов (или других веществ)
поддаваться изменению формы подвоздействием ударов молота
или прокатом, без разрушения. В некоторых случаях ковкость
увеличивается приповышении температуры
… Научно-технический энциклопедический словарь

Пластичность
Пластичность – свойство металла пластически деформироваться,
не разрушаясь под действием внешних сил.Это одно из важных механических свойств металла, которое в сочетании с высокой прочностью делает его основным конструкционным материалом.

Теплопроводность и электропроводность
Теплопроводность — это вид теплопередачи, при котором происходит
непосредственная передача энергии от частиц (молекул, атомов) более нагретой части тела к частицам его менее нагретой части.
Электропроводность (электри́ческая проводи́мость, проводимость) — способность тела (среды) проводить электрический ток, свойство тела или среды, определяющее возникновение в них электрического тока под воздействием.

Плотность , твердость и температура плавления
Плотность — физическая величина, определяемая для однородного
вещества массой его единичного объема
Твердость — это способность материала сопротивляться вдавливанию
в него другого, более твердого тела:режущего инструмента, бойков молота, штампа и т. п. Твердость характеризует возможность обработки металлана станках, в штампах, ручным инструментом.
Температура плавления металла - температура, при которой металл
переходит из твердого состояния, в котором находится в нормальном состоянии (кроме ртути),в жидкое состояние при нагревании. Температураплавления металлов находится в диапазоне от -39 градусов
Цельсия до +3410 градусов.




Металл, находящийся в жидком агрегатном состоянии при н.у. – это
а)W б)Hg
в)Ca г)Na
К тугоплавким металлам относится
а)Ga (tпл= 29,8oC) б)Al (tпл= 933,5oC)
в)Ba (tпл= 1002oC) г)Ra (tпл= 973oC)
Выберите из предложенных металлов легкий металл.
а)V (ρ = 5,7 г/см3) б)Bi (ρ = 9,8 г/см3) в)Mn (ρ = 7,3 г/см3) г)Al (ρ = 2,65 г/см3)
Свойство металлов раскатываться в тонкую фольгу, не ломаясь под внешним воздействием,
называется
а) пластичность б) эластичность
в) плотность г) твердость
Какая характеристика не относится к строению типичных металлов?
а) на внешнем энергетическом уровне 1-3 ē б) относительно большой радиус атома
в) заряд ядра положительный г) заряд образованного им иона отрицательный
Для всех металлов характерны:
а) мет.блеск, ковкость, пластичность б) лекгоплавкость, сверхпроводимость, твердость
в) электропроводность, хрупкость, тугоплавкость
г)теплопроводность, высокая электропроводимость, твердость
Выберите металл, обладающий наименьшей электропроводностью.
а) W б) Ag в) Cu г) Al

Домашнее задание
Параграф 39, задание 5
Спасибо за урок
Рабочие листы и материалы для учителей и воспитателей
Более 3 000 дидактических материалов для школьного и домашнего обучения

Читайте также:
