Какие металлы и почему получают пирометаллургическим восстановлением углем
Обновлено: 04.10.2024
Значительная химическая активность металлов (взаимодействие с кислородом воздуха, другими неметаллами, водой, растворами солей, кислотами) приводит к тому, что в земной коре они встречаются главным образом в виде соединений: оксидов, сульфидов, сульфатов, хлоридов, карбонатов и т. д. В свободном виде встречаются металлы, расположенные в ряду напряжений правее водорода (Аg, Нg, Рt,Аu, Сu), хотя гораздо чаще медь и ртуть в природе можно встретить в виде соединений.
Минералы и черные породы, содержащие металлы и их соединения, из которых выделение чистых металлов технически возможно и экономически целесообразно, называют рудами.
Получение металлов из руд — задача металлургии.
Металлургия — это и наука о промышленных способах получения металлов из руд, и отрасль промышленности.
Любой металлургический процесс — это процесс восстановления ионов металла с помощью различных восстановителей. Суть его можно выразить так:
Чтобы реализовать этот процесс, надо учесть активность металла, подобрать восстановитель, рассмотреть технологическую целесообразность, экономические и экологические факторы.

В соответствии с этим существуют следующие способы получения металлов:
Пирометаллургия
Пирометаллургия — восстановление металлов из руд при высоких температурах с помощью углерода, оксида углерода (II), водорода, металлов — алюминия, магния.
Например, олово восстанавливают из касситерита SnО2, а медь — из куприта Cu2O
прокаливанием с углем (коксом):
SnО2+ 2С = Sn + 2СО ↑; Cu2O + С = 2Cu+ СО ↑
Сульфидные руды предварительно подвергают обжигу при доступе воздуха, а затем полученный оксид восстанавливают углем:
2ZnS + 302 = 2ZnО + 2SO2 ↑; ZnО + С = Zn + СО ↑
сфалерит (цинковая обманка)
Из карбонатных руд металлы выделяют также путем прокаливания с углем, т. к. карбонаты при нагревании разлагаются, превращаясь в оксиды, а последние восстанавливаются углем:
FeСO3 = FеО + СO2 ↑ ; FеО + С = Fе + СО ↑
сидерит (шпатовый железняк)
Восстановлением углем можно получить Fе, Сu, Zn, Сd, Ge, Sn, Рb и другие металлы, не образующие прочных карбидов (соединений с углеродом).
В качестве восстановителя можно применять водород или активные металлы:
К достоинствам этого метода относится получение очень чистого металла.
2) TiO2+ 2Мg = Тi + 2МgO (магнийтермия)
Чаще всего в металлотермии используют алюминий, теплота образования оксида
которого очень велика (2А1 + 1,5 O2 = Аl2O3 + 1676 кДж/моль). Электрохимический ряд напряжений металлов нельзя использовать для определения возможности протекания реакций восстановления металлов из их оксидов. Приближенно установить возможность этого процесса можно на основании расчета теплового эффекта реакции (Q), зная значения теплот образования оксидов:
где Q1— теплота образования продукта, Q2 -теплота образования исходного вещества.
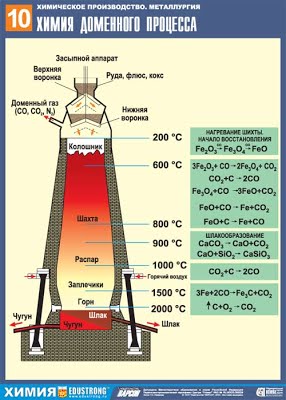
Доменный процесс (производство чугуна):
C + O2 = CO2, CO2 + C ↔ 2CO
3Fe2O3 + CO = 2(Fe 2 Fe 3 2)O4+ CO2
(Fe 2 Fe 3 2)O4+ CO= 3FeO + CO2
FeO + CO= Fe + CO2
(чугун содержит до 6,67% углерода в виде зерен графита и цементита Fe3C);

Выплавка стали (0,2-2,06% углерода) проводится в специальных печах (конвертерных, мартеновских, электрических), отличающихся способом обогрева. Продувание воздуха, обогащенного кислородом, приводит к выгоранию из чугуна избыточного углерода, а также серы, фосфора и кремния в виде оксидов. При этом оксиды либо улавливаются в виде отходящих газов (CO2, SO2), либо связываются в легко отделяемый шлак – смесь Ca3(PO4)2 и CaSiO3. Для получения специальных сталей в печь вводят легирующие добавки других металлов.
Гидрометаллургия
Гидрометаллургия — это восстановление металлов из их солей в растворе.
Процесс проходит в два этапа: 1) природное соединение растворяют в подходящем реагенте для получения раствора соли этого металла; 2) из полученного раствора данный металл вытесняют более активным или восстанавливают электролизом. Например, чтобы получить медь из руды, содержащей оксид меди СuО, ее обрабатывают разбавленной серной кислотой:
Затем медь либо извлекают из раствора соли электролизом, либо вытесняют из сульфата железом:
Таким образом, получают серебро, цинк, молибден, золото, уран.
Электрометаллургия
Электрометаллургия — восстановление металлов в процессе электролиза растворов или расплавов их соединений.
Этим методом получают алюминий, щелочные металлы, щелочноземельные металлы. При этом подвергают электролизу расплавы оксидов, гидроксидов или хлоридов.

Примеры:
а) NaCl (электролиз расплава) → 2Na + Cl2
Пирометаллургия — определение и способы получения металлов
Современная металлургия обладает большим количеством способов получения чистого металла. Одним из них является пирометаллургия. Она включает целую совокупность технологических процессов, которые протекают при высоких температурах. С его помощью получают различные металлы: чёрные (сталь, чугун) и цветные (медь, никель, титан и многие другие).

Описание
Основу технологического процесса пирометаллургии составляет плавка, которая протекает при достаточно высоких температурах. Необходимая величина температуры зависит от степени плавления элемента, который необходимо получить. Они делят на три большие категории:
- легкоплавкие (с температурой плавления до 600 °С);
- среднеплавкие (не более 1600 °С, к ним относятся: никель сурьма, кальций);
- тугоплавкие (их температура плавления превышает 1600 °С).
Сырьём в пирометаллургии служит: руда, содержащая необходимый металл, концентраты, различные добавки. При обработке первичного сырья получают два компонента: металл и шлак. В некоторых процессах получают так называемый штейн и шлак. Получение необходимой температуры обеспечивается за счёт применения естественного топлива (угля, газа, продуктов нефтепереработки), температуры химических реакций, электрического нагрева.

В черной пирометаллургии характерным примером получения стали служит доменная плавка. С её помощью получают сталь различных марок.
В цветной металлургии каждый металл обладает своими специфическими особенностями. Поэтому для получения используют свои специфические приёмы, которые подходят только для конкретного элемента. Например, для получения меди или никеля предварительно производят плавку на штейн. Потом из него получают черновой материал.
Современная пирометаллургия обладает большим количеством разнообразных конструкций плавильных печей. Они бывают вертикальные и горизонтальные, периодические и непрерывные, с различным способом нагрева, со специфическими процессами (ликвация, электроннолучевая плавка, зонная и другие)
Большую популярность такие процессы получили для получения многих тугоплавких металлов: молибдена, титана, ванадия.

На завершающем этапе пирометаллургии выделяют чистый материал различными приёмами. Получения алюминия осуществляется проведением электролиза. В качестве сырья применяется глинозём. Процесс протекает при температуре,более 1000 °С. Чистый элемент собирают на угольном катоде. Для этой технологической операции существует специальная ванна. Приведенный пример показывает, что у цветных металлов проведение электролиза необходимо для выделения чистой фракции.
Пирометаллургические методы
Основными методами (способам) такого извлечения металлов является восстановление. К ним относятся:
- металлотермия;
- силикатотермия;
- восстановление различными элементами или химическими соединениями.
Любой пирометаллургический метод предполагает высокотемпературное протекание процесса. Первый из перечисленных пирометаллургических способов предполагает ускорение реакции восстановления за счёт свойств более активных металлов. Например, алюминия, магния, натрия.

Второй метод пирометаллургии – это восстановление необходимого элемента с помощью кремния. Остальные способы реализовываются за счёт применения различных химических элементов (например, водорода,углерода) или соединениями (например, гидритами различных металлов, монооксидом углерода).
Применение углерода и его монооксида в пирометаллургии считается целесообразным, когда отсутствуют высокие требования к чистоте получаемого материала и не допускаются высокие затраты на проведение реакции.
Обычно углеродом восстанавливают следующие элементы:
- железо из двух его соединений с кислородом: оксид железа (III) и четырёхмерного оксида железа (магнетита);
- олова из касситерита;
- меди из куприта.

Методы с применением углерода объединяются одним термином – карбометрия. Кроме перечисленных технологий к современной пирометаллургии относят так называемую хлорную металлургию. Она обеспечивает выделение материала при хлорировании сырья с добавлением, так называемого восстановителя. На завершающем этапе производят переработку полученных хлоридов. Этот метод обладает определёнными преимуществами перед классической пирометаллургией. К ним относятся: практически полное извлечение необходимого содержимого, более высокая скорость реакции.
Пирометаллургический способ получения металлов уравнение
Природные соединения металлов:
сильвинит КСl ∙ NaCl, каменная соль NaCl;
серный колчедан FeS2, киноварь HgS, цинковая обманка ZnS;
мел, мрамор, известняк СаСО3, магнезит MgCO3,
доломит CaCO3 ∙ MgCO3;
глауберова соль Na2SO4 ∙ 10 H2O, гипс CaSO4 ∙ 2Н2О;
магнитный железняк Fe3O4, красный железняк Fe2O3, бурый железняк Fe2O3 ∙ Н2О.
чилийская селитра NaNO3;
Минералы и горные породы, содержащие металлы и их соединения и пригодные для промышленного получения металлов, называются рудами.
Отрасль промышленности, которая занимается получением металлов из руд, называется металлургией.
Способы получения металлов из руд.
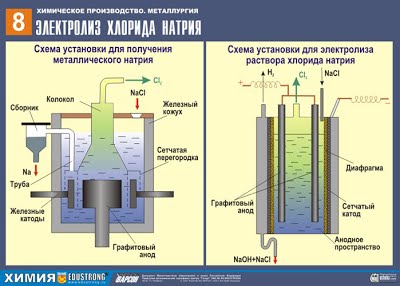
1. Электрометаллургический способ — это способы получения металлов с помощью электрического тока (электролиза). Этим методом получают алюминий, щелочные металлы, щелочноземельные металлы.
При этом подвергают электролизу расплавы оксидов, гидроксидов или хлоридов:
катод Na+ + e à Na0 ¦ 2
анод 2Cl — — 2e à Cl20 ¦ 1
суммарное уравнение: 2NaCl (распл.) – (э. ток)à 2Na + Cl2
Современный способ получения алюминия был изобретен в 1886 году. Он заключается в электролизе раствора оксида алюминия в расплавленном криолите. Расплавленный криолит растворяет Al2O3, как вода растворяет сахар.
катод Al3+ +3e à Al 0 ¦ 4
анод 4AlO33– –12 e à 2Al2O3 +3O2 ¦ 1
суммарное уравнение: 2Al2O3(распл.) – (э. ток)à 4Al + 3O2 .
2. Пирометаллургический способ — это восстановление металлов из их руд при высоких температурах с помощью восстановителей: неметаллических : кокс, оксид углерода (II), водород; металлических: алюминий, магний, кальций.
Fe+32O3 +2Al = 2Fe0 + Al2O3
Получают железо, хром.
Восстановление оксидов металлов водородом (водородотермия ):
Cu +2O + H2 –(t)à Cu0 + H2O
Получают малоактивные металлы – медь, вольфрам.
В вертикальной печи кокс окисляется до СО, затем происходит постепенное восстановление железа из руды:
3Fe2O3 + CO –(t)à 2Fe3O4 + CO2 ,
Fe3O4 + 4CO –(t)à 3FeО + 4CO2
FeO + CO –(t)à Fe+ CO2
Восстановление углём (коксом):
ZnO + C –(t)à Zn + CO
Получают цинк, никель.
3. Гидрометаллургический способ основан на растворении природного соединения с целью получения раствора соли этого металла и вытеснением данного металла более активным. Например, руда содержит оксид меди и ее растворяют в серной кислоте: CuO + H2SO4 = CuSO4 + H2O, затем проводят реакцию замещения:
CuSO4 + Fe = FeSO4 + Cu.
Таким способом получают серебро, цинк, молибден, золото, ванадий.
Если для восстановления требуется оксид металла, то в процессе переработки сначала получают оксид:
а) из сульфида – обжигом в кислороде: 2ZnS + 3O2 = 2ZnO + 2SO2
б) из карбоната – разложением: СаСО3 –(t)à СаО + СО2

Производство железа основано на карботермическом восстановлении оксидных металлсодержащих руд.
1) Сульфидные и другие руды вначале подвергают окислительному обжигу : 4FeS2 + 11O2 = 2Fe2O3 + 8SO2.
2)Восстановление оксидных руд осуществляется в доменных печах, при этом протекают следующие реакции:
3Fe2O3 + CO –(t)àCO2 + 2Fe3O4, Fe3O4 + CO–(t)àCO2 + 3FeO, FeO + CO–(t)àCO2 + Feили FeO + C –(t)àCO + Fe.

Полученное железо насыщено углеродом. 3)Затем происходит «выжигание» углерода в сталеплавильных или конверторных печах с образованием стали.
4.2.1. Понятие о металлургии: общие способы получения металлов.
Металлургия — это комплексная отрасль промышленности, которая занимается производством металлов.
Поскольку большинство металлов в природе существует в виде различных соединений, то химическая суть металлургических процессов заключается в восстановлении металлов:
В зависимости от того, какой используется восстановитель и каковы условия, при которых проводят процессы восстановления различают пиро-, гидро-, электро- и биометаллургию.
Пирометаллургия (от греч. огонь и металлургия) представляет собой все химические способы восстановления металлов из руд, осуществляемые с применением высоких температур.
В качестве восстановителей в пирометаллургии используют уголь (кокс), оксид углерода (II), водород, активные металлы, кремний.
Оксидные руды чаще всего восстанавливают коксом или оксидом углерода (II) — этот процесс носит название карботермия:
Для извлечения металлов пирометаллургическим способом из сульфидных руд их сначала подвергают предварительному отжигу:
А затем, полученный оксид восстанавливают коксом:
Тугоплавкие металлы, например, молибден и вольфрам, восстанавливают водородом:
Если восстановителями химически активные металлы, то этот пирометаллургический способ называют металлотермия. В зависимости от природы металла-восстановителя различают алюминотермию, или алюмотермию, — восстановление алюминием и магнийтермию — восстановление магнием. Способ металлотермии позволяет восстанавливать металлы не только из оксидов, но и с галогенидов:
Известен способ восстановления металлов кремнием, называемый силикотермией:
Гидрометаллургия представляет собой метод получения металлов, заклющийся в преобразовании природных соединений металлов в растворимую форму с последующим восстановлением металла из раствора. О возможности применения гидрометаллургических процессов для извлечения металлов еще в 1763 г.. Говорил М. В. Ломоносов. Гидрометаллургического способами добывают благородные (золото, серебро, платину), цветные (медь, никель, цинк, кобальт), редкие (цирконий, гафний, тантал) и другие металлы:
К преимуществам данного способа относится возможность его использования для получения металлов при их малом содержании в руде, которую невозможно перерабатывать обычными способами; снижение во многих случаях загрязнения окружающей среды, например, при обжиге сульфидных руд.
Электрометаллургия — это способ получения металлов с применением электрического тока — электролиза. Электролизом расплавов получают самые активные металлы (от лития до марганца в ряду активности), электролизом водных растворов — менее активные (Zn, Cu, Ni, Cr и т.д.).
Биометалургия основана на биохимических процессах, протекающих при использовании микроорганизмов. Известно, что микроорганизмы типа литотрофы (с лат. – «поедающие камни») могут преобразовывать нерастворимые сульфиды металлов в растворимые сульфаты. Сейчас с применением микроорганизмов добывают медь (в США данный метод достигает 10% от общего ее производства), уран, рений, серебро, никель, свинец, а также некоторые редкие металлы.





Пирометаллургия, гидрометаллургия и электрометаллургия.
Способы получения металлов обычно разделяют на три типа:
· пирометаллургические (восстановление при высоких температурах);
· гидрометаллургические (восстановление из солей в растворах);
· электрометаллургические (электролиз раствора или расплава).
Пирометаллургически получают (методы извлечения металлов из руд под действием высоких температур. Оксидные руды и оксиды восстанавливают углем, оксидом углерода (II), более активным металлами (алюминий, магний)): чугун, сталь, медь, свинец, никель, хром и другие металлы.
Fe2O3 + 2Al –> 2Fe + Al2O3
Гидрометаллургически получают (методы получения металлов, основанные на химических реакциях, протекающих в растворах): золото, цинк, никель и некоторые другие металлы.
CuSO4 + Fe –> FeSO4 + Cu
Электрометаллургически получают (выделение металлов из их солей и оксидов под действием электрического тока): щелочные и щёлочноземельные металлы, алюминий, магний и другие металлы.

При разработке технологии получения химических веществ используются законы термодинамики, кинетики, теплотехники, физико-химического анализа и др. Учитываются, естественно, и экономические условия. В случае, если реакция обратима, применяется принцип Ле Шателье:
Если на систему, находящуюся в равновесии, воздействовать извне, то равновесие в системе сместится в сторону той реакции (прямой или обратной), которая приводит к частичной компенсации этого воздействия.
Химические методы применяются и при очистке выбросов, а также сточных вод химических производств.
Коррозия.
Коррозия наносит прямой ущерб, ежегодно от неё теряется около 1/3 произведённого за год во всём мире металла, но и косвенно разрушает конструкции, на которые был затрачен труд (машины, крыши, памятники архитектуры, мосты…) Тратятся ежегодно огромные средства на борьбу с этим явлением. Коррозия не щадит памятники архитектуры: Царь-пушку (1586 г.), Царь-колокол (1735 г.), медный всадник в Санкт-Петербурге, Памятник Минину и Пожарскому в Москве, только в этом случае налёт тёмно-зелёный, его называют патиной. Неизлечимо больна Эйфелева башня – символ Парижа, она изготовлена из обычной стали и необратимо ржавеет и разрушается. Башню красили 18 раз, отчего её масса (9.00 тонн) каждый раз увеличивается на 70 тонн.
В результате коррозии уменьшается прочность, блеск, снижается электропроводность, возрастает трение между деталями.
Учебник Г.Е.Рудзитис, Ф.Г.Фельдман, Химия 11 класс, страница 1108 - 111.
1. Что такое коррозия?
2. Виды коррозии – химическая и электрохимическая.
3. Методы защиты от коррозии.
Сплавы черные и цветные.
Работа с учебником, заполнение таблицы.
Учебник Г.Е.Рудзитис, Ф.Г.Фельдман, Химия 11 класс, страница 150 – 154.
| Сплав | Состав | Свойства | Область применения |
Демонстрация. В процессе обсуждения областей применения сплавов учитель демонстрирует образцы из коллекции «Металлы и сплавы», отмечая при этом их физические свойства, стойкость к коррозии, преимущества сплавов.
| Название, состав. | Свойства. | Применение. |
| Алюминевые сплавы (Al,Mg,Zn,Mn,Be) | Легкость, высокая электро и тепло проводность, коррозионная стойкость,высокая удельная прочность. | В авиации, в машиностроении, электротехнические устройства. |
| Железоуглеродистые сплавы (чугун, сталь), ферросплавы (С,Р,S, Mn,Fe,W). | Механическая прочность, твердость. Упругость, коррозионная устойчивость. | Конструкционные материалы для всех областей техники. |
| Медные сплавы(Cu,Zn,Al,Sn,Ni,P). | Прочность,высокая электропроводность и коррозионная стойкость, пластичность. | Теплотехническая аппаратура, подшипники, втулки, пружины,декаративно-прикладные изделия. |
| Твердые сплавы (сталь, Со,Ni,Mo). | Высокая твердость, тугоплавкость, износоустойчивость. | Рабочие части буровых инструментов, инструмент для обработки металлов. |
| Типографские сплавы (Pb,Sb,Sn и др.) | Низкие температуры плавления и хорошие литейные свойства. | Элементы наборов шрифта, полиграфическая промышленность. |
| Титановые сплавы (Мn,W,Ni,Cu,Mo). | Легкость, высокая прочность, коррозионная стойкость. | Ракетостроение, авиация, химическая аппаратура. |
Учащиеся отвечают на вопросы учебника на странице 154:
Доменное производство чугуна, записать химические уравнения в тетрадь и на доске.
7. Лабораторная работа № 10
Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим.

Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ - конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой.


© cyberpedia.su 2017-2020 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!
Читайте также:
