Какие металлы подвержены вторичной кристаллизации
Обновлено: 04.10.2024
Рассмотрим теперь превращения, происходящие в сталях при дальнейшем охлаждении в твердом состоянии, т. е. вторичную кристаллизацию (рис. 4).
Сплав 5 (0,3 % С). Выше точки а сплав находится в аустенитном состоянии.
Рис. 4. Нижний левый угол диаграммы состояния Fе – С – вторичная кристаллизация сталей
После окончания первичной кристаллизации аустенит охлаждается без каких-либо изменений. Углерод в сплавах понижает температуру полиморфного превращения γ→α. В сплаве 5 это превращение начнется на линии GS в точке а и будет развиваться далее с понижением температуры до точки е. Так в сплаве появляется феррит. Концентрация углерода в уменьшающемся по количеству аустените будет изменяться по линии GS (к точке S), а концентрация углерода в увеличивающемся по количеству феррите – по линии GP (к точке Р). Из приведенных ранее данных известно, что количество углерода в ферритной фазе весьма мало, поэтому выделение феррита должно вызывать заметное увеличение содержания углерода в аустените, что и происходит.
В точке е выделение феррита закончится, и сплав будет состоять из двух фаз – α р + γS .
Чуть выше линии PSK:
a = ∙100% = ∙100% = 64,1 %;
γ = ∙100% = ∙100% = 35,9 %.
Аустенит с содержанием 0,8 % углерода на линии РSК претерпевает эвтектоидноепревращение, состоящее в том, что одновременно выделяются две кристаллические фазы – феррит предельного насыщения (точка Р) и цементит:
Возникающая при эвтектоидном распаде аустенита смесь феррита и цементита имеет тонкопластинчатое строение (чередующиеся пластинки a и Fе3С) и называется перлитом– по радужной окраске поверхности шлифа после травления, имеющей сходство с перламутром.
Феррит, который выделился из аустенита в интервале температур от точки а до точки е, в эвтектоидном превращении не участвует. Во время эвтектоидного распада аустенита на линии РSК система состоит из трех фаз: αр, γS и Fе3С, поэтому по правилу фаз
С= К + 1– Ф = 2 + 1– 3 = 0.
Устанавливаем, что число степеней свободы системы равно нулю. Следовательно, эвтектоидный распад аустенита происходит при постоянной температуре и при неизменной концентрации углерода во всех трех фазах.
Сразу после перлитного превращения система состоит из фаз a и Fe3C, их относительное количество:
a = ∙100% = ∙100% = 95,8 %;
Структурные составляющие – феррит+перлит, т. е.α + (α + Fе3С).Но 95,8 % феррита делится на избыточный феррит, выделившийся в интервале ae из аустенита (64,1 %) и феррит в составе перлита (95,8 %-64,1 %=31,7 %) Цементит же весь находится в составе перлита, т.о. получается: 64,1 %α + (31,7 % α + + 4,2 % Fе3С). Количество перлита (35,9 %) соответствует количеству аустенита перед эвтектоидным превращением.
При дальнейшем охлаждении сплава, состоящего из феррита и цементита, ферритная фаза должна обедняться углеродом (по линии PQ) с выделением цементита, называемого третичным.Это фазовое превращение дает столь незначительные изменения в структуре, составе и количестве фаз, что при рассмотрении превращений в среднеуглеродистых и высокоуглеродистых сталях и чугунах им можно пренебречь. Однако превращение с выделением третичного цементита имеет большое значение для мягких сортов сталей с низким содержанием углерода, так как выделения цементной фазы могут заметно ухудшать вязкость стали.
Таким образом, при комнатной температуре сталь взятого состава (0,3 % С) в точке f состоит из двух фаз: феррита и цементита, а структурные составляющие стали (после медленного охлаждения) будут представлены так:
феррит+перлит, т. е. α + (α + Fе3С).
При этом третичный цементит не учитывается.
На рис. 5 изображена микроструктура стали с 0,3 % С после медленного охлаждения (отжига). Обнаруживаются зерна феррита и перлита, иначе называемого феррито-карбиднойсмесью (ФКС). Светлые зерна структуры представляют собой феррит, а темные – перлит.

Рис. 5. Микроструктура доэвтектоидной стали
Точка S диаграммы (0,8 % С) называется эвтектоидной точкой, а вся линия РSК - линией эвтектоидного или перлитного превращения.По отношению к эвтектоидной точке S стали делятся:
- на доэвтектоидные (содержащие до 0,8 % углерода);
- заэвтектоидные (содержащие углерода от 0,8 до 2,14 %).
Следовательно, доэвтектоидные стали при комнатной температуре после медленного охлаждения имеют одни и те же структурные составляющие: избыточный феррит + перлит, но в разных количествах в зависимости от содержания углерода.
Вторичная кристаллизация эвтектоидной стали (0,8 %) начинается сразу с эвтектоидного превращения:
Относительное количество фаз соответственно сразу после превращения:
a = ∙100 % = ∙100 % = 88,3 %;
Fe3C = ∙100 % = ∙100 % = 11,7 %.
При комнатной температуре фазовый состав – 88,3 % феррита и 11,7 % цементита, структурная составляющая одна – перлит. Микроструктура такой стали приведена на рис. 6. Заметно, что перлит имеет характерное строение с чередующимися полосками феррита и цементита, причем в каждом зерне перлита ориентировка полосок своя, отличная от таковой в соседнем зерне.
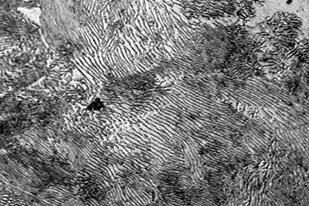
Рис. 6. Микроструктура эвтектоидной стали
Сплав 6(1,2 % С). После завершения первичной кристаллизации сталь охлаждается в аустенитном состоянии. Исходя из положения линии ES, можно установить, что аустенит стали с 1,2 % С вплоть до точки l (на линии ES) оказывается ненасыщенным углеродом. По достижении температуры точки l (рис. 4) аустенит становится предельно насыщенным углеродом, и так как растворимость углерода при охлаждении уменьшается (согласно линии ES), то, начиная с точки l, из аустенита выделяется избыток углерода в виде Fе3С, называемый вторичным (избыточным) цементитом (Fe3C)II.
Чуть выше линии PSK сплавбудет состоять из двух фаз – аустенита и вторичного цементита. Применяя правило рычага, можно установить, что весовое количество цементита и аустенита:
γ = ∙100 % = ∙100 % = 93,2 %;
Fe3C = ∙100 % = ∙100 % = 6,8 %.
Таким образом, перед превращением сплав состоит из (93,2 % γ+ + 6,8 % (Fe3C)II). Структурные и фазовые составляющие совпадают.
По достижении точки т аустенит содержит 0,8 % С (точка S) и претерпевает уже известное нам эвтектоидное превращение:
Вторичный цементит, выделившийся в интервале температур от точки l до точки m, в этом превращении не участвует. Сразу после превращения:
a = ∙100 % = ∙100 % = 82,3 %;
Fe3C = ∙100 % = ∙100 % = 17,7 %.
17,7 % – это общее количество цементита в сплаве, он включает в себя и 6,8 % избыточного (Fe3C)II, выделившегося в интервале lm, и цементит перлита: 17,7 %-6,8 %=10,9 %. Таким образом, получаем
При дальнейшем охлаждении вплоть до точки r фазовые и структурные составляющие стали не изменяются (не забывать о поправке, сделанной при разборе сплава 5 в связи с ходом линии PQ). Сплав состоит из двух фаз феррита и цементита, а структурные составляющие стали представлены так:
Микроструктура такой стали представлена на рис. 7. Здесь, наряду с перлитом, присутствует вторичный (избыточный) цементит (белая сетка вокруг зерен перлита).
При травлении шлифа обычными реактивами цементит не травится и так же, как феррит, остается чисто белым, поэтому, чтобы отличить белую сетку цементита от ферритной, нужен определенный навык исследователя или специальные методы испытаний.
При изучении микроструктур сталей часто возникает вопрос, почему перлит «темный», если феррит и цементит, как только что было рассмотрено, – это «светлые» фазы? Повторимся, перлит – это двухфазная структурная составляющая, а фазы, ее образующие, – это феррит и цементит, имеющие различную травимость. В этом случае на поверхности шлифа образуется сложный рельеф, приводящий к рассеянию падающего света.

Рис. 7. Микроструктура заэвтектоидной стали
Таким образом, заэвтектоидные стали при комнатной температуре после медленного охлаждения имеют одни и те же структурные составляющие: вторичный избыточный цементит + перлит, но в разных относительных количествах в зависимости от содержания углерода.
Конспект урока "Кристаллизация металлов и сплавов"
Цель: изучить механизм и закономерности кристаллизации; рассмотреть строение металлического слитка, научиться строить кривые охлаждения.
Основные понятия:
· Фактическая температура кристаллизации
План лекции:
1. Кристаллизация металлов и сплавов.
2. Механизм и закономерности кристаллизации металлов.
3. Условия получения мелкозернистой структуры.
4. Строение металлического слитка.
5. Кривая охлаждения железа.
1. Кристаллизация металлов и сплавов.
Любое вещество может находиться в трех агрегатных состояниях: твердом, жидком, газообразном. Возможен переход из одного состояния в другое, если новое состояние в новых условиях является более устойчивым, обладает меньшим запасом энергии.
С изменением внешних условий свободная энергия изменяется по сложному закону различно для жидкого и кристаллического состояний. Характер изменения свободной энергии жидкого и твердого состояний с изменением температуры показан на рис. 1.

Рис.1. Изменение свободной энергии в зависимости от температуры
В соответствии с этой схемой выше температуры ТS вещество должно находиться в жидком состоянии, а ниже ТS – в твердом.
При температуре равной ТS жидкая и твердая фаза обладают одинаковой энергией, металл в обоих состояниях находится в равновесии, поэтому две фазы могут существовать одновременно бесконечно долго. Температура ТS – равновесная или теоретическая температура кристаллизации.
Для начала процесса кристаллизации необходимо, чтобы процесс был термодинамически выгоден системе и сопровождался уменьшением свободной энергии системы. Это возможно при охлаждении жидкости ниже температуры ТS. Температура, при которой практически начинается кристаллизация называется реальная температурой кристаллизации.
Охлаждение жидкости ниже равновесной температуры кристаллизации называется переохлаждением, которое характеризуется степенью переохлаждения:
Степень переохлаждения зависит от природы металла, от степени его загрязненности (чем чище металл, тем больше степень переохлаждения), от скорости охлаждения (чем выше скорость охлаждения, тем больше степень переохлаждении).
Рассмотрим переход металла из жидкого состояния в твердое.
При нагреве всех кристаллических тел наблюдается четкая граница перехода из твердого состояния в жидкое. Такая же граница существует при переходе из жидкого состояния в твердое.
Кристаллизация – это процесс образования участков кристаллической решетки в жидкой фазе и рост кристаллов из образовавшихся центров.
Кристаллизация протекает в условиях, когда система переходит к термодинамически более устойчивому состоянию с минимумом свободной энергии.
Процесс перехода металла из жидкого состояния в кристаллическое можно изобразить кривыми в координатах время – температура. Кривая охлаждения чистого металла представлена на рис. 2.

Рис.2. Кривая охлаждения чистого металла
Процесс кристаллизации чистого металла:
До точки 1 охлаждается металл в жидком состоянии, процесс сопровождается плавным понижением температуры. На участке 1 – 2 идет процесс кристаллизации, сопровождающийся выделением тепла, которое называется скрытой теплотой кристаллизации. Оно компенсирует рассеивание теплоты в пространство, и поэтому температура остается постоянной. После окончания кристаллизации в точке 2 температура снова начинает снижаться, металл охлаждается в твердом состоянии.
2. Механизм и закономерности кристаллизации металлов.
При соответствующем понижении температуры в жидком металле начинают образовываться кристаллики – центры кристаллизации или зародыши. Для начала их роста необходимо уменьшение свободной энергии металла, в противном случае зародыш растворяется.
Минимальный размер способного к росту зародыша называется критическим размером, а зародыш – устойчивым.
Переход из жидкого состояния в кристаллическое требует затраты энергии на образование поверхности раздела жидкость – кристалл. Процесс кристаллизации будет осуществляться, когда выигрыш от перехода в твердое состояние больше потери энергии на образование поверхности раздела. Зависимость энергии системы от размера зародыша твердой фазы представлена на рис. 3.
Зародыши с размерами равными и большими критического растут с уменьшением энергии и поэтому способны к существованию.

Рис.3. Зависимость энергии системы от размера зародыша твердой фазы
Механизм кристаллизации представлен на рис.4.

Рис.4. Модель процесса кристаллизации
Центры кристаллизации образуются в исходной фазе независимо друг от друга в случайных местах. Сначала кристаллы имеют правильную форму, но по мере столкновения и срастания с другими кристаллами форма нарушается. Рост продолжается в направлениях, где есть свободный доступ питающей среды. После окончания кристаллизации имеем поликристаллическое тело.
Качественная схема процесса кристаллизации может быть представлена количественно кинетической кривой (рис.5).

Рис.5. Кинетическая кривая процесса кристаллизации
Процесс вначале ускоряется, пока столкновение кристаллов не начинает препятствовать их росту. Объем жидкой фазы, в которой образуются кристаллы, уменьшается. После кристаллизации 50 % объема металла, скорость кристаллизации будет замедляться.
Таким образом, процесс кристаллизации состоит из образования центров кристаллизации и роста кристаллов из этих центров.
В свою очередь, число центров кристаллизации (ч.ц.) и скорость роста кристаллов (с.р.) зависят от степени переохлаждения (рис. 6).

Рис. 6. Зависимость числа центров кристаллизации (а) и скорости роста кристаллов (б) от степени переохлаждения
Размеры образовавшихся кристаллов зависят от соотношения числа образовавшихся центров кристаллизации и скорости роста кристаллов при температуре кристаллизации.
При равновесной температуре кристаллизации ТS число образовавшихся центров кристаллизации и скорость их роста равняются нулю, поэтому процесса кристаллизации не происходит.
Если жидкость переохладить до температуры, соответствующей т.а, то образуются крупные зерна (число образовавшихся центров небольшое, а скорость роста – большая).
При переохлаждении до температуры соответствующей т.в – мелкое зерно (образуется большое число центров кристаллизации, а скорость их роста небольшая).
Если металл очень сильно переохладить, то число центров и скорость роста кристаллов равны нулю, жидкость не кристаллизуется, образуется аморфное тело. Для металлов, обладающих малой склонностью к переохлаждению, экспериментально обнаруживаются только восходящие ветви кривых.
3. Условия получения мелкозернистой структуры.
Стремятся к получению мелкозернистой структуры. Оптимальными условиями для этого являются: максимальное число центров кристаллизации и малая скорость роста кристаллов.
Размер зерен при кристаллизации зависит и от числа частичек нерастворимых примесей, которые играют роль готовых центров кристаллизации – оксиды, нитриды, сульфиды.
Чем больше частичек, тем мельче зерна закристаллизовавшегося металла.
Стенки изложниц имеют неровности, шероховатости, которые увеличивают скорость кристаллизации.
Мелкозернистую структуру можно получить в результате модифицирования, когда в жидкие металлы добавляются посторонние вещества – модификаторы,
По механизму воздействия различают:
1. Вещества, не растворяющиеся в жидком металле – выступают в качестве дополнительных центров кристаллизации.
2. Поверхностно - активные вещества, которые растворяются в металле, и, осаждаясь на поверхности растущих кристаллов, препятствуют их росту.
4. Строение металлического слитка.
Схема стального слитка, данная Черновым Д.К., представлена на рис.7.

Рис. 7. Схема стального слитка
Слиток состоит из трех зон:
1. мелкокристаллическая корковая зона;
2. зона столбчатых кристаллов;
3. внутренняя зона крупных равноосных кристаллов.
Кристаллизация корковой зоны идет в условиях максимального переохлаждения. Скорость кристаллизации определяется большим числом центров кристаллизации. Образуется мелко
Жидкий металл под корковой зоной находится в условиях меньшего переохлаждения. Число центров ограничено и процесс кристаллизации реализуется за счет их интенсивного роста до большого размера.
Рост кристаллов во второй зоне имеет направленный характер. Они растут перпендикулярно стенкам изложницы, образуются древовидные кристаллы – дендриты (рис. 8). Растут дендриты с направлением, близким к направлению теплоотвода.

Рис.8. Схема дендрита по Чернову Д.К.
Так как теплоотвод от незакристаллизовавшегося металла в середине слитка в разные стороны выравнивается, то в центральной зоне образуются крупные дендриты со случайной ориентацией.
Зоны столбчатых кристаллов в процессе кристаллизации стыкуются, это явление называется транскристаллизацией.
Для малопластичных металлов и для сталей это явление нежелательное, так как при последующей прокатке, ковке могут образовываться трещины в зоне стыка.
В верхней части слитка образуется усадочная раковина, которая подлежит отрезке и переплавке, так как металл более рыхлый (около 15…20 % от длины слитка)
Методы исследования металлов: структурные и физические
Металлы и сплавы обладают разнообразными свойствами. Используя один метод исследования металлов, невозможно получить информацию о всех свойствах. Используют несколько методов анализа.
5. Аллотропия или полиморфные превращения.
Способность некоторых металлов существовать в различных кристаллических формах в зависимости от внешних условий (давление, температура) называется аллотропией или полиморфизмом.
Каждый вид решетки представляет собой аллотропическое видоизменение или модификацию.
Примером аллотропического видоизменения в зависимости от температуры является железо (Fe).
Fe: ;
;
; (высокотемпературноеПревращение одной модификации в другую протекает при постоянной температуре и сопровождается тепловым эффектом. Видоизменения элемента обозначается буквами греческого алфавита в виде индекса у основного обозначения металла.
Примером аллотропического видоизменения, обусловленного изменением давления, является углерод: при низких давлениях образуется графит, а при высоких – алмаз.
Используя явление полиморфизма, можно упрочнять и разупрочнять сплавы при помощи термической обработки.
6. Кривая охлаждения железа.
Порядковый номер железа в таблице Менделеева – 26, атомная масса - A= 55,85 а.е.м. (атомные единицы массы). Радиус атома - R = 1,27А. Температура плавления - Тпл = 1539 0 С. Плотность – 7,68 г/см 3 .
Железо существует в двух аллотропических модификациях: объемноцентрированного куба ( Fe a ) и гранецентрированного куба ( Fe g ). Из кривой охлаждения чистого железа (рис.9) видно, что Fe a существует в двух интервалах температур : ниже 911 0 С и от 1392 до 1539 0 С. Достигнув при охлаждении температуры 1392 0 С, Fe a претерпевает аллотропическое превращение, в процессе которого кристаллическая решетка объемно-центрированного куба при постоянной температуре перестраивается в решетку гранецентрированного куба Fe g . Второе аллотропическое превращение в процессе охлаждения происходит при температуре 911 0 С, когда Fe g (решетка гранецентрированного куба) перестраивается в объемноцентрированную кубическую решетку Fe a .
При температуре 768 0 С, называемой точкой Кюри, железо испытывает магнитное превращение: ниже 768 0 С железо становится магнитным. Магнитное превращение есть особый вид превращения и имеет ряд особенностей, отличающих его от аллотропического превращения.
Большая Энциклопедия Нефти и Газа
Вторичная кристаллизация преимущественно протекает в соответствии с метастабильной диаграммой, вторичный цементит и цементит перлита могут сохраниться или графитизироваться в зависимости от содержания кремния и скорости охлаждения. [16]
Вторичная кристаллизация аустенита в условиях переохлажде ния сопровождается образованием эвтектоида с меньшим содержанием углерода и сниженной микротвердостью. Распад аустенита должен обеспечивать, образование троостито-мартенситных, мар-тенситных или мартенсито-аустенитных структур, обеспечивающих повышение износостойкости. В частности, легированием чугунов никелем решают только эту задачу. [17]
Вторичная кристаллизация сплавов происходит при аллотропических превращениях их компонентов или при частичном или полном распадении твердых растворов, при образовании новых твердых растворов, химических соединений или механических смесей. Все превращения в сплавах в твердом состоянии вызывают образование новых фаз и называются фазовыми превращениями, а температуры, при которых они протекают, носят название температур фазовых превращений. [18]
Вторичная кристаллизация сплава , протекающие эв-тектоидные превращения в твердом состоянии изменяют его структуру и свойства. [19]
Вторичная кристаллизация металла происходит в виде изменений форм зерен. Она в значительной степени зависит от химического состава металла, скорости охлаждения, а также от ряда других факторов. [20]
Вторичная кристаллизация заэвтектоидных сталей начинается с выпадения вторичного цементита. Вторичный цементит образует оторочку вокруг зерен аустенита. При пересечении линии SK аустенит превращается в перлит. [21]
Вторичную кристаллизацию , протекающую в процессе охлаждения пробы, частично можно предотвратить, уменьшая навеску, употребляемую для обжига; целый ряд силикатов удалось получить в стеклообразном состоянии, уменьшив величину проб от обычно применявшихся в 0 1 - 0 2 г до 0 02 - 0 01 г. Однако в ряде случаев и эта мера не приносит желаемых результатов. Для исследования термических превращений в подобных, кристалли зующихся с большими скоростями силикатных системах, применяют динамическую методику термического анализа. [22]
Явления вторичной кристаллизации возможны только в некоторых металлах переходных групп. [23]
При вторичной кристаллизации состав жидкой фазы изменяется по кривой КЕ, а состав твердой фазы - по прямой АН. [25]
Для вторичной кристаллизации : характерны те же закономерности, что и для первичной: кристаллизация идет путем зарождения и роста центров новой фазы, а течение этих процессов и размеры образовавшихся кристаллов зависят от степени переохлаждения. Однако вторичная кристаллизация имеет свои особенности, связанные с тем, что новая фаза появляется в среде с высокой упругостью и имеет другой удельный объем. [26]
При вторичной кристаллизации в сплавах Fe - Fe3C протекает аллотропическое превращение FeT - - Fe - и распад как твердого раствора 7, так и твердого раствора а, обусловленный изменением растворимости углерода в железе Т и а при понижении температуры. [27]
Примеры вторичной кристаллизации встречаются в железе, олове, марганце, кобальте и некоторых других металлах ( см. фиг. [28]
При вторичной кристаллизации может наблюдаться изменение плотности и механических свойств термопласта. [29]
При вторичной кристаллизации вследствие изменения растворимости с изменением температуры выделяются вторичные кристаллы. Вторичная кристаллизация наблюдается и в том случае, если хотя бы один из компонентов претерпевает аллотропические превращения. [30]
Вторичная кристаллизация в том смысле, как она определена выше, может быть рассмотрена с позиций отбрасывания ( или сегрегации) молекул растворителя, некристаллизующихся участков макромолекул и коротких макромолекул на поверхность растущего кристалла. В этом случае сегрегированный материал концентрируется между ветвями кристалла. По мере развития кристаллизации диффузионное смешение этого сегрегированного материала с остающимся аморфным материалом становится все более затрудненным. Хотя степень кристалличности, достигаемая в процессе вторичной кристаллизации в течение 5000 мин, проходила через максимум примерно при температуре 110 С, что является типичным для роста исходных кристаллов, однако продолжительное увеличение степени кристалличности ( после 100 мин) чаблюдалось при повышении температуры с возрастающей скоростью, i это свидетельствовало о наличии процесса совершенствования кри-зталлов. [1]
Вторичная кристаллизация в сплавах железо-углерод связана с переходом при охлаждении - железа в а-же-лезо и соответствующим распадом аустенита. Линия GS на диаграмме состояния соответствует началу превращения аустенита с выделением из него феррита. [2]
Вторичная кристаллизация в сплавах железо - углерод связана с переходом при охлаждении у-железа в а-железо и соответствующим распадом аустенита. Линия GS на диаграмме состояния соответствует началу превращения аустенита с выделением из него феррита. Линия ES указывает на уменьшение предела растворимости углерода в у-железе с понижением температуры - следовательно, она соответствует началу распада аустенита с выделением из него избыточного углерода в виде цементита. Температурные точки, образующие линию ES, принято обозначать Аст. [4]
Вторичная кристаллизация в сплавах железо - углерод связана с переходом при охлаждении v-железа в а-железо и распадом в связи с этим аустенита. Линия GS на диаграмме состояния ( рис. 59 и 61) соответствует началу распада аустенита с выделением из него феррита. Принято критические точки, образующие линию ( JS, обозначать при нагреве / Зс3, а при охлаждении АГЗ. Линия SE характеризует начало распада аустенита с выделением из него избыточного углерода в виде цементита. Точка S, отвечающая содержанию 0 8 % С ( точнее 0 83 % С), показывает минимальную температуру ( 723) равновесного существования аустенита. По достижении точки S происходит распад аустенита с одновременным выделением из него феррита и цементита, образующих эвт е кто и д н у ю смесь, которая называется перлитом. [6]
Вторичная кристаллизация происходит после завершения первичной и характеризуется сменой кристаллических решеток ( полиморфные превращения) и изменением структуры. [7]
Вторичная кристаллизация или перекристаллизация происходит в чугуне в твердом состоянии при высоких температурах. [8]
Вторичная кристаллизация в сплавах железо - углерод связана с переходом при охлаждении - железа в а-железо и соответствующим распадом аустенита. Линия GS на диаграмме состояния соответствует началу превращения аустенита с выделением из него феррита. Линия ES указывает на уменьшение предела растворимости углерода в у-железе с понижением температуры - следовательно, она соответствует началу распада аустенита с выделением из него избыточного углерода в виде цементита. Температурные точки, образующие линию ES, принято обозначать Аст. [10]
Вторичная кристаллизация как изменение кристаллического строения в твердом состоянии возможна, например, для веществ, обладающих полиморфными свойствами. Вторичную кристаллизацию называют также перекристаллизацией, так как зародыши новой структуры часто возникают на границах зерен исходных кристаллитов и растут, поедая их. [12]
Вторичная кристаллизация начинается с распада первичной структуры и заканчивается при низких температурах образованием устойчивых нераспадающихся микроструктур. [14]
Тест по материаловедению.

Укажите структуру, обладающую магнитными свойствами:
19. Какой тип чугуна представлен следующей маркировкой СЧ12-28
в) высокопрочный чугун
20. Какой тип чугуна представлен следующей маркировкой КЧ37-12
а) относительное удлинение;
б) предел прочности при изгибе;
в) предел прочности при растяжении.
22. Какие легирующие элементы входят в состав чугуна ЧН2МТ
а) ниобий, медь, титан;
б) никель, молибден, титан;
в) водород, марганец, тантал.
23. Определите содержание углерода, хрома, никеля в стали 08Х8Н2
24. Основной чугун – это…..
а) сплав железа с углеродом, содержание которого от 2,14 до 6,67 %;
б) сплав железа с углеродом, содержание которого до 2,14 %;
в) сплав железа с углеродом, содержание которого более 6, 67 %;
25. Какие стали по содержанию углерода С относятся к низкоуглеродистым:
26. По качественным признакам конструкционная углеродистая сталь делится на:
а) инструментальную б) сталь обыкновенного качества; в) легированную
27. В маркировке легированных сталей буква Г означает:
а) марганец б) молибден в) кремний
Укажите самый лёгкий цветной металл:
Укажите цветной металл, который будет находиться в жидком состоянии при комнатной температуре:
Используя справочную литературу, укажите, какая кристаллическая решётка присуща железу при температуре 900…. 1400 о С:
а) кубическая гранецентрированная;
б) кубическая объёмно-центрированная;
Как называется свойство металла медленно и непрерывно удлиняться под действием приложенных к нему постоянных рабочих напряжений в условиях повышенных и высоких температур:
При помощи, каких установок выполняют испытания металлических образцов на ударную вязкость:
а) разрывной машины МПБ – 2;
б) маятникового копра;
в) пресса Роквелла;
г) любой из перечисленных установок?
Укажите физические свойства металлов:
Как называется метод изучения структур металлов, который следует использовать для определения химического состава металлов:
Укажите способ, с помощью которого исследуют ферромагнитные материалы:
а) спектральный анализ;
б) ультразвуковая дефектоскопия;
в) магнитная дефектоскопия;
г) рентгеновский способ.
Какие металлы относятся к цветным:
Какой металл имеет самую высокую температуру плавления:
Как называется переход из жидкого состояния в твёрдое состояние:
Укажите структуру, которой соответствует определение: «Твёрдый раствор углерода в α-железе, который существует в стали только до температуры 727 0 С. Содержание углерода в таком сплаве незначи-тельно: минимальное (0,006 %) при комнатной температуре, максимальное (0,02 %) при температуре 727 0 С»:
При каком соотношении компонентов образуется сплав типа твёрдый раствор:
при любом соотношении компонентов;
при заданном соотношении компонентов;
в зависимости от назначения сплава?
Укажите самую твёрдую структуру железоуглеродистого сплава:
Каково максимальное количество компонентов в сплаве:
количество компонентов зависит от вида сплава и его назначения;
Укажите многокомпонентные сплавы:
все перечисленные сплавы.
в) высокопрочный чугун.
18. Какие стали по содержанию углерода С относятся к высокоуглеродистым
19. В маркировке легированных сталей буква М означает:
а) марганец б) молибден в) кремний.
20. Сталь марки 45 содержит углерода:
21. К сталям с особыми свойствами относят:
а) жаростойкие б) общего назначения в) углеродистые.
22. Определите содержание углерода, хрома в стали 40Х4:
Читайте также:
