Какие металлы растворяет йод
Обновлено: 04.10.2024
Руководитель:
Комлева Наталья Александровна,
учитель начальных классов.
г. Нижневартовск
2012г.
КООРДИНАЦИОННЫЙ ЦЕНТР НАЦИОНАЛЬНОЙ ОБРАЗОВАТЕЛЬНОЙ ПРОГРАММЫ «ИНТЕЛЛЕКТУАЛЬНО-ТВОРЧЕСКИЙ ПОТЕНЦИАЛ РОССИИ» МЕЖРЕГИОНАЛЬНЫЙ ФЕСТИВАЛЬ ИССЛЕДОВАТЕЛЬСКИХ РАБОТ «ОТКРЫТИЕ МИРА»
Актуальность выбранной темы
Йода в человеческом организме всего 25 мг, он играет важную роль.
При недостатке йода задерживается физическое и умственное развитие и возникает болезнь.
Одним из важнейших микроэлементов, необходимых для слаженной работы организма является йод. Роль йода в развитии и сохранении жизни на нашей планете не может взять ни один другой элемент. Йод такой знакомый и доступный – в любой аптеке можно купить пузырек йодной настойки, но это совсем не тот йод которого не хватает нашему организму.
И какими еще неизвестным свойствами обладает этот редкий,
но повсеместно распространенный элемент.
Актуальность выбранной темы
Проблема
Человек в повседневной жизни постоянно сталкивается с йодной настойкой и с препаратами содержащими йод. Но как применять их без вреда для здоровья и предметов?
Для полноценного развития организма
человека необходимы макро- и микроэлементы,
а для самозащиты наиболее важен йод.
Этот микроэлемент играет главную роль в организме, обеспечивая его устойчивость к повреждающим факторам внешней среды: радиации, химическим ядам, травмам и так далее.
Из йода на 65% состоит тироксин - гормон щитовидной железы, который повышает сопротивляемость тканей, способность клеток освобождаться от вредных веществ, регулирует интенсивность дыхания и энергетический обмен.
Но этим не ограничивается польза микроэлемента. Пока человек получает достаточное количество энергии, он бодр, полон сил, жизнерадостен и здоров.
Как только хотя бы в одной из энергетических цепочек происходит сбой, самочувствие ухудшается. При серьезных неполадках в энергетическом обмене человек заболевает.
Гипотеза
Предполагается, что йод, будучи активным веществом, при взаимодействии с металлом вступает в химическую реакцию (окисление) и образует новое химической соединение (йодистое железо).
Цель
исследовать взаимодействие йода с металлом
Задачи
Узнать историю открытия йода.
Выявить значение йода в природе и в жизни человека.
Провести в домашних условиях эксперимент по взаимодействию йода с металлом (сталь).
Методы
сбор информации;
анализ литературы;
эксперимент;
наблюдение;
Описание.
Интересные факты о йоде
Йод и кот
Йод — очень редкий элемент земной коры (60-е место среди всех элементов). У йода есть одна особенность — крайняя рассеянность в природе.
Будучи далеко не самым распространенным элементом, йод присутствует практически везде.
Находится в виде иодидов в морской воде Присутствует в живых организмах, больше всего в водорослях.
Известен в природе также в свободной форме, в качестве минерала, но такие находки единичны
Йод получают из золы морских водорослей и буровых нефтяных вод.
Нахождение йода в природе
Лазурит
Схема круговорота йода в природе
Дождь в горах
Море
В.О.Мохнач, известный российский учёный, охарактеризовал значение йода такими словами: " Этот элемент входит в состав тироксина (гормона щитовидной железы), который жизненно необходим в качестве регулятора роста организма и стимулятора процессов обмена веществ. Трудно даже себе представить, какую форму приняла бы жизнь позвоночного животного, если бы в природе отсутствовал этот элемент".
Если бы они употребляли йод,
то никогда бы не вымерли.
В пищу необходимо использовать:
овощи, фрукты, крупы, морепродукты
Каким образом наш организм получает йод
Сколько надо йода
Для того чтобы обеспечить поступление в организм необходимых количеств йода, используют йодированную поваренную соль, хлеб а также обогащенные йодом биологически активные добавок к пище.
В домашних условиях мы часто используем «йодную настойку», обладающую дезинфицирующим действием. Следует иметь в виду, что обрабатывать йодной настойкой можно только небольшие раны, так как йод может травмировать ткани и увеличить сроки их заживления.
Йод химически активный элемент, поэтому обращение с йодом требует осторожности.
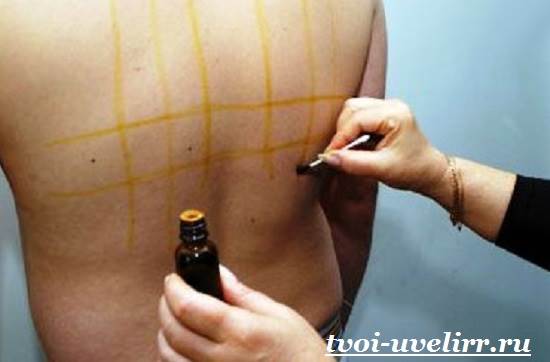
Рассмотрим в ходе эксперимента взаимодействие йода с металлом.
1. Берём стальную пластину, очищаем до металлического блеска, обезжириваем поверхность бензином.
Затем нагреваем пластину до t 40-45 С и наносим тонкий слой парафина на одну сторону пластины, остужаем до комнатной температуры.
ПРАКТИЧЕСКАЯ ЧАСТЬ.
Проведем эксперемент, с
целью узнать как взаимодействует
йод с металлом.
2. Острым предметом по парафину наносим надпись на поверхность.
3. Заполняем надпись раствором йода, по мере высыхания повторяем.
4. Через 24 часа смываем парафин и на поверхности пластины получаем результаты опыта
Практическое применение результатов исследования
Маркировка деталей на производстве
Маркировка деталей на производстве
В ходе эксперимента сделаны выводы:
1. Йод ,как и все химические элементы группы галогенов, является активным окислителем.
2. Йод в процессе взаимодействия со стальной пластиной вступил в реакцию окисления, в результате чего мы получили (йодистое железо) ожидаемый результат.
В ходе данного исследования мы научились проводить химический эксперимент
в домашних условиях.
Сделали вывод , что раствор йода химически активен с металлами, поэтому его производят и хранят только в стеклянной таре.
Выяснили, что свойства йода применяются в промышленности для получения высокочистого титана, циркония и др.металлов (йодное рафинирование металлов).
Также йод применяют в йодных лампах накаливания, в пищевых добавках, красителях, в медицине и фотографии.
Выявили, что йод имеет огромное значение как в природе так и в жизни человека.
ЗАКЛЮЧЕНИЕ
Исследовательская работа
Взаимодействие йода
с металлом
Автор: Юртаев Григорий Антонович МБОУ «Лицей №2», 1 а класс.
Благодарю за внимание!
КООРДИНАЦИОННЫЙ ЦЕНТР НАЦИОНАЛЬНОЙ ОБРАЗОВАТЕЛЬНОЙ ПРОГРАММЫ «ИНТЕЛЛЕКТУАЛЬНО-ТВОРЧЕСКИЙ ПОТЕНЦИАЛ РОССИИ» МЕЖРЕГИОНАЛЬНЫЙ ФЕСТИВАЛЬ ИССЛЕДОВАТЕЛЬСКИХ РАБОТ «ОТКРЫТИЕ МИРА»
Рабочие листы и материалы для учителей и воспитателей
Более 3 000 дидактических материалов для школьного и домашнего обучения
Йод

Йод (тривиальное (общеупотребительное) название — йод; от греч. ἰώδης — «фиалковый (фиолетовый)») — химический элемент с атомным номером 53. Принадлежит к 17-й группе периодической таблицы химических элементов (по устаревшей короткой форме периодической системы принадлежит к главной подгруппе VII группы, или к группе VIIA), находится в пятом периоде таблицы. Атомная масса элемента 126,90447 а. е. м. . Обозначается символом I (от лат. Iodum ). Химически активный неметалл, относится к группе галогенов.
Простое вещество йод при нормальных условиях — кристаллы чёрно-серого цвета с фиолетовым металлическим блеском, легко образует фиолетовые пары, обладающие резким запахом. Элементарный йод высокотоксичен. Молекула простого вещества двухатомна (формула I2).

Блестящий тёмно-серый неметалл. В газообразном состоянии — фиолетовый.

Содержание
- 1 Название и обозначение
- 2 История
- 3 Нахождение в природе
- 4 Физические свойства
- 4.1 Изотопы
- 6.1 В медицине
- 6.2 В криминалистике
- 6.3 В технике: рафинирование металлов
- 6.3.1 Источники света
- 6.3.2 Производство аккумуляторов
- 6.3.3 Лазерный термоядерный синтез
- 6.3.4 Радиоэлектронная промышленность
- 7.1 Й од и щитовидная железа
- 7.2 Токсичность
![йод]()
Название и обозначение
Название элемента предложено Гей-Люссаком и происходит от др.-греч. ἰο-ειδής (букв. «фиалкоподобный»), что связано с цветом пара, который наблюдал французский химик Бернар Куртуа, нагревая маточный рассол золы морских водорослей с концентрированной серной кислотой. В медицине и биологии данный элемент и простое вещество обычно называют йодом, например, «раствор йода», в соответствии со старым вариантом названия, существовавшим в химической номенклатуре до середины XX века.
В современной химической номенклатуре используется наименование йод. Такое же положение существует в некоторых других языках, например, в немецком: общеупотребительное Jod и терминологически корректное Iod. Одновременно с изменением названия элемента в 1950-х годах Международным союзом общей и прикладной химии символ элемента J был заменен на I.
История
Йод был открыт в 1811 г. Куртуа в золе морских водорослей, а с 1815 г. Гей-Люссак стал рассматривать его как химический элемент.
Нахождение в природе
![йод кристаллический]()
Йод — редкий элемент. Его кларк — всего 400 мг/т . Однако он чрезвычайно сильно рассеян в природе и, будучи далеко не самым распространенным элементом, присутствует практически везде. Йод находится в виде йодидов в морской воде ( 20—30 мг на тонну морской воды). Присутствует в живых организмах, больше всего в водорослях ( 2,5 г на тонну высушенной морской капусты, ламинарии). Известен в природе также в свободной форме, в качестве минерала, но такие находки единичны, — в термальных источниках Везувия и на острове Вулькано (Италия). Запасы природных йодидов оцениваются в 15 млн тонн , 99 % запасов находятся в Чили и Японии. В настоящее время в этих странах ведётся интенсивная добыча йода, например, чилийская Atacama Minerals производит свыше 720 тонн йода в год. Наиболее известный из минералов йода — лаутарит Ca(IO3)2. Некоторые другие минералы йода — йодобромит Ag(Br, Cl, I), эмболит Ag(Cl, Br), майерсит CuI·4AgI.
Сырьём для промышленного получения йода в России служат нефтяные буровые воды, тогда как в зарубежных странах, не обладающих нефтяными месторождениями, используются морские водоросли, а также маточные растворы чилийской (натриевой) селитры, щёлок калийных и селитряных производств, что намного удорожает производство йода из такого сырья.
Физические свойства
![йод кристаллический]()
Йод при обычных условиях — твёрдое вещество, чёрно-серые или тёмно-фиолетовые кристаллы со слабым металлическим блеском и специфическим запахом.
Пары имеют характерный фиолетовый цвет, так же, как и растворы в неполярных органических растворителях, например, в бензоле — в отличие от бурого раствора в полярном этиловом спирте. Слабо растворяется в воде ( 0,28 г/л ), лучше растворяется в водных растворах йодидов щелочных металлов с образованием трийодидов (например трийодида калия KI3).
При нагревании при атмосферном давлении йод сублимирует (возгоняется), превращаясь в пары фиолетового цвета; при охлаждении при атмосферном давлении пары йода кристаллизуются, минуя жидкое состояние. Этим пользуются на практике для очистки йода от нелетучих примесей.
Жидкий йод можно получить, нагревая его под давлением.
![йод кристаллы]()
Изотопы
Известны 37 изотопов йода с массовыми числами от 108 до 144. Из них только 127 I является стабильным, период полураспада остальных изотопов йода составляет от 103 мкс до 1,57⋅10 7 лет; отдельные изотопы используются в терапевтических и диагностических целях.
Радиоактивный нуклид 131 I распадается с испусканием β-частиц (наиболее вероятные максимальные энергии — 0,248, 0,334 и 0,606 МэВ ), а также с излучением γ-квантов с энергиями от 0,08 до 0,723 МэВ .
![йод цилиндр]()
Химические свойства
Йод относится к группе галогенов.
Электронная формула (Электронная конфигурация) йода: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 5p 5 .
Образует ряд кислот: йодоводородную (HI), йодноватистую (HIO), йодистую (HIO2), йодноватую (HIO3), йодную (HIO4).
Химически йод довольно активен, хотя и в меньшей степени, чем хлор и бром.
- Довольно известной качественной реакцией на йод является его взаимодействие с крахмалом, при котором наблюдается синее окрашивание в результате образования соединения включения. Эту реакцию открыли в 1814 году Жан-Жак Колен (Jean-Jacques Colin) и Анри-Франсуа Готье де Клобри (Henri-François Gaultier de Claubry).
- С металлами йод при легком нагревании энергично взаимодействует, образуя йодиды:
- С водородом йод реагирует только при нагревании и не полностью, образуя йодоводород:
- Йод является окислителем, менее сильным, чем фтор, хлор и бром. Сероводород H2S, Na2S2O3 и другие восстановители восстанавливают его до иона I − :
Последняя реакция также используется в аналитической химии для определения йода.
- При растворении в воде йод частично реагирует с ней (По "Началам Химии" Кузьменко: реакция не идёт даже при нагревании, текст нуждается в проверке)
- Реакция образования нитрида трийода:
Нитрид трийода в сухом кристаллическом состоянии разлагается с выделением фиолетовых паров йода, что демонстрируется как эффектная химическая реакция.
- Йодиды щелочных металлов очень склонны в растворах присоединять (растворять) молекулы галогенов с образованием полийодидов (перйодидов) — трийодид калия, дихлоройодат I калия:
Применение
В медицине
![раствор йода]()
5-процентный спиртовой раствор йода используется для дезинфекции кожи вокруг повреждения (рваной, резаной или иной раны), но не для приёма внутрь при дефиците йода в организме. Продукты присоединения йода к крахмалу, другим ВМС (т. н. «Синий йод» — Йодинол, Йокс, Бетадин и др.) являются более мягкими антисептиками.
При большом количестве внутримышечных инъекций, на их месте пациенту делается йодная сетка, — йодом рисуется сетка на площади, в которую делаются инъекции (напр., на ягодицах). Это нужно для того, чтобы быстро рассасывались «шишки», образовавшиеся в местах внутримышечных инъекций.
Широко рекламируется в альтернативной (неофициальной) медицине, однако его использование без назначения врача в целом мало обосновано и нередко сопровождается различными рекламными заявлениями.
В качестве антисептика применяется всё реже и реже, наряду со спиртовым раствором йода используется зелёнка, фукорцин, пиоктанин, растворы перекиси водорода и др.
В рентгенологических и томографических исследованиях широко применяются йодсодержащие контрастные препараты.
Йод-131, как и некоторые радиоактивные изотопы йода ( 125 I, 132 I) применяются в медицине для диагностики и лечения заболеваний щитовидной железы. Изотоп широко применяется при лечении диффузно-токсического зоба (болезни Грейвса), некоторых опухолей. Согласно нормам радиационной безопасности НРБ-99/2009, принятым в России, выписка из клиники пациента, лечившегося с использованием йода-131, разрешается при снижении общей активности этого нуклида в теле пациента до уровня 0,4 ГБк .
В криминалистике
В криминалистике пары йода применяются для обнаружения отпечатков пальцев на бумажных поверхностях, например, на купюрах.
В технике: рафинирование металлов
Источники света
Йод используется в источниках света:
- галогеновых лампах — в качестве компонента газового наполнителя колбы для осаждения испарившегося вольфрама нити накаливания обратно на неё.
- металлогалогеновых дуговых лампах — в качестве газовой среды разряда используются галогениды ряда металлов, использование различных смесей которых позволяет получать лампы с большим разнообразием спектральных характеристик.
Производство аккумуляторов
Йод используется в качестве компонента положительного электрода (окислителя) в литиево-ионных аккумуляторах для автомобилей.
Лазерный термоядерный синтез
Некоторые йодорганические соединения применяются для производства сверхмощных газовых лазеров на возбужденных атомах йода (исследования в области лазерного термоядерного синтеза).
Радиоэлектронная промышленность ]
В последние годы резко повысился спрос на йод со стороны производителей жидкокристаллических дисплеев.
Динамика потребления йода
Мировое потребление йода в 2005 году составило 25,8 тыс. тонн
![йод кристаллы]()
Биологическая роль
Йод относится к микроэлементам и присутствует во всех живых организмах. Его содержание в растениях зависит от присутствия его соединений в почве и водах. Некоторые морские водоросли (морская капуста, ламинария, фукус и другие) накапливают до 1 % йода. Богаты йодом водные растения семейства рясковых. Йод входит в скелетный белок губок и скелетопротеинов морских многощетинковых червей.
Йод и щитовидная железа
У животных и человека йод входит в состав так называемых тиреоидных гормонов, вырабатываемых щитовидной железой — тироксина и трийодтиронина, оказывающих многостороннее воздействие на рост, развитие и обмен веществ организма.
В организме человека (масса тела 70 кг ) содержится 12—20 мг йода. Суточная потребность человека в йоде определяется возрастом, физиологическим состоянием и массой тела. Для человека среднего возраста нормальной комплекции (нормостеник) суточная доза йода составляет 0,15 мг .
Отсутствие или недостаток йода в рационе (что типично для некоторых местностей) приводит к заболеваниям (эндемический зоб, кретинизм, гипотиреоз). В связи с этим к поваренной соли, поступающей в продажу в местностях с естественным геохимическим дефицитом йода, с профилактической целью добавляют йодид калия, йодид натрия или йодат калия (йодированная соль).
Недостаток йода приводит к заболеваниям щитовидной железы (например, к базедовой болезни, кретинизму). Также при небольшом недостатке йода отмечается усталость, головная боль, подавленное настроение, природная лень, нервозность и раздражительность; слабеет память и интеллект. Со временем появляется аритмия, повышается артериальное давление, падает уровень гемоглобина в крови.
Избыток йода в пище обычно легко переносится организмом, однако в отдельных случаях в людях с повышенной чувствительностью этот избыток может также привести к расстройствам щитовидной железы.
Токсичность
![кристаллы йода]()
Йод токсичен. Смертельная доза (LD50) — 3 г. Вызывает поражение почек и сердечно-сосудистой системы. При вдыхании паров йода появляется головная боль, кашель, насморк, может быть отёк лёгких. При попадании на слизистую оболочку глаз появляется слезотечение, боль в глазах и покраснение. При попадании внутрь появляется общая слабость, головная боль, повышение температуры, рвота, понос, бурый налёт на языке, боли в сердце и учащение пульса. Через день появляется кровь в моче. Через 2 дня появляются почечная недостаточность и миокардит. Без лечения наступает летальный исход.
ПДК йода в воде 0,125 мг/дм³, в воздухе 1 мг/м³.
Радиоактивный йод-131 (радиойод), являющийся бета- и гамма-излучателем, особенно опасен для организма человека, так как радиоактивные изотопы биохимически не отличаются от стабильных. Поэтому почти весь радиоактивный йод, как и обычный, концентрируется в щитовидной железе, что приводит к её облучению и дисфункции. Основным источником загрязнения атмосферы радиоактивным йодом являются атомные станции и фармакологическое производство. В то же время это свойство радиойода позволяет использовать его для борьбы с опухолями щитовидной железы и диагностики её заболеваний (см. выше).
Химия йода и его соединений
История открытия этого элемента, напрямую связана с именем французского химика–технолога и фармацевта Бернара Куртуа, родившегося в 1777 и умершего в 1838 году. Свое великое открытие ученый сделал в 1811 г. В этот период, как раз, когда шли Наполеоновский войны, государство нуждалось в больших объемах селитры, которая использовалась для производства пороха. Страна уже имела большие запасы натриевой селитры, но она была малопригодна для производства пороха, так как быстро сырела на воздухе. Однако, уже был известен способ превращения натриевой селитры в калийную, с использованием золы морских водорослей. Этим и занимался Куртуа в своей лаборатории, т.е. в тот период он являлся производителем селитры. По ходу своей работы он заметил, что в золе водорослей находится какое-то вещество, которое разъедает железные и медные сосуды, но ни он сам и ни один из его помощников не знали, как это вещество выделить. Очень распространена версия о том, что совершить открытие Куртуа помог его кот. Говорят, что Бернар Куртуа не только работал в своей лаборатории, но и зачастую любил обедать в ней. А его кот часто находился рядом с ним. В один из таких дней, что-то напугало кота, и он бросился бежать, столкнув на своем пути несколько колб, в одной из которых находился спиртовой экстракт золы водорослей, а в другой серная кислота. Колбы разбились и находящиеся в них вещества смешались вместе, при этом в воздух поднялись фиолетовые пары, а затем выпали в мелкие темные кристаллики вокруг. Действительно, при действие серной кислоты на йодные соли щелочных металлов (NaI, KI), выделяется йодоводород (HI), который является непрочным веществом и в присутствие серной кислоты разлагается с образованием молекулярного йода и некоторых других продуктов: H2SO4 + 8HI = H2S + 4I2 + 4H2O
Куртуа сильно заинтересовался наблюдаемым явлением и хорошо изучил новое вещество. Некоторое время спустя Куртуа сообщил о своем открытие двум друзьям Н. Клеману и Ш.Б. Дезорму. А спустя еще какое-то время, новым элементом заинтересовались двое знаменитых ученых – француз Ж.Л. Гей-Люссак и англичанин Г. Дэви. Начав исследования данного элемента, эти ученые долгое время вели между собой горячие научные споры, а когда пришло время выбирать название химического элемента Гей-Люссак предложил – Йод, а Дэви – Йодин, причем оба руководствовались цветом (от греч. Iodes – фиолетовый).
Йод при комнатной температуре представляет собой темно-фиолетовые кристаллы со слабым блеском. При нагревании под атмосферным давлением он сублимируется (возгоняется), превращаясь в пар фиолетового цвета; при охлаждении пары йода кристаллизуются, минуя жидкое состояние. Этим пользуются на практике для очистки йода от нелетучих примесей. Мало растворим в воде, хорошо во многих органических растворителях.
![https://present5.com/presentation/-33157459_83418436/image-9.jpg]()
Йод — редкий элемент. Он чрезвычайно сильно рассеян в природе и, будучи далеко не самым распространенным элементом, присутствует практически везде. Йод находится в виде йодидов в морской воде ( 20—30 мг на тонну морской воды). Присутствует в живых организмах, больше всего в водорослях ( 2,5 г на тонну высушенной морской капусты, ламинарии). Известен в природе также в свободной форме, в качестве минерала, но такие находки единичны, — в термальных источниках Везувия и на острове Вулькано (Италия). Запасы природных йодидов оцениваются в 15 млн тонн , 99 % запасов находятся в Чили и Японии. В настоящее время в этих странах ведётся интенсивная добыча йода.
Сырьём для промышленного получения йода в России служат нефтяные буровые воды
Природный йод состоит только из одного изотопа — йода-127
Строение атома и атомные характеристики йода
Электронная формула йода: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 5p 5 .
Конфигурация внешнего электронного слоя — 5s 2 p 5 .
Известной качественной реакцией на йод является его взаимодействие с крахмалом, при котором наблюдается синее окрашивание в результате образования соединения включения.
1) С металлами йод при легком нагревании энергично взаимодействует, образуя йодиды:
Йод легко реагирует с алюминием, причем катализатором в этой реакции является вода:
2) С водородом йод реагирует только при нагревании и не полностью, образуя йодоводород:
3) Йод является окислителем, менее сильным, чем фтор, хлор и бром. Сероводород H2S, Na2S2O3 и другие восстановители восстанавливают его до иона I − :
4) Йод может также окислять сернистую кислоту:
5) При растворении в воде йод частично реагирует с ней
6) Йод окисляется концентрированной кислотой:
7) В горячих водных растворах щелочей образуются йодид и йодат
I2 + 2KOH = KI + KIO + H2O
8) При нагревании йод взаимодействует с фосфором:
а йодид фосфора в свою очередь взаимодействует с водой, образуя йодоводород и фосфоновую (трив. фосфористую) кислоту:
![http://900igr.net/up/datas/239098/028.jpg]()
Йодоводород, газ, очень похож по своим свойствам на хлороводород, но отличается более выраженными восстановительными свойствами. Очень хорошо растворим в воде (425:1), концентрированный раствор йодоводорода дымит вследствие выделения паров HI, образующего с водяными парами туман.
В водном растворе принадлежит к числу наиболее сильных кислот.
Йодоводород уже при комнатной температуре постепенно окисляется кислородом воздуха, причем под действием света реакция сильно ускоряется:Восстановительные свойства йодоводорода заметно проявляются при взаимодействии с концентрированной серной кислотой, которая при этом восстанавливается до свободной серы или даже до H2S. Поэтому HI невозможно получить действием серной кислоты на иодиды. Обычно йодоводород получают действием воды на соединения йода с фосфором - РI3. Последний подвергается при этом полному гидролизу, образуя фосфористую кислоту и йодоводород: РI3 + ЗН2О = Н3РО3 + 3HI
Раствор йодоводорода (вплоть до 50%-ной концентрации) можно также получить, пропуская H2S в водную суспензию йода.Йодоводород реагирует с хлоридом железа (III) с образованием молекулярного йода:
или с сульфатом железа (III):
Йодоводород легко окисляется соединениями азота, например, оксидом азота (IV):
Йод. Свойства йода. Применение йода
Кошка бежала, хвостиком махнула. Это не сказка про курочку Рябу, а история открытия йода. Его обнаружили на парижском заводе, преобразующем натриевую селитру в калиевую. Первая отсыревала на воздухе, а вторая была дефицитом.
![Йод-Свойства-йода-Применение-йода-1]()
В воздух взметнулись фиолетовые пары. Это видел владелец завода Бернар Курт. Несколько опытов провел сам, потом передал информацию ученым. Итог – в 1814-ом году мир узнал о существовании нового элемента. Им стал йод.
Химические и физические свойства йода
Свойства йода обусвловлены его расположением в таблице Менделеева . Элемент зачислен в 7-ю группу. В ней собраны галогены – наиболее активные неметаллы. У йода, например, легко поляризуемая электронная оболочка.
То есть, ей не стоит труда разделиться в пространстве. Это позволяет катионам других элементов проникать в атом неметалла, масса которого, кстати, 127. «Гости» в электронной оболочке меняют ее, делая йод наиболее ковалентным из всех галогенов.
Проще говоря, элемент может образовывать больше разнообразных связей с другими атомами. Нередко йод поляризуется положительно. Такой атом наиболее активен. Выделяет его и цвет, тот самый фиолетовый.
Атом йода занесенный в таблицу Менделеева – природный экземпляр. Это стабильный изотоп с атомной массой 127. Искусственно получены и другие атомы с номерами 125, 129, 131.
![Йод-Свойства-йода-Применение-йода-2]()
Каждый из них – радиоактивный йод. Изотопы излучают бета- и гамма-лучи, применяются в медицине. Получают радиоактивный йод из продуктов деления урана. То есть, лабораториями служат атомные реакторы.
Стандартный йод можно совместить с большинством неметаллов и примерно 40% металлов. Благородные платина , золото , и не только, на 53-ий элемент не реагируют. Взаимодействие невозможно, так же, с азотом , углеродом, кислородом и всеми инертными газами.
Йод ли изучаете, или его соединения, можно определить с помощью воды. Чистый элемент в ней почти не растворяется. Йодиты же, то есть соединения вещества со щелочными и щелочноземельными атомами, растворимы. В исходном виде 53-ий элемент исчезает в воде лишь при сильном нагреве.
Раствор йода легко получить, если использовать органику. Подойдут глицерин, сероуглерод или четыреххлористый углерод. Если растворитель бескислородный, он окрасится в фиолетовый. Если в жидкости есть атомы кислорода, йод сделает ее бурой .
В чистом виде, при комнатной температуре, йод фиолетово-черный. Блеск вещества металлический, агрегатное состояние – кристаллы . Они плотные – почти 5 граммов на кубический сантиметр.
![Йод-Свойства-йода-Применение-йода-3]()
Кристаллы сложены из молекул, в каждой из которых по 2 атома. В газообразное состояние вещество переходит при температуре 183 градуса. Получение йода жидкого возможно уже при 114-ти по шкале Цельсия.
Применение йода
Соли йода используют в стекольной промышленности. Речь о фарах автомобилей и светильников со спецэффектами. Главный эффект – йодиты служат фильтрами от встречных лучей света. Водители знают, как важно, порой, их нейтрализовать.
Этот процесс назван поляроидом и, собственно, впервые пригодился в фотографическом искусстве. Автор придумки – англичанин Уильям Толбот. Он был выдающимся химиком и физиком 19-го столетия.
В 21-ом веке правят цифровые технологии. Тем не менее, чтобы получить негатив фото до сих пор применяют йодистую разновидность серебра . В сочетании с желатином она дает эмульсию, которой обмазывают подложку из стекла. На покрытие попадает свет, начинается выделение серебра . Больше света – больше металла. Так и составляется картинка.
Йод применение нашел и в металлургии. Соединения элемента помогают получить металлы высокой чистоты. Разлагая йодиты термическим путем, промышленники извлекают, к примеру, ванадий и цирконий. Эти тугоплавкие элементы необходимы для многих ракетных сплавов и материй атомных реакторов.
В автомобильных подшипниках тоже можно найти йод. Какой в нем смысл? Элемент добавляют в смазку. Она рекомендована для титановых сплавов и нержавеющей стали. Обработка позволяет деталям выдержать нагрузку в 50 раз больше стандартной. Это при том, что йода в смазке всего 1-2%.
![Йод-Свойства-йода-Применение-йода-4]()
Без 53-го элемента немыслима медицина. Йод в организме контролирует работу щитовидной железы, входит в вырабатываемые ей гормоны ТТГ, Т3 и Т4. При нехватке элемента развивается зоб, возможны раковые образования.
При этом, организм не может выработать вещество сам. Йод поступает исключительно с пищей, БАДами и медикаментами. Из последних легко вспоминается «Йодомарин».
Его назначают даже грудным детям, особенно, в местностях удаленных от морей. В таких районах, как правило, наблюдается дефицит 53-го элемента, содержащегося, в основном, в водах океанов и их дарах.
Одна из последних разработок врачей — синий йод. К нему примешен крахмал, меняющий цвет привычного раствора для наружного применения. Крахмал, так же, нейтрализует действие спирта и прочих вредных «присадок». Такой эликсир медики разрешают уже для внутреннего применения и для полоскания йодом. Хотя, с последним справится и смесь соль, сода, йод.
Лечение йодом допускается не только в его стабильной, но и радиоактивной формах. Так 131-ый изотоп применяют для восстановления функций щитовидной железы. Процедуры строго нормированы, поскольку переизбыток радиоактивного йода может спровоцировать онкологию.
Добыча йода
Сколько йода добывают в год? Около 30 000 тонн. Мировые запасы элемента оценены почти в 15 000 000 тонн. Большинство из них скрыты в соединениях йода. В чистом виде он встречается редко.
До сих пор актуален способ выделения вещества из природных накопителей – водорослей. В тонне высушенной ламинарии содержится 5 килограммов йода. Отзывы о морской воде иные, — в ней лишь 25 миллиграммов на каждую 1000 литров.
![Йод-Свойства-йода-Применение-йода-5]()
При сжигании водорослей образуются йодиты – соли калия и никеля . Это зола. При взаимодействии с серной кислотой из нее выделяется йодистый водород – фиолетовый дым. Он быстро разлагается. При этом, выпадает чистый элемент за номером 53.
Промышленники, как правило, добывают 53-ий элемент из вод нефтяных, газовых месторождений, технических вод. На 1 кубический метр в них, порой, содержится 300 граммов йода. Железа моет немного содержаться и прочих примесей, но они не мешают процессу.
Помогает метод воздушной десорбции. Он основан на разности упругости паров йода и воды. 53-ий элемент вытесняют из жидкости потоком воздуха. Возможный гидролиз подавляют, примешивая к воде кислоты. Потом добавляют хлор.
Он окисляет йодит (к примеру, калий-йод) до элементарного йода. Потом, собственно, происходит вытеснение. Остается абсорбировать вещество из воздуха. «Губкой» служит, как правило, диоксид серы . Кристаллы йода выпадут из него под воздействием все того же хлора.
Цена йода
Если нужно купить йод-мазь или другой препарат на основе 53-го элемента, его стоимость будет зависеть от производителя, наименования и назначения лекарства. Если же цель – чистый йод, придется выложить 4-5000 рублей за 100 граммов. Предложения есть, к примеру, у «Компонент реактив» и прочих фирм, снабжающих лаборатории. В России на кристаллический йод действует ГОСТ 4159-79.
Читайте также: