Какие металлы вытесняют водород из разбавленной серной кислоты
Обновлено: 14.05.2024
Кислородсодержащие кислоты: серная (H2SO4), азотная (HNO3), фосфорная (H3PO4), хлорная (HClO4) и другие.
Если в кислотах атомы неметаллов, их образующие, будут иметь высокие степени окисления, то металлы могут восстанавливать кислоты до различных степеней окисления, сами при этом окисляясь до ионного состояния.
9.4.4. Взаимодействие металлов с серной кислотой. Серная кислота может восстанавливаться или до S 2- или, чаще, до S(IV). Степень восстановления серы зависит от активности металла, концентрации кислоты и температуры.
Окислители: могут быть ионы водорода либо ионы серы (VI).
А) р а з б а в л е н н а я
Если серная кислота разбавлена, то диполи воды притягиваются к молекуле H2SO4, выделяется энергия гидратации, которая затрачивается на отрыв ионов водорода, в результате ионы водорода получают по сравнению с серой (VI), окруженной отрицательными ионами кислорода, преимущество. Поэтому выделяется водород и образуется сульфат металла.
Мe z + + zē= Мe 0 j 0 вос = j 0 Me z + /Me,
2Н + + 2ē = Н2 0 j 0 ок = j H + / H = – 0,059·pH
Вероятность осуществления реакции рассчитывается аналогично варианту взаимодействия металлов с бескислородными кислотами. Водород вытесняют из разбавленной серной кислоты те металлы, электродный потенциал которых меньше потенциала водородного электрода с учетом перенапряжения ( ).
Б) к о н ц е н т р и р о в а н н а я
Если серная кислота концентрированная, то число диссоциированных молекул мало и ионы водорода теряют свое преимущество. К тому же потенциалы восстановления S(VI) немного, но все-таки более положительны, чем водорода, поэтому восстанавливается сера. Общая схема взаимодействия выглядит следующим образом:
Какое соединение серы образуется при взаимодействии, зависит от активности металла. Сульфат-ион может восстанавливаться до соединений серы, где степень окисления серы понижается («+4» в SO2; «0» в S; «–2» – в H2S). Чем активнее металл, т.е. меньше величина электродного потенциала, тем полнее происходит восстановление сульфат-иона.
Сильноактивные металлы:
SO + 10H + + 8ē = H2S + 4H2O, j = +0,311 B;
Среднеактивные металлы:
HSO + 7H + + 6ē = S + 4H2O, j = +0,351 B;
Слабоактивные металлы:
H2SO4 + 2H + + 2ē = SO2 + 2H2O, j 0 = +0,438 B.
Концентрированная серная кислота с малой концентрацией ионов Н + может при нагревании окислять металлы, которые в ряду активности не могут вытеснять водород. Металлы, склонные к пассивации (Fe, Cr, Al, Ti), при взаимодействии с концентрированной серной кислотой, покрываются оксидной пленкой (Al2O3, Ti2O3), выделяется немного SO2, и далее не растворяются.
9.4.5. Взаимодействие металлов с азотной кислотой. Азотная кислота является сильнейшим окислителем, как и её соли. Атом азота N 2s 2 2p 3 не может иметь степень окисления «+5», так как он не имеет свободных орбиталей на валентном уровне, но s-электроны атома азота могут образовать неустойчивую связь еще с одним атомом кислорода, и в этом состоянии азот проявляет себя как очень сильный окислитель. Продуктами восстановления соединений, соответствующих оксиду N2O5 (азотный ангидрид), могут быть диоксид азота NO2, азотистый ангидрид N2O3, монооксид азота NO, закись азота N2O, азот N2, аммиак NH3.
Отметим при этом, что N2O3 неустойчив и при небольшом нагревании диспропорционирует на NO и NO2. «бурый газ» (NO2) – устойчивое соединение, и NOлегко переходит в него, окисляясь кислородом воздуха. За исключением N2O («веселящего газа»), все оксиды азота ядовиты.
Азотная кислота растворяет практически все металлы, за исключением золота и группы платиновых металлов, так как она является сильным окислителем и все ее соли (нитраты) хорошо растворимы в воде.
Взаимодействие металлов с таким сильным окислителем, как азотная кислота, может приводить к образованию продуктов с разными степенями окисления азота: «+4» в NO2, «+3» в HNO2, «+2» в NO, «0» в N2, «–3» в NH3.
При взаимодействии металлов с азотной кислотой металл – восстановитель, окислителем всегда является нитрат-ион. Поскольку потенциал восстановления N(V) гораздо более положителен, чем водорода, то водород никогда не выделяется при взаимодействии металлов с азотной кислотой.
А) к о н ц е н т р и р о в а н н а я HNO3
Взаимодействие с к о н ц е н т р и р о в а н н о й азотной кислотой протекает по схеме:
Me 0 - zē → Me z+ j 0 вос = j 0 Me z+ /Me,
(N +5 O3) - + 2H + + ē →N +4 O2+ H2O j 0 ок = +0,78 В.
Термодинамическую возможность реакции оцениваем по формуле ΔG 0 = –zFE 0 = – zF(φ 0 ок – φ 0 вос).
В концентрированной HNO3 пассивируются Fe, Cr, Al.
Б) р а з б а в л е н н а я
Если азотная кислота разбавленная, то молекул кислоты в растворе меньше, поэтому каждой молекуле достается разное количество электронов. Степень окисления N(V) меняется значительнее, все зависит от активности металла:
Me 0 + HNO3(разб) → Me(NO3)z + H2O + соединения азота.
Me – zē → Me z + ;
NO + 4H + + 3ē → N +2 O + 2H2O, φ = 0,96 В;
NO + 6H + + 5ē → ½N2 + 3H2O, φ = 1,24 В;
NO + 9H + + 8ē → N -3 H3 + 3H2O, φ = 0,87 В.
Активные металлы восстанавливают азот до NH3 и его комплексного иона – аммония, слабоактивные – до NO.
Обычно при взаимодействии металлов с азотной кислотой продуктами реакции являются несколько оксидов, но чаще всего они выделяются совместно и преобладание одного из оксидов определяется концентрацией азотной кислоты и температурой процесса.
9.4.6. Взаимодействие металлов со смесями кислот. Многие металлы с положительным электродным потенциалом, образующие устойчивые оксидные пленки, не растворяются в какой-либо отдельной кислоте, а растворяются и травятся в смесях кислот. Такие смеси состоят из кислоты, обладающей ярко выраженными окислительными свойствами (HNO3, H2SO4, H2SeO4, HClO3, HClO4), и кислоты, анион которой образует устойчивые комплексные ионы с катионом металла (HCl, HF и т.д.).
Взаимодействие металла со смесями кислот происходит по реакции
Me + HF + HNO3 → Hm-z[Me z + Fm] + NO + H2O.
Металл окисляется, анион окислительной кислоты восстанавливается.
Например, палладий растворяется в смеси кислот по реакции:
Аналогично в смесях кислот ведут себя золото, платиновые металлы, ниобий, тантал.
КОНТРОЛЬНЫЕ ВОПРОСЫ
9.1. Какую роль играют металлы в окислительно-восстановительных процессах?
9.2. Какими параметрами можно оценить химическую активность металла как элемента и простого вещества?
9.3. Какими свойствами обладают оксиды металлов в разных степенях окисления?
9.4. Как оценить термодинамическую вероятность взаимодействия металлов с водой, кислотами, диссоциирующими с образованием Н + и растворами щелочей?
9.5. Какие продукты реакции следует ожидать при взаимодействии различных металлов с азотной кислотой и почему? Как влияет на это концентрация раствора?
9.6. Какие продукты следует ожидать при взаимодействии металлов с разбавленной и концентрированной серной кислотой? Прокомментируйте ответ.
9.7. Какие ионы окисляют металлы при растворении их:
а) в разбавленной и концентрированной серной кислоте;
б) в водных растворах щелочей;
в) в разбавленной и концентрированной азотной кислоте?

Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни.



Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ - конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой.
© cyberpedia.su 2017-2020 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!
Серная кислота
Серная кислота - сильная двухосновная кислота, при н.у. маслянистая жидкость без цвета и запаха.
Обладает выраженным дегидратационным (водоотнимающим) действием. При попадании на кожу или слизистые оболочки приводит к тяжелым ожогам.
Замечу, что существует олеум - раствор SO3 в безводной серной кислоте, дымящее жидкое или твердое вещество. Олеум применяется при изготовлении красителей, органическом синтезе и в производстве серной кислот.

Получение
Известны несколько способов получения серной кислоты. Применяется промышленный (контактный) способ, основанный на сжигании пирита, окислении образовавшегося SO2 до SO3 и последующим взаимодействием с водой.
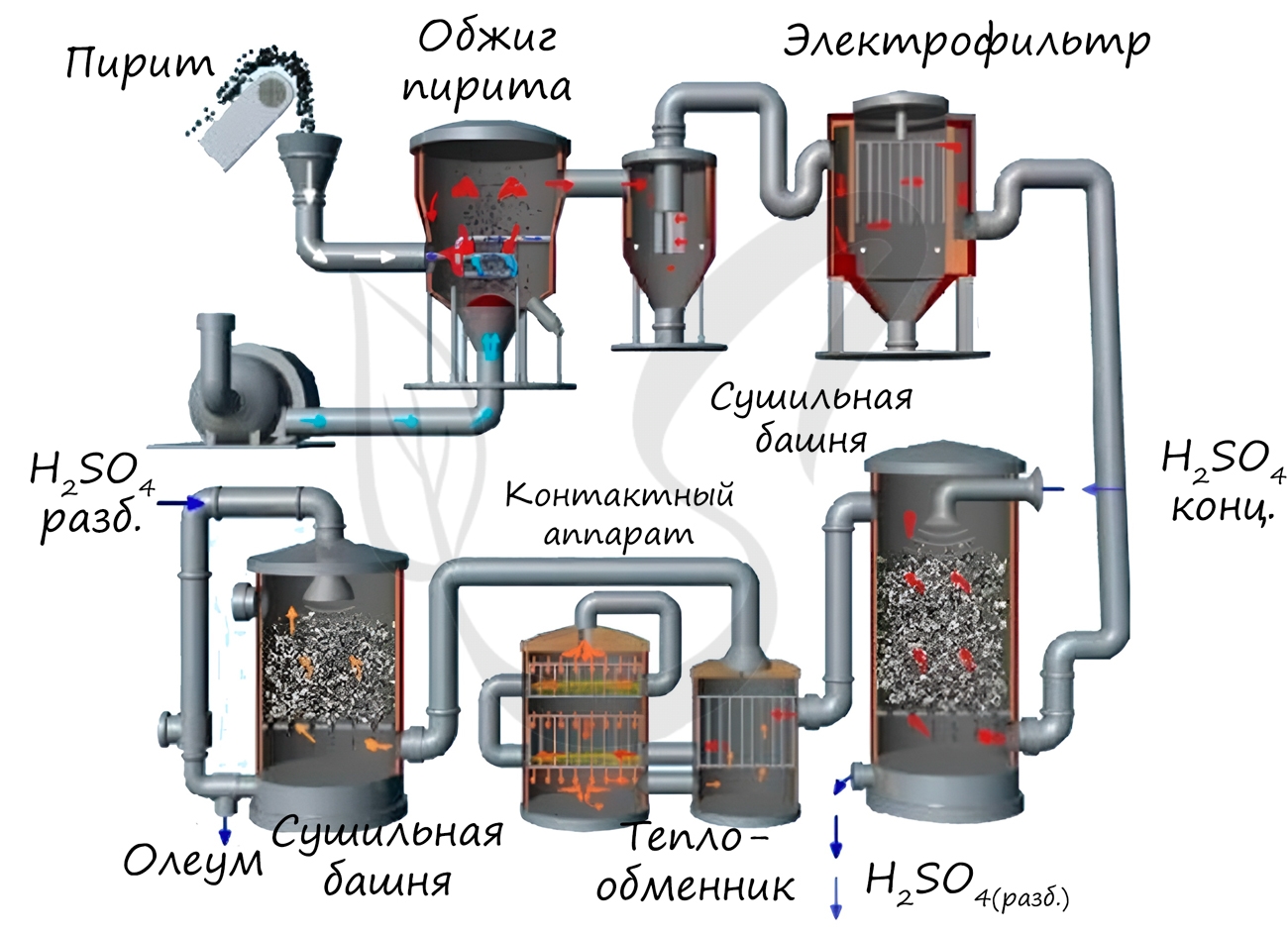
Нитрозный способ получения основан на взаимодействии сернистого газа с диоксидом азота IV в присутствии воды. Он состоит из нескольких этапов:
В окислительной башне смешивают оксиды азота (II) и (IV) с воздухом:
Смесь газов подается в башни, орошаемые 75-ной% серной кислотой, здесь смесь оксидов азота поглощается с образованием нитрозилсерной кислоты:
В ходе гидролиза нитрозилсерной кислоты получают азотистую кислоту и серную:
В упрощенном виде нитрозный способ можно записать так:

Химические свойства
В водном растворе диссоциирует ступенчато.
Сильная кислота. Реагирует с основными оксидами, основаниями, образуя соли - сульфаты.
KOH + H2SO4 = KHSO4 + H2O (гидросульфат калия, соотношение 1:1 - кислая соль)
2KOH + H2SO4 = K2SO4 + 2H2O (сульфат калия, соотношение 2:1 - средняя соль)

С солями реакция идет, если в результате выпадает осадок, образуется газ или слабый электролит (вода). Серная кислота, как и многие другие кислоты, способна растворять осадки.

Серная кислота окисляет неметаллы - серу и углерод - соответственно до угольной кислоты (нестойкой) и сернистого газа.
Реакции разбавленной серной кислоты с металлами не составляют никаких трудностей: она реагирует как самая обычная кислота, например HCl. Все металлы, стоящие до водорода, вытесняют из серной кислоты водород, а стоящие после - не реагируют с ней.
Подчеркну, что реакции разбавленной серной кислоты с железом и хромом не сопровождаются переходом этих элементов в максимальную степень окисления. Они окисляются до +2.
Cu + H2SO4(разб.) ⇸ (реакция не идет, медь не может вытеснить водород из кислоты)

Концентрированная серная кислота ведет себя совершенно по-иному. Водород никогда не выделяется, вместо него с активными металлами выделяется H2S, с металлами средней активности - S, с малоактивными металлами - SO2.


Холодная концентрированная серная кислота пассивирует Al, Cr, Fe, Ni, Be, Co. При нагревании или амальгамировании данных металлов реакция идет.
Обратите особое внимание, что при реакции железа, хрома с концентрированной серной кислотой достигается степень окисления +3. В подобных реакциях с разбавленной серной кислотой (написаны выше) достигается степень окисления +2.

Иногда в тексте задания даны подсказки. Например, если написано, что выделился газ с неприятным запахом тухлых яиц - речь идет об H2S, если же написано, что выделилось простое вещество - речь о сере (S).
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Урок 24. Выделение водорода в реакциях кислот с металлами
В уроке 24 «Выделение водорода в реакциях кислот с металлами» из курса «Химия для чайников» познакомимся с рядом активности металлов, а также больше узнаем о кислотах в химических реакциях.

Характерное химическое свойство кислот — выделение из них водорода в реакциях с некоторыми металлами. Атомы металлов замещают атомы водорода в молекулах кислот, в результате чего водород выделяется в виде газа. В пробирку с хлороводородной кислотой опустим кусочек цинка. На поверхности металла образуются, а затем выделяются из раствора пузырьки газа. Соберем этот газ в пробирку и поднесем ее к пламени спиртовки (рис. 100). Мы услышим хлопок. Это свидетельствует о наличии в пробирке водорода.
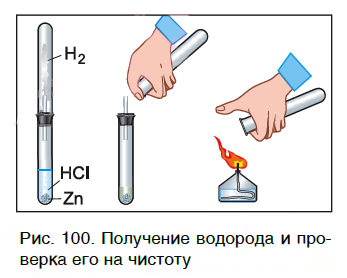
Каплю образовавшегося раствора поместим на стеклянную пластинку и подогреем ее в пламени спиртовки. После испарения воды на пластинке остается вещество белого цвета. Опытным путем можно установить, что состав этого вещества выражается формулой ZnCl2.
Теперь мы можем записать уравнение реакции цинка с кислотой:
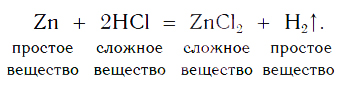
На рисунке 101 дана схема этой реакции. Из уравнения и поясняющей его схемы видим, что атомы цинка замещают атомы водорода в кислоте. В результате из простого вещества цинка и сложного вещества хлороводородной кислоты образуются два новых: сложное вещество ZnCl2 и простое вещество водород Н2.
Так же протекают реакции алюминия, железа, других металлов и с раствором серной кислоты:
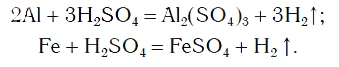
Эти химические реакции подтверждают, что кислоты являются сложными веществами, состоящими из атомов водорода,
способных замещаться на атомы металла, и кислотных остатков.
Вытеснительный ряд металлов
При проведении опыта вы убедились, что алюминий энергично вытесняет водород из раствора хлороводородной кислоты. С железом реакция вытеснения водорода протекает менее энергично, а с медью вовсе не идет.
По интенсивности вытеснения водорода из кислот металлы можно разместить в ряд:
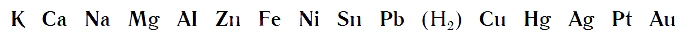
Его называют рядом активности или вытеснительным рядом металлов.
Чем левее расположен металл в вытеснительном ряду до водорода (Н2), тем активнее он вытесняет водород из кислот. Металлы, стоящие в ряду правее водорода, из кислот водород не вытесняют.
Зная расположение металлов в вытеснительном ряду, заранее можно предсказать:
- Будут ли реагировать металлы с кислотами с выделением водорода;
- Насколько активно будут протекать эти реакции.
Для получения водорода из кислот в лаборатории или школьном кабинете химии необходимо брать металлы, которые в вытеснительном ряду стоят до водорода. Но не каждый металл подходит для этих целей. Активные металлы натрий и калий реагируют с кислотами со взрывом, а реакции кислот с оловом и свинцом протекают медленно. Наиболее подходящими металлами для практического получения водорода являются цинк и алюминий. Как вы убедились, при проведении реакций этих металлов с раствором хлороводородной кислоты они протекают спокойно и достаточно быстро.
Краткие выводы урока:
- Кислоты — сложные вещества, состоящие из атомов водорода, способных замещаться на атомы металлов, и кислотных остатков.
- Металлы, стоящие в вытеснительном ряду до водорода, вытесняют его из кислот.
- В лаборатории водород получают в реакции металлов с кислотами.
Надеюсь урок 24 «Выделение водорода в реакциях кислот с металлами» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Какие металлы вытесняют водород из разбавленной серной кислоты
ОТНОШЕНИЕ МЕТАЛЛОВ К КИСЛОТАМ
Чаще всего в химической практике используются такие сильные кислоты как серная H 2 SO 4 , соляная HCl и азотная HNO 3 . Далее рассмотрим отношение различных металлов к перечисленным кислотам.
Соляная кислота ( HCl )
Соляная кислота – это техническое название хлороводородной кислоты. Получают ее путем растворения в воде газообразного хлороводорода – HCl . Ввиду невысокой его растворимости в воде, концентрация соляной кислоты при обычных условиях не превышает 38%. Поэтому независимо от концентрации соляной кислоты процесс диссоциации ее молекул в водном растворе протекает активно:
Образующиеся в этом процессе ионы водорода H + выполняют роль окислителя, окисляя металлы, расположенные в ряду активности левее водорода. Взаимодействие протекает по схеме:
Me + HCl соль + H 2 ↑
При этом соль представляет собой хлорид металла ( NiCl 2 , CaCl 2 , AlCl 3 ), в котором число хлорид-ионов соответствует степени окисления металла.
Соляная кислота является слабым окислителем, поэтому металлы с переменной валентностью окисляются ей до низших положительных степеней окисления:
Fe 0 → Fe 2+
Co 0 → Co 2+
Ni 0 → Ni 2+
Cr 0 → Cr 2+
Mn 0 → Mn 2+ и др .
2 Al + 6 HCl → 2 AlCl 3 + 3 H 2 ↑
2│ Al 0 – 3 e - → Al 3+ - окисление
3│2 H + + 2 e - → H 2 – восстановление
Соляная кислота пассивирует свинец ( Pb ). Пассивация свинца обусловлена образованием на его поверхности трудно растворимого в воде хлорида свинца ( II ), который защищает металл от дальнейшего воздействия кислоты:
Pb + 2 HCl → PbCl 2 ↓ + H 2 ↑
Серная кислота ( H 2 SO 4 )
В промышленности получают серную кислоту очень высокой концентрации (до 98%). Следует учитывать различие окислительных свойств разбавленного раствора и концентрированной серной кислоты по отношению к металлам.
Разбавленная серная кислота
В разбавленном водном растворе серной кислоты большинство ее молекул диссоциируют:
Образующиеся ионы Н + выполняют функцию окислителя.
Как и соляная кислота, разбавленный раствор серной кислоты взаимодействует только с металлами активными и средней активности (расположенными в ряду активности до водорода).
Химическая реакция протекает по схеме:
1│2Al 0 – 6e - → 2Al 3+ - окисление
Металлы с переменной валентностью окисляются разбавленным раствором серной кислоты до низших положительных степеней окисления:
Mn 0 → Mn 2+ и др .
Свинец ( Pb ) не растворяется в серной кислоте (если ее концентрация ниже 80%) , так как образующаяся соль PbSO 4 нерастворима и создает на поверхности металла защитную пленку.
Концентрированная серная кислота
В концентрированном растворе серной кислоты (выше 68%) большинство молекул находятся в недиссоциированном состоянии, поэтому функцию окислителя выполняет сера, находящаяся в высшей степени окисления ( S +6 ). Концентрированная H 2 SO 4 окисляет все металлы, стандартный электродный потенциал которых меньше потенциала окислителя – сульфат-иона SO 4 2- (0,36 В). В связи с этим, с концентрированной серной кислотой реагируют и некоторые малоактивные металлы.
Процесс взаимодействия металлов с концентрированной серной кислотой в большинстве случаев протекает по схеме:
Me + H 2 SO 4 (конц.) соль + вода + продукт восстановления H 2 SO 4
Продуктами восстановления серной кислоты могут быть следующие соединения серы:
Практика показала, что при взаимодействии металла с концентрированной серной кислотой выделяется смесь продуктов восстановления, состоящая из H 2 S , S и SO 2. Однако, один из этих продуктов образуется в преобладающем количестве. Природа основного продукта определяется активностью металла: чем выше активность, тем глубже процесс восстановления серы в серной кислоте.
Взаимодействие металлов различной активности с концентрированной серной кислотой можно представить схемой:

Алюминий ( Al ) и железо ( Fe ) не реагируют с холодной концентрированной H 2 SO 4 , покрываясь плотными оксидными пленками, однако при нагревании реакция протекает.
Ag , Au , Ru , Os , Rh , Ir , Pt не реагируют с серной кислотой.
Концентрированная серная кислота является сильным окислителем, поэтому при взаимодействии с ней металлов, обладающих переменной валентностью, последние окисляются до более высоких степеней окисления, чем в случае с разбавленным раствором кислоты:
Fe 0 → Fe 3+ ,
Cr 0 → Cr 3+ ,
Mn 0 → Mn 4+ ,
Sn 0 → Sn 4+
Свинец ( Pb ) окисляется до двухвалентного состояния с образованием растворимого гидросульфата свинца Pb ( HSO 4 )2 .

пятница, 20 февраля 2015 г.
Взаимодействие металлов с кислотами
С разбавленными кислотами, которые проявляют окислительные свойства за счет ионов водорода (разбавленные серная, фосфорная, сернистая, все бескислородные и органические кислоты и др.)

реагируют металлы:
• расположенные в ряду напряжений до водорода (эти металлы способны вытеснять водород из кислоты);
• образующие с этими кислотами растворимые соли (на поверхности этих металлов не образуется защитная солевая
пленка).
В результате реакции образуются растворимые соли и выделяется водород:
2А1 + 6НСI = 2А1С13 + ЗН2↑
М g + Н2 SO 4 = М gS О4 + Н2↑
разб.
С u + Н2 SO 4 → X (так как С u стоит после Н2)
разб.
РЬ + Н2 SO 4 → X (так как РЬ SO 4 нерастворим в воде)
разб.
Некоторые кислоты являются окислителями за счет элемента, образующего кислотный остаток, К ним относятся концентрированная серная, а также азотная кислота любой концентрации. Такие кислоты называют кислотами-окислителями.

Окислительные свойства кислотных остатков и значительно сильнее, чем нона водорода Н, поэтому азотная и концентрированная серная кислоты взаимодействуют практически со всеми металлами, расположенными в ряду напряжений как до водорода, так и после него, кроме золота и платины. Так как окислителями в этих случаях являются ноны кислотных остатков (за счет атомов серы и азота в высших степенях окисления), а не ноны водорода Н, то при взаимодействии азотной, а концентрированной серной кислот с металлами не выделяется водород. Металл под действием данных кислот окисляется до характерной (устойчивой) степени окисления и образует соль, а продукт восстановления кислоты зависит от активности металла и степени разбавления кислоты

Разбавленная и концентрированная серные кислоты ведут себя по-разному. Разбавленная серная кислота ведет себя, как обычная кислота. Активные металлы, стоящие в ряду напряжений левее водорода
вытесняют водород из разбавленной серной кислоты. Мы видим пузырьки водорода при добавлении разбавленной серной кислоты в пробирку с цинком.
Медь стоит в ряду напряжений после водорода – поэтому разбавленная серная кислота не действует на медь. А в концентрированной серной кислоты, цинк и медь, ведут себя таким образом…
Цинк, как активный металл, может образовывать с концентрированной серной кислотой сернистый газ, элементарную серу, и даже сероводород.
Медь - менее активный металл. При взаимодействии с концентрированно серной кислотой восстанавливает ее до сернистого газа.
Следует иметь в виду, что на схемах указаны продукты, содержание которых максимально среди возможных продуктов восстановления кислот.
На основании приведенных схем составим уравнения конкретных реакций — взаимодействия меди и магния с концентрированной серной кислотой:
0 +6 +2 +4
С u + 2Н2 SO 4 = С uSO 4 + SO 2 + 2Н2 O
конц.
0 +6 +2 -2
4М g + 5Н2 SO 4 = 4М gSO 4 + Н2 S + 4Н2 O
конц.
Некоторые металлы ( Fe . АI, С r ) не взаимодействуют с концентрированной серной и азотной кислотами при обычной температуре, так как происходит пассивации металла. Это явление связано с образованием на поверхности металла тонкой, но очень плотной оксидной пленки, которая и защищает металл. По этой причине азотную и концентрированную серную кислоты транспортируют в железных емкостях.
Если металл проявляет переменные степени окисления, то с кислотами, являющимися окислителями за счет ионов Н + , он образует соли, в которых его степень окисления ниже устойчивой, а с кислотами-окислителями — соли, в которых его степень окисления более устойчива:
0 +2
F е+Н2 SO 4 = F е SO 4 +Н2
0 разб. + 3
F е+Н2 SO 4 = F е2( SO4 )3 + 3 SO2 + 6Н2 O
конц
Читайте также:
