Какие углеводороды образуются при действии металлического натрия
Обновлено: 18.05.2024
Прежде, чем приступить к решению задач какого-либо раздела, следует внимательно изучить соответствующий раздел по учебнику. При этом необходимо обратить внимание на основные способы получения, химические свойства, условия реакций и на связь данного класса соединений с другими классами. Следует учесть, что между разными классами органических соединений существует тесная генетическая связь. Например, реакция присоединения галогенводородов к алкенам лежит в основе одного из способов получения галогеналканов и одновременно является иллюстрацией реакционной способности алкенов.
При решении задач нужно также обратить внимание на условие проведения реакции, что обеспечивает ее протекание по определенному механизму. Последнее определяет направление реакции и получение того или иного продукта. Иногда для синтеза определенного соединения надо создать условия, обеспечивающие нужное направление реакции. Например, присоединение бромистого водорода к пропену может протекать по двум направлениям: одно приводит к 1-бромпропану, если реакция протекает по радикальному механизму (в присутствии пероксидов, против правила Марковникова), другое – к 2-бромпропану, если реакция идет по механизму электрофильного присоединения (по правилу Марковникова).
Все уравнения реакций следует записывать с указанием условий (температуры, давления, катализатора, растворителя).
Задачи можно разделить на шесть основных типов:
1. изомерия и номенклатура органических соединений;
2. синтез с помощью заданных реагентов;
3. синтез на основании структурной формулы заданного вещества;
4. синтез заданного вещества из указанного;
5. синтез вещества и написание для него ряда химических реакций;
6. определение структурной формулы органического вещества.
1. При выводе формул изомеров данного вещества можно воспользоваться следующим приёмом. Исходят из формулы нормального строения для данного соединения. Изменяя положение функциональных групп или кратных связей, получают формулы изомеров. Например, для углеводорода C5H10:
Затем следует укоротить цепь на одну группу –CH3 и произвести все возможные перестановки группы –CH3 и кратной связи (а в гомологических рядах других классов – и функциональной группы):
Если есть возможность, можно укоротить цепь ещё на одну группу –CH3 и проделать все возможные перестановки CH3-группы, двойной связи или других функциональных групп.
2. Синтез с помощью заданных реагентов требует составления полных уравнений реакций. Иногда ход превращения изображается схемой. Так обычно поступают, если требуется провести ряд последовательных превращений.
При решении такой задачи необходимо представлять ход химического процесса, знать условия проведения синтеза, предвидеть образование побочных продуктов.
Пример 1. Какие углеводороды получатся при действии металлического натрия на смесь бромистого этила и бромистого изобутила?
Решение. Решение этой задачи можно представить в виде следующей схемы:
Схема реализуется из следующих превращений:
Затем этилнатрий взаимодействует с бромистым этилом и бромистым изобутилом с образованием соединений (1) и (2):
Аналогично, при взаимодействии бромистого изобутила с натрием образуется изобутилнатрий, который даст при реакции с бромистым этилом и бромистым изобутилом соединения (2) и (3).
Пример 2. Какое соединение получится при последовательном действии на метилацетилен амида натрия и изопропилбромида?
Решение.Прежде, чем приступить к решению данной задачи следует проработать лекционный материал и разделы рекомендуемых учебников по теме химические свойства ацетиленовых углеводородов. Обратить особое внимание на тот факт, что кроме реакций присоединения для ацетиленовых углеводородов характерны кислые свойства, т.е. замещение атома водорода при тройной связи на металл с образованием ацетиленидов. Следует отметить высокую подвижность металлов в ацетиленидах и их способность замещаться на алкильные группы.
Пример 3. Какое соединение получится при последовательном взаимодействии вторичного бромистого бутила с металлическим магнием, уксусным альдегидом и водой?
Решение.При решении данной задачи следует изучить химические свойства галогеналканов, обратить внимание на их высокую реакционную способность. В данном примере потребуются также знания раздела «Магнийорганические соединения» (реактивы Гриньяра).
3. Для синтеза вещества на основании структурной формулы нужно выбрать исходные соединения и написать соответствующие реакции или схемы (с указанием условий). Решению такой задачи помогает разделение структурной формулы заданного вещества на отдельные составные части – фрагменты, которые должны входить в форме легко отделимой части в структурные формулы исходных веществ.
Пример 1. Получить 2,2,3,3-тетраметилбутан по реакции Вюрца.
Решение. Следует мысленно разделить молекулу синтезируемого соединения по С-С связи:
Если молекула симметрична, то лучше разделить её на две равные части. Это позволит получить нужный продукт без побочных. В данном случае в качестве исходного соединения нужно взять бромистый третичный бутил и провести реакцию с металлическим натрием:
Пример 2. Получить триметилкарбинол по реакции Гриньяра.
Решение. Триметилкарбинол относится к третичным спиртам. Третичные спирты по реакции Гриньяра получают из соответствующих кетонов и реактива Гриньяра. Следует помнить, что общая сумма углеродных атомов кетона и реактива Гриньяра должна соответствовать сумме углеродных атомов получаемого спирта.
В качестве кетона берём ацетон, а в качестве алкилгалогенида – метилбромид.
Пример 3. Получить 3,3-диметил-2-бутанол реакцией гидратации алкена.
Решение.Следует помнить, что реакция гидратации алкенов протекает по правилу Марковникова:
4. При решении задач по синтезу заданного вещества из указанного требуется написать все промежуточные соединения, выбрать необходимые реагенты и указать условия проведения реакций.
Прежде, чем решать задачу, необходимо выразить её условие структурными формулами. Затем начинают подбор исходных продуктов для заданного соединения и таким образом доходят до указанного соединения.
Пример 1. При помощи каких реакций можно получить 2-бромбутан из 1,2-дибромбутана?
Решение. Вначале следует подобрать соединение, из которого можно получить 2-бромбутан. Это либо бутан, либо бутен-1. Далее следует обратить внимание на то, какое из соединений – бутан или бутен-1 – можно легко получить из 1,2-дибромбутана.
Алкены легко получаются дегалогенированием дигалогенпроизводных в присутствии цинка. Так, из 1,2-дибромбутана получаем бутен-1:
А далее проводим гидробромирование бутена-1. Реакция протекает по правилу Марковникова (ионный механизм):
Пример 2. Получить пара-нитробензойную кислоту из толуола.
Решение.
Бензойную кислоту получают окислением толуола водным раствором перманганата калия при нагревании. Нитрогруппу вводят в бензольное кольцо методом прямого нитрования. Следует учитывать также влияние заместителя на направление нитрования. Карбоксильная группа –COOH относится к числу электроноакцепторных заместителей и направляет нитрогруппу в мета-положение. Метильная группа - электронодонорный заместитель - направляет нитрогруппу в пара-положение.
Итак, можно предложить следующую схему синтеза:
Пара-нитротолуол далее окисляем до пара-нитробензойной кислоты:
Пример 3. Из неорганических реагентов получите этилацетат (уксусноэтиловый эфир).
Известно, что из неорганических реагентов легко можно получить ацетилен, который является исходным соединением для синтеза различных классов органических веществ:
Для синтеза уксусноэтилового эфира нужны уксусная кислота и этиловый спирт, которые могут быть получены из ацетилена:
5. Решение задач по синтезувещества и написанию для него ряда реакций требует знания, кроме способов получения, химических свойств данного класса соединений.
Пример 1. Предложите схему синтеза диэтилкетона и покажите его отношение к бисульфиту натрия, гидроксиламину, синильной кислоте.
Решение.Одним из способов получения кетонов является окисление вторичных спиртов с тем же числом углеродных атомов, что и у синтезируемого кетона. Т.е. следует взять в качестве исходного соединения пентиловый спирт. Поскольку карбонильная группа находится в третьем положении, то для окисления возьмём 3-пентанол:
Изучив химические свойства кетонов, делаем вывод, что реакции с бисульфитом натрия и синильной кислотой – реакции нуклеофильного присоединения, а с гидрокcиламином – присоединения–отщепления.
6. Определение структурной формулы органического соединения по его свойствам требует хорошего знания основных превращений важнейших классов органических соединений.
В задаче обычно указывается ряд свойств данного вещества и конечные продукты его превращения.
Пример 1. Установите строение вещества состава C5H10, если известно, что оно обесцвечивает бромную воду, в результате взаимодействия с HBr образует третичное бромпроизводное, а при окислении концентрированным раствором перманганата калия образует уксусную кислоту и ацетон.
Решение. Общая формула вещества и его способность обесцвечивать бромную воду указывают на то, что это алкен. При окислении уксусная кислота и ацетон могли образоваться из алкена, имеющего такие группировки:
Следовательно, строение алкена таково:
Из разобранных примеров видно, что очень часто возможно несколько вариантов решения одной и той же задачи. Из всех вариантов следует выбирать тот, в котором применяются простейшие исходные вещества и синтез проходит без образования побочных продуктов.
Какие углеводороды образуются при действии металлического натрия
Реакция Вюрца — конденсация алкилгалогенидов под действием Na (реже — Li или К) с образованием предельных углеводородов.
Реакция Вюрца — метод синтеза симметричных насыщенных углеводородов действием металлического натрия на алкилгалогениды (галогеналканы).
Легче реакция происходит с алкилиодидами и алкилбромидами, труднее – с алкилхлоридами.
В результате образуется алкан с более сложной углеродной цепью.
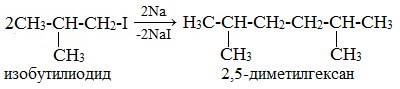
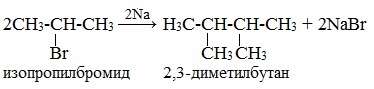
Реакцию обычно проводят в диэтиловом эфире.
В процессе реакции Вюрца происходит удвоение углеводородного скелета молекулы и образуется насыщенный углеводород (алкан). Эта реакция находит ограниченное применение, поскольку таким путем можно получать только симметричные алканы.
В основном с ее помощью получают предельные углеводороды с длинной углеродной цепью, особенно она полезна при получении индивидуальных углеводородов большой молекулярной массы (например, гептаконтана C70H142).
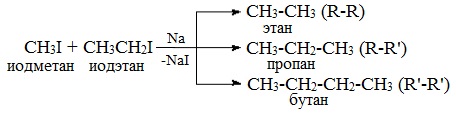
Реакцию используют для получения углеводородов с четным числом С-атомов. Если ввести в реакцию два различных галогеналкана, то образуется смесь трех продуктов.
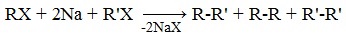
Например, при взаимодействии метил- и этилиодидов с натрием наряду с пропаном образуется этан и бутан:
Эта реакция была открыта французким химиком Ш. Вюрцем в 1855 г. при попытке получения этилнатрия из хлористого этила и металлического натрия.
В 1864г. немецкий химик Р. Фиттиг предложил реакцию, подобную реакции Вюрца, для синтеза жирноароматических углеводородов (реакция Вюрца-Фиттига).
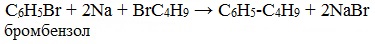
Реакция Вюрца используется для первичных алкилгалогенидов. Для вторичных алкилгалогенидов не имеет практического значения, т.к выход целевого продукта составляет всего 10-15%.
Реакцию Вюрца невозможно использовать для третичных алкилгалогенидов, т.к. вместо алкана с удвоенным числом атомов углерода образуется смесь алкана и алкена с исходным углеродным скелетом.
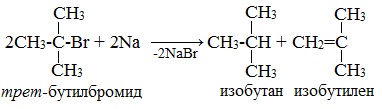
Внутримолекулярная реакция Вюрца
Реакция Вюрца успешно применяется для внутримолекулярных конденсаций. Этим путем можно получать циклоалканы заданного строения.
При взаимодействии 1,4-дибромбутана с металлическим натрием можно получить циклобутан:
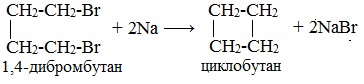
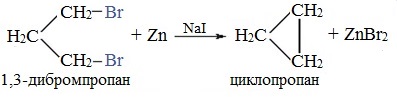
Из 1,3-дибромпропана под действием металлического цинка и йодида натрия, как активатора, может быть получен циклопропан:
Какие углеводороды получаются при действии металлического натрия на следующие смеси :
Вообще мы получим смеси веществ. а) CH3-CH2Cl + CH3-(CH2)4-CH2Cl + 2Na --> а дальше варианты: CH3-(CH2)2-CH3 + CH3-(CH2)6-CH3 + CH3-(CH2)10-CH3 и NaCl. б) CH3-(CH3)CI-CH3 + CH3I --> CH3-C(CH3)(CH3)-CH3 + CH3-CH3 + CH3-C(CH3)(CH3)-C(CH3)(CH3)-CH3
Масса примесей: 1,5*0,2=0,3кг
Масса чистого вещества: 1,5-0,3=1,2кг
Кол-во вещества СаС2: 1,2кг/0,064кг=18,75моль
Составим уравнение реакции:
n(C2H2)=18,75моль
2). Таблица растворимости имеет свою структуру.
Слева по вертикали вверху надпись "АНИОНЫ" . За исключением первого аниона OH⁻ .начиная с аниона фтора F⁻ и дальше вниз. написаны формулы анионов. соответствующие кислотным остаткам.
В правой стороне сверху написано "КАТИОНЫ" , ниже они все перечислены. Первым катионом написан катион водорода H⁺. Вспомним, что называется кислотами: Кислоты - сложные вещества, состоящие из атомов водорода и кислотного остатка. (С точки зрения теории электролитической диссоциации: кислоты - электролиты, которые при диссоциации в качестве катионов образуют только H+ и в качестве анионов кислотные остатки). Теперь составим ФОРМУЛЫ КИСЛОТ: ПЕРВЫМ СТАВИМ КАТИОН ВОДОРОДА И К НЕМУ ПОДСТАВЛЯЕМ КАТИОН КИСЛОТНОГО ОСТАТКА. При этом имя ввиду, что катион водорода имеет степень окисления +1, анионы имею разную степень окисления разную от +1 до +3. Мы с вами знаем, что формула веществ имеют нейтральную, нулевую степень окисления. Приведем пример:
H⁺F⁻ HF - фтороводородная кислота
H⁺CI⁻ HCI -хлороводородная кислота
H⁺₂ S²⁻ H₂S -сероводородная кислота
H⁺NO₃⁻ HNO₃ - азотная кислота
H⁺₂SO₄²⁻ H₂SO₄ - серная кислота
H⁺₃PO₄³⁻ H₃PO₄ - ортофосфорная кислота
Ba(OH)₂ + K₂SO₄ = 2KOH + BaSO4↓
Ba²⁺ + 2OH⁻ + 2K⁺ + SO₄²⁻ = 2K⁺ + 2OH⁻ + BaSO4↓
Ba²⁺ + SO₄²⁻ = BaSO4↓
K₂CO₃ + 2HCI= 2KCI + CO₂+ H₂O
2K⁺ + CO₃⁻+ 2H⁺ + CI⁻ = 2K⁺ + 2CI⁻ + CO₂↑+ H₂O
CO₃⁻+ 2H⁺ = CO₂↑+ H₂O
Отметим, что когда расписываем формулы вещества на ионы, то коэффициенты относятся ко всем частицам, например 2HCI ⇔2H⁺ + 2CI⁻. Если индекс указывает на число частиц, то они ставятся впереди частицы как коэффициент, например: Fe₃(PO₄)₂⇔3Fe + 2PO₄
Важным ингредиентом многих резиновых смесей являются наполнители, которые в зависимости от назначения резины вводятся обычно в количествах примерно от 25 до 400 частей на 100 частей каучука. Хороших физических свойств многих резин, особенно изготавливаемых на основе синтетических углеводородных каучуков, удается добиться лишь в том случае, если вулканизат содержит сажу. Из таблицы мы видим, сколь существенно влияет наполнение сажей на показатель прочности при растяжении ряда резин.
Существует много разновидностей сажи. Одни содержат очень короткие аморфные структуры, другие обладают весьма развитыми регулярными структурами, содержащими слои и фрагменты циклических соединений и графитовых систем. Нередко в сажах присутствуют многие насыщенные кислородом химические группы (в частности, хиноидные). Одни сажи являются основными соединениями, другие - кислотными. Естественно, что площадь поверхности и размеры частиц сажи, а также их распределение по размерам и степень агломерации зависят от способа производства
сажи. Это производство является обязательным дополнением к производству синтетических каучуков.
В процессе вулканизации сажа связывается с каучуком. Даже до вулканизации простую смесь сажи с каучуком невозможно при помощи растворителей полностью разделить на каучук и сажу. Это, по-видимому, объясняется тем, что в процессе приготовления смеси в результате механического разрушения некоторых молекулярных цепей каучука возникают свободные радикалы. Они и являются причиной химического связывания некоторого количества сажи с каучуком.
Типовые задачи и их решение
Практические задачи по теме «Алканы»
1. Назовите по систематической номенклатуре углеводороды:
а)  | д)  |
б)  | е)  |
в)  | ж)  |
г)  | з)  |
2. Напишите структурные формулы углеводородов:
3. Напишите структурные формулы изомерных углеводородов состава С6Н14. Назовите их. Укажите изомеры, содержащие третичные атомы углерода.
4. Укажите ошибки в названиях следующих углеводородов, дайте правильные названия:
5. Напишите структурные формулы изомерных углеводородов состава С8Н18 с шестью углеродными атомами в главной цепи. Назовите их по номенклатуре ИЮПАК.
6. Какие углеводороды получатся при действии металлического натрия на смесь: а) метилйодида и изобутилйодида; б) йодистого этила и йодистого изопропила; в) бромистого пропила и бромистого втор-бутила; г) бромистого пропила и бромистого изоамила?
7. Напишите структурную формулу органического вещества состава С5Н12, если известно, что при его хлорировании получается преимущественно третичное хлорпроизводное, а при нитровании – третичное нитросоединение. Объясните, почему замещение наиболее легко происходит у третичного атома углерода.
8. Получите 3-этилпентан: а) гидрированием непредельного углеводорода; б) восстановлением галогенопроизводного. Сколько изомерных соединений можно использовать для этого в каждом случае?
9. Напишите схемы получения изобутана (любым способом) и его нитрования.
10. Превратите изобутилбромид в предельный углеводород: а) с тем же строением углеродного скелета; б) с удвоенным числом углеродных атомов.
11. Из неорганических веществ получить метан.
12. Из неорганических веществ получить изобутан.
13. Какой объем воздуха (при нормальных условиях – н.у.) потребуется для полного сгорания 35,2 г парафина, если условно принять, что он состоит только из предельных углеводородов, содержащих 25 углеродных атомов в молекуле? Кислород составляет примерно 1/5 объема воздуха.
14. Какой объем раствора гидроксида натрия (плотность 1,1 г/см 3 ) потребуется для поглощения газа, выделяющегося при полном сгорании 2,12 г предельного углеводорода, содержащего 32 водородных атома в молекуле, если в результате образуется кислая соль? Объем измерен при нормальных условиях (н.у.).
15. Предскажите сколько монохлорированных изомеров получится при реакции хлора с 2-метилбутаном.
16. Изобразите структурные формулы всех изомеров состава С7Н16 и назовите их по номенклатуре IUPAC.
17. Изобразите структурные формулы всех изомеров состава С8Н18 и назовите их по номенклатуре IUPAC.
18. Сколько можно изобразить структурных формул изомеров для углеводорода состава С9Н20, содержащих не менее пяти алкильных групп? Назовите их по номенклатуре IUPAC.
19. Изобразите структурные формулы всех изомеров состава С11Н24, содержащих не менее пяти алкильных групп относительно главной цепи. Назовите их по номенклатуре IUPAC.
20. Сколько всего может существовать изомерных тетраметилгексанов? Назовите их по номенклатуре IUPAC.
21. Назовите по номенклатуре IUPAC следующие углеводороды:
22. Назовите углеводороды по номенклатуре IUPAC и по рациональной (метановой) номенклатуре:
Читайте также:
