Какое из указанных веществ имеет металлическую связь caf2 s zn k2o
Обновлено: 16.05.2024
Тип 1 № 7079Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне четыре электрона. Запишите в поле ответа номера выбранных элементов.
Для выполнения заданий 1–3 используйте следующий ряд химических элементов:
Ответом в заданиях 1–3 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
Тип 2 № 7080Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде.
Расположите выбранные элементы в порядке возрастания их металлических свойств. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Металлические свойства усиливаются по периоду справа налево: , и .
Источник: Демонстрационная версия ЕГЭ—2017 по химии, Демонстрационная версия ЕГЭ—2018 по химии, Демонстрационная версия ЕГЭ−2019 по химии
Тип 3 № 7081Из числа указанных в ряду элементов выберите два элемента, которые проявляют низшую степень окисления, равную –4. Запишите в поле ответа номера выбранных элементов.
Низшую степень окисления, равную –4, проявляют элементы IV группы: кремний и углерод.
На внешнем энергетическом уровне четыре электрона имеют элементы IV группы: углерод и кремний.
Тип 1 № 7148Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне один электрон. Запишите в поле ответа номера выбранных элементов.
Тип 2 № 7149В одном периоде находятся , , . Металлические свойства усиливаются по периоду справа налево: , и .
Тип 3 № 7150Из числа указанных в ряду элементов выберите два элемента, которые проявляют высшую степень окисления, равную +1. Запишите в поле ответа номера выбранных элементов.
Высшую степень окисления, равную +1, проявляют элементы I группы: натрий и калий.
На внешнем уровне один электрон имеют атомы I группы: натрий и калий.
Тип 1 № 7151Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне пять электронов. Запишите в поле ответа номера выбранных элементов.
Тип 3 № 7152Из числа указанных в ряду элементов выберите два элемента, которые проявляют низшую степень окисления, равную −2. Запишите в поле ответа номера выбранных элементов.
Низшую степень окисления, равную −2, проявляют элементы VI группы: сера и кислород.
Тип 2 № 7153На внешнем уровне пять электронов имеют атомы элементов V группы: фосфор и азот.
Тип 1 № 7154Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне два электрона. Запишите в поле ответа номера выбранных элементов.
Тип 3 № 7155Из числа указанных в ряду элементов выберите два элемента, которые проявляют высшую степень окисления, равную +2. Запишите в поле ответа номера выбранных элементов.
Высшую степень окисления, равную +2, проявляют элементы II группы: бериллий и магний.
Тип 2 № 7156Расположите выбранные элементы в порядке возрастания их неметаллических свойств. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
В одном периоде находятся , , . Неметаллические свойства усиливаются по периоду слева направо: , и .
Какое из указанных веществ имеет металлическую связь caf2 s zn k2o
Строение молекул. Химическая связь: ковалентная (полярная и неполярная), ионная, металлическая.

Задания из окрытого банка заданий ФИПИ. Материал пригодиться при повторении и подготовки к ОГЭ химии.
Просмотр содержимого документа
«Строение молекул. Химическая связь: ковалентная (полярная и неполярная), ионная, металлическая.»

Строение молекул. Химическая связь: ковалентная (полярная и неполярная), ионная, металлическая.

ХИМИЧЕСКАЯ СВЯЗЬ И СТРОЕНИЕ МОЛЕКУЛ
Химическая связь – это вид межатомных взаимодействий в молекулах, ионах, кри- сталлах, приводящий к понижению общей энергии системы. При всем многообразии химических связей их природа едина и носит электростатический характер.
Основные виды хим. связи (по распределению электронной плотности между взаимодействующими атомами):Различают ионную, ковалентную и металлическую связь, водородная.
Ковалентная и ионная связи являются базовыми типами связи.

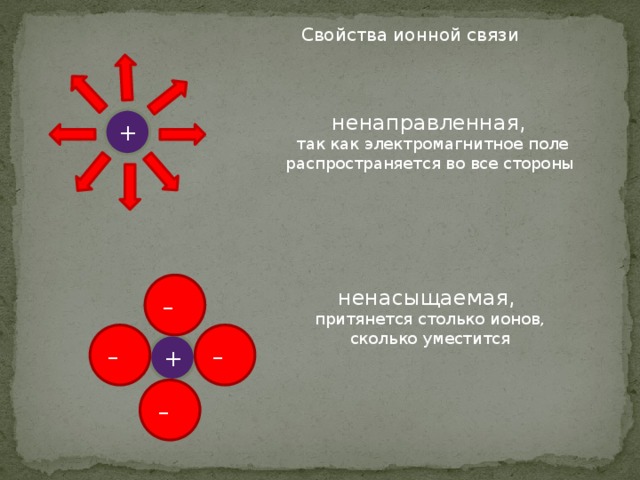
Свойства ионной связи
так как электромагнитное поле распространяется во все стороны
притянется столько ионов, сколько уместится

Поэтому все вещества с ионной связью имеют немолекулярное строение
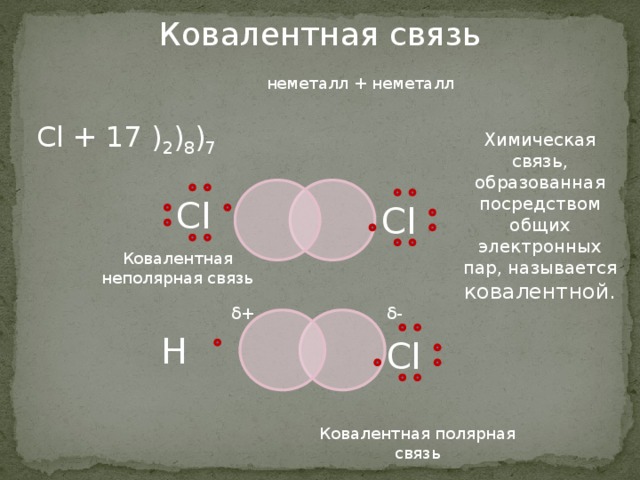
Cl + 17 ) 2 ) 8 ) 7
Химическая связь, образованная посредством общих электронных пар, называется ковалентной.
Ковалентная неполярная связь
Ковалентная полярная связь
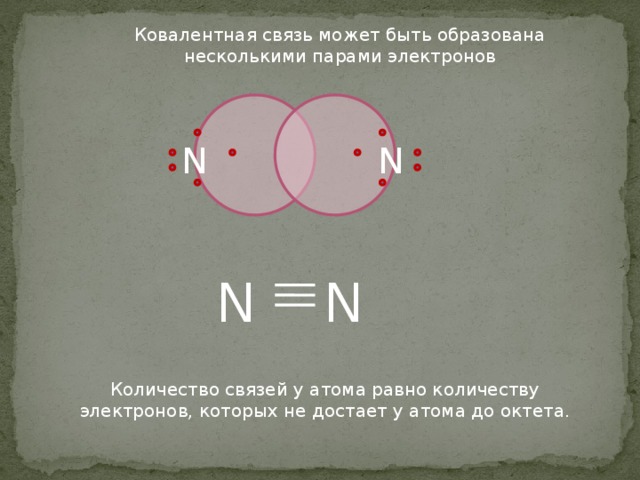
Ковалентная связь может быть образована несколькими парами электронов
Количество связей у атома равно количеству электронов, которых не достает у атома до октета.
Тренажер задания 5 ОГЭ по химии
Тренировочные упражнения по теме «Строение вещества. Химическая связь: ковалентная (полярная и неполярная), ионная, металлическая» в формате ОГЭ по химии (тренажер задания 5 ОГЭ по химии).
Теория по теме (теория для решения задания 5 ОГЭ по химии):
Тренажер по теме «Химические связи» — 10 вопросов, при каждом прохождении новые.
Из предложенного перечня выберите два вещества с ковалентной полярной связью.
Ответ: 15
Из предложенного перечня выберите два вещества, содержащие ионную связь.
1) оксид серы(IV)
2) бромид калия
3) оксид натрия
4) сероводород
5) хлорид фосфора(III)
Ответ: 23
Из предложенного перечня выберите два вещества с ионной связью.
Ответ: 13
Из предложенного перечня выберите два вещества с металлической связью.
Ответ: 34
Ответ: 25
Из предложенного перечня выберите два вещества, содержащие ковалентную полярную связь.
Ответ: 14
Из предложенного перечня выберите два вещества, в каждом из которых содержится как ионная, так и ковалентная связь.
Ответ: 45
Из предложенного перечня выберите два вещества с ковалентной неполярной связью.
Ответ: 24
Из предложенного перечня выберите два вещества, содержащие ковалентную неполярную связь.
Из предложенного перечня выберите два вещества, содержащие как ионную, так и ковалентную связь.
Ответ: 12
1) азотная кислота
2) бромоводород
3) иодид кальция
4) бромид натрия
5) оксид фосфора(V)
1) хлор
2) аммиак
3) вода
4) сероводород
5) водород
1) иодид калия
2) хлороводород
3) белый фосфор
4) оксид бария
5) гидроксид калия
1) оксид магния
2) сульфид натрия
3) оксид азота(II)
4) белый фосфор
5) фторид аммония
Ответ: 35
1) ромбическая сера
2) оксид магния
3) хлорид кальция
4) сероводород
5) графит
1) водород
2) алюминий
3) оксид углерода(II)
4) хлороводород
5) белый фосфор
1) бромид натрия
2) оксид азота(II)
3) сульфид калия
4) фторид фосфора(V)
5) хлороводород
Из предложенного перечня выберите два вещества, содержащие металлическую связь.
1) бром
2) хлороводород
3) аммиак
4) кальций
5) ромбическая сера
Реальный вариант ОГЭ по химии — 2021 № 5
Реальный вариант ОГЭ по химии-2021. Реальный КИМ ОГЭ по химии 2021 с ответами и решениями.
В 2021 году централизованный ОГЭ по химии отменили. Вместо этого провели контрольные работы в формате ОГЭ. Но КИМ остались те же самые (не пропадать же им).
Вариант 5
Часть 1
1. Выберите два утверждения, в которых говорится о железе как о химическом элементе.
1) Железная окалина состоит из железа и кислорода.
2) Оцинкованное железо устойчиво к атмосферным осадкам.
3) Железо выплавляют из природных руд.
4) Железо реагирует с кислородом.
5) В состав пирита входит железо.
2. На рисунке изображена модель строения ядра атома некоторого химического элемента.

Запишите в таблицу номер периода (Х) и номер группы (Y), в которой данный химический элемент расположен в Периодической системе Д.И. Менделеева. (Для записи ответа используйте арабские цифры.)
3. Расположите химические элементы:
1) кремний 2) азот З) сера
в порядке увеличения электроотрицательности их атомов.
Запишите номера элементов в соответствующем порядке.
4. Установите соответствие между формулой вещества и степенью окисления фосфора в этом веществе: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | СТЕПЕНЬ ОКИСЛЕНИЯ ФОСФОРА |
| А) AlPO4 | 1) 0 |
| Б) P4 | 2) -3 |
| В) Ca3P2 | 3) +4 |
| 4) +5 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
5. Из предложенного перечня выберите два вещества, содержащие ковалентную полярную связь.
6. Какие два утверждения верны для характеристики как кислорода, так и хлора?
1) Соответствующее простое вещество газообразно при обычных условиях.
2) Является металлом.
3) Химический элемент в соединениях с водородом проявляет отрицательную степень окисления.
4) Химический элемент не образует летучего водородного соединения.
5) Высшая валентность этого элемента равна VII
7. Из предложенного перечня веществ выберите кислотный оксид и оснóвный оксид,
Запишите в поле ответа сначала номер кислотного оксида, а затем номер основного оксида.
8. Какие два из перечисленных веществ вступают в реакцию c оксидом меди (II) ?
9. Установите соответствие между реагирующими веществами и возможными продуктами их взаимодействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ ВЗАИМОДЕЙСТВИЯ |
| А) CO2 и NaOH | 1) Na2CO3 и H2O |
| Б) HNO2 и NaOH | 2) NaNO2 и H2O |
| В) N2O5 и NaOH | 3) Na2CO3 и H2 |
| 4) NaNO3 и H2O | |
| 5) NaNO3 и H2 |
10. Установите соответствие между веществом и реагентами, с каждым из которых оно может вступать в реакцию: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
| А) алюминий | 1) Zn(OH)2, AgNO3 |
| Б) соляная кислота | 2) Ca, HNO3 |
| В) сульфат аммония | 3) KOH, HCl |
| 4) Ca(OH)2, BaCl2 |
11. Из предложенного перечня выберите две пары веществ, между которыми протекает реакция замещения.
1) магний и нитрат железа (III)
2) оксид серы(VI) и оксид железа(III)
3) оксид меди(II) и соляная кислота
3) алюминий и хлор
5) кальций и вода
12. Установите соответствие между реагирующими веществами и признаком протекающей между ними реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРИЗНАК РЕАКЦИИ |
| А) FeCl3 и NaOH | 1) выпадение белого осадка |
| Б) CuCl2 и Na2S | 2) выпадение бурого осадка |
| В) FeSO4 и BaCl2 | 3) выпадение черного осадка |
| 4) выпадение голубого осадка |
Запишите таблицу выбранные цифры под соответствующими буквами.
13. При полной диссоциации 1 моль каких двух из представленных веществ в качестве катионов образуются только ионы водорода?
14. Выберите два исходных вещества, взаимодействие которых соответствует сокращенное ионное уравнение реакции.
15. Установите соответствие между схемой процесса, происходящего в окислительно — восстановительной реакции, и названием этого процесса: к каждой позиции, обозначенной буквой, подберите соответствующую
позицию, обозначенную цифрой.
| СХЕМА ПРОЦЕССА | НАЗВАНИЕ ПРОЦЕССА |
| А) P -3 → P +5 | 1) окисление |
| Б) Mn +6 → Mn +4 | 2) восстановление |
| В) Br2 0 → 2Br +5 |
16. И перечисленных суждений о правилах работы с веществами в лаборатории и быту выберите верное(-ые) суждение(-я).
1) Для измельчения твердых веществ используют ступку.
2) Взаимодействие раствора серной кислоты и щелочи проводят без использования вытяжного шкафа
3) Раствор медного купороса для опрыскивания растений можно готовить в оцинкованной посуде.
4) При получении кислорода термическим разложением перманганата калия необходимо использовать защитные очки.
Запишите в поле ответа номер(-а) верного(-ых) суждения(-ий).
17. Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества: к каждой позиции, обозначенной буквой подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВА | РЕАКТИВ |
| А) H2SO4 и Li2SO4 | 1) Fe |
| Б) ZnSO4 и MgCl2 | 2) NaOH |
| В) Na2CO3 и K3PO4 | 3) HCl (р-р) |
| 4) фенолфталеин |
18. Вычислите массовую долю (в процентах) кальция в гидрофосфате кальция. Запишите число с точностью до десятых.
19. Вычислите массу гидрофосфата кальция (в миллиграммах), которую должна содержать одна таблетка витаминно — минерального комплекса, если рекомендован прием двух таблеток в сутки. Запишите число с точностью до целых.
Часть 2
20. Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой
Определите окислитель и восстановитель.
Zn 0 — восстановитель
HNO3 — окислитель за счет N +5
21. Дана схема превращений:

Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьей реакции составьте сокращённое ионное уравнение.
22. К раствору карбоната калия массой 27,6 г и массовой долей соли 10% прилили избыток раствора нитрата магния. Вычислите массу образовавшегося осадка. В ответ запишите уравнение реакции, о которой идёт речь в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения
искомых физических величин.)
m(MgCO3) = 0,02 * 84 = 1,68 г
Практическая часть
23. Запишите молекулярные уравнения двух реакций, которые характеризуют химические свойства хлорида алюминия, и укажите признаки их протекания. Используйте только вещества из приведенного выше перечня
Дан раствор хлорида алюминия, а также набор следующих реактивов: железо, растворы аммиака, серной кислоты, гидроксида натрия, нитрата серебра.
AlCl3 + 3NaOH = Al(OH)3↓ + 3NaCl выпадение белого студенистого осадка
AlCl3 + 3AgNO3 = 3AgCl↓ + Al(NO3)3 выпадение белого творожистого осадка
Сообщите организатору в аудитории о своей готовности приступить к выполнению задания 24.
24. Проведите химические реакции между хлоридом алюминия и выбранными веществами в соответствии с составленными уравнениями реакции, соблюдая правила техники безопасности, приведенные в инструкции
к заданию. Проверьте, правильно ли указаны в ответе на задание 23 признаки протекания реакций. При необходимости дополните ответ или скорректируйте его.
Инструкция по выполнению задания 24
1. Вы приступаете к выполнению задания 24. Для этого получите лоток с лабораторным оборудованием и реактивами у специалиста по обеспечению лабораторных работ в аудитории.
2. Прочтите ещё раз перечень веществ, приведённый в тексте к заданиям 23 и 24, и убедитесь (по формулам на этикетках) в том, что на выданном лотке находится пять указанных в перечне реактивов. При обнаружении
несоответствия набора веществ на лотке перечню веществ в условии задания сообщите об этом организатору в аудитории.
3. Перед началом выполнения эксперимента осмотрите ёмкости с реактивами и продумайте способ работы с ними. При этом обратите внимание на рекомендации, которым Вы должны следовать.
3.1 В склянке находится пипетка. Это означает, что отбор жидкости и переливание её в пробирку для проведения реакции необходимо проводить только с помощью пипетки. Для проведения опытов отбирают 7–10 капель реактива.
3.2 Пипетка в склянке с жидкостью отсутствует. В этом случае переливание раствора осуществляют через край склянки, которую располагают так, чтобы при её наклоне этикетка оказалась сверху («этикетку – в ладонь!»). Склянку медленно наклоняют над пробиркой, пока нужный объём раствора не перельётся в неё. Объём
перелитого раствора должен составлять 1–2 мл (1–2 см по высоте пробирки).
3.3 Для проведения опыта требуется порошкообразное (сыпучее) вещество. Отбор порошкообразного вещества из ёмкости осуществляют только с помощью ложечки или шпателя.
3.4 При отборе исходного реактива взят его излишек. Возврат излишка реактива в исходную ёмкость категорически запрещён. Его помещают в отдельную, резервную пробирку.
3.5 Сосуд с исходным реактивом (жидкостью или порошком) обязательно закрывается крышкой (пробкой) от этой же ёмкости.
3.6 При растворении в воде порошкообразного вещества или при перемешивании реактивов следует слегка ударять пальцем по дну пробирки.
3.7 Для определения запаха вещества следует взмахом руки над горлышком сосуда направлять на себя пары этого вещества.
3.8 Если реактив попал на рабочий стол, кожу или одежду, необходимо незамедлительно обратиться за помощью к специалисту по обеспечению лабораторных работ в аудитории.
Читайте также:
