Какое строение имеют металлы чем отличаются кристаллические вещества от аморфных
Обновлено: 16.05.2024
Вещество в твердом состоянии может иметь аморфное или кристаллическое строение. В аморфном веществе, например, стекле, структурные составляющие (атомы, молекулы, ионы) расположены беспорядочно, а в кристаллическом – по геометрически правильной схеме, на определенном расстоянии друг от друга.
Общим свойством металлов и сплавов является их кристаллическое строение, характеризующееся определенным закономерным расположением атомов в пространстве. Для описания атомно-кристаллической структуры используют понятие кристаллическойрешетки - воображаемой пространственной сетки с атомами в узлах. Наименьшая геометрически правильная часть объёма кристаллической решетки называется элементарной ячейкой. Трансляция (параллельное перемещение) элементарной ячейки в пространстве полностью воспроизводит структуру кристалла. Длина ребра элементарной ячейки, т.е.расстояние между центрами двух соседних частиц, называется периодом решетки измеряется в нм (10 -9 м).
Кристаллические решётки, в которых атомы расположены только в узлах, называются простыми. В сложных кристаллических решётках с плотной упаковкой атомы находятся не только в вершинах, но и внутри ячеек или на гранях.
Кристаллы характеризуются координационным числом (К) и базисом решётки (n). Координационное число показывает, сколько ближайших равноудалённых соседних атомов окружает каждый атом в кристалле и характеризует плотность упаковки атомов в кристалле. Чем больше К, тем выше плотность упаковки. Базис решётки означает число атомов, приходящихся на одну элементарную ячейку.
Для большинства металлов характерны 3 типа кристаллических решёток:
а). Объёмно-центрированная кубическая (ОЦК)
К = 8. Такую решётку имеют щелочные металлы и многие
тугоплавкие Cr, W, V, Mo, Nb и др.
n = 1/8 x 8 + 1 = 2
б). Гранецентрированная кубическая (ГЦК).
К = 12. Такую решётку имеют Ag, Au, Pt, Cu, Ni, Al, Pb и др.
n = 1/8х8 + 1/2х6 = 4
в). Гексагональная плотноупакованная (ГПУ).
К = 12. Такую решётку имеют Be, Mg, Cd и др.
n = 1/6x12 + 1/2x2 + 3 = 6
Существуют другие виды кристаллических решёток:
а). Простая кубическая
a = b = c, α = β = γ = 90 o
a = b ≠ c, α = β = γ = 90 o
a = b = c, α = β = γ ≠ 90 o
Из-за неодинаковой плотности атомов в различных направлениях, в кристаллах наблюдаются разные свойства. Различие свойств в кристаллах в зависимости от направления испытания называется анизотропией.
Разница в физико-химических и механических свойствах кристаллов в разных направлениях может быть весьма существенной. При измерении в двух взаимно перпендикулярных направлениях кристалла цинка значения температурного коэффициента линейного расширения различаются в 3-4 раза, а прочность кристалла железа – более чем в 2 раза.
Аморфные же тела все изотропны, т.е. имеют одинаковые физико-механические свойства по всем направлениям.
Анизотропия свойств (прочности, тепло- и электропроводимости, коэффициента линейного термического расширения и др.) характерна для монокристаллов. Применяющиеся металлические материалы являются, преимущественно, телами поликристаллическими, состоящими из большого числа случайно ориентированных по отношению друг к другу в пространстве кристалликов. Поэтому при испытании таких тел анизотропия не обнаруживается – свойства во всех направлениях усредняются, и поликристалл становится как бы изотропным. Это явление называют квазиизотропией.
Кристаллические и аморфные тела
Рассмотрим твердые тела подробнее. По упорядоченности мельчайших частиц, из которых состоят твердые тела, их можно разделить на аморфные и кристаллические.
Чем отличаются кристаллические и аморфные тела
У кристаллических тел есть строго упорядоченное положение мельчайших частиц. Эти частички образуют правильную кристаллическую решетку (рис. 1).
Примечание: Атомы кристаллических тел располагаются в узлах кристаллической решетки. Связи между атомами обозначены линиями. Эти линии у различных кристаллических тел образуют разные пространственные фигуры.
Рис.1. Кристаллические тела имеют более упорядоченную структуру в твердом состоянии, чем аморфные тела
Аморфные тела не обладают строгой упорядоченностью мельчайших частиц — молекул, из которых они состоят. У аморфных тел порядок есть, но он не так выражен, как у кристаллических тел. Аморфное тело по своему строению больше похоже на очень вязкую жидкость, чем на твердое тело. Поэтому, аморфные тела обладают текучестью.
Основные отличия кристаллических и аморфных тел приведены на рисунке 2.
Примечания:
- Благодаря текучести, спустя много лет после изготовления, верхняя часть установленного в раму оконного стекла, становится немного тоньше, чем его нижняя часть.
- Канифоль со временем может принимать форму сосуда, в который ее поместили.
Переход:
- из жидкого в твердое состояние – кристаллизация;
- из твердого в жидкое состояние – плавление;
Плавление аморфных тел
Аморфные тела конкретной температуры плавления не имеют. Строение аморфных тел больше похоже на очень вязкую жидкость, чем на твердое кристаллическое тело. Во время нагревания они будут становиться более текучими, все больше проявляя свойство жидкости. При этом, хрупкость, присущая твердому состоянию, будет исчезать. Одновременно с плавлением, температура аморфных тел будет повышаться.
Важно! Одновременно с плавлением, температура аморфных тел будет непрерывно повышаться. Потому, что такие тела не имеют конкретной температуры плавления.
Примеры аморфных тел
- канифоль (смола хвойных деревьев);
- стекло;
- эбонит;
- сургуч;
- различные пластмассы;
Примечание: Эбонит («Эбенос» др.-греч. — чёрное дерево) – это вулканизированный каучук с добавлением большого количество серы, до 50 % от массы каучука. Цвет эбонита обычно тёмно-бурый или чёрный. Этот материал не проводит электрических ток – то есть, является хорошим изолятором.
Плавление кристаллических тел
Чтобы кристаллическое тело начало плавиться, его нужно нагреть до определенной температуры. Одни кристаллические тела будут плавиться при низкой температуре, а другие – при высокой. То есть, у каждого вещества своя температура плавления. Ее можно найти в справочнике физики. При этом, пока вещество не расплавится, его температура изменяться не будет.
Важно! Кристаллические тела имеют конкретную температуру плавления. Пока кристаллическое вещество полностью не расплавится, его температура не изменится!
- Кристаллические вещества плавятся при той же температуре, при которой они будут превращаться в твердое тело (кристаллизоваться).
- Чтобы жидкое вещество начало кристаллизоваться, оно сначала должно остыть до определенной температуры.
- Температура плавления и температура кристаллизации – это одна и та же температура.
Примеры кристаллических тел
- лед;
- свинец;
- алюминий;
- ртуть;
- железо;
- золото;
- серебро;
Как на графике выглядит процесс плавления кристаллического тела
Рассмотрим переход из твердого состояния в жидкое — плавление и, обратно — кристаллизацию, на примере льда.
Возьмем лед при начальной температуре «-40» градусов по Цельсию (рис. 3) и поместим его в кастрюльку. Поставим эту кастрюльку на газовую плиту и начнем нагревать лед.
Процесс нагревания льда изображается наклонной линией синего цвета. Потому, что время идет, а температура льда повышается.
Во время нагревания льда от отрицательной температуры до нуля градусов, в емкости будет содержаться только твердый лед.
Как только будет достигнута температура плавления льда – «0» градусов по Цельсию, лед начнет превращаться в жидкость. В кастрюльке начнет понемногу появляться вода. То есть, будет присутствовать и лед, и вода одновременно. Постепенно воды становится все больше, а льда – все меньше.
Мы продолжаем подавать тепловую энергию. Но температура льда во время плавления не меняется до тех пор, пока весь лед не расплавится и не превратится в жидкость.
Поэтому на графике температуры плавление кристаллических тел изображается горизонтальной линией. На рисунке 3 эта линия выделена красным цветом.
- Чтобы тело расплавить, ему нужно передать тепловую энергию. Значит, при плавлении, тепловая энергия поглощается телом.
- При плавлении кристаллических тел, вся полученная тепловая энергия тратится на разрушение кристаллической решетки. Поэтому кристаллические тела имеют конкретную температуру плавления. Она не будет повышаться до тех пор, пока все кристаллическое тело полностью не расплавится.
Когда лед полностью расплавится, в кастрюльке будет присутствовать только жидкая вода. На рисунке 5 это — крайняя правая точка на горизонтальной красной линии.
Если продолжать подводить тепловую энергию, температура воды начнет повышаться. Идет процесс нагревания воды. На графике процесс нагревания – это еще одна наклонная прямая линия, она располагается справа от красной линии плавления.
Как на графике выглядит процесс кристаллизации для кристаллического тела
Давайте теперь прекратим нагревание воды, вынесем кастрюльку на мороз и, оставим ее там на какое-то время. Вода начнет охлаждаться, ее температура будет понижаться. На рисунке 4 это отражено убывающей до нуля прямой наклонной синей линией.
Когда вода охладится до нуля градусов, начнется процесс превращения жидкости в твердое тело – лед. Потому, что ноль градусов Цельсия – это температура не только плавления, но и кристаллизации льда. Вначале начнут появляться маленькие льдинки. Этому соответствует левая часть красной горизонтальной линии на графике 4.
Примечание: Если в воде присутствуют пылинки, или другие мелкие примеси, то кристаллизация проходит быстрее. Такие мелкие примеси называют центрами кристаллизации.
Постепенно, количество льда увеличивается, а воды становится все меньше. При этом, температура воды и льда в кастрюльке продолжает оставаться равной нулю градусов по Цельсию.
Когда вся вода в кастрюльке превращается в лед – этому соответствует крайняя правая точка на красной линии на графике.
Только после этого температура льда начинает понижаться от нуля в отрицательную область температур. На рисунке это описано наклонной синей линией, примыкающей справа к горизонтальной красной линии.
Примечание: Чтобы тело перешло из жидкого состояния в твердое (кристаллизовалось), оно должно избавиться от избытка тепловой энергии. Значит, при кристаллизации, тело отдает энергию окружающим телам. Физики скажут так: «Тело выделяет тепловую энергию во внешнюю среду».
Аморфное и кристаллическое состояние твёрдых тел
Вещества, находящиеся в твёрдом состоянии, могут быть либо аморфными, либо кристаллическими. Аморфное состояние твёрдых тел характеризуется тем, что атомы, молекулы или ионы вещества располагаются в пространстве хаотически. Аналогичную внутреннюю структуру имеют жидкости, но в них частицы вещества за счёт энергии теплового движения совершают частые перескоки с места на место, что и является причиной текучести жидкостей. В аморфных материалах более сильное взаимодействие удерживает частицы вещества вместе и не позволяет им совершать частые перескоки с места на место. В результате образец остаётся твёрдым и не течёт, хотя и имеет структуру жидкости. Учитывая вышесказанное, аморфное состояние обычно отождествляют с переохлаждённой жидкостью, у которой бесконечно высокая вязкость. С повышением температуры вязкость этой «твёрдой жидкости» плавно понижается, вещество размягчается и постепенно переходит из твёрдого состояния в жидкое. Примером материала, находящегося в аморфном состоянии, является обычное оконное стекло, а также янтарь – окаменевшая смола древних деревьев.
Кристаллические материалы переходят в жидкое состояние при постоянной температуре, называемой температурой плавления. Обратный переход осуществляется также при постоянной температуре, называемой температурой кристаллизации.
В кристаллических твёрдых телах частицы вещества располагаются в пространстве упорядоченно, т.е. выстроены правильными рядами, плоскостями, симметричными блоками, что придаёт отдельным кристаллам (монокристаллам) характерную правильную огранку. Кристаллическое состояние твёрдых тел встречается в природе чаще, чем аморфное, поскольку обладает меньшей свободной энергией и, в силу этого, является более стабильным. С течением времени многие аморфные тела стремятся перейти в кристаллическое состояние. Примерами кристаллических материалов являются различные горные минералы (кварц, гранит, рубин, алмаз и т.д.), а также соль, речной песок и глина, состоящая в основном из мелких кристаллов Al2O3. Металлы и сплавы также являются кристаллическими материалами. Однако они, в отличие от монокристаллов, имеют поликристаллическое строение, т.е. состоят из множества микроскопических кристалликов неправильной формы (зёрен), случайным образом ориентированных в пространстве.
Необходимо отметить, что одно и то же вещество может быть получено как в кристаллическом, так и в аморфном состоянии. Например, в металлах и сплавах при их сверхбыстром охлаждении из жидкого или газообразного состояний не успевает сформироваться упорядоченная кристаллическая структура и образуется аморфное твёрдое тело (metal glass - металлическое стекло). При этом свойства аморфного металла могут заметно отличаться от свойств кристаллического образца, что свидетельствует о важности внутренней атомной структуры материала в формировании его свойств. Аморфное состояние металлов чаще всего оказывается крайне нестабильным при комнатной температуре. С течением времени наблюдается переход из такого состояния в более стабильное кристаллическое состояние и этот процесс ускоряется с повышением температуры. В тоже время путём подбора химического состава металлических материалов их аморфное состояние иногда удаётся застабилизировать. Примером может служить металлическое стекло Fe80B20, аморфное состояние которого является достаточно стабильным при комнатной и более высоких температурах.
Строение металлов
В технике под металлами понимают вещества, обладающие комплексов металлических свойств: характерным металлическим блеском, высокой электропроводностью, хорошей теплопроводностью, высокой пластичностью.
Кристаллические решетки. Все вещества в твердом состоянии могут иметь кристаллическое или аморфное строение. В аморфном веществе атомы расположены хаотично, а в кристаллическом — в строго определенном порядке. Все металлы в твердом состоянии имеют кристаллическое строение.
Для описания кристаллической структуры металлов пользуются понятием кристаллической решетки. Кристаллическая решетка — это воображаемая пространственная сетка, в узлах которой расположены атомы. Наименьшая часть кристаллической решетки, определяющая структуру металла, называется элементарной кристаллической ячейкой,
На рис. 2 изображены элементарные ячейки для наиболее распространенных кристаллических решеток. В кубической объемно-центрированной решетке (рис. 2, а) атомы расположены в ушах ячейки и один атом в центре куба.
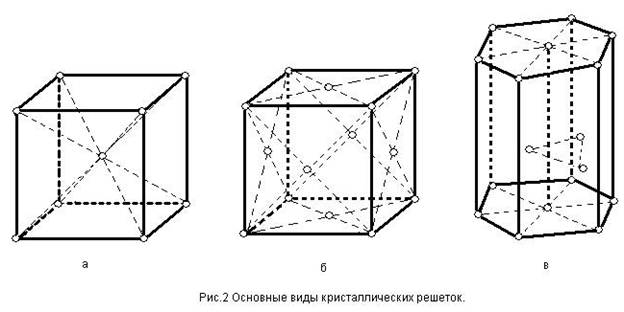
Такую решетку имеют хром, вольфрам, молибден и др. В кубической гранецентрированной решетке (рис. 2, б) атомы расположены в вершинах куба и в центре каждой грани. Эту решетку имеют алюминий, медь, никель и другие металлы. В гексагональной плотноупакованной решетке (рис. 2, в) атомы расположены в вершинах и центрах оснований шестигранной призмы и три атома в середине призмы. Такой тип решетки имеют магний, цинк и некоторые другие металлы.
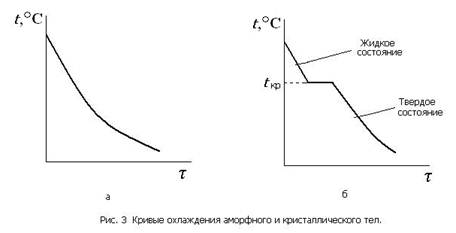
Кристаллизация металлов. Процесс образования в металлах кристаллической решетки называется кристаллизацией. Для изучения процесса кристаллизации строят кривые охлаждения металлов, которые показывают изменение температуры (t) во времени (τ). На рис. 3 приведены кривые охлаждения аморфного и кристаллического веществ. Затвердевание аморфного вещества (рис. 3, а) происходит постепенно, без резко выраженной границы между жидким и твердым состоянием- На кривой охлаждения кристаллического вещества (рис. 3, б) имеется горизонтальный участок с температурой tкр, называемой температурой кристаллизации. Наличие этого участка говорит о том, что процесс сопровождается выделением скрытой теплоты кристаллизации. Длина горизонтального участка — это время кристаллизации.
Кристаллизация металла происходит постепенно. Она объединяет два процесса, происходящих одновременно: возникновение центров кристаллизации и рост кристаллов. В процессе кристаллизации когда растущий кристалл окружен жидкостью, он имеет правильную геометрическую форму. При столкновении растущих кристаллов их правильная форма нарушается (рис. 4). После окончания кристаллизации образуются кристаллы неправильной
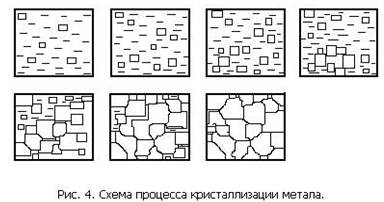
формы, которые называются зернами или кристаллитами. Внутри каждого зерна имеется определенная ориентация кристаллической решетки, отличающаяся от ориентации решеток соседних зерен.
Полиморфизм. Некоторые металлы в зависимости от температуры могут существовать в различных кристаллических формах. Это явление называется полиморфизм или аллотропия, а различные кристаллические формы одного вещества называются полиморфными модификациями. Процесс перехода от одной кристаллической формы к другой называется полиморфным превращением. Полиморфные превращения протекают при определенной температуре.
Полиморфные модификации обозначают строчными греческими буквами α, β, γ, δ и т. д., причем α соответствует модификации, существующей при наиболее низкой температуре. Полиморфизм характерен для железа, олова, кобальта, марганца, титана и некоторых других металлов.
Важное значение имеет полиморфизм железа. На рис. 5 изображена кривая охлаждения железа.
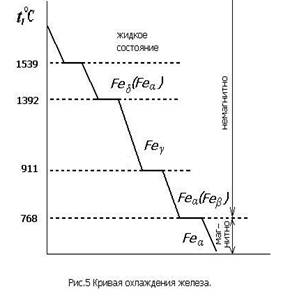
Полиморфные превращения характеризуются горизонтальными участками на кривой охлаждения, так как при них происходит полная перекристаллизация металла. До 911°С устойчиво Feα, имеющее кубическую объемноцептрированную решетку. В интервале 911…1392 °С существует Feγ с кубической гранецентрированной кристаллической решеткой.
При 1392…1539 °С вновь устойчиво Feα. Часто высокотемпературную модификацию Feα обозначают Feδ. Остановка на кривой охлаждения при 768 °С связана не с полиморфным превращением, а с изменением магнитных свойств. До 768 °С железо магнитно, а выше — немагнитно.
Дефекты кристаллического строения. Реальный металлический кристалл всегда имеет дефекты кристаллического строения. Они подразделяются на точечные, линейные и поверхностные (рис. 6).
Точечные дефекты малы во всех трех измерениях. К точечным дефектам относятся вакансии, представляющие собой узлы кристаллической решетки в которых отсутствуют атомы (рис. 6, а), а также замещенные атомы примеси (рис. 6, б) и внедренные атомы (рис. 6, в) которые могут быть как примесными, так и атомами основного металла.
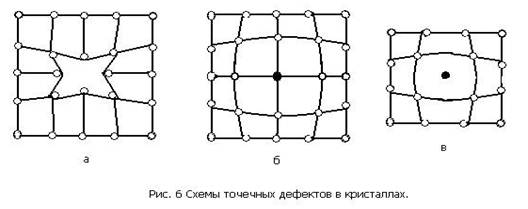
Точечные дефекты вызывают местные искажения кристаллической решетки, которые затухают достаточно быстро по мере удаления от дефекта.
Линейные дефекты имеют малые размеры в двух измерениях и большую протяженность в третьем. Эти дефекты называют дислокациями. Краевая дислокация (рис. 7) представляет собой искажение кристаллической решетки, вызванное наличием «лишней» атомной полуплоскости.
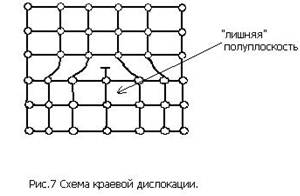
Поверхностные дефекты малы только в одном измерении. К ним относятся, например, границы между отдельными зернами или группами зерен.
Наклеп и рекристаллизация. При пластической деформации изменяется не только форма и размеры металла, но также его внутреннее строение и механические свойства. Зерна разворачиваются, деформируются и сплющиваются, вытягиваясь в направлении деформации. Образуется волокнистая структура. При этом прочность и твердость металла повышаются, а пластичность и вязкость снижаются. Явление упрочнения металла при пластической деформации называется наклепом.
Волокнистое строение и наклеп могут быть устранены при нагреве металла. Частичное снятие наклепа происходит уже при небольшом нагреве (до 300…400 °С для железа). Но волокнистая структура при этом сохраняется. При нагреве до более высокой температуры в металле происходит образование новых равноосных зерен. Этот процесс называется рекристаллизацией. Наклеп при этом снимается полностью.
Температура, при которой начинается процесс рекристаллизации называется температурой рекристаллизации. Абсолютная температура рекристаллизации Тp связана с абсолютной температурой плавления простой зависимостью:
где а — коэффициент, зависящий от состава и структуры металла. Для особо чистых металлов а = 0,2, для металлов технической чистоты а = 0,3…0,4, для сплавов а = 0,5…0,6.
Если деформирование металла происходит при температуре, которая выше температуры рекристаллизации, то наклеп после деформации не возникает. Такая деформация называется горячей. При горячей деформации идут одновременно процессы упрочнения и рекристаллизации. Деформация, которая происходит ниже температуры рекристаллизации называется холодной.
Кристаллическая решетка

У каждого вещества есть набор физических свойств. Например, соли легко растворяются в воде и проводят электрический ток, а металлы имеют характерный блеск и ковкость. Такие характеристики зависят от строения вещества — от его кристаллической решетки. В этом материале мы расскажем о видах кристаллических решеток и о том, какие свойства придает веществу каждая из них.
О чем эта статья:
11 класс, ЕГЭ/ОГЭ
Что такое кристаллическая решетка
Как известно, все вещества состоят из частиц — атомов, которые могут располагаться хаотично или в определенном порядке. У аморфных веществ частицы расположены беспорядочно, а у кристаллических они образуют определенную структуру. Эта структура называется кристаллической решеткой. Она определяет такие характеристики вещества, как твердость, хрупкость, температура кипения и/или плавления, пластичность, растворимость, электропроводность и т. д.
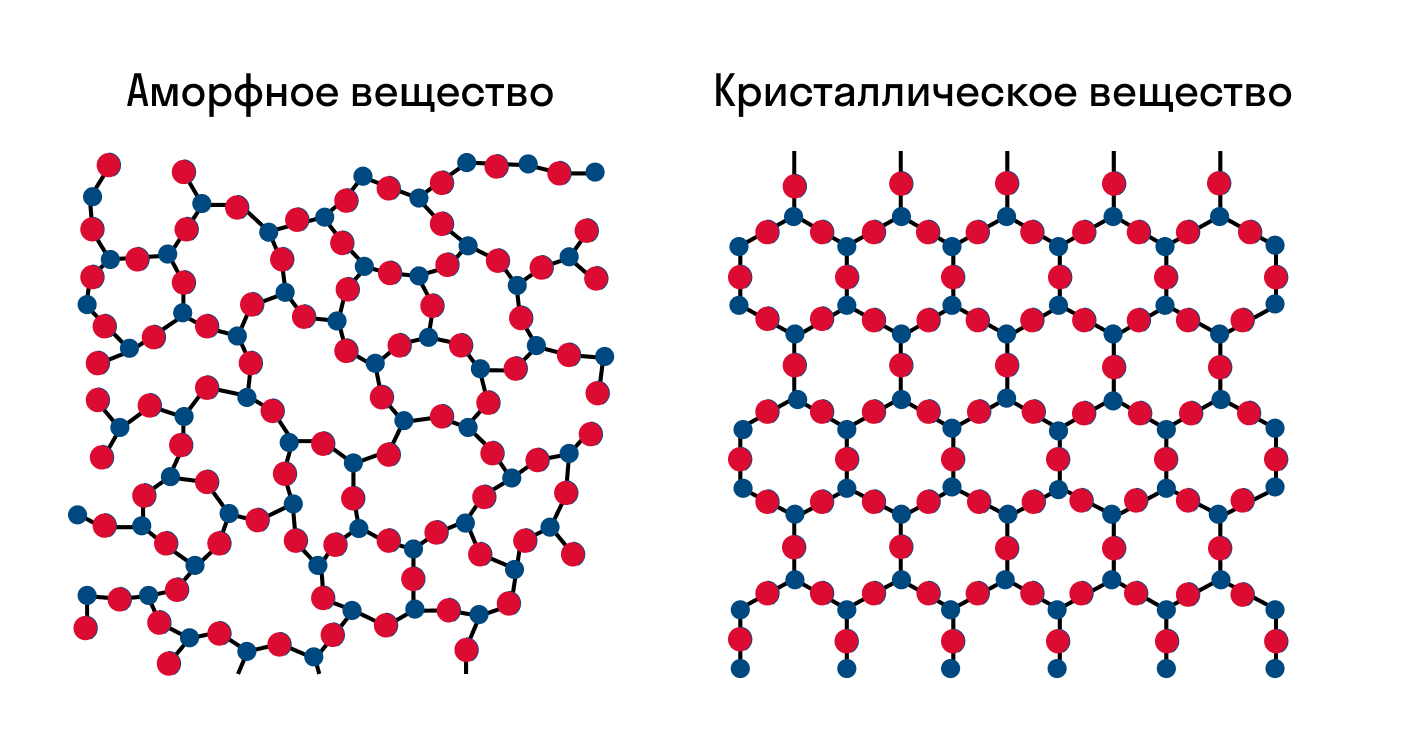
Кристаллическая решетка — это внутренняя структура кристалла, порядок взаимного расположения атомов, ионов или молекул. Точки, в которых находятся эти частицы, называются узлами решетки.
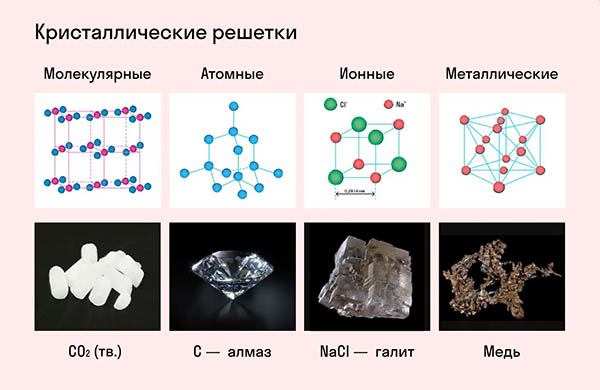
Частицы удерживаются на своих местах благодаря химическим связям между ними. В зависимости от того, какой вид связи удерживает атомы или ионы данного вещества, в химии выделяют основные типы кристаллических решеток:
атомная (ковалентные связи),
молекулярная (ковалентные связи и притяжение между молекулами),
металлическая (металлические связи),
ионная (ионные связи).
Не путайте эти два понятия — кристаллическая решетка и химическая связь. Тип решетки говорит о том, как расположены атомы/ионы в молекуле вещества, а тип связи — по какому принципу они между собой взаимодействуют.
Атомная кристаллическая решетка
Согласно своему названию, атомная кристаллическая решетка — это структура, в узлах которой расположены атомы. Они взаимодействуют с помощью ковалентных связей, то есть один атом отдает другому свободный электрон или же электроны из разных атомов образуют общую пару. В кристаллах с атомной решеткой частицы прочно связаны, что обуславливает ряд физических характеристик.
Свойства веществ с атомной решеткой:
неспособность к растворению в воде,
высокая температура кипения и плавления.
К примеру, атомную кристаллическую решетку имеет алмаз — самый твердый минерал в мире.
Другие примеры: германий Ge, кремний Si, нитрид бора BN, карборунд SiC.
Если нужно рассказать о свойствах веществ с атомной кристаллической решеткой, достаточно вспомнить песок и перечислить его характеристики.
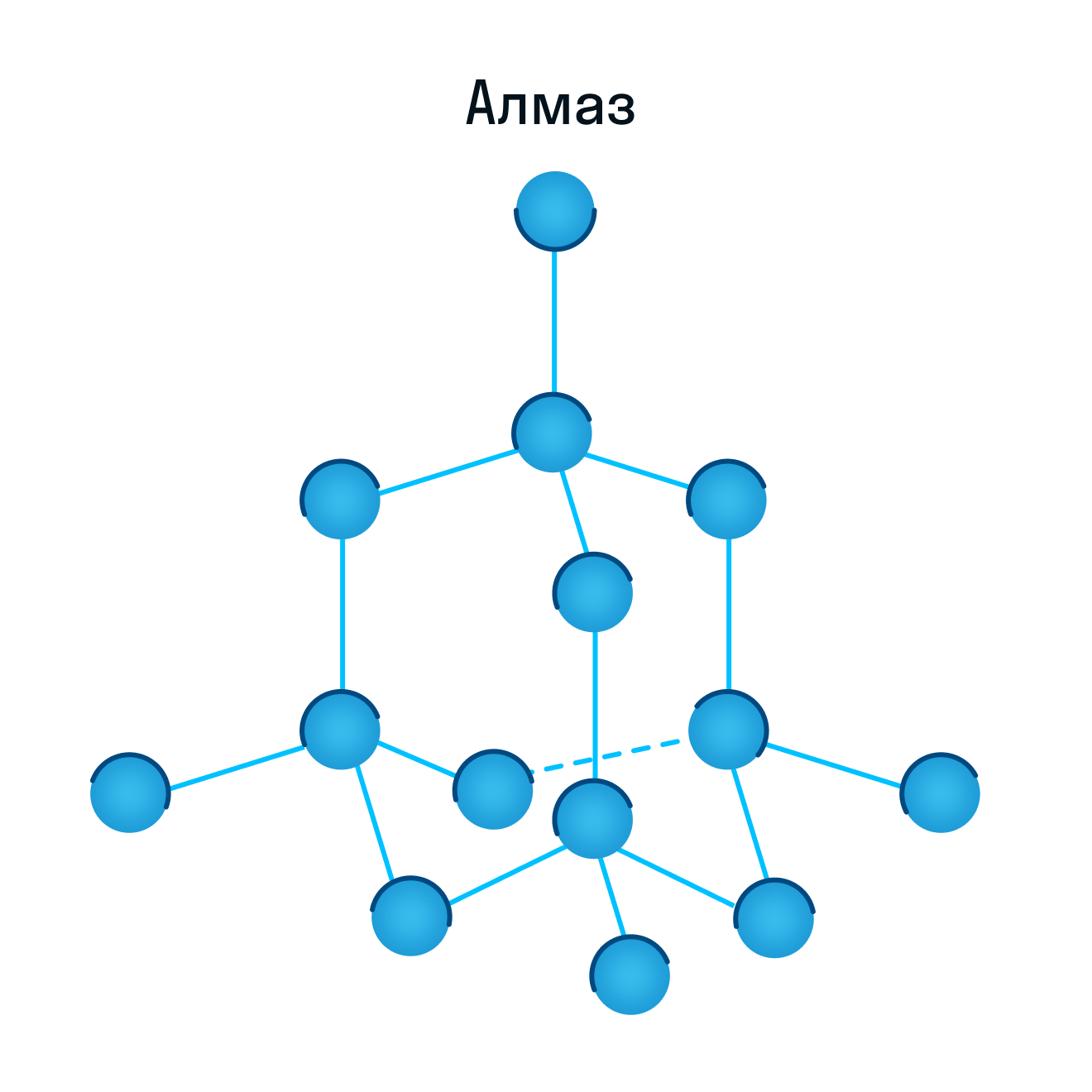
Молекулярная кристаллическая решетка
Как и в предыдущей группе, в этой находятся вещества с ковалентными связями между атомами. Но физические характеристики этих веществ совершенно иные — они легко плавятся, превращаются в жидкость, растворяются в воде. Почему так происходит? Все дело в том, что здесь кристаллы строятся не из атомов, а из молекул.
Молекулярная кристаллическая решетка — это структура, в узлах которой находятся не атомы, а молекулы.
Внутри молекул атомы имеют прочные ковалентные связи, но сами молекулы связаны между собой слабо. Поэтому кристаллы таких веществ непрочные и легко распадаются.
Молекулярная кристаллическая решетка характерна для воды. При комнатной температуре это жидкость, но стоит нагреть ее до температуры кипения (которая сравнительно низка), как она тут же начинает превращаться в пар, т. е. переходит в газообразное состояние.
Некоторые молекулярные вещества — например, сухой лед CO2, способны преобразоваться в газ сразу из твердого состояния, минуя жидкое (данный процесс называется возгонкой).
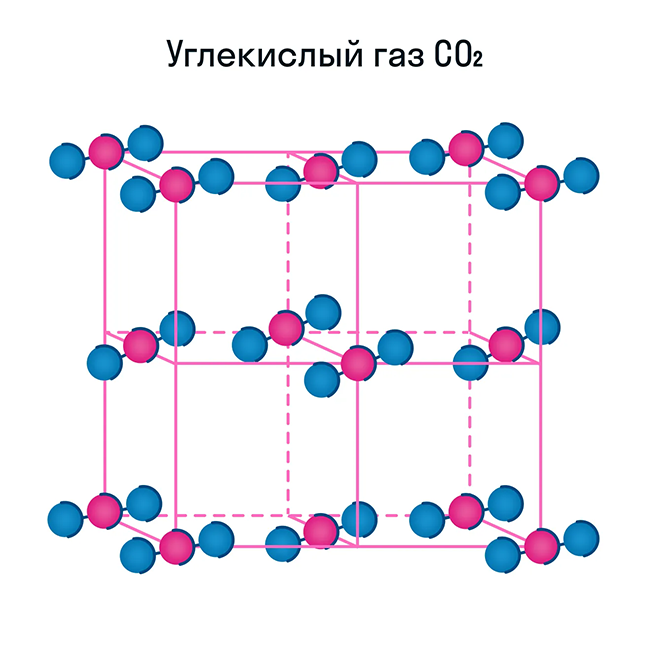
Свойства молекулярных веществ:
у некоторых — наличие запаха.
Помимо воды к веществам с молекулярной кристаллической решеткой относятся аммиак NH3, гелий He, радон Rn, йод I, азот N2 и другие. Все благородные газы — молекулярные вещества. Также к этой группе принадлежит и большинство органических соединений (например, сахар).
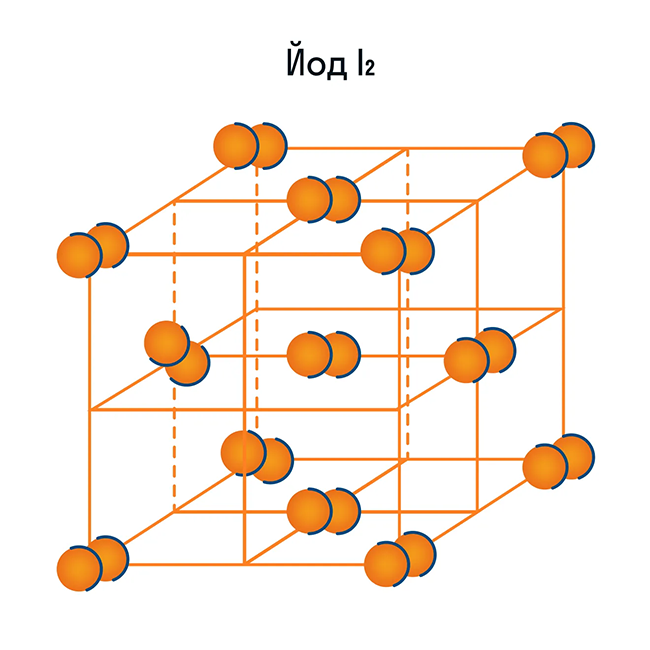
Ионная кристаллическая решетка
Как известно, при ионной химической связи один атом отдает другому ионы и приобретает положительный заряд, в то время как принимающий атом заряжается отрицательно. В итоге появляются разноименно заряженные ионы, из которых и состоит структура кристалла.
Ионная решетка — это кристаллическая структура, в узловых точках которой находятся ионы, связанные взаимным притяжением.
Ионную кристаллическую решетку имеют практически все соли, типичным представителем можно считать поваренную соль NaCl. О ней стоит вспомнить, если нужно перечислить физические характеристики этой группы. Также ионную решетку имеют щелочи и оксиды активных металлов.
Свойства веществ с ионной структурой:
способность растворяться в воде.
Примеры веществ с ионной кристаллической решеткой: оксид кальция CaO, оксид магния MgO, хлорид аммония NH4Cl, хлорид магния MgCl2, оксид лития Li2O и другие.
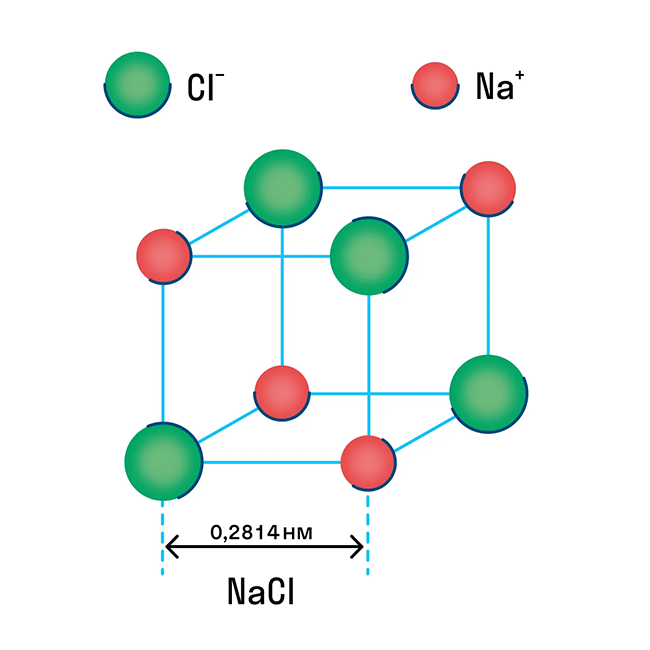
Металлическая кристаллическая решетка
Для начала вспомним, как проходит металлическая химическая связь. В молекуле металла свободные отрицательно заряженные электроны перемещаются от одного иона к другому и соединяются с некоторыми из них, а после отрываются и мигрируют дальше. В результате получается кристалл, в котором ионы превращаются в атомы и наоборот.
Металлическая кристаллическая решетка — это структура, которая состоит из ионов и атомов металла, а между ними свободно передвигаются электроны. Как несложно догадаться, она характерна лишь для металлов и сплавов.
Свободные электроны, мигрирующие между узлами решетки, образуют электронное облако, которое под воздействием электротока приходит в направленное движение. Это объясняет такое свойство металлов, как электрическая проводимость.
В химии типичным примером вещества, которое имеет металлическую кристаллическую решетку, считается медь. Она очень ковкая, пластичная, имеет высокую тепло- и электропроводность. Впрочем, все металлы ярко демонстрируют эти характеристики, поэтому назвать физические свойства данной группы несложно.
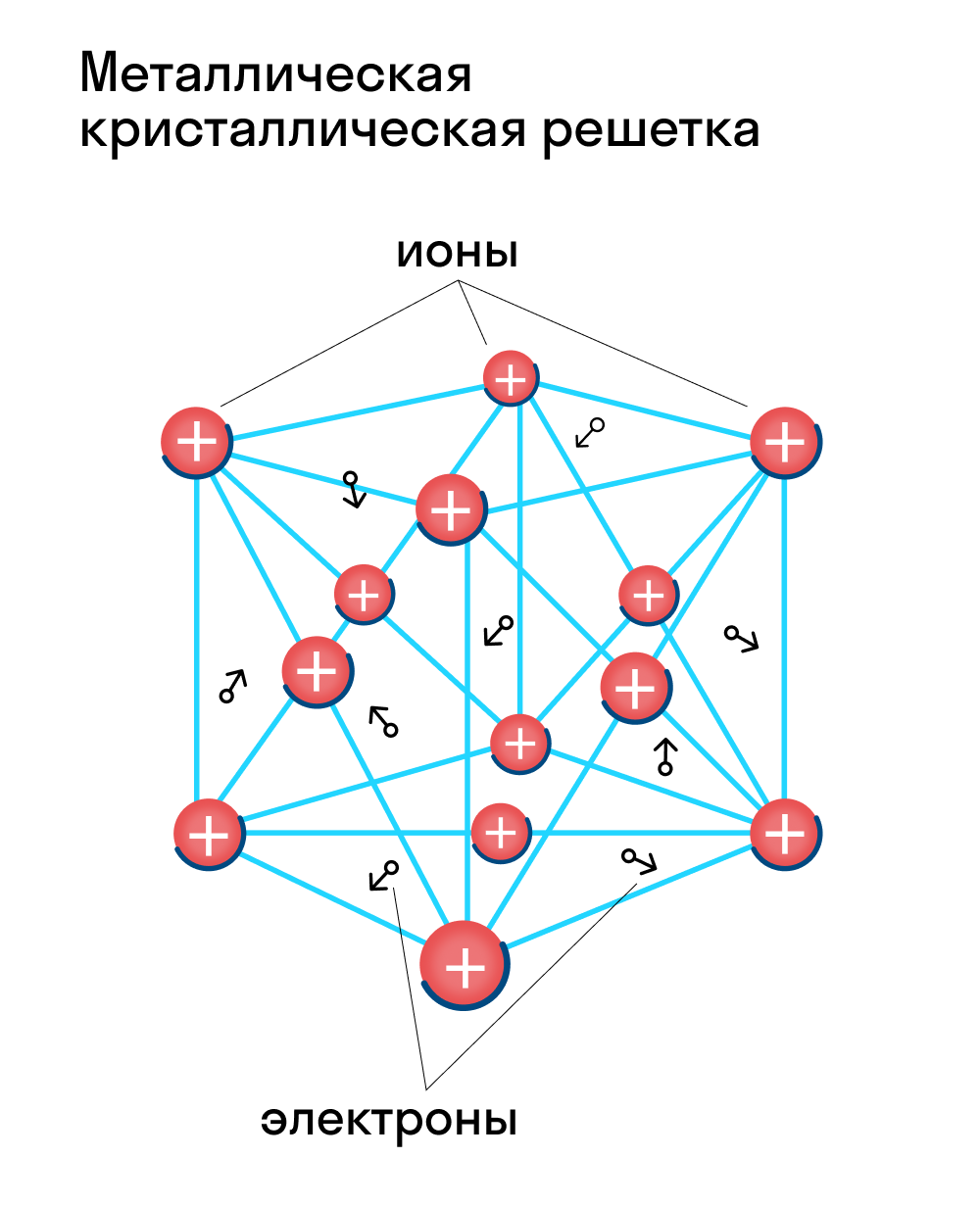
Свойства веществ с металлической кристаллической решеткой:
При этом температура плавления веществ может существенно различаться. Например, у ртути это −38,9°С, а у бериллия целых +1287°С.
Подведем итог: о характеристиках разных типов кристаллических решеток расскажет таблица.
Читайте также:
