Какой элемент не входит в условную границу между металлами и неметаллами
Обновлено: 20.09.2024
Разделительная линия между металлами и неметаллами может быть найдена в различных конфигурациях, на некоторых представлениях периодической таблицы элементов (см мини-пример, справа). Элементы в нижнем левом углу строки обычно демонстрируют усиление металлического поведения; элементы в правом верхнем углу отображают усиление неметаллического поведения. При представлении в виде обычной ступеньки элементы с наивысшей критической температурой для своих групп (Li, Be, Al, Ge, Sb, Po) располагаются чуть ниже линии.
СОДЕРЖАНИЕ
Имена
Эта линия была названа амфотерные линии, на металл-неметалл линии, в металлоид линии, в полуметаллическую линии, или лестницу. Хотя это также называется границей Zintl или линией Zintl этих термины вместо относятся к вертикальной линии , иногда нарисованной между группами 13 и 14. Этой специфической линия была названа Лавесом в 1941 году отличает группу 13 элементов от тех , и к справа от группы 14 . Первые обычно соединяются с электроположительными металлами с образованием интерметаллических соединений, тогда как последние обычно образуют солеподобные соединения.
История
Ссылки на разделительную линию между металлами и неметаллами появляются в литературе, по крайней мере, в 1869 году. В 1891 году Уокер опубликовал периодическую «таблицу» с диагональной прямой линией, проведенной между металлами и неметаллами. В 1906 году Александр Смит опубликовал периодическую таблицу с зигзагообразной линией, отделяющей неметаллы от остальных элементов, в своем очень влиятельном учебнике « Введение в общую неорганическую химию». В 1923 году американский химик Гораций Деминг опубликовал периодические таблицы для краткой ( стиль Менделеева ) и средней ( 18 столбцов ) формы. Каждый имел правильную ступенчатую линию, отделяющую металлы от неметаллов. В 1928 году компания «Мерк и компания» подготовила раздаточную форму таблицы Деминга из 18 столбцов, которая была широко распространена в американских школах. К 1930-м годам таблица Деминга появилась в справочниках и энциклопедиях по химии. Его также много лет распространяла научная компания Sargent-Welch.
Вариант с двойной линией
Разделительная линия между металлами и неметаллами иногда заменяется двумя разделительными линиями. Одна линия разделяет металлы и металлоиды ; прочие металлоиды и неметаллы.
Обеспокоенность
Менделеев писал, что «невозможно . провести четкую границу между металлами и неметаллами, поскольку существует много промежуточных веществ». Несколько других источников отмечают путаницу или двусмысленность относительно местоположения разделительной линии; предполагать, что его кажущаяся произвольность дает основания для опровержения его действительности; и прокомментировать его вводящий в заблуждение, спорный или приблизительный характер. Сам Деминг отмечал, что линия не может быть проведена очень точно.
условная граница между металлами и неметаллами проходит в ПСЭХ по диагонали:
А)H-Mg-Ti-Sb-W
Б)F-S-As-Sn-Au
B)C-Si-Ti-Sb-Po
Г)B-Si-As-Te-At
Посетители, находящиеся в группе Гости, не могут оставлять комментарии к данной публикации.
найдите все значения а кратных числу 3 при которых будет верным неравенство 145
Лабораторная работа № 9.1.1. Российская империя на рубеже XIX – ХХ вв. и её место в мире
Документ № 1. Из письма министра финансов С.Ю. Витте Николаю II
В настоящее время политическая сила Великих держав, которые призваны решить грандиозные исторические задачи в мире, создаётся не только силой духа их народов, но также их экономическим устройством. Даже военный потенциал страны определяется… степенью её промышленного развития. Россия нуждается, возможно, более чем какая-либо другая страна, в надлежащей экономической основе для её национальной политики и культуры.
Документ № 2. О положении нашей промышленности. Из доклада министра финансов С.Ю. Витте.
Возрастание промышленности в сравнительно короткий срок само по себе представляется очень значительным. По быстроте и силе этого роста Россия стоит впереди всех иностранных экономически развитых государств, и не подлежит сомнению, что страна, которая оказалась в состоянии в два десятилетия более чем утроить свою горную и фабрично-заводскую промышленность, таит в себе запас внутренних сил для дальнейшего развития, а такое развитие в ближайшем будущем настоятельно необходимо, ибо как ни велики уже достигнутые результаты, тем не менее и по отношению к потребностям населения, и по сравнению с иностранными государствами наша промышленность ещё очень отстала.
В иностранных государствах промышленность не развивается так быстро, как в России, потому что она уже достигла там уровня гораздо более высокого, чем у нас.
Документ № 3 Темпы роста основных экономических показателей развития Российской империи к 1914 г. (уровень 1887 г. принят за 100%)
Валовые сборы хлебов – 177%
Протяжённость железных дорог – 257%
Обороты торговых заведений- 264%
Внешнеторговые обороты – 285%
Капиталы акционерных обществ – 392%
Стоимость продукции фабрично-заводской промышленности – 456%
Пассивы акционерных коммерческих банков – 1096%
Документ № 4 Производство чугуна и каменного угля на рубеже XIX – XX вв. ( в кг. на одного жителя)
Англия 208 1808
Германия 128 2304
Документ № 5 Мнение историка: из книги Л. Холмса «Социальная история России: 1917 – 1941»
… Индустриализация для России была абсолютной необходимостью. Россия уже долгое время играла роль великой державы и делала это довольно успешно со времён Петра Великого. Но в ХХ в., чтобы сохранить этот статус, ей нужна была индустриализация. Выбора не было: к лучшему или худшему; но Россия была частью Европы – и не могла избежать её конфликтов.
Документ № 6 Свидетельство Ф .А. Щербины, известного статистика начала XX в.
В 1884 г. из 100 опрошенных крестьян, по крайней мере, человек 60 или 70 заявляли, что школа им не нужна, что это – дело барское и для крестьянина неподходящее… Содержать школу казалось и дорого и тяжело населению… С тех пор прошло 15 лет, и картина сильно и ярко изменилась. И сельская школа, и народный учитель, и грамотность, и книга – всё это стало насущной необходимостью крестьянской среды… Знания заметно увеличились, и сельская школа… играла в этом отношении, если не единственную, то во всяком отношении преобладающую роль.
Документ № 7 Мнения крестьян (начало ХХ в.)
…Учиться стало нужно: в солдаты возьмут, облегчение даётся; записать, что по извозу; деньги получить… Письменный всюду гож: приведи к купцу, в лавочку, в шинок, его принимают; и дома – расписка, какая, и всякое дело – ему видней…
Мальчика обязательно надо учить: на чужую сторону пойдёт – может хорошее место получить. Кроме того, и в солдатах говорят, легче служить…
Документ № 8. Из данных статистики начала ХХ в.
Из 976 отзывов крестьян 88,4% высказались в пользу грамотности; в том числе было 66% неграмотных. Безразлично отнеслись 8,9%, а против высказались 2,7%. Правда, относительно девочек старый взгляд сохранился крепче… Но и тут положение улучшилось. Из 551 ответа на этот вопрос 376 (68,3%) оказалось положительных и только 84 (15,2%) отрицательных.
Документ № 9 Рост государственных расходов на начальное образование .
Годы сумма в рублях
Документ № 10. Из «Докладной записки Совета съездов Представителей Промышленности и Торговли о мерах к развитию производительных сил России и улучшению торгового баланса». 1914 г.
. Города растут у нас с поистине американской быстротой. Целый ряд железнодорожных станций, фабричных и заводских посёлков, особенно на юге, обратился в крупные центры городской культуры. Естественный в известные периоды экономического развития процесс концентрации населения, в силу происходящих сейчас коренных изменений в жизни сельскохозяйственного населения России, пойдёт, несомненно, с возрастающей быстротой и лет через 20-30 мы увидим, быть может, картину самых крупных в этой области перемен, но рост городов есть в то же время рост совершенно новых потребностей, для удовлетворения которых будут возникать целые отрасли промышленности, неизвестные или очень слабо развитые в настоящее время. Без преувеличения можно сказать, что рост городской жизни вызовет переворот в нашей промышленности.
Документ № 11. Из книги французского экономического обозревателя начала века Э. Тэри «Россия в 1914 г. Экономический обзор».
Благодаря протяжённости своей территории, разнообразию продукции, богатству недр и, в особенности, необыкновенному росту населения, Россия призвана стать великой промышленной державой.
Почти не существовавшая в середине прошлого века, русская промышленность развивалась благодаря строительству железных дорог, которые сделали легкодоступными богатые месторождения Кривого Рога, Донбасса, Польши, Урала и Кавказа и позволили ввести их в эксплуатацию.
Молодые страны имеют то преимущество, что могут немедленно воспользоваться плодами прогресса, добытыми долгими годами опыта в старых промышленных странах. Вот почему шахты и металлургические предприятия, созданные в пустынных степях южной России, были сразу оснащены по образцу наиболее усовершенствованных предприятий Западной Европы, т.е. сразу воспользовались апробированной технологией и самым совершенным оборудованием.
Физические свойства металлов

Тест предназначен для проверки знаний учащихся по темам "Физические свойства металлов", "Сплавы". 19 заданий теста имеют различные формы ( тестовые с выбором ответа, задания на соотнесение, с открытой формой ответа), что позволяет оценить не только знания учащихся, но и их умения работать с различными типами заданий
Просмотр содержимого документа
«Физические свойства металлов»
1. К металлам не относятся элементы ряда:
А)B, As, Te; б). Ca, Na, Mg
В)Cu, Zn, Au; г). W, Ag, Os
Как изменяются металлические свойства в ряду элементов
Si Al Mg Na:
а) изменяются периодически б) не изменяются
в) ослабевают г) усиливаются
3. Наименьшее число электронов на наружном энергетическом уровне содержит:
а) Ca б) Сr в) Na г) Al
4. Какой металл не относится к щелочным?
Какой элемент не входит в условную границу между металлами и неметаллами?
Какие частицы находятся в узлах кристаллической решетки металлов:
а. только катионы металлов б. нейтральные атомы
в. катионы и нейтральные атомы г. анионы и катионы
С каким космическим телом ассоциировалось в древности золото:
в. Солнце г. Марс
8.Какой металл наименее электропроводен:
Вольфрам 2. Цинк 3. Хром 4. Серебро
Для металлов характерен вид связи:
А) ковалентная Б) металлическая В) донорно-акцепторная.
10. К физическим свойствам металлов не относят
а) пластичность б) электропроводность
в) металлический блеск г) растворимость в воде
Металл, находящийся в жидком агрегатном состоянии при н.у. – это
12. Все металлы и их сплавы делятся на
А)Чёрные, цветные и драгоценные Б) Железо и цветные
В) Железо и драгоценные Г) Чёрные и цветные
13. За счёт чего металлы проводят электрический ток?
14. Выберите из предложенных металлов легкий металл.
а) Mg (ρ = 1,74 г/см 3 ) б) V (ρ = 5,7 г/см 3 )
в) Hg (ρ = 13,54 г/см 3 ) г) Ag (ρ = 10,5 г/см 3 )
15. Сплав меди и олова
1) бронза 2) чугун 3) сталь 4) дюралюминий
16. Содержание углерода в чугуне
1) 1 - 1,5% 2) 1 - 3% 3) 2 - 4,5% 4) 3 – 6%
17. К черным сплавам относится
1) латунь 2) мельхиор 3) дюралюминий 4) сталь
18. Используется при производстве литых деталей
1) цементит 2) серый чугун 3) белый чугун 4) все выше перечисленные
Два электрона на внешнем энергетическом уровне содержит
а) Ca б) Li в) Al г) K
Выберите строку, содержащую только типичные металлы:
a) Na, Sc, N б) Mg, Ba, K в) O, Al, Mn г) F, O, Cl
Какая характеристика не относится к строению типичных металлов?
а) на внешнем энергетическом уровне 1-3 ē б) относительно большой радиус атома
в) заряд ядра положительный г) заряд образованного им иона отрицательный
3. Сколько электронов находится на внешней энергетической орбитали у металлов:
А) от 2 до 4 В)от1 до З С) от 1 до 8 Д) от 4 до 8
4. Какое место занимают металлы в ПСХЭ:
а) слева в нижней части; б) справа в верхней части в) по центру; г) слева в верхней части
5. Металлическая кристаллическая решетка содержит а) только ионы металлов б) атомы и ионы металлов в) электроны, атомы и ионы металлов г) электроны и атомы металлов.
Сколько электронов содержит на внешнем энергетическом уровне атом магния:
Один 2. Два 3. Три 4. Четыре
Какова электронная конфигурация атома калия?
2.
3. 4.
8. Самый тугоплавкий металл:
А) осмий В) вольфрам С) железо Д) литий
9.Самый пластичный металл:
А) платина С) Алюминий Д) никель
Для всех металлов характерны:
а) мет.блеск, ковкость, пластичность; б) легкоплавкость, сверхпроводимость, твердость
в)электропроводность, хрупкость, тугоплавкость; г)теплопроводность, высокая электропроводимость, твердость
Назовите самый легкоплавкий металл.
а) W б) Al в) Hg г) Ga
12. Чугун это:
А) Сплав железа с углеродом, содержащий более 2% углерода
б) Сплав железа с углеродом, содержащий менее 2%
в)сплав железа с углеродом с добавлением хрома, никеля, вольфрама
13. Укажите, чем объясняется электропроводность металлов.
а) движением «электронного газа» б) притяжением электронов к ядру;
в) способностью отражать световые лучи; г) смещением слоев атомов и ионов.
14. Выберите из ниже предложенного перечня- физические свойства меди.
а) жидкость; б) плотность выше 5,0 г/см 3 ; в) красный цвет; г)электропроводность.
15. Укажите, чем объясняется ковкость металлов.
а) притяжением электронов к ядру; б) смещением слоев атомов и ионов; в) наличием «свободных» электронов; г) способностью отражать световые лучи.
16. Как изменяются металлические свойства атомов элементов главных групп с ростом порядкового номера?
а) усиливаются; б) не изменяются; в) вначале усиливаются, а затем ослабевают; г) ослабевают.
Выберите металл, обладающий наименьшей электропроводностью.
а) W б) Ag в) Cu г) Al
Какой металл не относится к щелочным?
19. В каких сплавах основным компонентом является медь? а) латунь ; б) бронза; в) мельхиор; г) дюралюминий

-82%
Неметаллы

Видеофрагмент даёт представление об особенностях строения и свойствах атомов неметаллов, о положении их в Периодической системе, особенностях их физических и химических свойств, нахождении в природе и получении.
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Неметаллы"
Как известно, традиционное деление элементов на металлы и неметаллы исторически сложилось из-за того, что металлы, как правило, находятся в твёрдом агрегатном состоянии, имеют металлический блеск, тепло- и электропроводны, ковки и пластичны, а неметаллы при обычных условиях этими свойствами не обладают.

К неметаллам относятся 23 химических элемента, все неметаллы являются элементами главных групп.

Условная граница между металлами и неметаллами находится на линии в направлении от бора к астату. Таким образом, элементы, расположенные начиная с третьей А группы и заканчивая восьмой А группой, являются неметаллами. К неметаллам относится и водород, расположенный в первой A группе.
Число элементов неметаллов в группе увеличивается с номером группы.
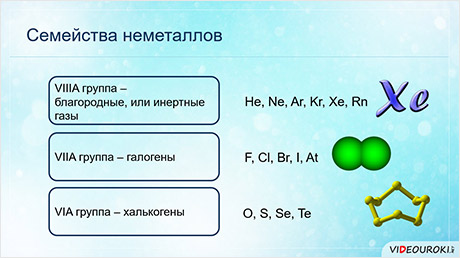
В третьей A группе находится только один элемент неметалл – бор, а восьмая A группа полностью состоит из неметаллов.
Для некоторых неметаллов используют групповые названия. Элементы восьмой A группы называются благородными, или инэртными газами, элементы седьмой A группы называются галогенами, элементы шестой A группы – халькогенами.
Наиболее типичными неметаллами являются: водород, кислород, углерод, азот, фосфор, сера, а также галогены – фтор, хлор, бром, йод.
Элементы, расположенные вдоль условной разграничительной линии: бор, кремний, германий, мышьяк, селен, тэллур, астат, являются неметаллам, но могут проявлять и металлические свойства, поэтому их называют полуметаллами.
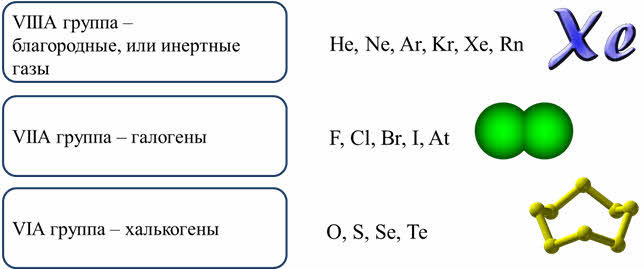
У атомов большинства неметаллов, кроме водорода, гелия и бора, на внешнем энэргетическом уровне от четырёх до восьми электронов. У атома водорода на внешнем уровне содержится только один электрон, у гелия – два и его электронный слой полностью заполнен, у бора на внешнем энергетическом уровне находится три электрона.
Число электронов на внешнем уровне численно равно номеру группы. Так, углерод и кремний – элементы четвёртой A группы содержат четыре электрона на внешнем энэргетическом уровне, а азот и фосфор – элементы пятой A группы содержат пять электронов на внешнем слое.
Атомы водорода и гелия относятся к эс-элементам, а все остальные атомы неметаллов – к пэ-элементам.
Электроотрицательность неметаллов гораздо выше, чем металлов.
Электроны внешнего энэргетического уровня прочно связаны с ядром, поэтому для атомов неметаллов характерна способность присоединять электроны до завершения внешнего слоя.
Для атомов неметаллов возможны различные степени окисления. Максимальная положительная степень окисления, кроме кислорода и фтора, равна номеру группы. Например, у углерода и кремния плюс четыре, у азота и фосфора — плюс пять, у хлора — плюс семь, у серы — плюс шесть.
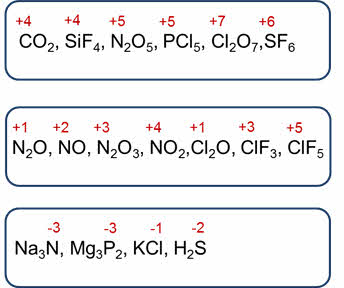
Некоторые неметаллы проявляют несколько положительных степеней окисления. Например, азот может кроме плюс пяти иметь такие степени окисления, как плюс один, плюс два, плюс три, плюс четыре, а хлор, кроме степени окисления плюс семь, имеет степени окисления плюс один, плюс три, плюс пять.
Минимальная отрицательная степень окисления равна номер группы минус восемь. У азота и фосфора минимальная отрицательная степень окисления равна минус трём, у атомов галогенов — минус один, у серы — минус два.
Таким образом, атомы неметаллов в их соединениях с атомами металлов, водорода и других менее электроотрицательных элементов проявляют отрицательные степени окисления, а в соединениях с более электроотрицательными элементами для атомов неметаллов характерны положительные степени окисления.
Благородные газа – ксенон и в меньшей степени криптон – в своих соединениях со фтором и кислородом также способны проявлять положительные степени окисления плюс два, плюс четыре, плюс шесть и плюс восемь.
Исключение составляет фтор, который в соединениях может проявлять только степень окисления минус один.
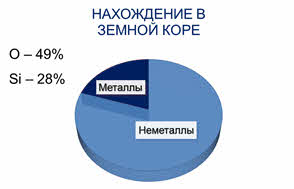
Массовая доля неметаллов в земной коре составляет почти 80%, а во вселенной достигает девяноста девяти процентов (в основном за счёт водорода и гелия). На долю кислорода в земной коре приходится более 49%, на долю кремния – около 28%, а на долю брома, йода, селена и тэллура – сотые доли процента.
Неметаллы входят и в состав живых организмов. Эти элементы называются органогенными. К ним относятся: углерод, кислород, водород, азот, фосфор, сера.
Несмотря на незначительное содержание селена, брома, йода в живых организмах, эти элементы относятся к жизненно необходимым.
В последние годы учёные установили, что селен оберегает клетки от вредного воздействия ультрафиолетового и радиоактивного облучения. Селен содержится в таких грибах, как лисички, опята, маслята, но значительно больше этого элемента содержится в ядовитых грибах: бледной поганке, мухоморе.

По мнению учёных, большие концентрации селена в грибах способствуют их быстрому росту. Но следует помнить, что употребление продуктов, содержащих селен в больших количествах, больше пяти миллиграмм на один килограмм пищи, приводит к острому отравлению организма человека.
В природе неметаллы встречаются как в виде простых веществ, так и в виде сложных соединений. Большая часть неметаллов входит в состав минералов и горных пород, в состав органических соединений.

Молекулы неметаллов могут быть одноатомными (благородные газы), двухатомными (галогены, кислород, азот и водород), а также содержать большее число атомов (как озон, фосфор и сера).
Атомы некоторых неметаллов могут образовывать цепи, например, атомы углерода образуют цепи неограниченной длины, а атомы кремния – недлинные цепи (до шести атомов).
Неметаллы образуют вещества молекулярного строения (кислород, азот, сера, благородные газы) и немолекулярного строения (углерод в виде алмаза и графита).
Для неметаллов характерно разнообразие в физических свойствах. Как вы знаете, при обычных условиях кислород, водород, азот, фтор, хлор – газы, как и элементы благородные, или инэртные газы.
Единственной жидкостью среди неметаллов является бром. Все остальные неметаллы – твёрдые вещества, которые имеют атомную кристаллическую решётку, как у бора и кремния, так и молекулярную, как у йода, фосфора, серы.
Многие неметаллы обладают окраской: графит – серо-чёрной, бром – красно-бурой, сера – жёлтой, хлор – жёлто-зелёной, йод – фиолетово-чёрной.

Очень различаются и другие физические свойства неметаллов: так температура плавления графита составляет 3850 градусов по Цэльсию, а у гелия — минус 272 градуса по Цэльсию.
Плотность газообразных неметаллов также различна: самая маленькая – у водорода, а самая большая – у радона.
Твёрдые неметаллы не обладают пластичностью.
В воде неметаллы нерастворимы или малорастворимы. Некоторые из них, как галогены, сера лучше растворяются в органических растворителях, а белый фосфор – в сероуглероде.
Различаются неметаллы и по электропроводности. Большинство неметаллов – это изоляторы.
Графит – является хорошим проводником электрического тока. Кремний, селен и тэллур обладают полупроводниковыми свойствами.
Интересно, что радиоактивный радон используется в медицине для лечения опорно-двигательного аппарата, сердечных и нервных заболеваний. Но в тоже время в литературе часто упоминается термин «радоновая проблема», который означает достаточно высокое облучение, вызванное радоном, который выделяется через разломы в земной коре.
Для неметаллов характерно явление аллотропии.
Аллотропия (от греч. аллотропия – другое свойство) явление существования элементов в виде нескольких простых веществ. Так, химический элемент кислород в природе существует в виде двух простых веществ – кислорода и озона. Различный состав и строение молекул определяют различие в их свойствах.
Кислород – газ без цвета и запаха, озон – газ светло-голубого цвета с резким характерным запахом. Они различаются также температурами плавления и кипения, реакционной способностью.
В природе озон образуется при грозовых разрядах и при окислении смолы хвойных деревьев. Озон в верхних слоях атмосферы образует озоновый слой, который защищает живые организмы от ультрафиолетового излучения.
Небольшое количество озона в воздухе оказывает целебное действие на людей с заболеванием лёгких, но сильное обогащение воздуха озоном может стать опасным для здоровья. Источником озона служат работающие ксероксы, лазерные принтеры, источники ультрафиолетового и рентгеновского излучения. Поэтому помещения, в которых находятся такие приборы необходимо часто проветривать.
Химический элемент углерод также встречается в нескольких аллотропных модификациях: графит, алмаз, карбин, фуллерен, но наиболее распространены алмаз и графит, которые отличаются по своим свойствам. Графит – мягкое, серо-чёрное вещество, хорошо проводит электрический ток, а алмаз – прозрачный кристалл, самое твёрдое природное вещество, является изолятором.
Простые вещества неметаллы различаются и по химической активности. Наиболее химически активны галогены и кислород. Сера, фосфор, углерод и кремний вступают в химические реакции, как правило, только при нагревании.
Для неметаллов характерны и восстановительные, и окислительные свойства. Способность неметаллов проявлять те или иные свойства определяется положением их в ряду электроотрицательности. Электрооотрицательность уменьшается от фтора к водороду.
В качестве окислителей неметаллы взаимодействуют с металлами. Например, при горении магния в кислороде образуется оксид магния, кислород понижает свою степень окисления с нуля до минус двух, поэтому он вступает в роли окислителя, при горении железа в хлоре образуется хлорид железа три, хлор понижает степень окисления с нуля до минус единицы, поэтому хлор является окислителем.
В реакции с водородом неметаллы выступают в качестве окислителей, а водород – в качестве восстановителя. Например, в реакции водорода с серой образуется сероводород. Сера понижает свою степень окисления с нуля до минус двух, поэтому сера – окислитель.
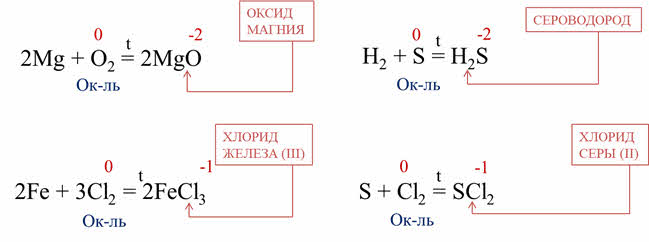
Неметаллы выступают в роли окислителей при взаимодействии с другими неметаллами, имеющими более низкую электроотрицательность. Так, в реакции серы с хлором образуется хлорид серы два, хлор понижает свою степень окисления с нуля до минус единицы, поэтому хлор – окислитель.
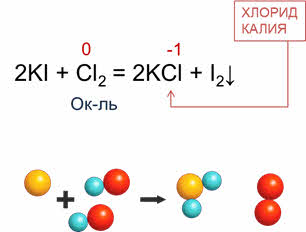
Неметаллы реагируют и со сложными веществами: в реакции хлора с йодидом калия образуется хлорид калия и йод. В этой реакции хлор понижает свою степень окисления с нуля до минус единицы, поэтому в данной реакции хлор является окислителем.
В качестве восстановителей неметаллы выступают в реакциях с неметаллами, атомы которых имеют более высокое значение электроотрицательности. Например, в реакции горения серы образуется оксид серы четыре, в данной реакции сера повышает свою степень окисления с нуля до плюс четырёх, поэтому в этой реакции сера – восстановитель.
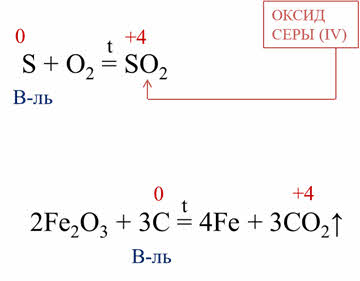
Восстановительные свойства неметаллы проявляют и в реакциях со сложными веществами. Например, в реакции углерода с оксидом железа три углерод повышает свою степень окисления с нуля до плюс четырёх, выступая в роли восстановителя.
В реакциях диспропорционирования один и тот же неметалл является одновременно и окислителем, и восстановителем.
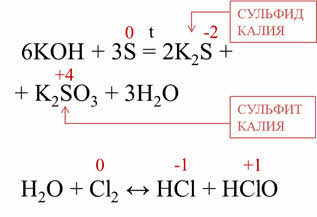
Например, в реакции серы с гидроксидом калия образуется сульфид калия, сульфит калия и вода. Сера, таким образом, изменила свою степень окисления с нуля до мину двух и плюс четырёх. В реакции хлора с водой хлор также изменяет свою степень окисления с нуля до минус единицы и плюс единицы.
Таким образом, все неметаллы являются элементами главных групп. Атомы неметаллов могут проявлять как отрицательные, так и положительные степени окисления. Простые вещества неметаллы существенно различаются между собой физическими и химическими свойствами. Для неметаллов характерно явление аллотропии. В химических реакциях неметаллы могут проявлять окислительные и восстановительные свойства.
§ 8. Положение металлов в Периодической системе Д. И. Менделеева и строение их атомов
Как вам уже известно из курса химии 8 класса, большинство химических элементов относят к металлам (рис. 24 и 25).
В Периодической системе Д. И. Менделеева каждый период, кроме первого (он включает в себя два элемента-неметалла — водород и гелий), начинается с активного химического элемента-металла. Эти элементы образуют главную подгруппу I группы (IA группу) и называются щелочными металлами. Своё название они получили от названия соответствующих им гидроксидов, хорошо растворимых в воде, — щелочей.

Рис. 24.
Положение химических элементов-металлов в Периодической системе Д. И. Менделеева (короткопериодный вариант)
Атомы щелочных металлов содержат на внешнем энергетическом уровне только один электрон, который они легко отдают при химических взаимодействиях, поэтому являются сильнейшими восстановителями. Понятно, что в соответствии с увеличением радиуса атома восстановительные свойства щелочных металлов усиливаются от лития к францию.

Рис. 25.
Положение химических элементов-металлов в Периодической системе Д. И. Менделеева (длиннопериодный вариант)
Следующие за щелочными металлами элементы, составляющие главную подгруппу II группы (IIA группы), также являются типичными металлами, обладающими сильной восстановительной способностью (их атомы содержат на внешнем уровне два электрона). Из этих металлов кальций, стронций и барий называют щёлочноземельными металлами. Такое название эти металлы получили потому, что их оксиды, которые на Руси в старину называли «землями», при растворении в воде образуют щёлочи.
К металлам относят и химические элементы главной подгруппы III группы (IIIA группы), исключая бор.
- * Германий проявляет и некоторые неметаллические свойства, занимая промежуточное положение между металлами и неметаллами.
Что касается элементов побочных подгрупп, то все они металлы.
Таким образом, условная граница между элементами-металлами и элементами-неметаллами проходит по диагонали В (бор) — Si (кремний) — As (мышьяк) — Те (теллур) — At (астат) (проследите её в таблице Д. И. Менделеева).
Атомы металлов имеют сравнительно большие размеры (радиусы), поэтому их внешние электроны значительно удалены от ядра и слабо с ним связаны. Вторая особенность, которая присуща атомам наиболее активных металлов, — это наличие на внешнем энергетическом уровне 1—3 электронов. Отсюда вытекает самое характерное химическое свойство всех металлов — их восстановительная способность, т. е. способность атомов легко отдавать внешние электроны, превращаясь в положительные ионы. Металлы — свободные атомы и простые вещества — не могут быть окислителями, т. е. атомы металлов не могут присоединять к себе электроны.
Следует, однако, иметь в виду, что деление химических элементов на металлы и неметаллы условно. Вспомните, например, свойства аллотропных модификаций олова: серое олово, или α-олово, — неметалл, а белое олово, или β-олово, — металл. Другой пример — модификации углерода: алмаз — неметалл, а графит имеет некоторые характерные свойства металла, например электропроводность. Хром, цинк и алюминий — типичные металлы, но образуют оксиды и гидроксиды амфотерного характера. И наоборот, теллур и иод — типичные неметаллы, но образованные ими простые вещества обладают некоторыми свойствами, присущими металлам.
Читайте также:
