Какой элемент пятого периода является самым активным металлом почему
Обновлено: 18.05.2024
В настоящее время такое понятие, как «легкие металлы», отсутствует в номенклатуре ИЮПАК. Таковыми принято называть металлы, имеющие небольшую плотность (как правило до 4,5 г/см3) или вес. Стоит отметить, что в настоящее время существуют такие металлы, которые легко держатся на воде, а некоторые из них имеют вес, в разы меньший пенопласта, но при этом все равно остаются достаточно прочными.
Группа легких металлов, как правило, включает в себя следующие: алюминий, олово, магний, титан, бериллий и литий. Кроме этого, к данной группе металлов часто также добавляют галлий, индий, таллий, висмут и кадмий.
Наиболее важными металлами данной группы с точки зрения технического применения являются алюминий, магний, титан, бериллий. Именно данные металлы служат в качестве основы сплавов. Алюминиевые сплавы являются наиболее значимой и распространенной группой, однако, не смотря на это, для специфического применения также предлагаются и материалы из титана и бериллия.
Что представляют собой
В номенклатуре IUPAC – уважаемой в мире международной организации, курирующей теорию и практику в сфере химии, термин «легкие металлы» отсутствует.
Неофициально к легким металлам относятся вещества с плотностью менее 5 граммов на кубический сантиметр.
Разные списки включают пять – десять позиций.
Самое распространенное деление – по используемости:
- На этом основании выделяют пять главных: алюминий, бериллий, магний, титан, литий.
- Их дополняет «экзотика»: галлий, индий, висмут, таллий, кадмий.
Вторая группа причисляется к редким металлам.
Редкими эти элементы названы потому, что на практике используются недавно и не так широко, как традиционные материалы.
Литий
Литий находится в первой группе периодической таблицы элементов. Он стоит под номером 3, после водорода и гелия, и обладает самой маленькой атомной массой среди всех металлов. Простое вещество – литий, при нормальных условиях имеет серебристо-белый цвет.
Это самый лёгкий щелочной металл с плотностью 0,534 г/см³. Из-за этого он всплывает не только в воде, но и в керосине. Для его хранения обычно используют парафин, газолин, минеральные масла или петролейный эфир. Литий очень мягкий и пластичный, легко режется ножом. Чтобы расплавить этот металл, его нужно нагреть до температуры 180,54 °C. Закипит он только при 1340 °C.
В природе существует только два стабильных изотопа металла: Литий-6 и Литий-7. Кроме них, есть 7 искусственных изотопа и 2 ядерных изомера. Литий является промежуточным продуктом в реакции превращения водорода в гелий, участвуя, таким образом, в процессе образования звёздной энергии.

Классификация
Каждый представитель «легкой» группы относится еще к какому-нибудь сообществу.
Основанием становится не плотность, а другие физико-химические характеристики:
- Щелочные элементы – литий.
- Щелочноземельные – бериллий, магний.
- Цветные металлы – алюминий, титан, магний.
- Легкоплавкие – висмут, галлий, кадмий, таллий, индий.
- Тугоплавкие – титан, магний.
Каждый химический элемент наделен специфическими свойствами, присущими своей группе.
Сплавы лития
Свойства лития повышают отдельные качества металлов, из-за чего его часто используют в сплавах. Полезной является его реакция с окислами, водородом, сульфидами. При нагревании он образует с ними нерастворимые соединения, которые легко извлечь из расплавленных металлов, очистив их от этих веществ.
Для придания сплаву стойкости к коррозии и пластичности его смешивают с магнием и алюминием. Медь в сплаве с ним становится более плотной и менее пористой, лучше проводит электричество. Самый легкий металл повышает твёрдость и пластичность свинца. При этом он повышает температуру плавления многих веществ.
Благодаря литию металл становится прочным и устойчивым к разрушениям. При этом он не утяжеляет их. Именно поэтому сплавы на его основе применяются в космической инженерии и авиации. Главным образом используются смеси с кадмием, медью, скандием и магнием.
Как представлены в природе
На легкий металлический сегмент приходится пятая часть литосферы (по массе).
Чаще они входят в состав руды либо минерала. Особенно химически сверхактивные элементы, например, литий. Этот самый легкий металл в природе представлен собственными минералами – лепидолитовой слюдой и сподуменом.

Сподумен
Особенности сдачи легких сплавов
В настоящее время физические и юридические лица имеют возможность получить прибыль от сдачи цветмета в специализированные пункты приема. Стоимость лома определяется рядом факторов, среди которых качество материала, чистота его химического состава, категория и прочие параметры. Также имеют значение актуальные расценки на рынке, тарифы конкретной принимающей компании.
Формальная сторона вопроса сдачи любого лома, в том числе легких цветных металлов, имеет свою специфику. Право на такое мероприятие есть у каждого, но реализуется оно по-разному. Например, если сдача цветмета производится юридическим лицом – организацией, предприятием или представителем малого бизнеса (ИП), – то потребуется специальная лицензия. На физических лиц данное требование не распространяется, однако следует учитывать несколько правил:
- к приемке допускается только собственный лом (при наличии документов, подтверждающих право на владение);
- подлежащий сдаче цветмет должен входить в реестр материалов, принимаемых без лицензии;
- сдача лома нелегальным пунктам приема может иметь весьма неприятные последствия в соответствии с действующим законодательством.
Помимо сугубо меркантильного интереса сдача цветных металлов привлекательна с точки зрения экологии, сохранения запасов природных ресурсов. Переработанный лом снова идет на изготовление необходимой продукции, причем производство из вторсырья оказывается дешевле, чем при использовании руды. С учетом того, что потребность промышленности в ломе неуклонно растет, тогда как природные запасы сырья стремительно сокращаются, замкнутый производственный цикл является наиболее рациональным. Таким образом, каждый, кто сдает сдает лом цветмета, не только повышает собственное благосостояние, но и действует во благо общества в целом.
Способы получения
Технологию выплавки легких металлов отработали к середине 19 века.
Для их получения в металлургии используется три способа:
- Электролиз расплава солей. То есть аккумуляция на электродах компонентов растворенных либо других веществ. Реакцию запускает электрический ток, пропускаемый через раствор либо расплав электролита.
- Металлотермия. Восстановление из их соединений другими, более активными металлами. Процесс проходит при повышенных температурах.
- Электротермия. Материал нагревается, затем расплавляется теплом, полученным из электрического тока.
Производство легких элементов – весьма энергоемкий процесс. Поэтому металлургические комбинаты располагают поближе к источникам энергии.
В отличие от тяжелых металлов: их базовые предприятия привязывают к месторождению.
Ценностью легких, особенно цветных металлов, обусловлен второй способ получения – переработка лома.
Свойства легких металлов
Алюминий
Алюминий является металлом, идеально сочетающим в своих характеристиках легкость и прочность. Его первооткрывателем является датский физик Ганс Эрстед, который в 1825 году восстановил хлорид алюминия амальгамой калия при воздействии высоких температур, в результате чего и выделил данный металл.
Имеет характерный серебристо-белый окрас. Плотность металла составляет 2712 кг/м3. Плавится при температуре: 6580С (для технического алюминий) и 6600С (для алюминия высокой чистоты). Удельная теплота плавления алюминия – 390 кДж/кг. Закипает при температуре 2515,80С. Имеет удельную теплоемкость 897Дж/кг*К. Обладает достаточно высокой пластичностью, которая составляет 35% у технического алюминия и 50% у чистого металла.
Первым изделием, для изготовления которого был применен алюминий, стала детская погремушка. Однако, с тех далеких времен, алюминий стал достаточно распространенным материалом. В настоящее время он нашел свое широкое применение во многих сферах человеческой деятельности. Однако, наибольший процент потребления данного металла приходится на упаковочную промышленность, особенно для банок с напитками.
Также следует отметить, что алюминий активно применяется наряду со сталью и в машиностроении. В настоящее время существует огромное множество алюминиевых сплавов, которые отвечают огромному количеству определенных и необходимых требований. Среди данных сплавов можно выделить две основные группы – литейные и деформируемые. Сплавы из каждой группы также можно разделить на те, которые способны дисперсионно твердеть и те, которые не способны. Чтобы материал сделать более прочным применяются:
- наклеп;
- легирование;
- дисперсионное твердение (старение).
Для того, чтобы получить оптимальные характеристики стареющих сплавов, их необходимо подвергнуть измельчению. В связи с этим, для дисперсионного старения деформируемых сплавов используется термообработка. Ее также могут применять с целью повышения прочности.
Среди наиболее важных литейных сплавов стоит выделить Al-Si, которые образуют эвтектическую систему с эвтектической точкой при 11,7% Si и 5770С. Сплавы, имеющие в своем составе содержание Si в пределах 11-13% называют близкими к эвтектическим. Кроме этого, они также известны как силуминовое литье. Стоит отметить, что если охлаждение сплава с содержанием Si 13% осуществляется медленно, то первично выделяющийся твердый раствор Si образует крупные, угловатые, игольчатые кристаллы, что, в свою очередь, чревато ярко выраженной хрупкостью подобных сплавов. Одним словом, такая структура является крайне неблагоприятной. Для того, чтобы подобного не происходило, применяют облагораживание металлов – т.е. добавляют в плавку 0,1% Na. При этом происходит очищение кристаллов кремния, а также их округление и, в конечном итоге, образование тонкодиспергированной эвтектики. Благодаря подмешиванию в сплав натрия происходит снижение эвтектической температуры до 5640С.
Если же сплав охлаждается за относительно короткий промежуток времени, что происходит в кокильном литье, то происходит действие, подобное облагораживанию металлов – сдвиг эвтектической точки при помощи переохлаждения. В результате происходит образование достаточно чистой эвтектической структуры, что избавляет от необходимости облагораживания металлов путем добавления в них натрия.
Деформируемые сплавы имеют в своем составе значительно меньшее количество легирующих элементов и примесей, в отличие от литейных сплавов. Деформируемые сплавы, обычно, отвечают более высоким требованиям. В связи с этим, для их выплавки применяется металлургический алюминий. К нестареющим деформированным сплавам относятся AlMg-сплавы. Они отличаются своей высокой твердостью и прочностью по причине легирования. Данные свойства сохраняются даже при отжиге и сварке.
К высокопрочным сплавам нового поколения относятся Al-Li- сплавы.
Титан
Представляет собой легкий тугоплавкий металл с характерным серебристо-белым цветом. Отличается своей высокой устойчивостью к коррозии. Данным свойством он обязан стабильному пассивированному оксидному слою, который образуется за достаточно короткий промежуток времени при слабых средствах окисления.

Для титановых сплавов характерна высокая жаропрочность, которая может достигать 1200 – 1400Н/мм2. Именно титановые сплавы занимают ячейку между алюминиевыми сплавами и жаропрочными сталями, поскольку могут применятся до температуры 5000С, а также до 10000С при непродолжительном использовании.
Титановый сплав используется для изготовления деталей, которые подвергаются сильной нагрузке, с целью их облегчения. Например, шатуны для высокомощных двигателей изготавливаются именно из титановых сплавов. Это связано с тем, что данный материал обладает идеальным соотношением прочности на разрыв к плотности Rm/p.
Однако, для титановых сплавов характерна достаточно высокая стоимость, что препятствует их широкому применению, в отличие от Al-сплавов.
Титану, как и железу, присуще аллотропное превращение. Титан сохраняет свою гексагональную структуру до температуры 8820С.
Среди наиболее важных легирующих элементов, которыми обогащаются технические титановые сплавы, следует назвать ванадий, олово, молибден, цирконий, ниобий, а также хром и алюминий.



Титан (Ti)
Открытый в конце XVIII столетия и сразу добавленный в периодическую таблицу Менделеева под 22-м номером химический элемент серебристого цвета с атомной массой в 47,867 а. е. м. (атомная единица массы) и плотностью в 4,5 г/см^3 отличается впечатляющей прочностью.
Также среди свойств металла, получившего статус самого твердого из используемых, выделяют отличную антикоррозионную устойчивость. Это справедливо и для сплавов, получаемых на основе титана, причем собственные прочностные характеристики последние сохраняют даже при температурах в 300 °C, что делает их незаменимыми в текущий период времени в авиации и ракетостроении.
Получивший название в честь титанов из древнегреческой мифологии металл входит в десятку самых распространенных в природе элементов, месторождения которого открыты на всех континентах, исключая Антарктиду. Причем Россия занимает по концентрации руд с содержанием рассматриваемого элемента второе место в мире после КНР.
Помимо уже упомянутых отраслей, титановые сплавы востребованы в кораблестроении, химической, автомобильной и оборонной промышленности, а также на пищевом производстве и в сельском хозяйстве. Благодаря собственной инертности титан без проблем способен контактировать с тканями живых организмов, не вызывая опасных для здоровья химических реакций, а потому активно используется в медицине, начиная с протезирования и изготовления имплантатов и заканчивая созданием хирургических инструментов.
ДЗ для 1ф к 1 практическому занятию

1. В каком периоде, в какой группе и в какой подгруппе находятся элементы с порядковыми номерами 14, 29, 52, 56, 78?
2. Напишите символ, название и порядковый номер элемента, который находится: а) в третьем периоде и в главной подгруппе шестой группы; б) в пятом периоде и в побочной подгруппе второй группы; в) в шестом периоде и в главной подгруппе четвертой группы; г) в четвертом периоде и в побочной подгруппе седьмой группы.
3. Напишите символы, названия и порядковые номера всех элементов, которые находятся: а) в главной подгруппе четвертой группы; б) в побочной подгруппе второй группы; в) в третьем периоде.
4. Какие элементы главной подгруппы пятой группы являются элементами малых периодов? Напишите их символы, названия, порядковые номера.
5. Какое общее свойство имеют элементы главной и побочной подгрупп одной группы?
6. Напишите формулы оксидов всех элементов четвертой группы, в которых эти элементы имеют высшую валентность.
7. Напишите формулы оксидов элементов с порядковыми номерами 16, 21, 25, 48, 76, в которых эти элементы имеют высшую валентность.
8..Какой элемент имеет более выраженные металлические свойства: Са (Z = 20) или Ва (Z = 56)? Почему?
9. Какой элемент имеет более выраженные неметаллические свойства: Р (Z = 15) или CI (Z = 17)? Почему?
10. Какой элемент четвертого периода является самым активным неметаллом? Почему?
11. Какой элемент пятого периода является самым активным металлом? Почему?
12. Какой элемент главной подгруппы шестой группы является самым активным неметаллом? Почему?
13. В каких группах Периодической системы все элементы являются металлами?
Просмотр содержимого документа
«ДЗ для 1ф к 1 практическому занятию»
Периодический закон и периодическая система химических элементов Д. И. Менделеева
Строение атома: физический смысл порядкового номера элемента, массовые числа атомов, изотопы
1. Чему равен заряд ядра и число электронов в атомах следующих элементов: углерод С, сера S, медь Си, барий Ва, серебро Ag?
2. Назовите элемент, в ядре атома которого содержится 11 протонов.
3. Назовите элемент, в атоме которого содержится 26 электронов.
4. Чему равно число нейтронов в атомах следующих изотопов: 15 N, 119 Sn, 235 U?
5. Напишите символы изотопов олова, атомы которых содержат 66, 68, 69, 71, 72 нейтрона.
6. Определите молекулярную массу воды, молекулы которой содержат тяжелый изотоп водорода — дейтерий.
7. Элемент медь существует в виде двух изотопов: 63 Сu и 65 Сu. Содержание в природе первого изотопа равно 73%, второго — 27%. Вычислите относительную атомную массу меди.
8. Чему равен порядковый номер элемента, массовое число одного из изотопов которого равно 31, а число нейтронов равно 16?
9. Сколько электронов и протонов входит в состав атома элемента, который находится: а) в 5-м периоде и в побочной подгруппе VI группы; б) в 4-м периоде и в главной подгруппе III группы?
Строение электронной оболочки атома. Квантовые числа. Принцип Паули
1. На каком энергетическом уровне нет р-подуровня? Почему?
2. На каких энергетических уровнях нет d-подуровней? Почему?
3. Продолжите табл. 1 (см. текст) для четвертого энергетического уровня (N-уровня). Сколько орбиталей на N-уровне?
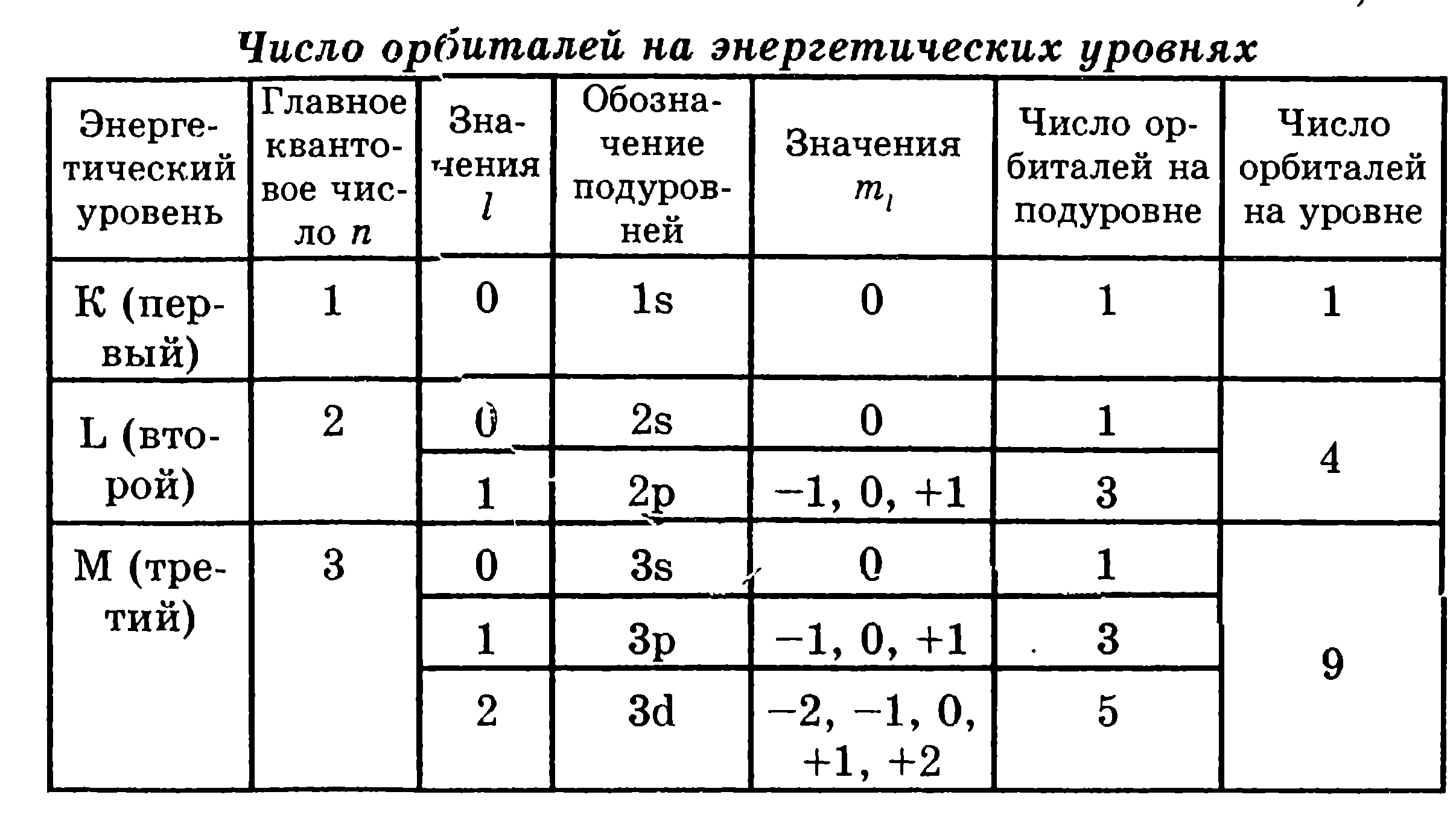
4. Продолжите табл. 2 (см. текст) для четвертого энергетического уровня (N-уровня). Чему равно максимальное число электронов на N-уровне?

5. Чему равны все квантовые числа для двух электронов, которые находятся на 3s-подуровне?
6. Напишите наборы всех четырех квантовых чисел для всех электронов, которые находятся на 4р-подуровне:7. На каком энергетическом уровне и на каком энергетическом подуровне находится электрон, для которого n = 4 и l = 1? Какую форму имеет облако этого электрона?
8. Какие значения имеют главное квантовое число n и побочное квантовое число l для следующих подуровней: 1s, 2s, 2p, 3s, 3р, 3d, 4s, 4p, 4d, 4f?
9. Заполните таблицу:

10. Чем отличается электронное облако, которое характеризуется n = 4 и l = 0, mi = 0, от электронного облака, которое характеризуется n = 3, l = 0, mi = 0?
Строение электронной оболочки атома. Заполнение орбиталей электронами. Электронные конфигурации атомов элементов I—IV периодов




1. Используйте правило Гунда и напишите электронно-графические формулы электронных конфигураций р 2 , р 4 , d 7 .
2. В каком электронном слое — внешнем или предвнешнем — происходит увеличение числа электронов в атомах ряда элементов от 21Sc до 30Zn?
5. Сколько электронов находится на внешнем электронном слое в атомах ряда элементов от 21Sc до 30Zn?
6. Сколько электронов находится на внешнем электронном слое в атомах благородных газов?
Периодическая система химических элементов и электронное строение атомов
1. По положению элементов в периодической системе определите число электронных слоев и число электронов на внешнем электронном слое в атомах: а) углерода 6С; б) серы 16S; в) цезия 55Cs; г) кальция 20Ca; д) висмута 83Bi; e) йода 53I; ж) ксенона 54Хе. Напишите для каждого из этих элементов электронную и электронно-графическую формулы внешнего электронного слоя.
2. Укажите, к какому электронному семейству относится каждый из следующих элементов: а) 6С; б) 56Ва; в) 41Nb; r)35Br; д) 37Rb; е) 26Fe; ж) 17Cl. Какой подуровень заполняется последним в атомах этих элементов?
3. По электронной формуле внешнего электронного слоя атома определите, какой это элемент. Напишите его название, символ и порядковый номер: a) 3s 2 3p 4 ; б) 4s 2 4p 6 ; B)2s 2 2p 1 , г) 5s 2 5p 3 ; д) 6s 2 6p 2 ; e) 5s 2 5p 2 ; ж) 3s 2 3p 3 . К какому электронному семейству относится каждый из этих элементов?
4. Чему равно общее число s-элементов в периодической системе? Напишите символы и порядковые номера всех s-элементов.
5. Атомы каких трех элементов имеют структуру внешнего электронного слоя 4s 1 ? Напишите их символы и названия. К каким электронным семействам они относятся? Чем отличаются они по электронному строению?
6. У какого элемента начинает заполняться 3d-подуровень? Сколько электронов на внешнем слое атома этого элемента? У какого элемента заканчивается заполнение 3d-подуровня? Сколько электронов на внешнем слое атома этого элемента?
7. У какого элемента начинается заполнение 4p-подуровня и у какого элемента заканчивается?
8. Определите положение элементов в периодической системе (период, группа, подгруппа) по электронным формулам:
а) ls 2 2s 2 2p 6 3s 2 3p 4 ;
б) ls 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 5 (или ls 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 2 );
в) ls 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 (или ls 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 );
г) ls 2 2s 2 2p 1 ;
д) ls 2 2s 2 2p 6 3s 1 ;
е) ls 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 5 (или ls 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 5 );
Модель решения задания 8
В атоме три электронных слоя, значит, элемент находится в III периоде.
Последним в атоме заполняется s-подуровень, следовательно, это элемент главной подгруппы. На внешнем электронном слое атома находятся два электрона, поэтому это элемент II группы магний Mg.
Электрохимический ряд напряжений металлов (ряд Бекетова)

Металлы, легко вступающие в реакции, называются активными металлами. К ним относятся щелочные, щелочноземельные металлы и алюминий.
Положение в таблице Менделеева
Металлические свойства элементов ослабевают слева направо в периодической таблице Менделеева. Поэтому наиболее активными считаются элементы I и II групп.

Рис. 1. Активные металлы в таблице Менделеева.
Все металлы являются восстановителями и легко расстаются с электронами на внешнем энергетическом уровне. У активных металлов всего один-два валентных электрона. При этом металлические свойства усиливаются сверху вниз с возрастанием количества энергетических уровней, т.к. чем дальше электрон находится от ядра атома, тем легче ему отделиться.
Наиболее активными считаются щелочные металлы:
К щелочноземельным металлам относятся:
- бериллий;
- магний;
- кальций;
- стронций;
- барий;
- радий.
Узнать степень активности металла можно по электрохимическому ряду напряжений металлов. Чем левее от водорода расположен элемент, тем более он активен. Металлы, стоящие справа от водорода, малоактивны и могут взаимодействовать только с концентрированными кислотами.

Рис. 2. Электрохимический ряд напряжений металлов.
К списку активных металлов в химии также относят алюминий, расположенный в III группе и стоящий левее водорода. Однако алюминий находится на границе активных и среднеактивных металлов и не реагирует с некоторыми веществами при обычных условиях.

При внесении уточнений и рассмотрения наиболее электрохимически активного элемента становится очевидно, что лидирующее положение в плане активности займет литий. Название данного элемента переводится как «камень» – связано это с тем, что он был обнаружен в петалите (минерал). Металл, обладающий серебристым цветом, тонет в воде, но уверенно держится на поверхности керосина. По электрохимической активности данный элемент превосходит все остальные щелочные элементы, вытесняя другие металлы при химических реакциях. Это главное свойство лития является определяющим для остальных его характеристик.

Свойства
Активные металлы отличаются мягкостью (можно разрезать ножом), лёгкостью, невысокой температурой плавления.
Основные химические свойства металлов представлены в таблице.
– 2K + 2HMnO4 → 2KMnO4 + H2
– 2Na + 2H2O → 2NaOH + H2; – 2NaOH + CuCl2 → Cu(OH)2↓ + 2NaCl
Активные металлы легко вступают в реакции, поэтому в природе находятся только в составе смесей – минералов, горных пород.

Рис. 3. Минералы и чистые металлы.
Цезий – самый активный и взрывной металл на планете
Цезий — мягкий щелочной металл серебристо-жёлтого цвета. Своё название цезий получил за наличие двух ярких синих линий в эмиссионном спектре. Открыт он был в 1860 году немецкими учёными Р. В. Бунзеном и Г. Р. Кирхгофом, которые проводили спектральный анализ вод минерального источника в Германии при помощи оптической спектроскопии. Это первый элемент, который был открыт таким методом. Кстати говоря, что бы получить 50 г искомого вещества, химики переработали 300 тонн минеральной воды.
В чистом виде цезий был получен в 1882 году шведским химиком К. Сеттербергом при электролизе расплава смеси цианида цезия и бария. Из-за низкой температуры плавления цезий уже при 24,5 градусах Цельсия находится в полужидком состоянии. Расплав представляет подвижную жидкость, хорошо отражающую свет. Само вещество – парамагнетик.
Цезий самый редкий и рассеянный в земной коре элемент. В природе встречается лишь один его изотоп – цезий 133. Он полностью устойчив и не подвержен радиоактивному распаду. Поэтому все радиоактивные изотопы металла получены искусственно.
Период его полураспада изотопа цезия-135 составляет 3 000 000 лет. А цезий- 137 за 33,5 года распадается только наполовину. Этот изотоп цезия признан одним из основных источников загрязнения биосферы.
Долгий период полураспада позволяет веществу проникать в воду, почву, растения и накапливаться в них.
Цезий самый активный металл в мире. Атом цезия взрывается на воздухе, в замерзшей воде, при контакте цезия с кислотами, простыми спиртами и т.д. Почему же так происходит? Элемент имеет сильный отрицательный электрохимический потенциал.
Его атом заряжен отрицательно и стремится притянуть к себе положительно заряженные частицы. А еще особую роль играет площадь поверхности цезия при реакциях с другими веществами.
Что мы узнали?
К активным металлам относятся элементы I и II групп – щелочные и щелочноземельные металлы, а также алюминий. Их активность обусловлена строением атома – немногочисленные электроны легко отделяются от внешнего энергетического уровня. Это мягкие лёгкие металлы, быстро вступающие в реакцию с простыми и сложными веществами, образуя оксиды, гидроксиды, соли. Алюминий находится ближе к водороду и для его реакции с веществами требуются дополнительные условия – высокие температуры, разрушение оксидной плёнки.
Какой металл является Щелочноземельным?
Щёлочноземе́льные мета́ллы — химические элементы 2-й группы периодической таблицы элементов: бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba), радий (Ra).
Как убрать ссылки на файлы в автокаде? Как убрать ссылки в Яндексе? Как убрать ссылку с картинки в ворде? Как убрать старые наклейки со шкафа? Как убрать старый известковый налет? Как убрать ставку ндс в 1с? Как убрать стену в контакте? Как убрать стим Гуард без телефона? Как убрать столбец1 в Excel? Как убрать страницу в клетку в ворде?
Получение в России
Как было указано, главным минералом, из которого получают цезий, является поллуцит. А также этот наиболее активный металл можно получить из редкого авогадрита. В промышленности используется именно поллуцит. Добыча его после распада Советского Союза в России не велась, несмотря на то что еще в те времена были обнаружены гигантские запасы цезия в Вороньей тундре под Мурманском.
К тому моменту, когда отечественная промышленность смогла позволить себе добычу цезия, лицензия на разработку этого месторождения была приобретена компанией из Канады. Сейчас извлечение цезия производит новосибирская .

Каким способом был открыт цезий?
Самый активный металл был первым химическим элементом, наличие которого в поверхности земной коры было обнаружено при помощи метода спектрального анализа. Когда ученые получили спектр металла, то в нем они увидели две линии небесно-голубого цвета. Таким образом и получил свое название этот элемент. Слово caesius в переводе с латинского языка значит «небесно-голубой».

Использование цезия
Этот металл используется для изготовления различных фотоэлементов. А также соединения цезия применяются в специальных отраслях оптики – в изготовлении инфракрасных приборов, биноклей ночного видения. Цезий используют в изготовлении прицелов, которые позволяют заметить технику и живую силу врага. Также его применяют для изготовления особых металлогалогенных ламп.
Но этим не исчерпывается круг его применения. На основе цезия был создан также ряд медицинских препаратов. Это лекарства для лечения дифтерии, язвенных болезней, шоков и шизофрении. Как и соли лития, соли цезия обладают нормотимическими свойствами – или, попросту, способны стабилизировать эмоциональный фон.

Что относится к металлам и Неметаллам?
Типичными металлами являются щелочные (литий, натрий, калий, рубидий, цезий) и щелочноземельные (кальций, стронций, барий, магний) металлы. … Неметаллы в обычных условиях находятся в твердом (фосфор, сера, селен, углерод и др.), жидком (бром) и газообразном (кислород, водород, азот и др.)
Кто поет песню и мое сердце остановилось? Кто поет песню я стала сильнее? Кто поет песню из фильма чародеи? Кто поет песню из кинофильма Москва слезам не верит? Кто поёт песню километры дорог где мы будем Чилить? Кто поет песню Лирика Сектор Газа девушка? Кто поет песню Мама я танцую под нашу босую? Кто поет песню Мауи на русском? Кто поет песню между нами тает лед? Кто поет песню моя моя неземная?
Литература
- Перельман Ф. М.. Рубидий и цезий.
М., Изд-во АН УССР, 1960. 140 стр. с илл. - Кульварская Б. С., Соболева Н. А., Татаринова Н. В. Изв. АН СССР. Сер. физич.; 1988. Т.52. № 8. С.1509-1512.
- Лидин Р.А. и др.
Химические свойства неорганических веществ. — 3-е изд., испр. — Москва: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0. - Плющев В. Е., Степин Б. Д. Химия и технология соединений лития, рубидия и цезия.
— М.-Л.: Химия, 1970.- 407 с - Солодов Н. А., Рубидий и цезий,
М., 1971; - Плющев В. Е., Степин Б. Д., Аналитическая химия рубидия и цезия,
М., 1975 - Коган Б. И., Названова В. А., Солодов Н. А., Рубидий и цезий
, М., 1971; - Моисеев А. А., Рамзаев П. В., Цезий-137 в биосфере
, М., 1975; - Редкол.: Зефиров Н. С. (гл. ред.).
Химическая энциклопедия: в 5 т. — Москва: Большая Российская энциклопедия, 1999. — Т. 5. — 783 с. — ISBN 5-85270-310-9. - Mattsson S., Radionuclides in lichen, reindeer and man
, Lund, 1972.
Почему водород не является металлом?
Водород – неметалл, имеет молекулярное строение. Молекула водорода состоит из двух атомов, связанных между собой ковалентной неполярной связью. Энергия связи в молекуле водорода составляет 436 кДж/моль, что объясняет низкую химическую активность молекулярного водорода. … В своих соединениях водород всегда одновалентен.
Как на самсунге сохранить контакты на сим карту? Как начисляются проценты на остаток денежных средств на банковской карте? Как найти карту клада в майнкрафте? Как найти особняк по карте в Майнкрафт? Как найти Сбербанк Онлайн реквизиты карты? Как найти Сириус на карте? Как найти старые карты гугл? Как найти свою карту Летуаль? Как настроить голос в Яндекс картах? Как настроить карту халва?
Добыча цезия из руды
Производство металла затруднено сложностью извлечения металла высокой очистки из руд.

Способы получения предполагают ректификацию, очистку от мехпримесей, удаление следов газов (O2, H2, N2), ступенчатая кристаллизация.
Интересно: цезий хранят в герметичных сосудах, заполненных инертным газом, жидкостью или в вакууме.
Активные металлы

Рис. 1. Активные металлы в таблице Менделеева.
- литий;
- натрий;
- калий;
- рубидий;
- цезий;
- франций.

Рис. 2. Электрохимический ряд напряжений металлов.
Реакция
Уравнение
Исключение
Щелочные металлы самовозгораются на воздухе, взаимодействуя с кислородом
Литий реагирует с кислородом только при высокой температуре
Щелочноземельные металлы и алюминий на воздухе образуют оксидные плёнки, а при нагревании самовозгораются
Реагируют с простыми веществами, образуя соли
Алюминий не вступает в реакцию с водородом
Бурно реагируют с водой, образуя щёлочи и водород
Реакция с литием протекает медленно. Алюминий реагирует с водой только после удаления оксидной плёнки
Реагируют с кислотами, образуя соли
Взаимодействуют с растворами солей, сначала реагируя с водой, а затем с солью

Рис. 3. Минералы и чистые металлы.



К списку активных металлов в химии также относят алюминий, расположенный в III группе и стоящий левее водорода. Однако алюминий находится на границе активных и среднеактивных металлов и не реагирует с некоторыми веществами при обычных условиях.




Рис. 3. Минералы и чистые металлы.




История открытия
Его открытие принадлежит немецким исследователям Р. Бунзену и Г. Кирхгофу. Уже тогда ученые интересовались, какие металлы активные, а какие – нет. В 1860 году исследователи изучали состав воды из Дюркгеймского водохранилища. Делали они это при помощи спектрального анализа. В образце воды ученые обнаружили такие элементы, как стронций, магний, литий, кальций.
Затем они решили проанализировать каплю воды при помощи спектроскопа. Тогда они и увидели две ярко-голубые линии, находящиеся недалеко друг от друга. Одна из них по своему положению практически совпадала с линией металла стронция. Ученые решили, что выявленное ими вещество является неизвестным и отнесли его к группе щелочных металлов.
В том же году Бунзен написал письмо своему коллеге-фотохимику Г. Роско, в котором рассказывал об этом открытии. А официально о цезии было сообщено 10 мая 1860 года на заседании ученых Берлинской академии. Через шесть месяцев Бунзен смог выделить около 50 граммов хлороплатинита цезия. Ученые переработали 300 тонн минеральной воды и выделили порядка 1 кг хлорида лития в качестве побочного продукта, чтобы в конечном счете получить самый активный металл. Это говорит о том, что цезия в минеральных водах содержится очень мало.

Сложность получения цезия постоянно толкает ученых на поиск содержащих его минералов, одним из которых является поллуцит. Но извлечение цезия из руд всегда оказывается неполным, в процессе эксплуатации цезий очень быстро рассеивается. Это делает его одним из самых труднодоступных веществ в металлургии. В земной коре, к примеру, содержится 3,7 граммов цезия на одну тонну. А в одном литре морской воды лишь 0,5 мкг вещества представляют собой самый активный металл. Это приводит к тому, что извлечение цезия является одним из самых трудоемких процессов.

Сравнение самых активных металлов
Унуненний – это пока еще не открытый металл. Он будет занимать первое место в восьмой строке периодической системы. Разработка и исследования этого элемента проводятся в России в Объединенном институте ядерных исследований. Этот металл должен будет обладать также очень высокой активностью. Если же сравнивать уже известные франций и цезий, то самым высоким потенциалом ионизации – 380 кДж/моль – будет обладать франций.
У цезия этот показатель составляет 375 кДж/моль. Но реагирует франций все же не так быстро, как цезий. Таким образом, цезий – самый активный металл. Это – ответ (химия чаще всего является тем предметом, в программе которого можно встретить подобный вопрос), который может быть полезным как на уроке в школе, так и в профессионально-техническом училище.
Тест по теме
Какой из металлов наиболее активный?
Чтобы попасть сюда — пройдите тест.

Применение
Общие химические свойства металлов используются для создания сплавов, моющих средств, применяются в каталитических реакциях. Металлы присутствуют в аккумуляторах, электронике, в несущих конструкциях.
Основные отрасли применения указаны в таблице.
| Отрасль | Производство | Металлы |
| Химическая промышленность | Катализаторы, соли, щёлочи | Pt, Fe, Ni, K |
| Пищевая промышленность | Поваренная соль (NaCl), сода (Na2CO3, NaHCO3) | Na, Ca, Ag |
| Металлургия | Сплавы, покрытия, детали разной формы, проволока, облицовка, строительные материалы и инструменты | Fe, Cr, Ni, W, Mo |
| Приборостроение | Микросхемы, фотоэлементы, датчики | Cs, Co, Ni, Cu |
| Ювелирная промышленность | Украшения | Au, Pt, Ag |
| Медицина | Протезы | Ti, Ni, Au |

Рис. 3. Висмут.
Металл франций
Еще одним из металлов с самыми интенсивными свойствами является франций. Он получил свое название в честь родины первооткрывательницы металла. М. Пере, родившаяся во Франции, открыла новый химический элемент в 1939 году. Он принадлежит к числу таких элементов, о которых даже сами исследователи-химики затрудняются делать какие-либо выводы.
Франций является самым тяжелым металлом. При этом и самый активный металл – это франций, наряду с цезием. Этим редким сочетанием – высокой химической активностью и низкой ядерной устойчивостью и обладает франций. У его самого долгоживущего изотопа период полураспада составляет всего лишь 22 минуты. Франций используется для обнаружения другого элемента – актиния. А также соли франция раньше предлагалось применять для обнаружения раковых опухолей. Однако из-за высокой стоимости эту соль невыгодно производить.

Читайте также:
