Какой элемент является самым активным металлом и почему
Обновлено: 17.05.2024

Металлы, легко вступающие в реакции, называются активными металлами. К ним относятся щелочные, щелочноземельные металлы и алюминий.
Положение в таблице Менделеева
Металлические свойства элементов ослабевают слева направо в периодической таблице Менделеева. Поэтому наиболее активными считаются элементы I и II групп.
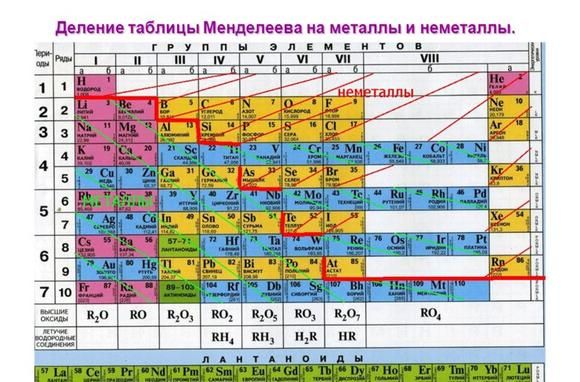
Рис. 1. Активные металлы в таблице Менделеева.
Все металлы являются восстановителями и легко расстаются с электронами на внешнем энергетическом уровне. У активных металлов всего один-два валентных электрона. При этом металлические свойства усиливаются сверху вниз с возрастанием количества энергетических уровней, т.к. чем дальше электрон находится от ядра атома, тем легче ему отделиться.
Наиболее активными считаются щелочные металлы:
- литий;
- натрий;
- калий;
- рубидий;
- цезий;
- франций.
К щелочноземельным металлам относятся:
- бериллий;
- магний;
- кальций;
- стронций;
- барий;
- радий.
Узнать степень активности металла можно по электрохимическому ряду напряжений металлов. Чем левее от водорода расположен элемент, тем более он активен. Металлы, стоящие справа от водорода, малоактивны и могут взаимодействовать только с концентрированными кислотами.

Рис. 2. Электрохимический ряд напряжений металлов.
К списку активных металлов в химии также относят алюминий, расположенный в III группе и стоящий левее водорода. Однако алюминий находится на границе активных и среднеактивных металлов и не реагирует с некоторыми веществами при обычных условиях.
Свойства
Активные металлы отличаются мягкостью (можно разрезать ножом), лёгкостью, невысокой температурой плавления.
Основные химические свойства металлов представлены в таблице.
Реакция
Уравнение
Исключение
Щелочные металлы самовозгораются на воздухе, взаимодействуя с кислородом
Литий реагирует с кислородом только при высокой температуре
Щелочноземельные металлы и алюминий на воздухе образуют оксидные плёнки, а при нагревании самовозгораются
Реагируют с простыми веществами, образуя соли
Алюминий не вступает в реакцию с водородом
Бурно реагируют с водой, образуя щёлочи и водород
Реакция с литием протекает медленно. Алюминий реагирует с водой только после удаления оксидной плёнки
Реагируют с кислотами, образуя соли
Взаимодействуют с растворами солей, сначала реагируя с водой, а затем с солью
Активные металлы легко вступают в реакции, поэтому в природе находятся только в составе смесей – минералов, горных пород.

Рис. 3. Минералы и чистые металлы.
Что мы узнали?
К активным металлам относятся элементы I и II групп – щелочные и щелочноземельные металлы, а также алюминий. Их активность обусловлена строением атома – немногочисленные электроны легко отделяются от внешнего энергетического уровня. Это мягкие лёгкие металлы, быстро вступающие в реакцию с простыми и сложными веществами, образуя оксиды, гидроксиды, соли. Алюминий находится ближе к водороду и для его реакции с веществами требуются дополнительные условия – высокие температуры, разрушение оксидной плёнки.
Ряд активности металлов

Химия
Что же из себя представляет ряд активности металлов давайте разбираться. Металлы — группа химических элементов, обладающих сходными свойствами. Среди них — электропроводность, пластичность, температурная зависимость сопротивления. По виду металлы можно отличить по характерному блеску, который так и назвали — металлический. Но химические свойства элементов отличаются в зависимости от строения их молекул и кристаллической решетки. Особенно ярко отличия проявляются по отношению взаимодействия с кислотами и щелочами. Всего на данный момент насчитывается 96 металлов. Общие свойства металлов показаны в таблице:
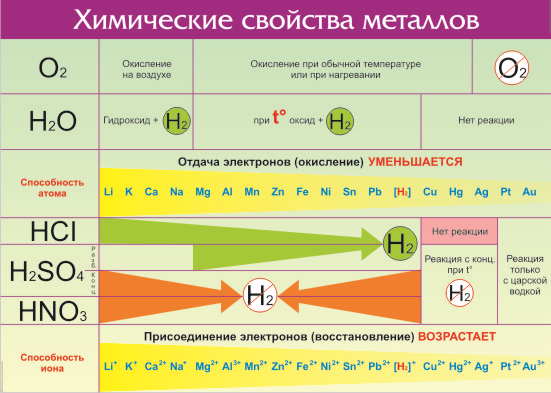
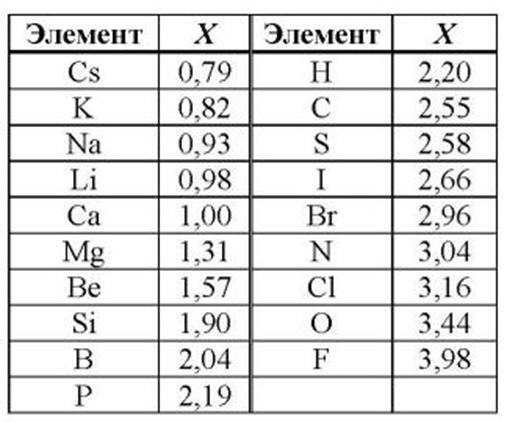
Все металлы в той или иной степени являются восстановителями, то есть, отдают электроны при течении окислительно-восстановительных реакций. Таблица электроотрицательности металлов показывает, какой металл является наиболее активным восстановителем. Если цифра напротив элемента больше 2, то это окислитель с характерными свойствами и выходит из ряда металлов, проявляя типичные свойства неметалла.
Электрохимический ряд активности металлов показывает, какие из металлов более активные, какие менее. Расположение элементов в горизонтальном ряду слева направо показывает направление снижения восстановительной способности и возрастание окислительной.
Восстановительная способность — свойство отдавать электроны в химических реакциях с водными растворами солей и щелочей.
Окислительная способность — свойство присоединять электроны в реакциях с теми же веществами.

Металлы в правой стороне более слабые восстановители, они вытесняются при реакциях с солевыми растворами металлами, расположенными левее. Пример реакции — Zn + Cu 2+ → Zn 2+ + Cu, которая протекает только в одном направлении. Цинк вытесняет медь, реагируя с водным раствором любой соли меди. Цинковая пластинка, при этом, растворяется, а медная восстанавливается.
Такую последовательность элементов еще называют ряд напряженности металлов, или ряд Бекетова. На всех вариантах записи ряда можно заметить, что последовательность металлов разделена знаком водорода (гидрогена), который металлом никак не является. Это своеобразный маркер, показывающий, что стоящие левее металлы вытесняют водород из водных растворов кислот, не обладающих окислительными свойствами. Некоторые металлы, например, литий, кальций, барий и остальные, стоящи до алюминия, вытесняют водород и при реакции с водой.
2Al +3H2SO4 = Al2(SO4)3 + 3H2↑
Fe + 2HCl = FeCl2 + H2↑
Стоящие правее знака водорода металлы с кислотами-неокислителями не взаимодействуют при нормальных условиях.
Шкала активности металлов широко используется для практических целей, например, в гальванике. Если электроды сделаны из разных металлов, то разрушаться будет тот, который стоит левее. Чем больше промежуток между металлами в ряду, тем активнее проходит процесс коррозии.
Например, метод оцинковки позволяет защитить железо именно потому, что цинк находится левее железа в ряду активности. Пока он не разрушится, то ржавчина на железе не появится. При электролизе, расположенные за водородом металлы осаживаются на катоде, а самые активные, занимающее места до алюминия, выделить из солевых растворов в не получится при нормальных температуре и давлении.
Малоактивные металлы, так называемые переходные элементы с электроотрицательностью в пределах 1,5 – 2. Это:
- Ртуть;
- Олово;
- Серебро;
- Никель;
- Рений;
- Медь;
- Марганец и еще несколько элементов.
К металлам средней активности относятся элементы с числом электроотрицательности от 1 до 1,5. В эту группу входят такие известные элементы, как магний, плутоний, неодим, кальций. Остальные элементы обладают высокой химической активностью. Лидирует в этом списке Франций, который практически не встречается в чистом виде. Из более известных можно назвать калий и натрий, которые приходится хранить в керосине, чтобы они не взаимодействовали с водой и воздухом. Если извлечь их из керосина, то металлы практически мгновенно сгорают.
Реакции кальция и натрия с водой при комнатной температуре выглядят так:
2Na + 2H2O = 2NaOH + H2↑
Сa + 2H2O = Сa(OH)2 + H2↑Стоящие в ряду электронапряжения металлов правее элементы тоже взаимодействуют с водой, но реакция протекает при более высокой температуре с образованием оксида и водорода.
3Fe + 4H2O = Fe3O4 + 4H2↑
Если вступает в реакцию металл и неметалл, то электрический ряд напряжений металлов тоже дает возможность заранее узнать, в каком направлении будет протекать реакция. Скорость реакции зависит как от восстановительной активности металла, так и от окислительных свойств неметалла. Стоящие до водорода металлы реагируют с кислородом уже при комнатной температуре, некоторые — достаточно бурно, например, литий и кальций.
4Li + O2 = 2Li2O
2Ca + O2 = 2CaO.
При таком взаимодействии образуются оксиды. Менее активные металлы, например железо, реагируют с кислородом спокойнее, а некоторые, например, золото и серебро, платина не окисляются вовсе, благодаря чему получили определение благородных.
С хлором реагируют практически все активные металлы с выделением теплоты.
2Fe + 3Cl2 = 2FeCl3
Также выделяется теплота при реакции активных металлов с серой, но начинается она при нагревании. После начала реакции нагрев не нужен — образовавшегося тепла достаточно для поддержания реакции.
2Al + 3S = Al2S3
Внимательно изучив ряд металлов, несложно определить тип реакции при контакте с другими элементами в зависимости от места в последовательности. Также легко назвать основные характеристики металла, как химического элемента, и возможность его использования на практике.
Самый активный металл - это какой?
Когда люди слышат слово «металл», то обычно оно ассоциируется с холодным и твердым веществом, проводящим электрический ток. Однако металлы и их сплавы могут очень сильно отличаться между собой. Есть те, которые относятся к группе тяжелых, эти вещества имеют самую высокую плотность. А некоторые, к примеру, литий, настолько легки, что могли бы плавать в воде, если бы только не вступали с ней в активную реакцию.

Какие металлы активны наиболее всего?
Но какой металл проявляет наиболее интенсивные свойства? Самый активный металл – это цезий. По активности среди всех металлов он занимает первое место. Также его «собратьями» считаются франций, находящийся на втором месте, и унуненний. Но о свойствах последнего ученым пока известно мало.
Свойства цезия
Цезий – это элемент, который, подобно металлу галлию, легко расплавить в руках. Сделать это, правда, можно лишь при одном условии: если цезий находится в стеклянной ампуле. В противном случае металл может быстро вступить в реакцию с окружающим воздухом – воспламенится. А взаимодействие цезия с водой сопровождается взрывом – таков в своем проявлении самый активный металл. Это ответ на вопрос о том, почему так сложно помещать в контейнеры цезий.
Для того чтобы его поместить внутрь пробирки, необходимо, чтобы она была изготовлена из специального стекла и наполнена аргоном или водородом. Температура плавления цезия составляет 28,7 о С. При комнатной температуре металл находится в полужидком состоянии. Цезий представляет собой вещество золотисто-белого цвета. В жидком состоянии металл хорошо отражает свет. Пары цезия имеют зеленовато-синий оттенок.
Каким способом был открыт цезий?
Самый активный металл был первым химическим элементом, наличие которого в поверхности земной коры было обнаружено при помощи метода спектрального анализа. Когда ученые получили спектр металла, то в нем они увидели две линии небесно-голубого цвета. Таким образом и получил свое название этот элемент. Слово caesius в переводе с латинского языка значит «небесно-голубой».

История открытия
Его открытие принадлежит немецким исследователям Р. Бунзену и Г. Кирхгофу. Уже тогда ученые интересовались, какие металлы активные, а какие – нет. В 1860 году исследователи изучали состав воды из Дюркгеймского водохранилища. Делали они это при помощи спектрального анализа. В образце воды ученые обнаружили такие элементы, как стронций, магний, литий, кальций.
Затем они решили проанализировать каплю воды при помощи спектроскопа. Тогда они и увидели две ярко-голубые линии, находящиеся недалеко друг от друга. Одна из них по своему положению практически совпадала с линией металла стронция. Ученые решили, что выявленное ими вещество является неизвестным и отнесли его к группе щелочных металлов.
В том же году Бунзен написал письмо своему коллеге-фотохимику Г. Роско, в котором рассказывал об этом открытии. А официально о цезии было сообщено 10 мая 1860 года на заседании ученых Берлинской академии. Через шесть месяцев Бунзен смог выделить около 50 граммов хлороплатинита цезия. Ученые переработали 300 тонн минеральной воды и выделили порядка 1 кг хлорида лития в качестве побочного продукта, чтобы в конечном счете получить самый активный металл. Это говорит о том, что цезия в минеральных водах содержится очень мало.

Сложность получения цезия постоянно толкает ученых на поиск содержащих его минералов, одним из которых является поллуцит. Но извлечение цезия из руд всегда оказывается неполным, в процессе эксплуатации цезий очень быстро рассеивается. Это делает его одним из самых труднодоступных веществ в металлургии. В земной коре, к примеру, содержится 3,7 граммов цезия на одну тонну. А в одном литре морской воды лишь 0,5 мкг вещества представляют собой самый активный металл. Это приводит к тому, что извлечение цезия является одним из самых трудоемких процессов.
Получение в России
Как было указано, главным минералом, из которого получают цезий, является поллуцит. А также этот наиболее активный металл можно получить из редкого авогадрита. В промышленности используется именно поллуцит. Добыча его после распада Советского Союза в России не велась, несмотря на то что еще в те времена были обнаружены гигантские запасы цезия в Вороньей тундре под Мурманском.
К тому моменту, когда отечественная промышленность смогла позволить себе добычу цезия, лицензия на разработку этого месторождения была приобретена компанией из Канады. Сейчас извлечение цезия производит новосибирская компания ЗАО «Завод редких металлов».

Использование цезия
Этот металл используется для изготовления различных фотоэлементов. А также соединения цезия применяются в специальных отраслях оптики – в изготовлении инфракрасных приборов, биноклей ночного видения. Цезий используют в изготовлении прицелов, которые позволяют заметить технику и живую силу врага. Также его применяют для изготовления особых металлогалогенных ламп.
Но этим не исчерпывается круг его применения. На основе цезия был создан также ряд медицинских препаратов. Это лекарства для лечения дифтерии, язвенных болезней, шоков и шизофрении. Как и соли лития, соли цезия обладают нормотимическими свойствами – или, попросту, способны стабилизировать эмоциональный фон.

Металл франций
Еще одним из металлов с самыми интенсивными свойствами является франций. Он получил свое название в честь родины первооткрывательницы металла. М. Пере, родившаяся во Франции, открыла новый химический элемент в 1939 году. Он принадлежит к числу таких элементов, о которых даже сами исследователи-химики затрудняются делать какие-либо выводы.
Франций является самым тяжелым металлом. При этом и самый активный металл – это франций, наряду с цезием. Этим редким сочетанием – высокой химической активностью и низкой ядерной устойчивостью и обладает франций. У его самого долгоживущего изотопа период полураспада составляет всего лишь 22 минуты. Франций используется для обнаружения другого элемента – актиния. А также соли франция раньше предлагалось применять для обнаружения раковых опухолей. Однако из-за высокой стоимости эту соль невыгодно производить.

Сравнение самых активных металлов
Унуненний – это пока еще не открытый металл. Он будет занимать первое место в восьмой строке периодической системы. Разработка и исследования этого элемента проводятся в России в Объединенном институте ядерных исследований. Этот металл должен будет обладать также очень высокой активностью. Если же сравнивать уже известные франций и цезий, то самым высоким потенциалом ионизации – 380 кДж/моль – будет обладать франций.
У цезия этот показатель составляет 375 кДж/моль. Но реагирует франций все же не так быстро, как цезий. Таким образом, цезий – самый активный металл. Это – ответ (химия чаще всего является тем предметом, в программе которого можно встретить подобный вопрос), который может быть полезным как на уроке в школе, так и в профессионально-техническом училище.
Радиоактивный металл и его свойства. Какой самый радиоактивный металл
Среди всех элементов периодической системы значительная часть принадлежит таким, о которых большинство людей говорят со страхом. А как же иначе? Ведь они являются радиоактивными, а это означает прямую угрозу здоровью людей.
Попробуем разобраться, какие же именно элементы являются опасными, и что они собой представляют, а также выясним, в чем заключается их вредоносное действие на организм человека.

Общее понятие о группе радиоактивных элементов
В данную группу входят металлы. Их достаточно много, располагаются они в периодической системе сразу после свинца и до самой последней ячейки. Главный критерий, по которому принято относить тот или иной элемент к группе радиоактивных, - это его способность обладать определенным периодом полураспада.
Другими словами, радиоактивный распад - это преобразование ядра металла в другое, дочернее, которое сопровождается испусканием излучения определенного вида. При этом происходят превращения одних элементов в другие.
Радиоактивный металл - это тот, у которого хотя бы один изотоп является таковым. Даже если всего разновидностей будет шесть, и при этом лишь одна из них будет носителем данного свойства, весь элемент станет считаться радиоактивным.
Виды излучений
Основными вариантами излучения, которое испускается металлами при распадах, являются:
- альфа-частицы;
- бета-частицы или нейтринный распад;
- изомерный переход (гамма-лучи).
Есть два варианта существования подобных элементов. Первый - это естественный, то есть когда радиоактивный металл встречается в природе и самым простым путем под влиянием внешних сил с течением времени преобразуется в иные формы (проявляет свою радиоактивность и распадается).

Вторая группа - это искусственно созданные учеными металлы, способные к быстрому распаду и мощному выделению большого количества радиационного излучения. Делается это для использования в определенных сферах деятельности. Установки, в которых производятся ядерные реакции по превращениям одних элементов в другие, называются синхрофазотронами.
Разница между двумя обозначенными способами полураспада очевидна: в обоих случаях он самопроизвольный, однако лишь искусственно полученные металлы дают именно ядерные реакции в процессе деструктуризации.
Основы обозначения подобных атомов
Так как у большей части элементов лишь один или два изотопа являются радиоактивными, принято указывать конкретный вид при обозначениях, а не весь элемент в целом. Например, свинец - это просто вещество. Если же принимать во внимание, что он - радиоактивный металл, то следует называть его, например, "свинец-207".
Периоды полураспада рассматриваемых частиц могут сильно варьироваться. Есть изотопы, которые существуют лишь 0,032 секунды. Но наравне с ними встречаются и те, что распадаются миллионы лет в земных недрах.
Радиоактивные металлы: список
Полный перечень всех принадлежащих к рассматриваемой группе элементов может быть достаточно внушительным, ведь всего к ней относятся около 80 металлов. В первую очередь это все, стоящие в периодической системе после свинца, включая группу лантаноидов и актиноидов. То есть висмут, полоний, астат, радон, франций, радий, резерфордий и так далее по порядковым номерам.

Выше обозначенной границы располагается множество представителей, каждый из которых также имеет изотопы. При этом некоторые из них могут быть как раз радиоактивными. Поэтому важно, какие разновидности имеет химический элемент. Радиоактивный металл, точнее одна из его изотопных разновидностей, есть практически у каждого представителя таблицы. Например, их имеют:
- кальций;
- селен;
- гафний;
- вольфрам;
- осмий;
- висмут;
- индий;
- калий;
- рубидий;
- цирконий;
- европий;
- радий и другие.
Таким образом, очевидно, что элементов, проявляющих свойства радиоактивности, очень много - подавляющее большинство. Часть из них безопасна из-за слишком длинного периода полураспада и содержится в природе, другая же создана искусственно человеком для различных нужд в науке и технике и является крайне опасной для организма людей.
Характеристика радия
Название элементу дано его первооткрывателями - супругами Кюри, Пьером и Марией. Именно эти люди впервые обнаружили, что один из изотопов этого металла - радий-226 - это наиболее устойчивая форма, обладающая особыми свойствами радиоактивности. Это произошло в 1898 году, и о подобном явлении только стало известно. Подробным его изучением как раз и занялись супруги химики.
Этимология слова берет корни из французского языка, на котором оно звучит как radium. Всего известно 14 изотопных модификаций данного элемента. Но наиболее устойчивые формы с массовыми числами:
Ярко выраженной радиоактивностью обладает форма 226. Сам по себе радий - химический элемент под номером 88. Атомная масса [226]. Как простое вещество способен к существованию. Представляет собой серебристо-белый радиоактивный металл с температурой плавления около 670 0 С.

С химической точки зрения проявляет достаточно высокую степень активности и способен реагировать с:
- водой;
- органическими кислотами, формируя устойчивые комплексы;
- кислородом, образуя оксид.
Свойства и применение
Также радий - химический элемент, который формирует ряд солей. Известны его нитриды, хлориды, сульфаты, нитраты, карбонаты, фосфаты, хроматы. Также есть двойные соли с вольфрамом и бериллием.
То, что радий-226 может быть опасен для здоровья, его первооткрыватель Пьер Кюри узнал не сразу. Однако сумел убедиться в этом, когда провел эксперимент: сутки он ходил с привязанной к плечевой части руки пробиркой с металлом. На месте контакта с кожей появилась незаживающая язва, избавиться от которой ученый не мог больше двух месяцев. От своих экспериментов над явлением радиоактивности супруги не отказались, поэтому и умерли оба от большой дозы облучения.
Помимо отрицательного значения, существует и ряд областей, в которых радий-226 находит применение и приносит пользу:
Плутоний и его изотопы
Данный элемент был открыт в сороковых годах XX века американскими учеными. Впервые его выделили из урановой руды, в которой он сформировался из нептуния. Последний при этом - результат распада уранового ядра. То есть все они между собой тесно взаимосвязаны общими радиоактивными превращениями.

Существует несколько устойчивых изотопов данного металла. Однако наиболее распространенной и важной практически разновидностью является плутоний-239. Известны химические реакции данного металла с:
- кислородом,
- кислотами;
- водой;
- щелочами;
- галогенами.
По своим физическим свойствам плутоний-239 является хрупким металлом с температурой плавления 640 0 С. Основные способы воздействия на организм - это постепенное формирование онкологических заболеваний, накапливание в костях и вызывание их разрушения, заболевания легких.
Область использования - в основном ядерная промышленность. Известно, что при распаде одного грамма плутония-239 выделяется такое количество теплоты, которое сравнимо с 4-мя тоннами сгоревшего угля. Именно поэтому этот вид металла находит такое широкое применение в реакциях. Ядерный плутоний - источник энергии в атомных реакторах и термоядерных бомбах. Он же используется при изготовлении электрических аккумуляторов энергии, срок службы которых может достигать пяти лет.
Уран - источник радиации
Данный элемент был открыт в 1789 году химиком из Германии Клапротом. Однако исследовать его свойства и научиться применять их на практике люди сумели лишь в XX веке. Основная отличительная особенность в том, что радиоактивный уран способен при естественном распаде образовывать ядра:
- свинца-206;
- криптона;
- плутония-239;
- свинца-207;
- ксенона.
В природе этот металл светло-серого цвета, обладает температурой плавления свыше 1100 0 С. Встречается в составе минералов:
- Урановые слюдки.
- Уранинит.
- Настуран.
- Отенит.
- Тюянмунит.
Известны три стабильных природных изотопа и 11 искусственно синтезированных, с массовыми числами от 227 до 240.

В промышленности широко используется радиоактивный уран, способный быстро распадаться с высвобождением энергии. Так, его используют:
- в геохимии;
- горном деле;
- ядерных реакторах;
- при изготовлении ядерного оружия.
Влияние на организм человека ничем не отличается от предыдущих рассмотренных металлов - накопление приводит к повышенной дозе облучения и возникновению раковых опухолей.
Трансурановые элементы
Самыми главными из металлов, стоящих вслед за ураном в периодической системе, являются те, что были открыты совсем недавно. Буквально в 2004 году в свет вышли источники, подтверждающие рождение на свет 115 элемента периодической системы.
Им стал самый радиоактивный металл из всех известных на сегодняшний день - унунпентий (Uup). Его свойства остаются не изученными до сих пор, ведь период полураспада составляет 0,032 секунды! Рассмотреть и выявить подробности строения и проявляемые особенности при таких условиях просто невозможно.
Однако его радиоактивность во много раз превосходит показатели второго по данному свойству элемента - плутония. Тем не менее используется на практике не унунпентий, а более "медленные" его товарищи по таблице - уран, плутоний, нептуний, полоний и прочие.
Еще один элемент - унбибий - теоретически существует, однако доказать это практически ученые разных стран не могут с 1974 года. Последняя попытка была совершена в 2005 году, однако оказалась не подтвержденной общим советом ученых-химиков.
Торий
Был открыт еще в XIX веке Берцелиусом и назван в честь скандинавского бога Тора. Является слаборадиоактивным металлом. Такой особенностью обладают пять из его 11-ти изотопов.
Основное применение в ядерной энергетике основано не на способности испускать огромное количество тепловой энергии при распаде. Особенность в том, что ядра тория способны захватывать нейтроны и превращаться в уран-238 и плутоний-239, которые уже и вступают непосредственно в ядерные реакции. Поэтому и торий можно отнести к группе рассматриваемых нами металлов.

Полоний
Серебристо-белый радиоактивный металл под номером 84 в периодической системе. Открыт был все теми же ярыми исследователями радиоактивности и всего, что с ней связано, супругами Марией и Пьером Кюри в 1898 году. Главная особенность этого вещества в том, что оно свободно существует около 138,5 дней. То есть таков период полураспада данного металла.
В природе встречается в составе урановых и других руд. Используется как источник энергии, причем достаточно мощной. Является стратегическим металлом, так как применяется для изготовления ядерного оружия. Количество строго ограничено и находится под контролем каждого государства.
Также используется для ионизации воздуха, устранения статического электричества в помещении, при изготовлении космических обогревателей и прочих схожих предметов.
Воздействие на организм человека
Все радиоактивные металлы обладают способностью проникать сквозь кожу человека и накапливаться внутри организма. Они очень плохо выводятся с продуктами жизнедеятельности, вообще не выводятся с потом.
Со временем начинают поражать дыхательную, кровеносную, нервную системы, вызывая в них необратимые изменения. Воздействуют на клетки, заставляя их функционировать неправильно. В результате происходит образование злокачественных опухолей, возникают онкологические заболевания.
Поэтому каждый радиоактивный металл - большая опасность для человека, особенно если говорить о них в чистом виде. Нельзя трогать их незащищенными руками и находиться в помещении вместе с ними без специальных защитных приспособлений.
Электрохимический ряд напряжений металлов (ряд Бекетова)


Рис. 1. Активные металлы в таблице Менделеева.

Рис. 2. Электрохимический ряд напряжений металлов.
Литий

При внесении уточнений и рассмотрения наиболее электрохимически активного элемента становится очевидно, что лидирующее положение в плане активности займет литий. Название данного элемента переводится как «камень» – связано это с тем, что он был обнаружен в петалите (минерал). Металл, обладающий серебристым цветом, тонет в воде, но уверенно держится на поверхности керосина. По электрохимической активности данный элемент превосходит все остальные щелочные элементы, вытесняя другие металлы при химических реакциях. Это главное свойство лития является определяющим для остальных его характеристик.

– 2K + 2HMnO4 → 2KMnO4 + H2
– 2Na + 2H2O → 2NaOH + H2; – 2NaOH + CuCl2 → Cu(OH)2↓ + 2NaCl

Рис. 3. Минералы и чистые металлы.
Цезий – самый активный и взрывной металл на планете
Цезий — мягкий щелочной металл серебристо-жёлтого цвета. Своё название цезий получил за наличие двух ярких синих линий в эмиссионном спектре. Открыт он был в 1860 году немецкими учёными Р. В. Бунзеном и Г. Р. Кирхгофом, которые проводили спектральный анализ вод минерального источника в Германии при помощи оптической спектроскопии. Это первый элемент, который был открыт таким методом. Кстати говоря, что бы получить 50 г искомого вещества, химики переработали 300 тонн минеральной воды.
В чистом виде цезий был получен в 1882 году шведским химиком К. Сеттербергом при электролизе расплава смеси цианида цезия и бария. Из-за низкой температуры плавления цезий уже при 24,5 градусах Цельсия находится в полужидком состоянии. Расплав представляет подвижную жидкость, хорошо отражающую свет. Само вещество – парамагнетик.
Цезий самый редкий и рассеянный в земной коре элемент. В природе встречается лишь один его изотоп – цезий 133. Он полностью устойчив и не подвержен радиоактивному распаду. Поэтому все радиоактивные изотопы металла получены искусственно.
Период его полураспада изотопа цезия-135 составляет 3 000 000 лет. А цезий- 137 за 33,5 года распадается только наполовину. Этот изотоп цезия признан одним из основных источников загрязнения биосферы.
Долгий период полураспада позволяет веществу проникать в воду, почву, растения и накапливаться в них.
Цезий самый активный металл в мире. Атом цезия взрывается на воздухе, в замерзшей воде, при контакте цезия с кислотами, простыми спиртами и т.д. Почему же так происходит? Элемент имеет сильный отрицательный электрохимический потенциал.
Его атом заряжен отрицательно и стремится притянуть к себе положительно заряженные частицы. А еще особую роль играет площадь поверхности цезия при реакциях с другими веществами.
Какой металл является Щелочноземельным?
Щёлочноземе́льные мета́ллы — химические элементы 2-й группы периодической таблицы элементов: бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba), радий (Ra).
Как убрать ссылки на файлы в автокаде? Как убрать ссылки в Яндексе? Как убрать ссылку с картинки в ворде? Как убрать старые наклейки со шкафа? Как убрать старый известковый налет? Как убрать ставку ндс в 1с? Как убрать стену в контакте? Как убрать стим Гуард без телефона? Как убрать столбец1 в Excel? Как убрать страницу в клетку в ворде?
К тому моменту, когда отечественная промышленность смогла позволить себе добычу цезия, лицензия на разработку этого месторождения была приобретена компанией из Канады. Сейчас извлечение цезия производит новосибирская .



Что относится к металлам и Неметаллам?
Типичными металлами являются щелочные (литий, натрий, калий, рубидий, цезий) и щелочноземельные (кальций, стронций, барий, магний) металлы. … Неметаллы в обычных условиях находятся в твердом (фосфор, сера, селен, углерод и др.), жидком (бром) и газообразном (кислород, водород, азот и др.)
Кто поет песню и мое сердце остановилось? Кто поет песню я стала сильнее? Кто поет песню из фильма чародеи? Кто поет песню из кинофильма Москва слезам не верит? Кто поёт песню километры дорог где мы будем Чилить? Кто поет песню Лирика Сектор Газа девушка? Кто поет песню Мама я танцую под нашу босую? Кто поет песню Мауи на русском? Кто поет песню между нами тает лед? Кто поет песню моя моя неземная?
Литература
- Перельман Ф. М.. Рубидий и цезий.
М., Изд-во АН УССР, 1960. 140 стр. с илл. - Кульварская Б. С., Соболева Н. А., Татаринова Н. В. Изв. АН СССР. Сер. физич.; 1988. Т.52. № 8. С.1509-1512.
- Лидин Р.А. и др.
Химические свойства неорганических веществ. — 3-е изд., испр. — Москва: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0. - Плющев В. Е., Степин Б. Д. Химия и технология соединений лития, рубидия и цезия.
— М.-Л.: Химия, 1970.- 407 с - Солодов Н. А., Рубидий и цезий,
М., 1971; - Плющев В. Е., Степин Б. Д., Аналитическая химия рубидия и цезия,
М., 1975 - Коган Б. И., Названова В. А., Солодов Н. А., Рубидий и цезий
, М., 1971; - Моисеев А. А., Рамзаев П. В., Цезий-137 в биосфере
, М., 1975; - Редкол.: Зефиров Н. С. (гл. ред.).
Химическая энциклопедия: в 5 т. — Москва: Большая Российская энциклопедия, 1999. — Т. 5. — 783 с. — ISBN 5-85270-310-9. - Mattsson S., Radionuclides in lichen, reindeer and man
, Lund, 1972.
Почему водород не является металлом?
Водород – неметалл, имеет молекулярное строение. Молекула водорода состоит из двух атомов, связанных между собой ковалентной неполярной связью. Энергия связи в молекуле водорода составляет 436 кДж/моль, что объясняет низкую химическую активность молекулярного водорода. … В своих соединениях водород всегда одновалентен.
Как на самсунге сохранить контакты на сим карту? Как начисляются проценты на остаток денежных средств на банковской карте? Как найти карту клада в майнкрафте? Как найти особняк по карте в Майнкрафт? Как найти Сбербанк Онлайн реквизиты карты? Как найти Сириус на карте? Как найти старые карты гугл? Как найти свою карту Летуаль? Как настроить голос в Яндекс картах? Как настроить карту халва?
Добыча цезия из руды
Производство металла затруднено сложностью извлечения металла высокой очистки из руд.

Способы получения предполагают ректификацию, очистку от мехпримесей, удаление следов газов (O2, H2, N2), ступенчатая кристаллизация.
Интересно: цезий хранят в герметичных сосудах, заполненных инертным газом, жидкостью или в вакууме.
Читайте также:
