Какой из элементов 4 периода обладает наиболее выраженными металлическими свойствами
Обновлено: 21.09.2024
Задание 47.
Какой из элементов четвертого периода - ванадий или мышьяк - обладает более выраженными металлическими свойствами? Какой из этих элементов образует газообразное соединение с водородом? Ответ мотивируйте, исходя из строения атомов данных элементов?
Решение:
+23V 1s 2 2s 2 2p 6 3s 2 3p 6 3d 3 4s 2 ; +33Аs 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 3 .
Ванадий d-элемент VВ- группы, а мышьяк – р-элемент VА- группы. На внешнем энергетическом уровне у атома ванадия два электрона, а у атома мышьяка – пять. Атомы типичных металлов характеризуются наличием небольшого числа электронов на внешнем энергетическом уровне, и, следовательно, тенденцией терять эти электроны. Эти атомы обладают только восстановительными свойствами и не образуют элементарных отрицательных ионов. Элементы, атомы которых на внешнем энергетическом уровне содержат более трёх электронов, обладают определённым сродством к электрону, и, следовательно, приобретают определённую отрицательную степень окисления и даже образуют элементарные отрицательные ионы. Таким образом, ванадий, как и все металлы, обладает только восстановительными свойствами, тогда как для мышьяка, проявляющего слабые восстановительные свойства, более свойственны окислительные функции. Общей закономерностью для всех групп, содержащих р- и d-элементы, является преобладание металлических свойств у d-элементов. Следовательно, металлические свойства у ванадия сильнее выражены, чем у мышьяка.
Мышьяк с водородом образует газообразный гидрид AsH3 – арсин, где мышьяк проявляет отрицательную степень окисления -3, так как атом мышьяка способен присоединять три электрона до полного заполнения внешнего энергетического уровня:
MnO – оксид марганца (II);
Mn2O3 - оксид марганца(III);
MnO2 - оксид марганца(IV);
MnO3 - ; оксид марганца(VI);
Mn2O7 - оксид марганца(VII).
Формулы гидроксидов марганца:
Mn(OH)2 – гидроксид марганца(II);
Mn(OH)3 – гидроксид марганца(III);
Mn(OH)4 – гидроксид марганца(IV);
H2MnO4 – марганцовистая кислота;
HMnO4 – марганцовая кислота.
Mn(OH)4 – гидроксид марганца(IV) – амфотерное основание, которое реагирует как с кислотами, так и со щелочами:
Задание 49.
У какого элемента четвертого периода - хрома или селена - сильнее выражены металлические свойства? Какой из этих элементов образует газообразное соединение с водородом? Ответ мотивируйте строением атомов хрома и селена.
Решение:
Электронные формулы хрома и селена:
+24Cr 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 1 ; +34Se 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 4 .
Хром d-элемент VIВ- группы, а селен – р-элемент VIА – группы. На внешнем энергетическом уровне у атома хрома один электрон, а у атома селена – шесть. Атомы типичных металлов характеризуются наличием небольшого числа электронов на внешнем энергетическом уровне, и, следовательно, тенденцией терять их. Они обладают только восстановительными свойствами и не образуют элементарных отрицательных ионов. Элементы, атомы которых на внешнем энергетическом уровне содержат более трёх электронов, обладают определённым сродством к электрону, и, следовательно, приобретают определённую отрицательную степень окисления и даже образуют элементарные отрицательные ионы. Таким образом, хром, как и все металлы, обладает только восстановительными свойствами, тогда как для селена, проявляющего слабые восстановительные свойства, более свойственны окислительные функции. Общей закономерностью для всех групп, содержащих р- и d-элементы, является преобладание металлических свойств у d-элементов. Следовательно, металлические свойства у хрома сильнее выражены, чем у селена. К тому же селен, присоединив два электрона к наружному р-подуровню, проявляет отрицательную степень окисления и образует с водородом газообразное соединение H2Se, которое называют селеноводород.
Задание 50.
Какую низшую степень окисления проявляют хлор, сера, азот и углерод? Почему? Составьте формулы соединений алюминия с данными элементами в этой степени окисления. Как называются соответствующие соединения?
Решение:
Низшая степень окисления определяется тем условным зарядом, который приобретает атом при присоединении того числа электронов, которое необходимо для образования устойчивой восьмиэлектронной оболочки (ns 2 p 6 ). Элементы хлор, сера, азот и углерод находятся соответственно в VIIА-, VIА-, VА-, IVА- группах и имеют структуру внешнего энергетического уровня s 2 p 5 , s 2 p 4 , s 2 p 3 , s2p 2 . Следовательно, низшая степень окисления хлора, серы, азота и углерода равны соответственно -1, -2, -3 и -4.
Формулы соединений алюминия с данными элементами в этой степени окисления:
AlCl3 – хлорид алюминия;
Al2S3 – сульфид алюминия;
AlN – нитрид алюминия;
Al4C3 – карбид алюминия.
Задание 51.
У какого из р-элементов пятой группы периодической системы - фосфора или сурьмы - сильнее выражены неметаллические свойства? Какое из водородных соединений данных элементов более сильный восстановитель? Ответ мотивируйте строением атома этих элементов.
Решение:
Фосфор и сурьма находятся в VА- группе и имеют следующие электронные формулы:
+15Р 1s 2 2s 2 2p 6 3s 2 3p 3 ; +51Sb 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 5p 3
На внешнем энергетическом уровне оба элемента содержат по пять валентных электронов, из которых два s-и три р-электрона.
Так как фосфор – элемент третьего периода, а сурьма – пятого, то из этого следует, что радиус атома фосфора значительно меньше, чем у атома сурьмы. В группах с увеличением порядкового номера элементов закономерно увеличиваются радиусы их атомов, что приводит к уменьшению связи внешних электронов; поэтому атом фосфора обладает определённым сродством к электрону, и, следовательно, приобретает отрицательную степень окисления и имеет больше шансов образовывать отрицательные ионы. Таким образом, фосфор, как все неметаллы, обладает только очень слабыми восстановительными свойствами и более сильными окислительными функциями. Сурьма, имея большие размеры атома, будет легче отдавать электроны внешнего энергетического уровня, чем принимать и поэтому будет проявлять восстановительные функции, т. е. обладать характерными металлическими свойствами.
Водородное соединение сурьмы (SbH3 - стибин) обладает более сильными восстанови-тельными свойствами, чем водородное соединение фосфора (РН3 - фосфин). Это объясняется тем, что в группах с ростом порядкового номера элемента закономерно возрастают радиусы атомов элементов и, соответственно ионные радиусы. Ион Sb 3- имеет больший диаметр, чем ион Р 3- , поэтому иону сурьмы значительно легче отдать электроны (из-за большего радиуса иона требуется меньше энергии на отрыв электрона).
Задание 52.
Исходя из положения металла в периодической системе, дайте мотивированный ответ на вопрос: какой из двух гидроксидов более сильное основание: Ва(ОН)2 или Мg(OH)2; Ca(OH)2 или Fе(ОН)2; Сd(ОН)2 или Sr(OH)2.
Решение:
Гидроксиды можно изобразить общей формулой ЭОН, где Э – металл. Гидроксиды могут диссоциировать по схеме:
Диссоциация зависит от прочности и полярности связей Э — О и О — Н и может протекать по двум направлениям:
Прочность связей определяется разностью электроотрицательностей компонентов, размерами и эффективными зарядами ионов. Если прочность связей Э — О и О — Н близки или равны , то диссоциация гидроксида может одновременно протекать и по основному (I), и по кислотному типу (II). В этом случае речь идёт об амфотерных электролитах (амфолитах):
где Э – элемент (металл или неметалл); n+ - положительная степень окисления элемента.
а) Ва(ОН)2 будет более сильным основанием, чем Mg(OH)2, так как эти элементы стоят во IIА- группе главной подгруппе, а в группе у элементов с увеличением порядкового номера увеличиваются размеры атомов (ионов), что уменьшает прочность связей Ва 2+ с ОН - , чем у Mg 2+ с ОН - .
б) Ca и Fe – элементы большого ряда четвёртого периода периодической системы химических элементов, поэтому с ростом порядкового номера элемента будет наблюдаться рост эффективного заряда, что приводит к уменьшению размеров атома (радиус атома железа будет намного меньше, чем радиус атома кальция). Из-за чего связь между Са 2+ и ОН - будет значительно меньше, чем между Fe 2+ с ОН - , значит, Са(ОН) 2 будет проявлять сильнее основные свойства, чем Fe(ОН)2.
в) Стронций – типичный р-элемент IIА- группы, а кадмий – d-элемент IIВ- группы и у их атомов на внешнем энергетическом уровне содержатся по два электрона, поэтому они в своих соединения будут проявлять степень окисления +2. У кадмия порядковый номер (48) значительно больше, чем у стронция (38), поэтому радиус иона кадмия (Cd 2+ ) имеет большее численное значение, чем у иона стронция (Sr 2+ ), значит, связь между ионами Cd 2+ и ОН - будет прочнее, чем связь между Sr 2+ и ОН - , Sr(OH)2 будет проявлять меньше основных свойств чем Cd(ОН)2.
Задание 53.
Исходя из степени окисления атомов соответствующих элементов, дайте мотивированный ответ на вопрос: какой из двух гидроксидов является более сильным основанием: СuОН Или Сu(OH)2; Fе(ОН)2 или Fе(ОН)3; Sn(ОН)2 или Sn(ОН)4? Напишите уравнения реакций, доказывающих амфотерность гидроксида олова (II).
Решение:
Если данный элемент проявляет переменную степень окисления (валентность) и образует несколько оксидов и гидроксидов, то с увеличением степени окисления свойства послед-них меняются от основных к амфотерным и кислотным. Это объясняется характером электролитической диссоциации (ионизации) гидроксидов ЭОН, которая в зависимости от сравнительной прочности и полярности связей Э — О и О — Н может протекать по двум направлениям:
Полярность связей, в свою очередь, определяется разностью электроотрицательностей компонентов, размерами и эффективными зарядами ионов. Диссоциация по кислотному типу (II) протекает, если
ЕО—Н < < ЕЭ—О (высокая степень окисления), а по основному типу (I), если ЕО—Н >> ЕЭ—О (низкая степень окисления).
Если прочности связей Э — О и О — Н близки или равны, то диссоциация гидроксида может одновременно протекать и по основному (I), и по кислотному типу (II). В этом случае речь идёт об амфотерных электролитах (амфолитах):
где Э – элемент (металл или неметалл); n + - положительная степень окисления элемента. Таким образом, исходя из степени окисления атомов соответствующих элементов, можно уверенно считать, что, если элемент образует два гидроксида, то более сильным основанием будет тот гидроксид, в котором степень окисления элемента имеет меньшее численное значение.
Отсюда вытекает, что гидроксид меди (I) CuOH более сильное основание, чем гидроксид меди (II) Cu(OH)2; а Fe(OH)2 более сильное основание, чем Fe(OH)3; Sn(OH)2 более сильное основание, чем Sn(OH)4.
1)Какой из элементов 4 - го периода обладает наиболее выраженными металлическими свойствами?
1)Какой из элементов 4 - го периода обладает наиболее выраженными металлическими свойствами?
2)Элементы 5 - ой группы образуют высшие оксиды с общей формулой : а)ЭО3 б)Э2О3 в)Э2О5 г)ЭО2
3)Какие свойства атомов элементов уменьшаются при движении слева направо по периоду?
4)В каком ряду символы элементов приведены в порядке возрастания значения электроотрицательности атомов?
5)Укажите формулы веществ с ионной связью : а)КОН б)Н2О в)КF г)HCI.



Составьте электронные формулы и представьте графически размещение электронов по квантовым ячейкам для Серы и Молибдена?
Составьте электронные формулы и представьте графически размещение электронов по квантовым ячейкам для Серы и Молибдена.
Объясните различие в свойствах данных элементов.
Как изменяются радиусы атомов элементов, потенциалы ионизации, электроотрицательность, химические свойства элементов в периодах и группах.
Высшие оксиды элементов имеют общую формулу ЭО?
Высшие оксиды элементов имеют общую формулу ЭО.
Какими свойствами будут обладать гидроксиды этих элементов?
Назовите эти элементы и их соединения.

Металлические свойства элементов в периоде с увеличением заряда ядра атома?
Металлические свойства элементов в периоде с увеличением заряда ядра атома.

Вещества магний, аллюминий и натрий расположили в порядке увиличения металлических свойств?
Вещества магний, аллюминий и натрий расположили в порядке увиличения металлических свойств.
Для элемента, образующего простое вещество с наименее выраженными металическими свойствами, изобразите схему строения атома, составтье формулу высших оксида и гидроксида.
УКажите их свойства (кислотные, основные, амфотереые).
Как изменяется металлические и неметаллические свойства атомов элементов в периодах с увеличением порядкового номера?
Как изменяется металлические и неметаллические свойства атомов элементов в периодах с увеличением порядкового номера?
Как изменяется металлические и неметаллические свойства атомов элементов в группах с увеличением порядкового номера?

Расположите химические элементы сера алюминий кремний расположите в порядке увеличения электроотрицательности их атомов?
Расположите химические элементы сера алюминий кремний расположите в порядке увеличения электроотрицательности их атомов.
Для элемента образуещего простое вещество с наиболее выраженными металлическими свойствами составте электронную схему атома напишите формулу его соединения с серой и укажите вид связи между атомами назовите это соединения.
Как изменяется радиус атомов элемента в периоде слева направо?
Как изменяется радиус атомов элемента в периоде слева направо?
Напишите формулу высшего оксида d - элемента, расположенного в 4 - м периоде и 6 группе периодической системы хим?
Напишите формулу высшего оксида d - элемента, расположенного в 4 - м периоде и 6 группе периодической системы хим.
Дайте название веществу, определите характер его свойств.
Какими свойствами обладает низший оксид этого хим.
2. Химические элементы хром, марганец и ванадий расположите в порядке увеличения металлических свойств?
2. Химические элементы хром, марганец и ванадий расположите в порядке увеличения металлических свойств.
Для элемента, обладающего наименьшими металлическими свойствами, изобразите схему строения его атома, составьте формулу высшего оксида и гидроксида, укажите его свойства (кислотный, основный или амфотерный).
Объясните, подробно, пожалуйста.
Если вам необходимо получить ответ на вопрос 1)Какой из элементов 4 - го периода обладает наиболее выраженными металлическими свойствами?, относящийся к уровню подготовки учащихся 10 - 11 классов, вы открыли нужную страницу. В категории Химия вы также найдете ответы на похожие вопросы по интересующей теме, с помощью автоматического «умного» поиска. Если после ознакомления со всеми вариантами ответа у вас остались сомнения, или полученная информация не полностью освещает тематику, создайте свой вопрос с помощью кнопки, которая находится вверху страницы, или обсудите вопрос с посетителями этой страницы.
Я про алюминийАлюминий – легкий, прочный и пластичный металл. Это один из самых востребованных металлов, и по темпам роста потребления он давно и с большим отрывом оставил позади сталь, никель, медь и цинк. Алюминий без преувеличений можно назвать ..
Тому що рН показує ступінь концентрації катіонів гідрогену у воді, що є дуже важливим для косметики.

1. дано N(NH3) = 4. 816 * 10 ^ 23 - - - - - - - - - - - - - - - - - - - - - - - - - - - - - V(NH3) - ? N(NH3) / N(A) = V(NH3) / Vm V(NH3) = N(NH3) * Vm / N(A) = 4. 816 * 10 ^ 23 * 22. 4 / 6. 02 * 10 ^ 23 = 15. 58 L ответ 15. 58 л 2) дано m(O2)..

Соотвественно правильным ответом будет являться : 4) KCl ; 5) AgCl ; 6) NH4Cl.
Дано W(O) = 47 % - - - - - - - - - - - - - - - - E - ? Е - это неизвестный элемент W(O) = Ar(O) * n / M(X2O3) * 100% 47% = 16 * 3 / 2x + 48 * 100% 94x + 2256 = 4800 X = 27 - это алюминий Al2O3 ответ алюминий.

Напиши нормально не понятно или сфоткай.
В SO3 32 / (32 + 3 * 16) = 0, 4 или 40 %.
Реакции есть на фотографии.
4HCl + MnO2 = MnCl2 + Cl2 + 2H2O соляная кислота отдаёт в свободном виде половину имеющегося хлора. M(Cl общ. ) = 1000 * 0, 365 * 0, 9726 = 355 г масса выделившегося хлора = 355 / 2 = 177, 5 г.

Типы химической реакции соединение, разложение замещение.
© 2000-2022. При полном или частичном использовании материалов ссылка обязательна. 16+
Сайт защищён технологией reCAPTCHA, к которой применяются Политика конфиденциальности и Условия использования от Google.
Готовимся к углубленному изучению химии
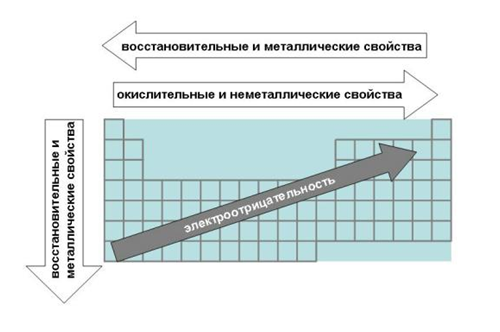
Теория строения атомов объясняет периодическое изменение свойств элементов при увеличении порядкового номера.
Важнейшими свойствами элементов являются металличность (металлические свойства) и неметалличность (неметаллические свойства).
Металличность – это способность атомов элемента отдавать электроны. Количественной характеристикой металличности элемента является энергия ионизации.
Энергия ионизации атома – это количество энергии, которое необходимо для отрыва электрона от атома элемента, т.е. для превращения атомов в положительно заряженный ион:

Чем меньше энергия ионизации, тем легче атом отдает электрон, тем сильнее металлические свойства элемента.
Сродство к электрону – это энергия, которая выделяется при присоединении электрона к нейтральному атому, т.е. при превращении атомов в отрицательно заряженный ион:

Чем больше сродство к электрону, тем легче атом присоединяет электрон, тем сильнее неметаллические свойства элемента. Универсальной характеристикой металличности и неметалличности элементов является электроотрицательность элемента (ЭО).
Электроотрицательность элемента характеризует способность его атомов притягивать к себе электроны, которые участвуют в образовании химических связей с другими атомами в молекуле.
При определении значений относительной электроотрицательности различных элементов за единицу принята ЭО лития.

В больших периодах с увеличением заряда ядер электронное строение атомов изменяется сложнее, чем в малых периодах. Поэтому и изменение свойств элементов в больших периодах более сложное.
Рассмотрим это изменение свойств на примере четвертого периода. Он начинается, как и малые периоды, двумя s-элементами – К и Са, в атомах которых на внешнем слое находится соответственно 1 и 2 электрона. Эти элементы имеют наибольшие радиусы атомов среди всех элементов IV периода, поэтому электроны внешнего слоя слабо связаны с атомами, и эти элементы являются типичными металлами. Эти элементы имеют самые низкие в IV периоде значения ЭО.

В малых периодах закономерно изменяется высшая валентность элементов: во втором периоде от I у Li до V у N; в третьем периоде от I у Na до VII у Cl. В большом четвертом периоде высшая валентность увеличивается от I у K до VII у Mn; у следующих элементов она понижается до II у Zn, а потом снова увеличивается от III у Ga до VII у Br.

Периодическое изменение высшей валентности объясняется периодическим изменением числа валентных электронов в атомах.
В атомах d-элементов валентными являются электроны внешнего слоя, а также все или некоторые d-электроны предвнешнего слоя.

1. Расположите в порядке усиления металлических свойств, следующие элементы: As, Sb, N, P, Bi. Обоснуйте полученный ряд, исходя из строения атомов этих элементов.
N < P < As < Sb < Bi → металлические свойства возрастают так как:
На внешнем энергетическом уровне у всех элементов по 5 электронов, но от N до Bi возрастают радиусы атомов.
Чем больше радиус атома, тем слабее притяжение внешних электронов к ядру, тем сильнее проявляются металлические свойства (способность отдавать электроны).
2. Расположите в порядке усиления неметаллических свойств, следующие элементы: Si, Al, P, S, Cl, Mg, Na.
Обоснуйте полученный ряд, исходя из строения атомов этих элементов.
Na < Mg < Al < Si < P < S < Cl → неметаллические свойства возрастают так как:
Число энергетических уровней постоянно.
Увеличивается число электронов на внешнем уровне, и увеличивается заряд ядра. (от 11 у Na до 17 у Cl )
Следовательно притяжение электронов к ядру увеличивается, и радиус, немного уменьшается.
Из-за усиления притяжения электронов к ядру металлические свойства (способность отдавать электроны) уменьшается, а неметаллические свойства увеличиваются.
3. Напишите формулы оксидов бора, бериллия и лития и расположите их в порядке возрастания основных свойств. Запишите формулы гидроксидов, соответствующих этим оксидам. Каков их химический характер?
H3BO3 - борная кислота, характер кислотный.
Be(OH)2 - гидроксид бериллия, характер амфотерный.
LiOH - гидроксид лития, характер основный.
1. Электронная конфигурация элемента 1s 2 2s 2 2p 6 3s 1 . Назовите атомный (порядковый) номер и группу, в которую входит этот элемент.
2. Приведены электронные формулы внешних электронных оболочек элементов: а) 2s 2 2p 5 , б) 3s 2 3p 4 , в) 3d 1 4s 2 . Составьте полные электронные формулы и определите порядковые номера элементов. Какие это элементы?
3. В каком периоде Периодической таблицы находится элемент с полностью или частично заселенными орбиталями 1s 2s 2p 3s 3p 3d 4s?
4. По положению в Периодической таблице определите: а) что лучший окислитель - сера или фосфор? б) У селена или у мышьяка лучше выражены металлические свойства?
5. По положению элементов в периодической системе определите, какой элемент имеет большую ЭО; больший радиус атома:

7. Напишите символы всех металлов третьего периода, если первым неметаллом в этом периоде является кремний.
8. Напишите символы всех неметаллов главной подгруппы V группы, если известно, что в этой подгруппе два элемента являются металлами.
9. Атомы каких элементов – металлов или неметаллов – имеют обычно большее число электронов на внешнем электронном слое.
10. Напишите символы всех элементов, атомы которых содержат пять валентных электронов. Напишите формулы высших оксидов этих элементов.
Какой из элементов 4 - го периода обладает наиболее выраженными металлическими св - вами?
Какой из элементов 4 - го периода обладает наиболее выраженными металлическими св - вами?
Если учесть, что в периоде металлические свойства ослабевают слева на право, то это К(калий).
Какой элемент Са или Ве обладает более металлическими свойствами, почему?
Какой элемент Са или Ве обладает более металлическими свойствами, почему?
У какого элемента наиболее ярко выражены металлические свойства?
У какого элемента наиболее ярко выражены металлические свойства.
Каких элементов - металлических или неметаллических - больше в 3 - тем периоде, 4 - том периоде?
Каких элементов - металлических или неметаллических - больше в 3 - тем периоде, 4 - том периоде?
Наиболее выраженными металлическими свойствами обладает : а) Na б)K в)AL г)Mg?
Наиболее выраженными металлическими свойствами обладает : а) Na б)K в)AL г)Mg.
Элемент с наиболее ярко выраженными металлическими свойствами1) калий2)литий3)натрий4)рубидий?
Элемент с наиболее ярко выраженными металлическими свойствами
Элемент, обладающий наименее выраженными металлическими свойствами : А) Ge Б) Ga В) K Г) Ca?
Элемент, обладающий наименее выраженными металлическими свойствами : А) Ge Б) Ga В) K Г) Ca.
Сравните какой из 2 металлов магний и аллюминий обладает наиболее ярко выраженными металлическими свойствами ?
Сравните какой из 2 металлов магний и аллюминий обладает наиболее ярко выраженными металлическими свойствами ?
Укажите элемент атомы которого проявляют наиболее выраженные металлические свойства Ba Al Na Ca?
Укажите элемент атомы которого проявляют наиболее выраженные металлические свойства Ba Al Na Ca.
Сравните какой из двух металов магний или алюминий калий или рубидий обладает наиболее ярко выраженными металлическими свойствами почему?
Сравните какой из двух металов магний или алюминий калий или рубидий обладает наиболее ярко выраженными металлическими свойствами почему.
Наиболее выраженные металлические свойства свойства обладает : Ca, Se, Br?
Наиболее выраженные металлические свойства свойства обладает : Ca, Se, Br.
Читайте также:
