Какой из перечисленных металлов не растворяется в царской водке
Обновлено: 16.05.2024
Если я правильно помню, то в смеси в смеси соляной и азотной кислот с легкой руки алхимиков именуемой за способность растворять "царя металлов" золото "царской водкой", нерастворяется сразу несколько металлов платиновой группы, и даже некоторые сплавы платины.
Это такие металлы как осмий, иридий, родий и рутений
Чистое золото (так же как платина и палладий) легко растворяется в царской водке. Не растворяются, кроме перечисленных, и некоторые другие металлы, у которых под действием сильных окислителей на поверхности образуется защитный оксидный слой. К ним относятся, например, ниобий и тантал.
Конкретно насчет металла не подскажу, просто знаю, что раньше распределительные щиты изготавливали по ГОСТ 10985-80. (довольно объёмный документ, регламентировавший и тип материалов в том числе).
Сейчас производители "подсели" на ТУ 3431-001-18461115-2003.
P.S. Конечно, кому было в 2003г. новым ГОСТом заниматься?
В 2017 году, больше всего меди в мире добывалось в в Чили - 34% от мировой добычи меди. В США добывалось 9,1% от мировой добычи. В Перу -9%, в Австралии -6% и в России - 5% от мировой добычи меди.
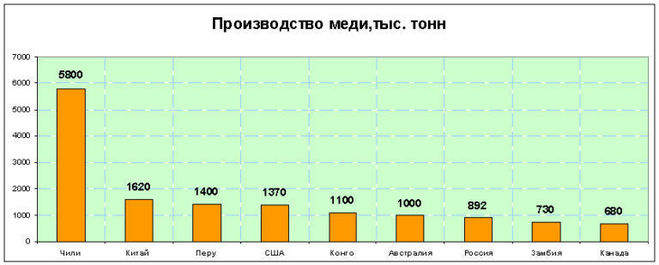
Именно в Чили находится около 20% разведанных запасов меди в мире, в США находится 12,7% от разведанных мировых запасов. А по выплавке меди в 2017 году места распределились следующим образом: Чили, Китай, Перу, США, Австралия, Конго, Россия, Замбия, Канада. В Чили было выплавлено столько меди, сколько в Китае, Перу и США вместе взятых.
Это на фото карьер "Эскондида" в Чили, один из крупнейших в мире.

Химический элемент (металл) тантал был назван в честь героя древнегреческих мифов Тантала. Открытый А. Г. Экбергом в 1802 году новый химический элемент (металл) по свойствам почти полностью совпадал с танталом. Но это был другой элемент. А в 1844 г. из-за невероятной схожести нового элемента по свойствам с титаном, и чтобы отличить его от титана, немецкий химик Генрих Розе переименовал его в Ниобий, в дочери Титака – Ниобы.
Ниобий (Nb) это металл светло-серого цвета, относится к категории редких элементов и является компонентом тугоплавких сплавов. Втаблице Менделеева занимает 41 место.
Самый простой способ определить качество стали, из которой сделан садовый инструмент - проверить его "на звон". Для этого нужно взять, скажем, лопату за тулейку (это часть лопаты, в которую вставляется черенок) и щелкнуть пальцем ближе к острию полотна. Металл хорошего качества должен звенеть. Инструменты, сделанные из "сырого" металла, издают глухой звук, без звона. Этот способ проверки подходит практически для всех инструментов, не только садово-огородных.
Аморфное состояние (от греч. - бесформенное), твёрдое состояние вещества, характеризующееся двумя особенностями: его свойства (механические, тепловые, электрические и т. д.) в естественных условиях не зависят от направления воздействия в веществе, а при повышении температуры вещество, размягчаясь, переходит в жидкое состояние постепенно (т. е. отсутствует определённая точка плавления). Характерные представители веществ (материалов) находящихся в аморфном состоянии стекло, парафин, смолы, битумы и т.д. У веществ находящихся в аморфном состоянии отсутствует характерная кристаллическая решётка, которая не успевает сформироваться при обычном охлаждении.
Аморфные металлы – твёрдые металлы (сплавы металлов) у которых отсутствует кристаллическая решётка. Др. названия – металлическое стекло, метгласс. Получают аморфные металлы путём мгновенного (со скоростью до 1000 К/сек) охлаждения. В результате такого охлаждения у расплава не успевает сформироваться кристаллическая решётка и он, переходя в аморфное состояние, приобретает совершенно уникальные свойства, которых нет у обычных металлов. В частности прочность и твердость аморфных металлов значительно выше, чем у их "родственников" в кристаллическом состоянии, а пределы текучести и прочности близки к расчетным теоретическим значениям.
Механические свойства аморфных металлов также определяются отсутствием кристаллических решёток. Их отсутствие приводит к тому, что они обладают очень высокой прочностью и твёрдостью, и как следствие, более износостойки. Среди других уникальных особенностей аморфных металлов - слабое поглощение звука, каталитические свойства и уникальная коррозионная стойкость, недостижимая для лучших нержавеющих сталей.
Применяются аморфные металлы в точной механике, радиоэлектронике, медицине.
- На основе аморфных титановых сплавов возможно получение покрытия конструкционного материала толщиной в несколько нанометров, повышающее коррозионную и износостойкость в десятки раз.
- На основе аморфных сплавов цинка возможно изготовление приспособлений для сращивания костей, так как этот материал в организме человека распадается со скоростью примерно 1 миллиметр в месяц и замещается костной тканью.
Жаль только, что ведомство, руководимое рыжим орденоносцем не занимается внедрением этих технологий в РФ.
Растворимость металлов в различных жидкостях
а) Хорошо растворяется в соляной кислоте. Медленно растворяется в концентрированной и разбавленной HNO3 н разбавленной Н2SO4.
б) Алюминий и его сплавы хорошо растворяются в концентрированных растворах едких щелочей (20—40% NaOH или KОН).
Бериллий
Хорошо растворяется в соляной и серной кислотах, а также в азотной кислоте при нагревании. Холодная азотная кислота пассивирует металл вследствие образования пленки окиси бериллия.
Растворяется в кислотах-окислителях: в концентрированных азотной и серной, а также в хлорной при нагревании до белого дыма. Сплавляется с едкими щелочами, образуя метабораты.
Ванадий
Растворяется на холоду в «царской водке» и в азотной кислоте. При нагревании растворяется в концентрированной серной и плавиковой кислотах. Сплавляется со щелочами, образуя соли ванадиевой кислоты (ванадаты). Нерастворим в разбавленных серной и соляной кислотах.
Висмут
Хорошо растворяется в разбавленной азотной кислоте, в смеси азотной и соляной кислот, в горячей концентрированной серной кислотах. Нерастворим в разбавленных соляной и серной кислотах.
Вольфрам
Нерастворим в серной и соляной кислотах. Концентрированная азотная кислота и «царская водка» окисляют вольфрам с поверхности, переводя его в нерастворимую вольфрамовую кислоту. Растворяется в смеси плавиковой и азотной кислот. Растворим в смесях кислот, содержащих фосфорную кислоту, вследствие образования комплексной вольфрамо-фосфорной кислоты H7[P(W2O7)6]*xH2O
Растворяется в насыщенном растворе щавелевой кислоты в присутствии перекиси водорода. Сплавляется со щелочами или Na2CO3 в присутствии окислителей (например, КСlO3) с образованием солей вольфрамовой кислоты.
Гафний
Германий
Хорошо растворяется в «царской водке», а также в щелочном растворе перекиси водорода. Кислоты на германий действуют слабо; в азотной кислоте образуется гидрат двуокиси германия.
Железо
Легко растворяется в азотной кислоте, разбавленной серной, а также в соляной кислоте. Чистейшее железо растворяется в азотной кислоте, но не растворяется в соляной.
Золото
Индий
Легко растворяется в соляной кислоте, медленно — в серной, с трудом в концентрированной азотной кислоте.
Кадмий
Растворяется в горячей разбавленной азотной кислоте. Плохо растворяется в разбавленной соляной и серной кислотах; растворение ускоряется в присутствии перекиси водорода.
Кобальт
Растворяется в разбавленной азотной кислоте, а также в разбавленной соляной и серной кислотах. Концентрированные серная и азотная кислоты пассивируют кобальт.
Лантан
Магний
Легко растворяется во всех разбавленных кислотах, в т. ч. и в уксусной. Растворяется в концентрированных растворах хлорида аммония.
Марганец
Растворяется в разбавленных азотной, соляной и серной кислотах с образованием солей двухвалентного марганца (Мn 2+ ). В концентрированной серной кислоте растворяется с выделением SO2
Легко растворяется в азотной кислоте. Нерастворима в соляной и в разбавленной серной кислотах. Концентрированная серная кислота растворяет медь при нагревании до паров Н2SO4. Соляная кислота растворяет медь в присутствии окислителей (например, Fe 3+ , Н2О2, НNО3 и т. д.).
Молибден
Легко растворяется в «царской водке» и в смеси плавиковой и азотной кислот. Растворяется в концентрированной серной кислоте при нагревании до паров Н2SO4. В разбавленной соляной кислоте растворяется при нагревании очень медлепно.
Сплавляется со щелочами в присутствии окислителей. Концентрированная азотная кислота пассивирует молибден.
Мышьяк
Растворяется в смеси азотной и соляной кислот, в концентрированной серной кислоте при нагревании до паров Н2SO4. Нерастворим в соляной и разбавленной серной кислотах.
Никель
Растворяется в разбавленной азотной кислоте. В концентрированной азотной кислоте пассивируется и не растворяется. Плохо растворяется в разбавленных соляной и серной кислотах.
Ниобий
Нерастворим в «царской водке» и концентрированной азотной кислоте. Растворяется в плавиковой кислоте с добавкой азотной кислоты. Концентрированная серная кислота с добавкой (NH4)2SO4 или К2SO4 растворяет ниобий при нагревании до паров Н2SO4. Сплавляется со щелочами, образуя солн-ниобаты.
Олово
Растворяется в соляной кислоте и в смеси соляной и азотной кислот. Растворяется в концентрированной серной кислоте при нагревании. В азотной кислоте образуется нерастворимый осадок метаоловянной кислоты H2SnO3
Платина
Рений
Растворяется в азотной кислоте с образованием раствора рениевой кислоты. Концентрированная серная кислота при нагревании медленно растворяет рений. Соляная и разбавленная серная кислоты очень медленно растворяют его.
Ртуть
Хорошо растворяется в азотной кислоте, а также в концентрированной серной при нагревании. Нерастворима в соляной кислоте и в разбавленной серной.
Свинец
Хорошо растворяется в разбавленной азотной кислоте. Соляная и серная кислоты растворяют свинец лишь при нагревании. Растворяется в уксусной кислоте.
Селен
Растворяется в азотной кислоте с образованием растворимой селенистой кислоты H2SeO3. Растворяется также в «царской водке».
Серебро
Легко растворяется в азотной кислоте; при нагревании растворяется в концентрированной серной кислоте. Нерастворимо в соляной, а также на холоду в серной кислотах.
Сурьма
Растворяется в концентрированной серной кислоте при нагревании до паров Н2SO4, в смеси азотной и соляной кислот, в смеси азотной кислоты с винной.
Таллий
Легко растворяется в азотной кислоте. В серной кислоте растворяется труднее, в соляной — плохо вследствие образования малорастворимого хлорида одновалентного таллия.
Тантал
Нерастворим в «царской водке» и в азотной кислоте. На него не действует плавиковая кислота (в отсутствие платины). Концентрированная серная кислота лишь при нагревании действует на металл. Растворяется в плавиковой кислоте с добавкой азотной. Металл сплавляется со щелочами, образуя танталаты.
Теллур
Растворяется в азотной кислоте с образованием растворимой теллуристой кислоты H2TeO3. Растворим в «царской водке», в концентрированной серной кислоте, в растворах NaOH и KCN.
Титан
Растворяется в разбавленной 1 : 1 соляной и разбавленной 1 : б серной кислотах с образованием солей трех валентного титана фиолетового цвета. Очень легко растворяется в разбавленной плавиковой кислоте и в смеси плавиковой и азотной кислот.
Азотная кислота пассивирует титан вследствие образования нерастворимой метатитановой кислоты. Такой пассивированный титан плохо растворяется в соляной и серной кислотах.
Торий
Легко растворяется в концентрированной соляной кислоте и в смеси соляной и азотной кислот. Одна азотная кислота пассивирует металл.
Растворяется в разбавленных серной и соляной кислотах, а также в хлорной кислоте. Азотная кислота на холоду пассивирует уран (при растворении образуется нитрат уранила UO2(NO3)2 ).
Легко растворяется в соляной и хлоркой кислотах, а также в разбавленной серной кислоте. В азотной кислоте хром с поверхности пассивируется, и дальнейшее растворение его протекает крайне медленно.
Церий
Цирконий
Растворяется в «царской водке» и плавиковой кислоте, а также в смеси плавиковой и азотной кислот. Медленно растворяется в серной и концентрированной соляной кислоте. Устойчив к действию 5%-ной соляпой кислоты даже при нагревапии.
Легко переводится в раствор мокрым сплавлением (на 10 мл концентрированной Н2SO4 добавляют 3 грамма K2SO4).
--> Растворимость металлов в различных жидкостях. Ртуть Хорошо растворяется в азотной кислоте, а также в концентрированной серной при нагревании. Нерастворима в соляной кислоте и в разбавленной серной. | растворимость, металл, химия, кислота
Какой из перечисленных металлов не растворяется в царской водке

Все мы вирус разума в звёздной пыли. запись закреплена
Господа растворяльщики серебра в царской водке. Не хотел вас разочаровывать в самих себе, но прийдется.
И так;
Растворение серебра в царской водке .
Само понятие растворить серебро в царской водке невозможно, так как серебро покрывается тонким слоем хлорида серебра (этому реально учат в школе).
Но эта проблема решаема, если к основной кислоте царя, добавить ещё избыток соляной кислоты в присутствие свободного кислорода ( перекись водорода например, сильнейший окислитель ) . В результате чего серебро "растворяется" без остатка выпадая на дно колбы в виде белого творожистого осадка. Однако по сути не растворение как таковое а подмена понятий. Поскольку в растворённом виде, мы при всём желании не получим не каких соединений. НЕ БУДЕТ СЕРЕБРА В РАСТВОРЕ! Хлорид серебра не растворимое в воде соединение соляная + азотная кислоты, это вода с растворёнными в ней газами.
Идём дальше, серик разрушить царём сможем. Развалили же металл на хлорид и получили хоть и не растворимый но порошок. А как же так получается растворить, реально растворить хлорид серебра? Так чтобы он был в растворе! А не в осадке твёрдый и белый. Да так чтобы он держался в растворе и даже цвета не было и мути. Реальный раствор получить. КАК?
Да просто.
В максимально концентрированной соляной кислоте (это в районе 40% массовой доли хлороводорода), образуется комплекс [AgCl2]- . По сути - "сереброхлористоводородная кислота" H[AgCl2]. Такие же комплексы могут образовываться в концентрированных растворах хлоридов. То есть можно растворить уже готовый хлорид в концентрированной соляной кислоте а не в разбавленной кислоте с помощью азотной! Чтобы растворённый хлорид весь выпал из концентрированной соляной кислоты, этот раствор достаточно разбавить водой и он сразу потеряет способность насыщаться, прекратит быть комплексом. И хлорид весь выпадет в осадок практически без остатка в растворе. Растворимость в воде мене 0.001г на 100 мл, вода его просто вытеснит из раствора.
Хм. ЗАДУМАЛИСЬ. Оказывается серебро можно "растворить" в максимально концентрированной соляной кислоте?. Можно, только сначала это получится хлорид серебра и он медленно весь растворится в пере насыщенном хлороводородом растворе воды. Не металл растворится а соль серебра. Для этого нужны особые условия концентрации. И постоянный избыток хлороводорода.
Надеюсь всем понятно? Даже тем кто на бронепоезде? Не получится в классической царской водке растворённого хлорида. И не надо называть растворением химическую реакцию разрушения пассивирующей плёнки хлорида на металлическом серебре. Это подмена понятий и жаргон. Растворением называется не химическая реакция а физический процесс. Для которого создаются условия. И есть растворимое вещество и его растворитель. Даже на соляную кислоту влияет изменяя её физические свойства концентрация хлороводорода.
Ещё раз объясняю (некоторым нужно два раза), смесь соляной и азотной кислот может полностью разрушить металлическое серебро до хлорида серебра, это не растворение, (повторяю не путайте понятия), но об этом нужно помнить всегда! Поскольку вы можете решить, что соляная кислота не даст серебру реагировать с азотной кислотой. Вас этому в школе учили. Всё как раз на оборот, это азотная кислота, или перекись водорода, или какой либо другой окислитель, снимают пассивирующую плёнку и отдают металл на растерзание соляной кислоте. И она его с аппетитом жрёт, переваривая в хлорид. Который выпадает в нерастворимый осадок который вы можете выбросить не зная об этом.
Похожие процессы происходят и с золотом и с платиной палладием и прочими металлами в царской водке .(Их хлористоводородные кислоты, комплексы, соли, хлориды, растворимы в воде). Вы не металлы растворяете а их соединения получившиеся в результате реакции с соляной кислотой и окислителем. ХВАТИТ ГНАТЬ ЧУШЬ ПРО РАСТВОРЕНИЕ МЕТАЛЛА! Есть понятие растворённых металлов в мелкодисперсионном состоянии практически на уровне атомов, ионов. Это коллоидный раствор и его можно получить даже не в результате химических реакций. Это физическая взвесь в жидкости.
И уж окончательно вас добить. Есть способы (не один даже) с использованием сильных окислителей в смеси с не особо концентрированной соляной кислотой, реально растворить хлорид серебра (прям как любую растворимую в воде соль), например при выщелачивании из руд. Лично освоен на собственном опыте но с вашего позволения не стану выкладывать рецепт. Просто поверьте на словоЕсли остались или появились вопросы, милости прошу в комментарии.
Видео уже многие видели. Не обращаем внимание на жаргон.
Какой металл не поддается растворению в "царской водке"?
Читайте также:
