Какой металл быстро ржавеет
Обновлено: 04.10.2024
Ржавчина, обычно называемая окислением, возникает, когда железо или металлические сплавы, содержащие железо, такие как сталь, подвергаются воздействию кислорода и воды в течение длительного периода времени.
Ржавчина образуется, когда железо подвергается процессу окисления, но не все окисления образуют ржавчину. Как уже говорилось выше, ржаветь может только железо или сплавы, содержащие железо, но и другие металлы могут подвергаться коррозии аналогичным образом.
Что такое коррозия?
Коррозия возникает, когда элемент, легко теряющий свои электроны (например, некоторые металлы), соединяется с элементом, который поглощает дополнительные электроны (кислород), а затем вступает в контакт с раствором электролита (водой). Работа воды в процессе коррозии заключается в ускорении потока электронов от металла к кислороду.
Этот процесс называется окислительно -восстановительной реакцией и на самом деле представляет собой два химических процесса, которые происходят одновременно: восстановление (редукция) и окисление.
Что такое редукция?
Редукция – это название химической реакции, которая происходит, когда молекула получает электрон. Это роль кислорода в коррозии металлов.
Что такое окисление?
Окисление – это противоположная восстановлению реакция, которая происходит, когда молекула теряет электрон. Это роль воздействия металла в коррозии металла. Ржавчина и патина меди странного зеленого цвета – видимые результаты того, что металлы теряют свои электроны в воздухе.
Ржавеют ли медь, железо и алюминий?
Технически ржаветь может только железо и сплавы, содержащие железо. Другие металлы, включая драгоценные металлы, такие как золото и серебро, могут подвергаться аналогичной коррозии.
Что отличает определенные металлы, так это время, необходимое для того, чтобы они начали ржаветь или подвергаться коррозии.
Вот несколько примеров о том, как наиболее распространенные металлы противостоят ржавчине и коррозии.

В ассортименте нашей компании есть эффективный удалитель ржавчины с металлов «РжавоМед-У»
Ржавеет ли медь?
Медь не ржавеет, однако, корродирует. Медь имеет естественный коричневый цвет и при коррозии приобретает ярко-зеленый оттенок. Хотя некоторые считают, что реакция меди скорее потускнение, чем окисление, металл по-прежнему подвергается аналогичному процессу «ржавления».
В естественной среде медь крайне несклонна к коррозии. Тип коррозии, которая в конечном итоге приводит к поломке медных питьевых труб, называется эрозионной коррозией, и она возникает только из-за воздействия текущей турбулентной воды в течение длительного периода времени. Обычно видимая на старых монетах знаменитая красивая зеленая «патина» может полностью сформироваться за 20 лет.
Это один из немногих природных металлов, который не добывается из руды (хотя он может быть получен другими способами), пригодный для непосредственного использования в естественной среде. Этот, а также тот факт, что медь очень мягкая и с ней легко работать, повлекли за собой то, что медь стала одним из первых металлов, с которыми работали люди в истории человечества.
Фактически, медь имела такое большое значение, что у нас действительно есть период в истории, называемый медным веком.
Медь обладает высокой проводимостью к теплу и электричеству, поэтому ее часто используют в электропроводке.
Медь также имеет очень низкую реакционную способность. Известный инструмент в химии, который представляет собой последовательность металлов, упорядоченную от самой высокой до самой низкой реакционной способности до кислот, воды, извлечения металлов из их руд и других реакций. Из-за её низкой реакционной способности специальный сплав меди (90% меди и 10% никеля) используется для деталей лодок, которые в дальнейшем подвергаются воздействию морской воды, или в качестве труб для транспортировки питьевой воды. Если вы осмотритесь в своем доме или здании, то заметите, что во многих ваших приборах используются медные трубы для подачи и отвода воды.
По данным Министерства жилищного строительства и городского развития России, средний срок службы медной водопроводной трубы составляет 50-70 лет.
Ржавеет ли железо?
Да. Помните, что технически ржаветь может только железо и сплавы, содержащие железо.
По сравнению с коррозией других металлов, железо относительно быстро ржавеет, особенно если оно подвергается воздействию воды и кислорода. Фактически, когда железо подвергается воздействию воды и кислорода, оно может начать ржаветь в течение нескольких часов.
Железо также быстро ржавеет при воздействии высоких температур. Экстремальные температуры могут изменить химический состав металла, что делает его чрезвычайно склонным к рекомбинации с кислородом в окружающей среде.
Алюминий производится в 3 этапа:
Этап 1. Добыча полезных ископаемых
Этап 2. Обработка
Этап 3. Электролитическое восстановление (при котором образуется сам алюминий)
Алюминий получают из минерала боксита. Бокситы чаще всего встречаются в субтропических местах, таких как Африка, Западная Индия, Южная Америка и Австралия, хотя есть небольшие месторождения и в других местах, например, в Европе. Австралия является крупнейшим производителем бокситов. На его долю приходится около 23% мировой добычи.
Затем этот боксит перерабатывается в оксид алюминия, который состоит только из атомов алюминия и кислорода, связанных вместе.
Затем через оксид алюминия пропускается электрический ток, который отделяет различные компоненты друг от друга. Пузырьки кислорода образуются на одном конце, а капли чистого расплавленного алюминия собираются на другом.
Около 4-5 тонн боксита перерабатывается в 2 тонны оксида алюминия, что дает 1 тонну чистого алюминия.
Алюминий корродирует намного медленнее, чем другие металлы, такие как железо. Причина того, что алюминий не так легко подвергается коррозии, как другие металлы, заключается в его особой реакции с водой.
Обычно, когда вода вступает в контакт с металлом, она побуждает металл еще быстрее отдавать свои электроны окружающему его кислороду.
Однако у алюминия особая реакция на воду. Когда вода соприкасается с алюминием, атомы алюминия и кислорода (содержащиеся в металле, а не кислород в окружающем его воздухе) перемещаются дальше друг от друга.
Они окажутся почти на 50% дальше друг от друга, чем были в начале. Эта реакция удаления меняет молекулярную структуру алюминия настолько, что он становится химически инертным, а это означает, что он не так легко подвергается коррозии.
Как предотвратить ржавление металлов
Ржавчина – это естественная химическая реакция. Несмотря на то, что некоторые металлы ржавеют быстрее других, это не должно вас сдерживать от использования этих металлов для определенных целей. Есть много способов предотвратить ржавчину металлов, например, металлические краски и покрытия, защитные барьеры, барьерные пленки, а также многочисленные антикоррозионные растворы и лужение. В каждом методе используются разные соединения и материалы для создания защитного барьера между металлом и элементами, вызывающими ржавчину и коррозию.
4 типа металлов устойчивые к коррозии или нержавеющие
Мы обычно думаем о ржавчине как о оранжево-коричневых хлопьях, которые образуются на открытой стальной поверхности, когда молекулы железа в металле реагируют с кислородом в присутствии воды с образованием оксидов железа. Металлы также могут реагировать в присутствии кислот или агрессивных промышленных химикатов. Если ничто не остановит коррозию, чешуйки ржавчины будут продолжать отламываться, подвергая металл дальнейшей коррозии, пока он не распадется.
Не все металлы содержат железо, но они могут коррозировать или потускнеть в других окислительных реакциях. Чтобы предотвратить окисление и разрушение металлических изделий, таких как поручни, резервуары, приборы, кровля или сайдинг, вы можете выбирать металлы, которые «устойчивы к ржавчине» или, точнее, «устойчивы к коррозии». В эту категорию попадают четыре основных типа металлов:
- Нержавеющая сталь
- Алюминиевый металл
- Медь, бронза или латунь
- Оцинкованная сталь
Нержавеющая сталь
Типы нержавеющей стали такие, как 304 или 316, представляют собой смесь элементов и большинство из них содержат некоторое количество железа, которое легко окисляется с образованием ржавчины. Но многие сплавы нержавеющей стали также содержат высокий процент хрома (не менее 18%), который даже более активен, чем железо. Хром быстро окисляется, образуя защитный слой оксида хрома на поверхности металла. Этот оксидный слой противостоит коррозии и в то же время предотвращает попадание кислорода на нижележащую сталь. Другие элементы сплава, такие как никель и молибден, повышают его устойчивость к ржавчине.

Рекомендуем эффективный удалитель ржавчины с металлических поверхностей — «РжавоМед-У»
Алюминиевый металл
Многие самолеты сделаны из алюминия, как и детали автомобилей и мотоциклов. Это связано с его небольшим весом, а также с устойчивостью к коррозии. Алюминиевые сплавы почти не содержат железа, а без железа металл не может ржаветь, но окисляется. Когда сплав подвергается воздействию воды, на поверхности быстро образуется пленка оксида алюминия. Слой твердого оксида довольно устойчив к дальнейшей коррозии и защищает лежащий под ним металл.
Медь, бронза и латунь
Эти три металла содержат мало железа или вовсе его не содержат, поэтому не ржавеют, но могут вступать в реакцию с кислородом. Медь со временем окисляется, образуя зеленую патину, которая фактически защищает металл от дальнейшей коррозии. Бронза представляет собой смесь меди и олова, а также небольшого количества других элементов, и, естественно, гораздо более устойчива к коррозии, чем медь. Латунь – это сплав меди, цинка и других элементов, которая также устойчива к коррозии.
Оцинкованная сталь
Оцинкованная сталь долго ржавеет, но со временем она ржавеет. Это углеродистая сталь, оцинкованная или покрытая тонким слоем цинка. Цинк действует как барьер, не позволяющий кислороду и воде достигать стали, поэтому она защищена от коррозии. Даже если цинковое покрытие поцарапано, оно продолжает защищать близлежащие участки лежащей под ним стали за счет катодной защиты, а также путем формирования защитного покрытия из оксида цинка. Как и алюминий, цинк очень реактивен по отношению к кислороду в присутствии влаги, а покрытие предотвращает дальнейшее окисление железа в стали.
Как быстро ржавеет сталь и что с этим делать?
Одной из наиболее насущных проблем во многих странах является борьба с коррозией. На большинстве металлов вследствие различных реакций происходит корродирование. Нередко можно увидеть и на изделиях из нержавеющей стали следы ржавчины. Стоит разобраться, отчего это происходит, можно ли предотвратить появление коррозии, и как быстро убрать появившиеся пятна.


На какой стали появляется коррозия и почему?
Резкие перепады температур способствуют образованию трещин на поверхностях. Жидкость, попадая в эти трещины, приводит к разрушению металла. Изделия же из нержавеющей стали даже при повреждении верхнего слоя способны сохранять антикоррозийные свойства. Благодаря этому материал нашел широкое применение в разных отраслях, на предприятиях, в быту.
К преимуществам этого материала стоит отнести:
- долгий срок службы изделий из нержавейки;
- высокую сопротивляемость коррозии;
- экологичность;
- безопасность в использовании;
- прекрасные эстетические характеристики.



Хотя материал отличается массой преимуществ, у нержавейки есть и недостатки. В некоторых случаях на поверхности таких изделий может появляться ржавчина. Одной из причин является наличие недостаточно прочной защитной пленки, которую можно повредить, используя кислоты, йод, хлор или фтор. Страшными врагами нержавеющей стали остаются чистящие и моющие средства с хлором, а также морская и даже дождевая вода.
Кроме того, изделия из нержавейки начинают ржаветь из-за недостаточного количества хрома. Это может произойти при контакте с углеродистой сталью.
Ускорить процесс может и соприкосновение с обычным черным металлом или стружкой, транспортировка без соблюдения правил, либо сварка.
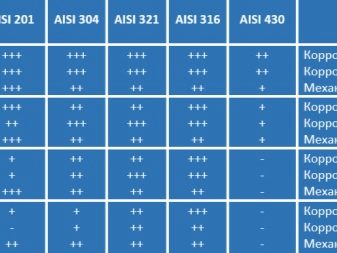
По международной классификации AISI, указывающей на состав в сплаве отдельных элементов, изделия, имеющие более высокую долю никеля, отличаются лучшими антикоррозионными качествами.



Чаще всего в производстве используется следующие разновидности стали.
- AISI 304. В состав этой марки входит 18% хрома и 8% никеля. Благодаря такому составу на поверхности образуется тонкая пленка, устойчивая к негативным воздействиям. Рекомендуется использовать этот вариант для оформления бассейнов, ограждений на улице в виде перил.
- AISI 201. К более дешевым аналогам можно отнести марку AISI 201. Изделия из такого материала не стоит использовать в помещениях, имеющих повышенную влажность, к примеру, бассейны, ванные. Выбрав же этот вариант в качестве ограждений на улице, спустя некоторое время можно увидеть следы ржавчины, что говорит о начале коррозионного процесса. Особенно явно эти следы будут видны в месте сварки, на стыках.
- AISI 430. Что касается этой марки, то ее лучше не использовать в качестве ограждений, так как в составе ее совершенно нет никеля. Даже в помещении через некоторое время такие изделия могут начать ржаветь.
Хромированная сталь может ржаветь при несоответствии марки материала. Углеродная сталь в ряде случаев может влиять на коррозионную стойкость.
При выборе изделий из нержавеющей стали важно убедиться в качестве, используя пригодные марки для разных целей.

Как предотвратить появление ржавчины?
За любыми изделиями из нержавеющей стали, в том числе и за ограждениями и перилами, требуется уход. Учитывая, что оксидная пленка защищает поверхность от ржавчины, необходимо регулярно заботиться о покрытии и использовать для чистки его специальные средства. Основной целью является защита поверхности от царапин, трещин, которые возможны при использовании жестких грубых щеток при чистке поверхностей. Ухаживая за изделиями из нержавейки, нельзя использовать средства с абразивными компонентами, с песком, содой, кислотой, хлором.
Чтобы предотвратить образование ржавчины, и защитить поверхность, используют специальные средства, способствующие защите и восстановлению слоя.
Перед нанесением антикоррозийного слоя необходимо предварительно убрать следы ржавчины, а затем восстанавливать пленку.
На первом этапе производится очистка поверхности. Сделать ее можно механическим путем, используя абразивные материалы, что не всегда эффективно и уместно.
Учитывая, что пасты травильные могут оказывать негативное воздействие на самочувствие, в качестве альтернативы лучше использовать электронно-химическую пассивацию. Благодаря пассивации металла происходит образование слоя, препятствующего коррозии. Обработать поверхность лучше специальными средствами. Для мытья следует пользоваться мягкой ветошью, чистой водой или средством для нержавейки.
Как быстро убрать ржавые пятна?
Существует немало способов, помогающих удалить следы ржавчины с изделий из нержавеющей стали.
Обычно для этих целей применяют преобразователь WD-40. Использование его позволяет не только очистить поверхность от окиси и ржавчины, но и создать пленку, предотвращающую появление коррозии.
Чтобы убрать ржавчину, используя средство WD-40, нужно сделать следующие действия.
- Обезжирить поверхность.
- Нанести WD-40, используя баллончик.
- После этого необходимо оставить средство на металле на 10-20 минут. За это время ржавчина превратится в ортофосфат. Это будет видно по изменению цвета, он станет серым.
- Осталось убрать остатки загрязнений, используя чистую ветошь.
Простым и действенным способом является очищение от ржавчины с помощью уксуса. Этот вариант больше подходит для чистки небольших изделий.
Ход работы.
- Необходимо налить уксус в емкость. Размер ее должен соответствовать размеру изделия, нуждающегося в обработке.
- Погрузить изделие в тару.
- Оставить в емкости с уксусом.
- Достать изделие, используя резиновые перчатки, затем почистить его.
- Ополоснуть металл, просушить.
А также для этих целей могут использоваться и иные компоненты вроде соды, лимонной кислоты, алюминиевой фольги.
Как мы страдаем от ржавчины
Мы - продавцы металлопроката - как никто сталкивается с этим наваждением - ржавиной. И мы точно знаем вред от коррозии. В этой статье мы скажем несколько слов об этой проблеме, ее проявлениях, ее масштабах.

Ущерб, ущерб.
Все видели эти оранжево-бурые или желтоватые пятна ржавчины на металлических деталях. Экономический ущерб от коррозии металлов огромен. В США и Германии подсчитанный ущерб от коррозии и затраты на борьбу с ней составляют примерно 3 % ВВП. При этом потери металла, в том числе из-за выхода из строя конструкций, изделий, оборудования, составляют до 20 % от общего объема производства стали в год. По России точные данные о потерях от коррозии не подсчитаны.
Доподлинно известно, что именно проржавевшие металлоконструкции стали причиной обрушения нескольких мостов в Соединенных Штатах, в том числе с многочисленными человеческими жертвами. Крайне неприятен и экологический вред: утечка газа, нефти при разрушении трубопроводов приводит к загрязнению окружающей среды.
Виды коррозии и ее причины
Перед тем как говорить о ржавчине на железе, кратко рассмотрим другие ее типы.
Коррозии подвержены не только металлы, но и неметаллические изделия. В этом случае коррозию еще называют «старением». Старению подвержены пластмассы, резины и другие вещества. Для бетона и железобетона существует термин "усталость". Происходит их разрушение или ухудшение эксплуатационных характеристик из-за химического и физического воздействия окружающей среды. Корродируют и металлические сплавы - медь, алюминий, цинк: в процессе их коррозии на поверхности изделий образуется оксидная пленка, плотно прилегающая к поверхности, что значительно замедляет дальнейшее разрушение металла (а патина на меди еще и придает ей особый шарм). Драгоценные металлы являются таковыми не только из-за своей красоты, ценимой ювелирами, но и за счет стойкости к коррозии. Золото и серебро до сих пор используется для покрытия особо чувствительных электронных контактов а платина применяется в космической отрасли.
Корродировать металл может в некоторых участках поверхности (местная коррозия), охватить всю поверхность (равномерная коррозия), или же разрушать металл по границам зерен (межкристаллитная коррозия). Коррозия заметно ускоряется с повышением температуры.

Типы ржавчины
В большей степени коррозии подвержено железо. С точки зрения химии ржавчина - это окислительный процесс (как и горение). Элементы возникающие при окислении в кислородной среде называются Оксиды. Можно выделить 4 основных типа.
1. Желтая ржавчина - химическая формула FeO(OH)H2O (оксид железа двухвалетный). Возникает во влажной, недонасыщенной кислородом среде. Часто встречается под водой. В природе существует в виде минерала вюстита, при этом являясь монооксидом (те содержит 1 атом кислорода).
2. Коричневая ржавчина - Fe2O3 (двойной оксид железа): растет без воды и встречается редко.
3. Черная ржавчина - Fe3O4 (оксид железа четырех валентый). Образуется при малом содержании кислорода и без воды поэтому стабильна и распространяется очень медленно. Этот оксид является ферромагнетиком (при определенных условиях обладает намагниченностью в отсутствие внешнего магнитного поля), поэтому потенциально применим для создания сверх-проводников.
4. Красная ржавчина - химическая формула Fe2O3•H2O (оксид железа трехвалентный). Возникает под воздействием кислорода и воды, самый частый тип, процесс протекает равномерно и затрагивает всю поверхность. В отличии от всех вышеперечисленных не столь опасных для железа видов окисления этот в своей толще образует гидроксид железа, который, начиная отслаиваться, открывает для разрушения все новые слои металла. Реакция может продолжатся до полного разрушения конструкции. Применяется при выплавке чугуна и как краситель в пищевой промышленности. Встречается в природе в естественном виде под названием гематид.
Несколько видов ржавления могут протекать одновременно, не особо мешая друг другу.
Химическая и электрохимическая коррозия
Железо ржавеет, если в нем есть добавки и примеси (например, углерод) и при этом контактирует с водой и кислородом. Если же в воде растворена соль (хлорида натрия и калия), реакция становится электрохимической и процесс ржавления ускоряется. Массовое применение этих солей как в бытовой химии так и для борьбы с льдом и снегом делают электрохимическую коррозию очень распространенным и опасным явлением: потери в США от использования солей в зимний период составляют 2,5 млрд. долларов. При одновременном воздействии воды и кислорода образуется гидроксид железа, который, в отличие от оксида, отслаивается от металла и никак его не защищает. Реакция продолжается либо до полного разрушения железа, либо пока в системе не закончится вода или кислород.

Электрохимическую коррозию могут вызывать блуждающие токи, возникающие при утечке из электрической цепи части тока в водные растворы или в почву и оттуда — в конструкции из металла. В тех местах, где блуждающие токи выходят из металлоконструкций обратно в воду или в почву, происходит разрушение металлов. Особенно часто блуждающие токи возникают в местах движения наземного электротранспорта (например, трамваев и ж/д локомотивов на электрической тяге). Всего за год блуждающие токи силой в 1А способны растворить железа — 9,1 кг, цинка — 10,7 кг, свинца — 33,4 кг.
Во второй части статьи мы расскажем, как вы можете защитить свои металлоконструкции от этой напасти или победить ее, если она уже атакует.
«Рыжая чума», или что мы знаем о ржавчине и коррозии

Пожалуй, каждый автомобилист согласится с тем, что именно ржавчина – одна из самых неприятных проблем, способных омрачить настроение любого автовладельца. Казалось бы, ещё вчера машина радовала взгляд безупречным глянцем лакокрасочного покрытия и вдруг – по кузову полезли «жуки», появились рыжие пятна. На первых порах ничего, кроме эстетического неудовольствия автовладельца, ржавчина под собой не подразумевает. Да и сквозные дыры в крыльях или дверях автомобиля, возникающие в запущенных случаях, неприятны, но, практически неопасны. А вот когда процесс глубоко поразил детали силового каркаса кузова или подвеску машины, последствия могут быть весьма печальными. «Страшилки» про сложившиеся при ДТП «домиком» кузова старых автомобилей – как раз из этой «оперы».
Да что там машины! Ржавчина является одной из главных причин аварий таких титанических железных конструкций, как мосты. Так, 28 июня 1983 года в США произошла катастрофа с мостом через реку Мианус (Mianus). В результате падения в воду с высоты 21 метра двух автомобилей и двух тракторных прицепов погибли 3 человека и ещё 3 были серьёзно травмированы.
Участок межштатного 95-го моста длиной 100 футов через реку Мианус в Гринвиче, Коннектикут, рухнул 29 июня 1983 года. Фотография Боба Чайлда
Согласно заключению комиссии Национального совета по безопасности на транспорте, разрушение было вызвано механической поломкой наружного кронштейна, удерживающего пролёт моста, и его обоих штифтов («пальцев»). Ржавчина образовалась в подшипнике «пальца» кронштейна. Ее объем всегда превышает объем исходной металлической детали, что приводит к неравномерному сопряжению друг с другом деталей конструкции. В случае с данным мостом, масса ржавчины отодвинула внутренний кронштейн от конца штифта, скрепляющего между собой наружный и внутренний кронштейны. (При этом возникло усилие, превышающее допустимые проектом пределы для зажимов, удерживающих эти «пальцы»!) В результате вся масса пролета переместилась на внешний кронштейн. Такая непредвиденная нагрузка на него вызвала усталостную трещину в «пальце». Когда два тяжелых грузовика въехали в данную секцию моста, штифты окончательно разрушились, и пролет упал в реку…
Вообще, процесс коррозии и образования ржавчины сопровождает нас с незапамятных времён. Одновременно с открытием железа и началом железного века человечество столкнулось и с возникновением ржавчины на создаваемых им орудиях труда и предметах быта.
Что такое ржавчина?
Что же такое ржавчина? В обычной жизни этим словом обозначают красные оксиды железа, образующимся в ходе его реакции с кислородом в присутствии воды или влажного воздуха. При наличии кислорода, воды и неограниченного времени любое количество железа, в конце концов, полностью разрушается, превратившись в ржавчину. Физически она представляет собой рыхлый порошок светло-коричневого цвета.
Процесс превращения железа в ржавчину называется коррозией – самопроизвольным разрушением металлов и их сплавов в результате химического, электрохимического или физико-химического взаимодействия с окружающей средой. Разрушение металлов и сплавов по физическим причинам не является коррозией, а характеризуется терминами «истирание» и «износ».
С точки зрения химии коррозия металлов чаще представляет собой процесс их окисления и превращения в оксиды. Ржавление железа – также химическая коррозия. В виде упрощенных уравнений она может быть описана так:
4Fe + 3O2 + 2H2O = 2Fe2O3⋅H2O или 4Fe + 3O2 + 6H2O = 4Fe(OH)3
Т.о. ржавчина состоит из гидратированного оксида железа (III) Fe2O3⋅H2O, гидроксида железа (III) Fe(OH)3 и метагидроксида железа FeO(OH).
Интересно, что ржавчиной, как правило, называют продукты коррозии железа и его сплавов, (например, стали), хотя на самом деле целый ряд металлов также подвергается коррозии.
Однако, многие металлы (Cu, Ti, Zn, Cr, Al и др.) при коррозии покрываются плотной, хорошо скрепленной с ними оксидной пленкой (слой пассивации). Он не позволяет кислороду воздуха и воде проникнуть в более глубокие слои металла и потому предохраняет его от дальнейшего окисления (коррозии).
Взять, к примеру, алюминий – в химическом отношении это очень активный металл, хорошо реагирующий с водой с бурным выделением газа водорода:
2Al + 3H2O = Al2O3+ 3H2 ↑
Но, по причине той же высокой активности, чистый алюминий также хорошо реагирует и с кислородом воздуха. В результате этого взаимодействия поверхность металла покрывается прочной плотной плёнкой оксида Al2O3. Оксидная плёнка защищает алюминий от дальнейшего взаимодействия с водой и кислородом. Именно по этой причине нагреваемая в алюминиевой кастрюльке вода хоть и кипит, но не вступает в реакцию с металлом. (Потому такая посуда может служить длительное время.)
Как ни странно, химически чистое железо относительно устойчиво к воздействию чистой воды и сухого кислорода. Как и у алюминия, плотно скреплённое с поверхностью металла оксидное покрытие защищает основную массу железа от дальнейшего окисления.
Однако, надо отметить, что химически чистое железо в своей деятельности человечество практически не применяет. На практике наша цивилизация использует сталь и чугун – сплавы железа с углеродом (и другими химическими элементами), содержащие не менее 45% железа.
В реальной жизни в воздухе наших городов содержатся оксиды серы, азота, углерода и ряд других; а в воде – растворённые газы и соли. Поэтому процесс коррозии металлов и его продукты зачастую выглядят не так просто, как в учебнике химии за 9 класс. Так, бронзовые статуи, корродируя, покрываются слоем хорошо знакомой нам зелёной патины, представляющей собой с точки зрения химии не гидроксид, а основной сульфат меди (II) (CuOH)2SO4.
В отличие от оксида алюминия и появляющейся на бронзовой (медной) поверхности патины, ржавчина, образующаяся на сплавах железа, не создаёт никакой защиты для нижележащего металла.
Усугубляет ситуацию с коррозией железа содержание неметаллических примесей в его сплавах. Например, наличие серы в сплаве лишь способствует развитию ржавчины. Обычно она присутствует, как сульфид FeS, но может быть и в виде других химических соединений. В процессе коррозии сульфид железа разлагается с выделением газа сероводорода (H2S), который сам по себе является хорошим катализатором дальнейшей коррозии железа:
FeS + 2HCl = H2S ↑+ FeCl2
Нас удивляет хорошая сохранность (а значит, устойчивость к коррозии) ряда железных предметов, дошедших из глубины веков до наших дней. Одна из причин этого – низкое содержание в них серы. В сплавы железа сера обычно попадает из каменноугольного кокса при выплавке железа из руды в доменной печи. А вот в древние времена для производства этого металла использовался не каменный, а, практически не содержащий серы, древесный уголь…
По выраженности поражения различают сплошную и местную коррозию металлов. Как ни странно, но сплошная коррозия не представляет большой опасности для металлических конструкций и агрегатов. Считается, что она предсказуема, а ее последствия могут быть относительно легко смоделированы. Поэтому при проектировании металлоконструкций, эксплуатирующихся в водной среде или под открытым небом, в соответствии с технически обоснованными нормами, учитываются и будущие потери металла на коррозию.
Усугубляющие факторы
А вот местная коррозия гораздо опаснее, несмотря на то, что потери металла из-за неё могут быть вполне небольшими. Один из самых опасных видов местной коррозии – точечная. Ведь снижая прочность на отдельных участках, она значительно уменьшает общую надёжность конструкций, сооружений и агрегатов. Суть её заключается в формировании сквозных поражений деталей – образовании в них точечных полостей, называемых питтингами.
Развитию местной коррозии очень способствуют морская вода и растворы солей, в частности хлориды (особенно хлорид натрия – NaCl). Во многих странах его используют для плавления снега и льда, разбрасывая зимой на дорогах и тротуарах. В присутствии NaCl лёд и снег превращаются в воду, с дальнейшим образованием соляных растворов.
При этом не учитывается, что соли (и особенно хлориды) являются активаторами коррозии! Отлично диссоциируя в воде и взаимодействуя с образующейся из-за выбросов предприятий серной кислотой, хлориды образуют соляную кислоту (HCl). А ведь она сама по себе является триггером коррозии! (Вспомним приведенную выше реакцию с входящим в состав стали сульфидом железа.) Какие ещё нужны доказательства, что зимняя соляная «каша» приводит к ускоренному разрушению металла деталей, узлов и агрегатов транспортных средств?
Экономические потери от коррозии металлов
Экономические потери от коррозии металлов огромны. Современная цивилизация тратит значительные материальные и финансовые ресурсы на борьбу с коррозией трубопроводов, мостов и морских конструкций, судов, деталей машин, а также различного технологического оборудования.
Как уже говорилось, из-за планирования возможной коррозии приходится завышать прочность таких важных и нагруженных узлов и агрегатов, как паровые котлы, реакторы, лопатки и роторы турбин, опоры морских буровых платформ. Это автоматически увеличивает расход металла на их изготовление, а, значит, приводит к дополнительным экономическим затратам.
За два века работы металлургической промышленности в мире было выплавлено огромное количество металла. При этом, потери на коррозию составляют около 30% от его годового мирового производства! Более того – около 10% подвергшегося коррозии металла безвозвратно теряется в виде ржавчины.
По оценкам ряда экспертов, ущерб от коррозии металлов бюджету промышленно развитых стран составляет от 2 до 4 % их валового национального продукта. Так, по данным Национальной ассоциации инженеров-коррозионистов (National Association of Corrosion Engineers – NACE) в США потери от коррозии и затраты на борьбу с ней составляют 3,1 % ВВП. Для Германии это обходится в 2,8 % от ВВП.
P.S. Казалось бы, проблемы коррозии автомобильных кузовов, узлов и агрегатов меркнут на фоне вопросов защиты от коррозии таких грандиозных железных сооружений, как мосты и Эйфелева башня. Но, это только на первый взгляд. А если учесть численность мирового автопарка? Так, по данным Международной ассоциации автопроизводителей (OICA), в 2015 году в мире эксплуатировалось 947 млн. легковых и 335 млн. коммерческих автомобилей. Ожидается, что к 2035 году мировой автопарк достигнет 2-миллиардной отметки.
При этом, коррозией в той или иной степени, рано или поздно поражается практически 100% транспортных средств. Кроме того, надо учесть, что кузов – самая дорогая деталь автомобиля, а кузовные работы (и слесарные, и малярные) достаточно материалоёмкие и очень недешёвые.
Поэтому, проблема изыскания новых и совершенствование старых способов защиты от коррозии актуальна, как для всей тяжёлой промышленности в целом, так и для автомобильной отрасли в частности.
___________
KROWN — ЗА НАМИ НЕ ЗАРЖАВЕЕТ
Центр антикоррозийной защиты автомобилей
Читайте также:
