Какой металл входит в состав хлорофилла
Обновлено: 05.07.2024
Почему трава, а также листья на деревьях и кустах зеленые? Виной всему хлорофилл. Можно взять прочную веревку знаний и завязать с ним крепкое знакомство.
История
Проведем небольшой экскурс в сравнительно недалекое прошлое. Жозеф Бьенеме Каванту и Пьер Жозеф Пеллетье – вот кому нужно пожать руку. Мужи науки постарались отделить зеленый пигмент из листьев разных растений. Старания увенчались успехом в 1817 году.
Пигмент наименовали хлорофилл. От греческого chloros – зеленый, и phyllon - лист. Независимо от вышесказанного, в начале 20 века Михаил Цвет и Рихард Вильштеттер пришли к выводу: оказывается, в хлорофилл входит несколько компонентов.
Засучив рукава, Вильштеттер принялся за работу. Очистка и кристаллизация выявили два компонента. Назвали их просто, альфа и бета (а и b). За труды в поле исследования данного вещества в 1915 году ему торжественно вручили премию Нобеля.
В 1940 Ханс Фишер предложил всему миру окончательную структуру хлорофилла «а». Король синтеза Роберт Бернс Вудворд и несколько ученых из Америки получили в 1960 году ненатуральный хлорофилл. Так и приоткрылась завеса тайны – появление хлорофилла.

Химические свойства
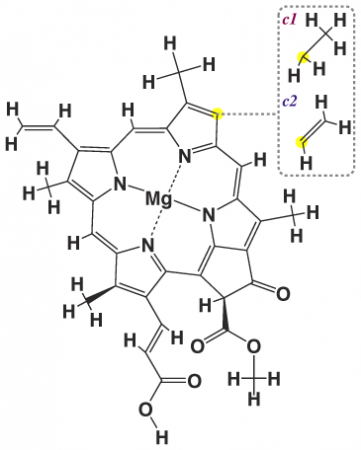
Формула хлорофилла, определенная из опытных показателей, выглядит так: C55H72O5N4Mg. В конструкцию входит органическая дикарбоновая кислота (хлорофиллин), а также спирты метиловый и фитол. Хлорофиллин – это металлорганическое соединение, имеющее прямое отношение к магнийпорфиринам и содержащее азот.
Хлорофилл значится сложным эфиром из-за того, что оставшиеся части метилового спирта CH3OH и фитола C20H39OH заместили водород карбоксильных группировок.
Выше размещена структурная формула хлорофилла альфа. Разглядев ее внимательно, можно увидеть, что у бета-хлорофилла на один атом кислорода больше, но на два атома водорода меньше (группа CHO вместо CH3). Отсюда молекулярная масса альфа-хлорофилла ниже, чем у бета.
В середине частицы интересующего нас вещества обосновался магний. Он соединяется с 4 атомами азота пиррольных формирований. Систему элементарных и сменяющихся двойных связей можно наблюдать в пиррольных связках.
Хромофорное формирование, удачно вписываемое в состав хлорофилла - это и есть N. Оно делает возможным впитывание отдельных лучей солнечного спектра и его цвет, независимо от того, что днем солнце горит, как пламя, а вечером похоже на тлеющие угли.
Перейдем к размерам. Порфириновое ядро в диаметре 10 нм, фитольный фрагмент оказался длинной в 2 нм. В ядре хлорофилл составляет 0,25 нм, меж микрочастицами пиррольных группок азота.
Хотелось бы отметить, что атом магния, который входит в состав хлорофилла, в диаметре всего 0,24 нм и практически полностью заполняет свободное место между атомами пиррольных группировок азота, что помогает ядру молекулы быть более крепким.
Можно прийти к выводу: из двух составляющих под нехитрым названием альфа и бета и состоит хлорофилл (a и b).
Хлорофилл a
Относительная масса молекулы - 893,52. Создают в отделенном пребывании микрокристаллы черного цвета с голубым отливом. При температуре 117-120 градусов Цельсия они расплавляются и перевоплощаются в жидкость.
В этаноле такие же хлороформы, в ацетоне, а еще бензолах растворяются охотно. Результаты принимают сине-зеленую окраску и имеют отличительную особенность - насыщенная красная флуоресценция. Плохо растворяются в петролейном эфире. В воде не распускаются вовсе.
Формула хлорофилла альфа: C55H72O5N4Mg. Вещество по своей химической конструкции относят к хлоринам. В кольце к пропионовой кислоте, а именно к ее остатку, прикреплен фитол.
Кое-какие растительные организмы, вместо хлорофилла a, образуют его аналог. Здесь этильную группу (-CH2-CH3) во II пиррольном кольце сменила винильная (-CH=CH2). Такая молекула заключает в себе первую винильную группу в кольце один, вторую в кольце два.
Хлорофилл b
Формула хлорофилла-бета имеет следующий вид: C55H70O6N4Mg. Молекулярный вес вещества составляет 903. У атома углерода C3 в пиррольном кольце два, обнаруживается немного спирта, лишенного водорода –H-C=O, который обладает желтым цветом. Это и есть отличие от хлорофилла a.
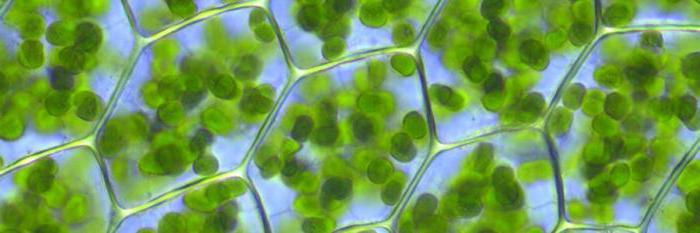
Смеем заметить, что в специальных постоянных частях клетки, жизненно важных для ее дальнейшего существования пластидах-хлоропластах, пребывают несколько типов хлорофиллов.
Хлорофиллы c и d
У криптомонад, динофлагеллятов, а также у бациллариофициевых и бурых водорослей найден хлорофилл с. Классический порфирин – вот чем отличается этот пигмент.
У водорослей красной окраски хлорофилл d. Некоторые сомневаются в его существовании. Полагается, что он является только продуктом вырождения хлорофилла a. На данный момент можно уверенно сказать, что хлорофилл с литерой d – это основной краситель кое-каких фотосинтезирующих прокариотов.
Свойства хлорофилла
После продолжительных исследований возникло доказательство, что в особенностях хлорофилла, пребывающего в растении и добытого из него, замечена несхожесть. Хлорофилл в растениях соединен с белком. Об этом свидетельствуют следующие наблюдения:
- Спектр впитывания хлорофилла в листе другой, если сравнить его с извлеченным.
- Чистым спиртом из высохших растений предмет описания достать нереально. Протекает экстракция благополучно при хорошо увлажненных листьях, либо следует долить в спирт воду. Именно она разбивает связанный с хлорофиллом белок.
- Материал, вытянутый из листьев растений, быстро разрушается под влиянием кислорода, концентрированной кислоты, световых лучей.
Зато хлорофилл в растениях устойчив ко всему вышеперечисленному.
Хлоропласты
В растениях хлорофилла содержится 1% от сухого вещества. Найти можно в особых органеллах клетки – пластидах, что показывает неравномерное распределение его в растении. Пластиды клеток, окрашенные в зеленый цвет и имеющие в себе хлорофилл, имеют название хлоропласты.
Количество H2O в хлоропластах колеблется от 58 до 75%, содержимое сухого вещества состоит из белков, липидов, хлорофилла и каротиноидов.
Функции хлорофилла
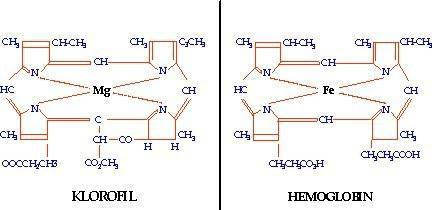
Удивительное сходство обнаружили ученые в устройстве молекул хлорофилла и гемоглобина – главного дыхательного компонента человеческой крови. Отличие состоит в том, что в клешневидном соединении посередине в пигменте растительного происхождения размещен магний, а в гемоглобине - железо.
В ходе фотосинтеза растительность планеты поглощает углекислый газ, выделяет кислород. Вот еще одна замечательная функция хлорофилла. По деятельности его можно сравнить с гемоглобином, но объем воздействия на человеческий организм несколько больше.

Хлорофилл – это растительный пигмент, чувствительный к свету и покрытый зеленым цветом. Далее идет фотосинтез, при котором его микрочастицы преобразовывают энергию солнца, поглощаемую клетками растений, в химическую энергию.
Можно прийти к следующим умозаключениям, что фотосинтез – это процесс преобразования энергии солнца. Если доверять современным сведениям, замечено, что протекание синтеза органических веществ из газа углекислого и воды с использованием световой энергии разложено на три этапа.
Этап №1
Данная фаза вершится в процессе фотохимического распада воды, при содействии хлорофилла. Отмечается выделение молекулярного кислорода.
Этап №2
Здесь наблюдается несколько окислительно-восстановительных реакций. В них берут активное содействие цитохромы и иные переносчики электронов. Реакция происходит за счет световой энергии, переносимой электронами от воды на NADPH и образующей ATP. Тут запасается световая энергия.

Этап №3
Уже образовавшиеся NADPH и ATP пускаются в ход для преобразования углекислого газа в углевод. Поглощенная энергия света участвует в реакциях 1 и 2 этапов. Реакции последнего, третьего, происходят без участия света и называются темновыми.
Фотосинтез – это единственный биологический процесс, проходящий с возрастанием свободной энергии. Прямо или косвенно обеспечивает доступной химической предприимчивостью обитающих на земле двуногих, крылатых, бескрылых, четвероногих и прочие организмы.
Гемоглобин и хлорофилл
Молекулы гемоглобина и хлорофилла имеют сложную, но в то же время схожую атомарную структуру. Общим в их строении является профин – кольцо из маленьких колечек. Различие замечено в отросточках, присоединённых к профину, и в атомах, расположенных внутри: атом железа (Fe) у гемоглобина, у хлорофилла магний (Mg).
Хлорофилл и гемоглобин по строению похожи, но формируют разные белковые структуры. Вокруг атома магния сформирован хлорофилл, вокруг железа - гемоглобин. Если взять молекулу жидкого хлорофилла и отсоединить фитольный хвост (20 углеродную цепь), поменять атом магния на железо, то зеленый цвет пигмента станет красным. В итоге - готовая молекула гемоглобина.
Усваивается хлорофилл легко и быстро, благодаря именно такому сходству. Хорошо поддерживает организм при кислородном голодании. Насыщает кровь нужными микроэлементами, отсюда она лучше транспортирует важнейшие для жизни вещества к клеткам. Происходит своевременный выброс отработанных материалов, токсинов, отходов, возникающих в результате естественного обмена веществ. Имеет воздействие на спящие лейкоциты, пробуждая их.
Описываемый герой без страха и упрека защищает, укрепляет мембраны клетки, помогает восстановиться соединительной ткани. К заслугам хлорофилла можно отнести быстрое заживление язв, разных ран и эрозий. Улучшает иммунную работу, выделена способность купировать патологические нарушения молекул ДНК.
Положительная тенденция при лечении инфекционных и простудных заболеваний. Это не весь список добрых дел рассмотренного вещества.
Хлорофилл
пигмент, окрашивающий растения в зеленый цвет. Это азотистое тело, не растворимое в воде, растворимое в спирте, эфире, сероуглероде и маслах. X. легко разлагается от действия света, кислот и щелочей. При падающем свете флуоресцирует вишнево-красным цветом. Для извлечения X. листья обрабатываются спиртом. Зеленая вытяжка кроме X. содержит другие пигменты и посторонние примеси. Для разделения пигментов существует несколько способов. Один изх них состоит в том, что спиртовая вытяжка осаждается баритовой водой, образовавшийся зеленый осадок собирается на фильтре и обрабатывается спиртом, который извлекает желтые пигменты — ксантофилл и каротин. Хорошо промытый спиртом зеленый осадок разлагается едким кали. На полученный зеленый раствор наливается слой эфира, и затем, для нейтрализации едкого кали, прибавляется по каплям слабая уксусная кислота. После нейтрализации и взбалтывания X. переходит в слой эфира. Но полученный по этому способу X. уже несколько изменен. Получить вполне чистый и неизмененный X. крайне трудно. Лучшие результаты дает следующий способ. Листья извлекаются 82-процентным спиртом. Экстракт взбалтывается с равным объемом сероуглерода. Сероуглеродный слой отделяется и еще несколько раз взбалтывается с равными объемами спирта прежней крепости. Затем сроуглеродный раствор выпаривается и осадок растворяется в спирте. Из всех свойств X. особенного внимания заслуживает его спектр поглощения.
Фиг. 1. I — спектр раствора X. слабой концентрации. II — спектр раствора Χ средней концентрации. III — спектр желтых пигментов.
В спектре X. слабой концентрации замечается одна резкая полоса между фрауенгоферовыми линиями В и С и поглощение лучей вправо от линии b (фиг. 1, I). При средней концентрации появляются еще три полосы между С и D, на D и немного влево от E (фиг. 1, II). При увеличении концентрации абсорбционные полосы делаются толще, сливаются, так что через концентрированный раствор X. проходят уже только красные лучи между А и В и часть зеленых лучей. Наконец, при еще большей концентрации и зеленые лучи поглощаются, проходят только одни красные лучи между А и В. Желтые пигменты дают сплошное поглощение всех лучей вправо от линии b (фиг. 1, III). Образование X. зависит от нескольких условий. Одно из них — свет. Выросшие в темноте листья всегда желтого цвета. Такие листья называются этиолированными; будучи выставлены на свет, они скоро зеленеют. Исключение представляют только ростки некоторых хвойных, молодые ваи папоротников, а также некоторые одноклеточные водоросли, зеленеющие в темноте. Для зеленения наиболее благоприятен свет средней напряженности. Если часть выросших в темноте растений выставить на прямой солнечный свет, другую же часть, также выставленную на свет, затенить вертикально повешенными листьями бумаги, то зеленеть постоянно начинают скорее затененные растения. Это объясняется тем, что одновременно с зеленением идет противоположный процесс разрушения X. На слабом и среднем свете разрушения X. почти не происходит. На ярком же свете одновременно с сильным образованием X. идет очень значительное разрушение его и в результате — более слабое зеленение, чем на рассеянном свете. Для зеленения достаточно очень слабого света. Различные лучи спектра неодинаково влияют на образование X. Для изолирования отдельных частей спектра пользуются методом цветных экранов: берутся стеклянные колокола с двойными стенками, наполненные цветными жидкостями. Один колокол наполняется раствором двухромокислого калия, другой — аммиачным раствором окиси меди. Первая жидкость при средней концентрации пропускает лучи первой менее преломляемой части спектра, т. е. красные, оранжевые, желтые и часть зеленых. Вторая жидкость пропускает лучи остальной половины спектра, т. е. вторую половину зеленых, голубые, синие и фиолетовые. Следовательно, при помощи двух названных растворов спектр делится на две половины. На слабом свете зеленение наступает ранее под желтыми колпаками, на ярком же свете — под синими колпаками. Образование X. зависит также от температуры. При очень низкой, как и при очень высокой температуре, нет зеленения. Так, опыты над зеленением ростков ячменя показали:
В зависимости от света и температуры воздуха находится осенняя окраска листьев. Осенние лучи солнца разрушают X., низкая же температура препятствует его новообразованию. Напр., ветви Chamaecypans obtusa, освещаемые солнцем, имеют осенью золотисто-желтый цвет, тогда как затененные ветви остаются зелеными. Третье необходимое условие для образования X. — это присутствие железа. Без железа вырастают бледно-желтые растения, называемые хлоротическими. Самая болезнь называется хлорозисом (см.) и излечивается железными солями. Для зеленения необходим также кислород. На свете в атмосфере, лишенной кислорода, листья остаются желтыми. Недостаток в почве необходимых для растения зольных элементов отражается уменьшением количества X. Уменьшение количества X. вызывается также и избытком минеральных веществ. Наконец, для образования X. необходимы углеводы. Этиолированные листья различных растений, по содержанию в них углеводов, распадаются на две группы. Этиолированные листья одних растений, как, напр., пшеницы, содержат значительное количество растворимых углеводов. Листья же других этиолированных растений (бобов) не содержат их почти ни следа. Если отрезанные этиолированные листья положить на поверхность воды и выставить на свет, то листья пшеницы позеленеют, листья же бобов останутся желтыми. Если же листья бобов положить не на воду, а на раствор сахарозы, глюкозы, фруктозы, то они также все позеленеют. Попытки установить химическую природу X. не давали определенных результатов, пока не занялись продуктами его распада. При пропускании через спиртовой раствор X. тока хлороводорода осаждается почти черная масса. Этот осадок отфильтровывается, промывается спиртом и растворяется в эфире. Раствор отфильтровывается и разбавляется равным объемом крепкой соляной кислоты и взбалтывается. Соляно-кислый слой отделяется, оставляется некоторое время открытым для испарения оставшегося эфира и затем разбавляется избытком воды. Получившийся сине-черный осадок отфильтровывается, промывается, растворяется в кипящей крепкой уксусной кислоте и оставляется стоять. Через некоторое время оседают кристаллики филлоцианина, который перекристаллизовывается из крепкой уксусной кислоты. Для уксусно-кислой медной двойной соли филлоцианина вычислена следующая формула C68H71N5O17Cu2. Оставшийся после отделения соляно-кислого раствора филлоционина грязно-желтый эфирный раствор выпаривается в плоских чашках. Полученная темно-коричневая масса растворяется в хлороформе и разбавляется большим количеством спирта. В осадке будет филлоксантин. При обработке кислотами филлоксантин переходит в филлоцианин. Последний же, выпаренный с соляной кислотой, дает филлотаонин. Филлотаонин удобнее, впрочем, получать следующим образом. Зеленые листья кипятят около двух часов с алкогольным раствором едкого натра. Через отфильтрованный зеленый раствор пропускается ток хлороводорода. Раствор делается светлее и, наконец, становится пурпуровым. Через несколько дней из раствора осаждаются красивые игольчатые кристаллы филлотаонина. Формула его: С40Н38N6О5(ОН). При нагревании филлотаонина с алкогольным раствором едкого кали в течение нескольких часов при 190°, разбавлении затем водой и взбалтывании с эфиром, последний окрашивается в пурпурово-красный цвет. При выпаривании эфира получается осадок, который по очистке дает темные красно-фиолетовые кристаллы филлопорфирина — C16H18N2O. Эти исследования получают еще тот интерес, что из пигмента крови гемоглобина был получен гематопорфирин такого состава: C16H18N2O3. Близость состава заставляет предполагать, что гематопорфирин представляет собой диоксифиллопорфирин.

Фиг. 2. 1 — филлопорфирин в эфире; 2 — гематопорфирин в эфире; 3 — филлопорфирин в соляной кислоте; 4 — гематопорфрин в соляной кислоте.
Оба тела имеют замечательно сходные спектры, как видно на фиг. 2, только линии гематопорфирина по сравнению с линиями филлопорфирина немного сдвинуты в сторону красных лучей. Следовательно X., выдающийся синтетик, является близким родственником гемоглобина — величайшего аналитика. Близким родственником им оказывается также пигмент желчи билирубин — Cl6Н16N2О3. Если нагревать филлотоанин в пробирке, и в отделяющихся парах поместить смоченные соляной кислотой еловые опилки, то последние краснеют, что указывает на присутствие пиррола. Ту же реакцию дает гематопорфирин, который при восстановлении дает гемопиррол C8H13N, производное пиррола — C4H5N. Из продуктов изменения X. заслуживает внимания также протофиллин, получаемый при действии водорода in statu nascendi. Это вещество в растворе желтого или красного цвета в зависимости от концентрации в высшей степени легко окисляется и дает X. В этиолированных листьях находится сходное вещество — протохлорофилл.
Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона. — С.-Пб.: Брокгауз-Ефрон . 1890—1907 .
Хлорофилл: его свойства и биосинтез
Белки – высокомолекулярные азотосодержащие органические вещества, молекулы которых построены из остатков аминокислот. Белки составляют до половины и более сухой массы живой клетки.
Состав белков по химическим элементам: C, O, H, N, иногда S. В белках встречаются также элементы Fe, Cu, Zn и др. Но не химические элементы являются «буквами алфавита», из которых складывается всё многообразие «слов» – молекул белков. Такими структурными элементами белков природа выбрала простые соединения -- -аминокислоты.
Все белки состоят в основном из 20 -аминокислот.
По составу белки делятся на простые и сложные. Простые состоят только из аминокислотных остатков. Сложные белки отличаются от простых наличием простетической группы. Сложный белок, утративший простетическую группу, называют анобелком. Сложные белки подразделяют на классы в зависимости от состава и структуры простетической группы
название сложных белков простетическая группа
металлопротеины атомы металлов
фосфопротеины фосфатные группы
гликопротеины алигосахариды, простые сахара
нуклеопротены ДНК или РНК
Белки относятся к высокомолекулярным соединения, в состав которых входят сотни и даже тысячи аминокислотных остатков, объединённых в макромолекулярную структуру. Молекулярная масса белков колеблется от 6000 до 1000000 дальтон и выше в зависимости от количества отдельных полипептидных цепей в составе единой молекулярной структуры белка. Такие полипептидные цепи получили название субъединиц. Их молекулярная масса варьируется в широких пределах: от 6000 до 100000 и более дальтон.
Хлорофилл относится к классу белков. Хлорофилл представляет собой «одно из интереснейших веществ на земной поверхности» (Ч. Дарвин), так как благодаря ему возможен синтез органических веществ из неорганических C и .
Важнейшую роль в процессе фотосинтеза играет зелёный пигмент – хлорофилл. Французские учёные Пелетье и Кавенту (1818) выделили из листьев зелёное вещество и назвали его хлорофиллом (от греч. «хлорос» – зелёный и «филлон» – лист). В настоящее время известно около 10 хлорофиллов. Они отличаются по химическому строению, окраске, распространению среди живых организмов. У всех высших растений содержатся хлорофиллы а и b. Хлорофилл с содержится в диатомовых водорослях, хлорофилл d – в красных водорослях. Кроме того, известны четыре бактериохлорофилла, содержащиеся в клетках фотосинтезирующих бактерий. В клетках зелёных бактерий содержатся бактериохлорофиллы с и d. В клетках пурпурных бактерий – бактериохлорофиилы а и b. Основными пигментами, без которых фотосинтез не идёт, являются хлорофилл а для зелёных растений и бактериохлорофилл для бактерий.
В первые точное представление и пигментах зелёного листа было получено благодаря работам крупнейшего русского ботаника М. С. Цвета. Он выделил пигменты листа в чистом виде и разработал новый хроматографический метод разделения веществ. Метод этот в дальнейшем получил широкое применение, как в биохимии, так и в чисто химических исследованиях.
Хлорофиллы а и b различаются по цвету. Хлорофилл а имеет сине-зелённый оттенок, а хлорофилл b – жёлто-зелёный. Содержание хлорофилла а в листе примерно в три раза больше по сравнению с хлорофиллом b.
Условия образования хлорофилла.
Образование хлорофилла осуществляется в 2 фазы: первая фаза – темновая, во время которой образуется предшественник хлорофилла – протохлорофилл, а вторая – световая, при которой из протохлорофилла на свету образуется хлорофилл. Для образования хлорофилла необходимо наличие железа. При недостатке железа получаются растения, характеризующиеся бледными полосами и слабой зелёной окраской листьев. Образование хлорофилла зависит от температуры. Оптимальная температура для накопления хлорофилла 26-30 С. Как и следовало ожидать, от температуры зависит лишь образование протохлорофилла (темновая фаза). При наличии уже образовавшихся протохлорофиллов процесс зеленения (световая фаза) идёт с одинаковой скоростью независимо от температуры. На скорость образования хлорофилла оказывает влияние содержания воды. Сильное обезвоживание проростков приводит к полному прекращению образования хлорофилла. Особенно чувствительно к обезвоживанию образование протохлорофилла.
Ещё В. И. Палладин обратил внимание на необходимость углеводов для протекания процесса зеленения. Именно с этим связано то, что зеленение проростков на свету зависит от их возраста. После 7-9-дневного возраста способность к образованию хлорофилла у таких проростков резко падает. При опрыскивании сахарозой проростки снова начинают интенсивно зеленеть.
Важнейшее значение для образования хлорофилла имеют условия минерального питания. Прежде всего, необходимо достаточное количества железа. При недостатке железа даже листья взрослых растений теряют окраску. Это явление названо хлорозом. Железо – необходимый катализатор образования хлорофилла. Оно необходимо на этапе синтеза δ-аминолевулиновой кислоты из глицерина и сукцинил-КоА, а также синтеза протопорфирина. Большое значение для обеспечения синтеза хлорофилла имеет нормальное снабжение растений азотом и магнием, так как оба эти элемента входят в состав хлорофилла. При недостатке меди хлорофилл легко разрушается. Это, по-видимому, связано с тем, что медь способствует образованию устойчивых комплексов между хлорофиллом и соответствующими белками.
Исследования процесса накопления хлорофилла у растений в течение вегетационного периода показало, что максимальное содержание хлорофилла приурочено к началу цветения. Есть даже мнение, что повышение образования хлорофилла может быть использовано как индикатор, указывающий на готовность растений к цветению. Синтез хлорофилла зависит от деятельности корневой системы. Так, при прививках содержание хлорофилла в листьях привоя зависит от свойств корневой системы подвоя. Возможно, что влияние корневой системы связано с тем, что там образуются гормоны (цитокинины). У двудомных растений большим содержанием хлорофилла характеризуются листья женских особей.
Химические свойства хлорофилла.
По химическому составу хлорофилл представляет сложный эфир дикарбоновой кислоты хлорофинилла. Хлорофинилл представляет собой азотосодержащее металлоорганическое соединение, относящееся к магний-порфиринам. В центре молекуле хлорофилла расположен атом магния, который соединён с четырьмя азотами пиррольных группировок. В пиррольных группировках хлорофилла имеется система чередующихся двойных и простых связей. Это и есть хромофорная группа хлорофилла, обуславливающая его окраску.
Наличие магния обнаруживается легко. Стоит только подействовать на спиртовую вытяжку хлорофилла слабым раствором соляной или какой-нибудь другой кислоты, чтобы определить магний. При этом произойдёт изменение окраски – вытяжка приобретает жёлто-бурый оттенок. Хлорофилл без магния получил название феофитина:
В молекуле феофитина сравнительно легко ввести обратно какой-нибудь металл и восстановить металлоорганическую связь. Для этого к раствору феофитина прибавляют уксуснокислую медь или уксуснокислый цинк и нагревают. Цинк или медь входят в молекулу хлорофилла, и вытяжка становится опять зелёного цвета.
Химическая формула была установлена в 1913 году немецкими биохимиками Р. Вильштеттером и А. Штоллем. Им удалось её установить, последовательно отщепляя от молекулы хлорофилла отдельные её части действием кислот и щелочей, а в дальнейшем и нагреванием под давлением. До этих работ в физиологии растений считалось, что хлорофилл содержит железо, а не магний. Они же окончательно доказали и наличие двух хлорофиллов – а и b.
Эти же работы сделали образование кристаллического хлорофилла. Вильштеттер и Штолль показали, что имеющийся в зелёных листьях фермент хлорофиллаза отщепляет спирт фитол и на его место становится остаток этилового или метилового спирта. Такие соединения получили название хлорофиллидов. Если фитол замещается остатком этилового спирта, то полученное соединение называется этилхлорофиллидом.
Оптические свойства хлорофилла.
Хлорофилл поглощает солнечную энергию и направляет её на химические реакции, которые не могут протекать без энергии, получаемой извне. Раствор хлорофилла в проходящем свете имеет зелёный цвет, но при увеличении толщины слоя или концентрации хлорофилла он приобретает красный цвет.
Хлорофилл поглощает свет не сплошь, а избирательно. При пропускании из семи видимых цветов, которые постепенно переходят друг в друга. При пропускании белого света через призму и раствор хлорофилла на полученном спектре наиболее интенсивное поглощение будет в красных и сине-фиолетовых лучах. Зелёные лучи поглощаются мало, поэтому в тонком слое хлорофилл имеет в проходящем свете зелёный цвет. Однако с увеличением концентрации хлорофилла полосы поглощения расширяются (значительная часть зелёных лучей также поглощается) и без поглощения проходит только часть крайних красных. Спектры поглощения хлорофилла а и b очень близки.
В отражённом свете хлорофилл, кажется вишнёво-красным, так как он излучает поглощённый свет с изменением длины его волны. Это свойство хлорофилла называется флюоресценцией.
Биосинтез хлорофилла
Исходными для синтеза хлорофилла субстратами являются очень простые органические соединения – ацетат и глицин. Процесс синтеза хлорофилла принято подразделять на три этапа.
Первый этап состоит из следующих реакций:
1. Образование ацетилкофермента А, в котором принимает участие ацетат, кофермент А и АТФ. Реакция катализируется ацилкофермент А-синтетазой.
2. Образование сукцинилкофермента А из двух молекул ацетилкофермента А. Считается не менее вероятным другой путь: вовлечение ацетата в цикл Кребса и образование в нём сукцината и затем сукцинилкофермента А. Некоторые исследователи считают исходным субстратом биосинтеза хлорофилла именно сукцинилкофермент А, не рассматривая реакции его образования (как не специфичные, осуществляющиеся в связи и с другими метаболическими цепочками).
3. Образование -амино--кетоадипиновой кислоты из сукцинилкофермента А и глицина, катализируемого так же, как и следующая реакция, ферментом синтетазой -аминолевулиновой кислоты:
4. Из -амино--кетоадипиновой кислоты путём декарбоксилирования образуется -аминолевулиновая кислота:
5. Синтез из двух молекул -аминолевулиновой кислоты пирроленинового кольца и затем изомеризация его в пиррольное кольцо с образованием порфобилиногена. Реакция катализируется ферментом дегидразой -аминолевулиновой кислоты.
Второй этап включает реакции синтеза из четырёх пиррольных колец одной молекулы протопорфирина.
6. Из четырех молекул порфобилиногема под влиянием фермента порфобилиноге-дезаминазы синтезируется цепочка тетрапиррана.
7. Наименее изучен механизм реакции замыкания открытой цепи тетрапиррана в уропорфириноген III.
8. В результате декарбоксилирования всех четырёх остатков ацетата из уропорфириногена III образуется копропорфириноген III, фермент – уропорфириногендекарбоксилаза.
9. Происходит декарбоксилирование и дегидрирование двух из четырёх пропионатных остатков, что приводит к появлению винильных радикалов в кольцах и образованию протопорфириногена IX, фермент – копропорфириногендекарбоксилаза.
10.
В результате дегидрирования протопорфириногена IX появляется протопорфирин IX.
Третий этап характеризуется образованием и превращением магнийпорфиринов.
11. Протопорфирин, взаимодействуя с магнием, превращается в магнийпротопорфирин.
12.
Далее следует ферментативная этерификация метилом пропионатного остатка и образование монометилового эфира магний протопорфирина.
13.
Последний превращается в протохлорофиллид в серии реакций, включающих преобразование метильного производного пропионата.
14.
Превращение протохлорофиллида в хлорофиллид, заключающееся в гидрировании одной из двух двойных связей кольца, осуществляется, как правило, при участии света (в ходе фотохимической реакции).
Лишь у некоторых низших и голосеменных растений эта реакция может протекать ферментативно в темноте. В хлорофиллид превращается не свободная форма протохлорофиллида, а связанная с белком в единый комплекс – так называемый протохлорофиллидголохром.
15. Последняя реакция – ферментативная этерификация хлорофиллида фитолом, в результате чего образуется хлорофилл а.
Поскольку синтез хлорофилла – многоэтапный, в нём участвуют различные ферменты, составляющие, по-видимому, полиферментный комплекс. Интересно заметить, что образование многих из этих белков-ферментов ускоряется на свету. Содержание хлорофилла в листе колеблется незначительно. Это связано с тем, что идёт непрерывный процесс разрушения старых молекул и образование новых молекул хлорофилла. Причём эти два процесса уравновешивают друг друга. При этом предполагается, что вновь образовавшиеся молекулы хлорофилла не смешиваются со старыми и имеют несколько иные свойства.
Различные виды хлорофилла.
Различные виды хлорофилла отличаются, как правило, природой заместителей при -атомах углерода в пиррольных кольцах порфиринов. Все связи -углеродных атомов заняты в формировании порфиринового кольца и поэтому не могут определять специфику отдельных видов хлорофилла. Хлорофиллы бактерий называют бактериохлорофиллами. Их известно четыре. Большинство пурпурных бактерий содержит бактериохлорофилл а, который и обуславливает их способность к фотосинтезу:
Этот пигмент представляет собой порфирин, у которого -углеродные атомы имеют следующих заместителей в положениях: 1 – метил, 2 – ацетил, 3 – метил, 4 – этил, 5 – метил, 6-й атом углерода участвует в образовании насыщенного циклопентанового кольца, 7 – сложный эфир пропионовой кислоты и высокомолекулярного ненасыщенного спирта фитола, 8 – метил. Кольца В и D имеют лишь по одной двойной связи. В циклопентановом кольце в положении 9 – кетогруппа, а в 10 – карбоксиметильный радикал . Фитол может рассматриваться как производное изопрена или дитерпена с одной двойной связью.
Бактериохлорофиллы с и d зелёных бактерий отличаются от бактериохлорофилла а рядом особенностей. Они не имеют циклопентановного кольца. Карбоксиметильный радикал при атоме 10 отсутствует, а атомы 9 и 10 входят в состав пропила. Вместо фитольного остатка содержат фарнезильный -- .
При втором углеродном атоме порфирин имеется вместо ацетильного оксиэтильный радикал . У некоторых зелёных бактерий имеется несколько процентов (до 10) бактериохлорофилла а.
Все другие фотосинтезирующие организмы содержат в качестве основного зелёного пигмента хлорофилл а.
От бактериохлорофилла а он отличается тем, что в положении 2 имеет винильный радикал , а кольцо В имеет ещё одну двойную связь (за счёт того, что содержит на 2 атома водорода меньше).
Кроме хлорофилла а, все высшие растения и большинство водорослей (за исключением сине-зелёных и красных) содержат хлорофилл. Он отличается от хлорофилла а тем, что при углеродном атоме 3 вместо метильной имеется формильная группа СНО.
У бурых и хризофитовых водорослей, а также динофлагеллят обнаружен хлорофилл с, не имеющий остатка фитола.
Красные водоросли имеют хлорофилл, который отличается от хлорофилла а тем, что вместо винильной группы при углеродном атоме 2 имеется формильный радикал.
Распознавание различных видов хлорофилла осуществляется с помощью спектральных характеристик. Обычно изучают спектр поглощения растворов пигментов, реже – спектр люминесценции.

Хлорофи́лл (от греч. χλωρός , «зелёный» и φύλλον , «лист») — зелёный пигмент, обусловливающий окраску хлоропластов растений в зелёный цвет. При его участии осуществляется процесс фотосинтеза. По химическому строению хлорофиллы — магниевые комплексы различных тетрапирролов. Хлорофиллы имеют порфириновое строение и структурно близки гему.
Содержание
Синтез
Синтезирован Робертом Вудвордом в 1960 году.
В природе


Некоторые высшие растения, наоборот, лишены хлорофилла (как, например, петров крест).
Свойства и функция при фотосинтезе
Хотя максимум непрерывного спектра солнечного излучения расположен в «зелёной» области 550 нм (где находится и максимум чувствительности глаза), поглощается хлорофиллом преимущественно синий, частично — красный свет из солнечного спектра (чем и обуславливается зелёный цвет отражённого света).
Растения могут использовать и свет с теми длинами волн, которые слабо поглощаются хлорофиллом. Энергию фотонов при этом улавливают другие фитосинтетические пигменты, которые затем передают энергию хлорофиллу. Этим объясняется разнообразие окраски растений (и других фотосинтезирующих организмов) и её зависимость от спектрального состава падающего света [1] .
Химическая структура
Хлорофиллы можно рассматривать как производные протопорфирина — порфирина с двумя карбоксильными заместителями (свободными или этерифицированными). Так, хлорофилл a имеет карбоксиметиловую группу при С10, фитоловый эфир пропионовой кислоты — при С7. Удаление магния, легко достигаемое мягкой кислотной обработкой, дает продукт, известный как феофитин. Гидролиз фитоловой эфирной связи хлорофилла приводит к образованию хлорофиллида (хлорофиллид, лишенный атома металла, известен как феофорбид a).
Все эти соединения интенсивно окрашены и сильно флуоресцируют, исключая те случаи, когда они растворены в органических растворителях в строго безводных условиях. Они имеют характерные спектры поглощения, пригодные для качественного и количественного определения состава пигментов. Для этой же цели часто используются также данные о растворимости этих соединений в соляной кислоте, в частности для определения наличия или отсутствия этерифицированных спиртов. Хлороводородное число определяется как концентрация HCl (%, масс./об.), при которой из равного объема эфирного раствора пигмента экстрагируется 2 /3 общего количества пигмента. «Фазовый тест» — окрашивание зоны раздела фаз — проводят, подслаивая под эфирный раствор хлорофилла равный объем 30%-ного раствора KOH в MeOH. В интерфазе должно образовываться окрашенное кольцо. С помощью тонкослойной хроматографии можно быстро определять хлорофиллы в сырых экстрактах.
Хлорофиллы неустойчивы на свету; они могут окисляться до алломерных хлорофиллов на воздухе в метанольном или этанольном растворе.
Хлорофиллы образуют комплексы с белками in vivo и могут быть выделены в таком виде. В составе комплексов их спектры поглощения значительно отличаются от спектров свободных хлорофиллов в органических растворителях.
Хлорофиллы можно получить в виде кристаллов. Добавление H2O или Ca 2+ к органическому растворителю способствует кристаллизации.
Хлорофи́лл (от греч. χλωρός , «зелёный» и φύλλον , «лист») — зелёный пигмент, окрашивающий хлоропласты растений в зелёный цвет. При его участии происходит фотосинтез. По химическому строению хлорофиллы — магниевые комплексы различных тетрапирролов. Хлорофиллы имеют порфириновое строение и близки гему.
- 1 История открытия
- 2 В природе
- 3 Синтез
- 4 Свойства и функция при фотосинтезе
- 5 Химическая структура
- 6 Применение
История открытия
В 1817 году Жозеф Бьенеме Каванту и Пьер Жозеф Пеллетье выделили из листьев растений зелёный пигмент, который они назвали хлорофиллом. В 1900-х годах Михаил Цвет и Рихард Вильштеттер независимо обнаружили, что хлорофилл состоит из нескольких компонентов. Вильтштеттер очистил и кристаллизовал два компонента хлорофилла, названные им хлорофиллами а и b и установил брутто-формулу хлорофилла а. В 1915 году за исследования хлорофилла ему была вручена Нобелевская премия. В 1940 Ханс Фишер, получивший в 1930 Нобелевскую премию за открытие структуры гема, установил химическую структуру хлорофилла a. Его синтез был впервые осуществлен в 1960 Робертом Вудвордом, а в 1967 была окончательно установлена его стереохимическая структура.


Хлорофилл присутствует во всех фотосинтезирующих организмах — высших растениях, водорослях, сине-зелёных водорослях (цианобактериях), фотоавтотрофных простейших (протистах) и бактериях.
Синтез
Синтез включает в себя 15 реакций, которые можно разделить на 3 этапа. Исходными веществами для синтеза хлорофилла являются глицин и ацетат. На первом этапе образуется аминолевулиновая кислота. На втором этапе происходит синтез одной молекулы протопорфирина из четырёх пиррольных колец. Третий этап представляет собой образование и превращение магнийпорфиринов.
Свойства и функция при фотосинтезе
В процессе фотосинтеза молекула хлорофилла претерпевает изменения, поглощая световую энергию, которая затем используется в фотохимической реакции взаимодействия углекислого газа и воды с образованием органических веществ (как правило, углеводов):
После передачи поглощенной энергии молекула хлорофилла возвращается в исходное состояние.
Растения могут использовать и свет с теми длинами волн, которые слабо поглощаются хлорофиллом. Энергию фотонов при этом улавливают другие фотосинтетические пигменты, которые затем передают энергию хлорофиллу. Этим объясняется разнообразие окраски растений (и других фотосинтезирующих организмов) и её зависимость от спектрального состава падающего света.
Хлорофиллы можно рассматривать как производные протопорфирина — порфирина с двумя карбоксильными заместителями (свободными или этерифицированными). Так, хлорофилл a имеет карбоксиметиловую группу при C10, фитоловый эфир пропионовой кислоты — при С7. Удаление магния, легко достигаемое мягкой кислотной обработкой, дает продукт, известный как феофитин. Гидролиз фитоловой эфирной связи хлорофилла приводит к образованию хлорофиллида (хлорофиллид, лишенный атома металла, известен как феофорбид a).
Все эти соединения интенсивно окрашены и сильно флуоресцируют, исключая те случаи, когда они растворены в органических растворителях в строго безводных условиях. Они имеют характерные спектры поглощения, пригодные для качественного и количественного определения состава пигментов. Для этой же цели часто используются также данные о растворимости этих соединений в соляной кислоте, в частности для определения наличия или отсутствия этерифицированных спиртов. Хлороводородное число определяется как концентрация HCl (%, масс./об.), при которой из равного объёма эфирного раствора пигмента экстрагируется 2 /3 общего количества пигмента. «Фазовый тест» — окрашивание зоны раздела фаз — проводят, подслаивая под эфирный раствор хлорофилла равный объём 30%-го раствора KOH в MeOH. В интерфазе должно образовываться окрашенное кольцо. С помощью тонкослойной хроматографии можно быстро определять хлорофиллы в сырых экстрактах.
Читайте также:

