Какой металл является анодом а какой катодом
Обновлено: 19.05.2024
Часто возникает проблема определения, какой из электродов является катодом, а какой — анодом. Для начала нужно разобраться с терминами.
Понятие катода и анода — простое объяснение
В сложных веществах электроны между атомами в соединениях распределены неодинаково. В результате взаимодействия частицы перемещаются от атома одного вещества к атому другого. Реакция именуется окислительно-восстановительной. Потеря электронов называется окислением, элемент, отдающий электроны — восстановителем.
Присоединение электронов носит название восстановление, принимающий элемент в этом процессе — окислитель. Переход электронов от восстановителя к окислителю может протекать по внешней цепи, и тогда его можно использовать в качестве источника электрической энергии. Устройства, в которых энергия химической реакции превращается в электрическую энергию, называются гальваническими элементами.
Простейший классический пример гальванического элемента — две пластины, изготовленные из различного металла и погруженные в раствор электролита. В такой системе окисление происходит на одном металле, а восстановление — на другом.
ВАЖНО! Электрод, на котором протекает окисление, называется анодом. Электрод, на котором протекает восстановление — катодом.
Из школьных учебников химии известен пример медно-цинкового гальванического элемента, работающего за счет энергии реакции между цинком и сульфатом меди. В устройстве Якоби — Даниэля пластина из меди помещена в раствор сульфата меди (медный электрод), цинковая пластина погружена в раствор сульфата цинка (цинковый электрод). Цинковый электрод отдает катионы в раствор, создавая в нем избыточный положительный заряд, а у медного электрода раствор обедняется катионами, здесь раствор заряжен отрицательно.

Замыкание внешней цепи заставляет электроны перетекать от цинкового электрода к медному. Равновесные отношения на границах фаз прерываются. Идёт окислительно-восстановительная реакция.
Энергия самопроизвольно протекающей химической реакции превращается в электрическую.
Если химическую реакцию провоцирует внешняя энергия электрического тока, идёт процесс, называемый электролизом. Процессы, протекающие при электролизе, обратны процессам, протекающим при работе гальванического элемента.
ВНИМАНИЕ! Электрод, на котором происходит восстановление, также называется катодом, но при электролизе он заряжен отрицательно, а анод — положительно.
Применение в электрохимии
Аноды и катоды принимают участие во многих химических реакциях:
- Электролиз;
- Электроэкстракция;
- Гальваностегия;
- Гальванопластика.
Электролизом расплавленных соединений и водных растворов получают металлы, производят очистку металлов от примесей и извлечение ценных компонентов (электролитическое рафинирование). Из металла, подлежащего очистке, отливают пластины. Они помещаются в качестве анодов в электролизер. Под воздействием электрического тока металл подвергается растворению. Его катионы переходят в раствор и разряжаются на катоде, образуя осадок чистого металла. Примеси, содержащиеся в первоначальной неочищенной металлической пластине, либо остаются нерастворимыми в виде анодного шлама, либо переходят в электролите, откуда удаляются. Электролитическому рафинированию подвергают медь, никель, свинец, золото, серебро, олово.

Электроэкстракция — процесс выделения металла из раствора в ходе электролиза. Для того чтобы металл перешёл в раствор, его обрабатывают специальными реагентами. В ходе процесса на катоде происходит выделение металла, характеризующегося высокой чистотой. Так получают цинк, медь, кадмий.
Чтобы избежать коррозии, придать прочность, украсить изделие поверхность одного металла покрывают слоем другого. Этот процесс называется гальваностегией.

Гальванопластика — процесс получения металлических копий с объёмных предметов электроосаждением металла.

Применение в вакуумных электронных приборах
Принцип действия катода и анода в вакуумном приборе может продемонстрировать электронная лампа. Она выглядит как герметически запаянный сосуд с металлическими деталями внутри. Прибор используется для выпрямления, генерирования и преобразования электрических сигналов. По числу электродов выделяют:
- диоды;
- триоды;
- тетроды;
- пентоды и т.д.

Диод — вакуумный прибор с двумя электродами, катодом и анодом. Катод подключен к отрицательному полюсу источника питания, анод — к положительному. Предназначение катода — испускать электроны под действием нагрева электрическим током до определенной температуры. Посредством испущенных электронов создается пространственный заряд между катодом и анодом. Самые быстрые электроны устремляются к аноду, преодолевая отрицательный потенциальный барьер объемного заряда. Анод принимает эти частицы. Создается анодный ток во внешней цепи. Электронным потоком управляют с помощью дополнительных электродов, подавая на них электрический потенциал. Посредством диодов переменный ток преобразуется в постоянный.
Применение в электронике
Сегодня используется полупроводниковые типы диодов.
В электронике широко используется свойство диодов пропускать ток в прямом направлении и не пропускать в обратном.

Работа светодиода основана на свойстве кристаллов полупроводников светиться при пропускании через p-n переход тока в прямом направлении.
Гальванические источники постоянного тока — аккумуляторы
Химические источники электрического тока, в которых протекают обратимые реакции, называются аккумуляторами: их перезаряжают и используют многократно.

При работе свинцового аккумулятора происходит окислительно-восстановительная реакция. Металлический свинец окисляется, отдает свои электроны, восстанавливая диоксид свинца, принимающего электроны. Металлический свинец в аккумуляторе — анод, он заряжен отрицательно. Диоксид свинца — катод и заряжен положительно.
По мере разряда аккумулятора расходуются вещества катода и анода и их электролита, серной кислоты. Чтобы зарядить аккумулятор, его подключают к источнику тока (плюсом к плюсу, минусом к минусу). Направление тока теперь обратное тому, какое было при разряде аккумулятора. Электрохимические процессы на электродах «обращаются». Теперь свинцовый электрод становится катодом, на нем проходит процесс восстановления, а диоксид свинца — анодом, с протекающей процедурой окисления. В аккумуляторе вновь создаются вещества, необходимые для его работы.
Что такое анод и катод: объясняю простыми словами
Для корректной работы полупроводниковых приборов, работающих в цепях с постоянным током, электроды радиоэлементов необходимо подключать с учетом их полярности. Неправильное подключение может привести к выходу из строя радиоэлемента либо к отказу в работе электронного прибора. С целью избегания ошибок электроды таких деталей получили специальное название – анод и катод.
Часто эти электроды обозначаются на схемах соответствующими символами «+» или «–», либо определяются по схематическому изображению радиоэлемента. На корпусах деталей иногда проставляется точка или другая метка, позволяющая определить направление тока на конкретном электроде. Иногда полярность выводов приходится определять по специальным таблицам или с помощью измерительного прибора.
Понятие анода и катода
Для лучшего понимания терминов дадим определения этих понятий.
Под данным термином будем подразумевать электрод, по которому электрический ток втекает в разглядываемый прибор. При этом подразумевается, что электрический ток образуется потоком положительных зарядов. В действительности, по металлическим проводникам перемещаются электроны (носители отрицательных зарядов), которые движутся в сторону положительного полюса источника электрического тока.
Проще говоря, положительным электродом будем считать анод, а отрицательным электродом – катод. При подключении радиоэлементов следует соблюдать их полярность, руководствуясь обозначениями на схемах.
Катод
Это электрод, по которому электрический ток вытекает с прибора (подразумевается конвенциальное понимание тока, в виде потока положительных зарядов). Таким образом, если к аноду подключается провод с положительным потенциалом, то к катоду – клеммы с отрицательными потенциалами.
Вышеуказанные термины применяются по отношению к гальваническим элементам. В гальванике анод – это электрод, на поверхности которого проходит реакция окисления металла. Названия электродов встречаются:
- в химии;
- физике;
- электротехнике;
- радиоэлектронике.
При монтаже радиодеталей очень важно не перепутать электроды. Для этого необходимо знать, как определить их назначение.
Как определить, где анод, а где катод?
При определении катода и анода необходимо в первую очередь ориентироваться на направление тока, а не на полярность источника питания. Несмотря на то, что эти понятия тесно связаны с полярностью тока, они больше обусловлены направлениями векторов электричества.
Например, в аккумуляторах, при перезарядке, происходит изменение ролей катода и анода. Это связано с тем, что во время зарядки изменяется направление электрического тока. Электрод, выполнявший роль электрода при работе аккумулятора в режиме источника питания во время зарядки выполняет функции катода и наоборот – катод превращается в анод.
На рис. 1, изображено процесс электролиза, при котором происходит перемещение анионов (отрицательных ионов) и катионов (положительных ионов). Анионы устремляются к аноду, а положительные катионы – в сторону катода.

Рис. 1. Электролиз
При электролизе перемещаются носители зарядов разных знаков, однако, по определению, анодом является тот электрод, в который втекает ток. На рисунке анод подсоединён к положительному полюсу источника тока, а значит, ток условно втекает в этот электрод.
Обратите внимание на рисунок 2, где изображена схема гальванического элемента.

Рис. 2. Гальванический элемент
Плюсовой вывод источника тока является катодом, а не анодом, как можно было бы ожидать. При внимательном изучении принципа работы гальванического элемента можно понять, почему анод является отрицательным полюсом.
Обратите внимание на рисунок строения гальванического источника тока. Стрелки (вверху) указывают направление движения электронов, однако направлением тока условно принято считать перемещение от плюса к минусу. То есть, при замыкании цепи, ток входит именно в отрицательный полюс, который и является анодом, на котором происходит реакция окисления. Иначе говоря, ток от положительного электрода через нагрузку попадает на анод, являющийся отрицательным полюсом гальванического элемента. При вдумчивом подходе все стает на свои места.
При определении позиций анода и катода в радиоэлектронных элементах пользуются справочными материалами.
На назначение электродов указывает:
Определение назначений выводов у полупроводниковых диодов можно определить с помощью измерительных приборов. Например, все типы диодов (кроме стабилитронов) проводят ток только в одном направлении. Если вы подключили тестер или омметр к диоду, и он показал незначительное сопротивление, то к положительному щупу прибора подключен анод, а к отрицательному – катод.
Если известен тип проводимости транзистора, то с помощью того же тестера можно определить выводы эмиттера и коллектора. Между ними сопротивление бесконечно велико (тока нет), а между базой и каждым из них проводимость будет (только в одну сторону, как у диода). Зная тип проводимости, по аналогии с диодом, можно определить: где анод, а где катод, а значит определить выводы коллектора или эмиттера (см. рис. 5).

Рис. 5. Транзистор на схемах и его электроды
Что касается вакуумных диодов, то их невозможно проверить путем измерения обычными приборами. Поэтому их выводы расположены таким образом, чтобы исключить ошибки при подключении. В электронных лампах выводы точно совпадают с расположением контактов гнезда, предназначенного для этого радиоэлемента.
Анод и катод: где плюс, а где минус?
Из сказанного выше следует, что ток всегда течет в направлении от анода к катоду. Вывод один – на анод поступает плюс, а катод подсоединяется к минусу. Придерживаясь этого правила можно безошибочно определить, где плюс, а где минус.

Вот так можно запомнить:)
В гальванотехнике на катоде происходит реакция восстановления. То есть положительные ионы из раствора оседают на катоде. По этому признаку определяем знак минус.
Как определить катод и анод радиодеталей мы рассмотрели выше. Если есть схема устройства то по ней довольно легко можно указать направление тока, и, соответственно, назначение электродов. При отсутствии схемы пользуйтесь признаками и метками на корпусах деталей.
Примечание: по отношению к стабилитрону некорректно применять термин катод и анод, так как он проводит ток в разных направлениях.
Отдельно заострю ваше внимание на элементах питания. Обычно «+» указывается на гальванических устройствах, а на аккумуляторах часто маркируются обе клеммы. В аккумуляторах автомобильного типа плюсовую клемму делают толще. По этому признаку также можно определить полярность полюсов.
В качестве выводов см. рисунок 6.
Цифрами обозначено:
- 1– анод;
- 2 – электролит;
- 3 – катод;
- 4 – источник тока.
Применение
Электроды в качестве анода и катода наиболее часто применяются:
- в электрохимии;
- вакуумных электронных приборах;
- полупроводниковых элементах.
Рассмотрим в общих чертах сферы применения анодов и катодов.
В электрохимии
В данной сфере анод и катод являются ключевыми понятиями, в процессе прохождения электрохимических реакций, используемых в основном для восстановления металлов. Такие реакции называют электролизом. Использование процессов электролиза позволяет получать чистые металлы, так как на катоде образуются атомы только того металла, положительные ионы которого содержатся в растворе электролита.
Методом электролиза наносят очень тонкое цинковое покрытие стальных листов и деталей любой конфигурации. Гальваническое покрытие эффективно защищает металл от коррозии.
В вакуумных электронных приборах
Примером вакуумных приборов служат радиоэлектронные лампы, электронно-лучевые трубки, кинескопы телевизоров. Они работают по одному и тому же принципу: Разогретый катод испускает электроны, которые устремляются к аноду с высоким положительным электрическим потенциалом.
Образование электронов на раскаленном электроде называется термоэмиссией, а электрический ток, возникающий между катодом и анодом, называется термоэмиссионным. Ценность таких приборов в том, что они проводят ток только в одном направлении – от катода к аноду.
Добавление сетки между электродами позволяет регулировать параметры тока в широких пределах, путем изменения напряжения на сетке. Такие вакуумные лампы используются в качестве усилителей сигналов. В данное время вакуумные приборы используются довольно редко, так как их с успехом заменяют миниатюрные полупроводниковые диоды и транзисторы, часто выполненные на монокристалле в виде микросхемы.
В полупроводниковых приборах
Электронные детали на основе полупроводников ценятся малым потреблением тока и небольшими размерами. Они почти вытеснили вакуумные лампы из употребления. Выводы полупроводниковых приборов традиционно называют анодами и катодами.
При всех плюсах полупроводников, у этих приборов есть недостаток – они «шумят». В усилителях большой мощности эти шумы становятся заметными. В качественной усилительной аппаратуре по-прежнему применяются вакуумные лампы.
Электронно-лучевые кинескопы в современных телевизорах вытесняются экранами с LED подсветкой. Они более экономичны, отлично передают цветовую палитру, позволяют сделать приемник почти плоским.
Гальванический элемент. Как определить что является катодом, а что - анодом?
Например пластина Ni иZn, погружённые в раствор, соответственно, NiSo4 и ZnSo4. И как заряжённые сами пластины?
Идея с электрохимическим рядом напряжений очень хорошая. Разовьем ее?
Если пластинку любого металла опустить в воду, то на границе вода-металл возникает скачок потенциала. Полярные молекулы воды «вытягивают» с пластинки ионы металла, на пластинке получается отрицательный заряд за счет оставшихся электронов. Конечно, гидратированные ионы металла далеко не уйдут, так и находятся у границы пластинки. Но все равно получается разделение зарядов, а следовательно, скачок потенциала.
Так будет на границе ЛЮБОГО металла с водой или водным раствором электролита. НО, чем правее стоит металл в ряду напряжений, тем прочнее металлическая связь в решетке металла, тем труднее он отдает свои ионы воде, тем меньше будет скачок потенциала на границе металл вода. И, наоборот, чем левее стоит металл в ряду напряжений, тем легче он отдает свои ионы воде. (Такие металлы, как натрий, калий, кальций вообще растворяются в воде) .
Теперь обратимся к системе никель-цинк в воде. Пусть каждая из пластинок будет в своем сосуде с водой (или раствором своей соли, например, цинковая пластинка – в растворе соли цинка (например ZnSO4), никелевая – в растворе соли никеля (NiSO4). Соединим сосуды изогнутой трубкой-мостиком, заполненной также электролитом (в принципе любым, лишь бы не реагировал с сульфатами, а можно и любым из двух сульфатов) . А пластинки соединим проволокой, имеющей некоторое сопротивление. На цинковой пластинке электронов больше, потому что она уже изначально отдала раствору больше ионов цинка, чем никелевая отдала ионов никеля в раствор. Электроны по проволоке пойдут с цинковой пластинки на никелевую. (Формально направление тока, наоборот, от плюса к минусу, т. е. от никеля к цинку) . В результате этого перемещения электронов на обеих границах металл-раствор нарушится равновесие, которое было до соединения. Чтобы восстановить равновесие, часть ионов цинка перейдет в раствор, создавая новые «лишние» электроны на пластинке. На никелевую пластинку пришли электроны с цинка, и для восстановления равновесия часть ионов никеля из раствора вернется на пластинку, нейтрализуя эти электроны. В растворе около никелевой пластинки получился избыток сульфат-анионов, а около цинковой пластинки – недостаток анионов (потому что ионы цинка перешли в раствор) . Для восстановления равновесия анионы по трубке мостику передвинутся от никеля к цинку. Цепь замкнулась. Электроны продолжают идти от цинка к никелю по проволоке, катионы цинка переходят в раствор (цинковая пластинка растворяется) , катионы никеля возвращаются на свою пластинку, анионы по раствору двигаются от никеля к цинку.
С точки зрения химии цинк окисляется Zn – 2e = Zn(2+), а на никелевой пластинке происходит восстановление Ni(2+) + 2e = Ni. АНОДОМ НАЗЫВАЕТСЯ ЭЛЕКТРОД, НА КОТОРОМ ПРОИСХОДИТ ОКИСЛЕНИЕ. На катоде соответственно восстановление. Зная это, вы никогда не ошибетесь, потому что плюс и минус менее определенные понятия (при электролизе, например, плюс и минус меняются местами, по сравнению с гальваническим элементом, но анодом всегда остается электрод, на котором происходит окисление) .
Гальванические элементы
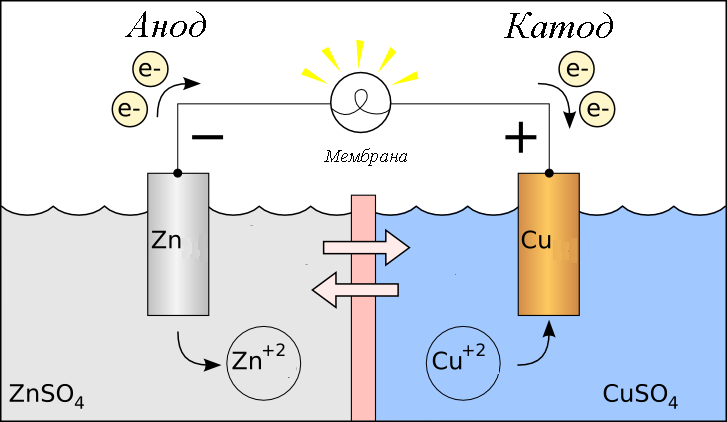
Если два электрода, например Zn и Cu погрузить в растворы их солей (соответственно ZnSO4 и CuSO4) и соединить металлическим проводником, образуется гальванический элемент. Гальваническими элементаминазывают устройства, в которых химическая энергия окислительно-восстановительных процессов преобразуется в электрическую энергию.
При работе гальванического элемента цинк, как более активный металл, окисляется, его ионы переходят в раствор, а высвобождающиеся электроны движутся по внешней цепи к медному электроду. На медном электроде протекает реакция восстановления ионов меди из раствора.
Суммируя оба процесса, получаем уравнение, выражающее происходящую в гальваническом элементе реакцию в ионной форме:
Zn + Cu 2+ → Cu + Zn 2+ .
Молекулярное уравнение этой реакции будет иметь вид:
Суммарная окислительно-восстановительная реакция, протекающая в гальваническом элементе, называется токообразующей.
В гальваническом элементе процессы окисления и восстановления протекают раздельно, на разных электродах. Электрод, на котором протекает окисление, называется анодом. В гальваническом элементе анод имеет знак минус. Электрод, на котором протекает восстановление, называется катодом. В гальваническом элементе катод имеет знак плюс. В паре металлов всегда более активный металл является анодом, менее активный – катодом.
Гальванический элемент обозначают схемой. Слева записывается анод Zn|Zn 2+ , на котором возникает избыток электронов и происходит процесс окисления. Справа – катод Cu 2+ |Cu – электрод с недостатком электронов. Одна вертикальная черта изображает фазовый раздел между металлом и раствором электролита. Двойная вертикальная линия отделяет анодное пространство от катодного. Электроны по внешнему участку цепи, металлическому проводнику, переходят от отрицательного полюса к положительному. Внешнюю цепь на схеме не изображают. В круглых скобках знаками «плюс» и «минус» обозначают полюсы электродов. В рассмотренном примере эта схема будет иметь следующий вид:
Максимальная разность потенциалов электродов, которая может быть получена при работе гальванического элемента, называется электродвижущей силой(ЭДС). Обозначается E, измеряется в вольтах. ЭДС элемента равна разности потенциалов катода и анода: E = jк – jа.
Стандартная ЭДС равна разности стандартных электродных потенциалов катода и анода: E 0 = j 0 к – j 0 а. Так, для элемента Даниэля – Якоби стандартная ЭДС равна: E o = j o Сu 2+ /Cu – j 0 Zn 2+ /Zn = +0,337 – (–0,763) = +1,100 В.
Окислительно-восстановительная реакция, характеризующая работу гальванического элемента, протекает в направлении, в котором ЭДС имеет положительное значение. В этом случае ΔG 0 х.р. < 0, т.к. энергия Гиббса химической реакции и ЭДС связаны соотношением
где - число электронов, участвующих в электродной реакции; F - постоянная Фарадея, равная 96500 Кл; Е 0 – стандартная ЭДС.
Катод и анод
Иногда требуется подключить к источнику питания постоянного тока электроды какого-либо прибора или элемента. Их присоединяют, соблюдая полярность. Катод и анод – так называются проводники (электроды) устройства, с помощью которых выполняется это подключение. Однозначного понятия этих двух терминов нет. Их различают в зависимости от того, в каких химических и физических процессах применяют эти обозначения.
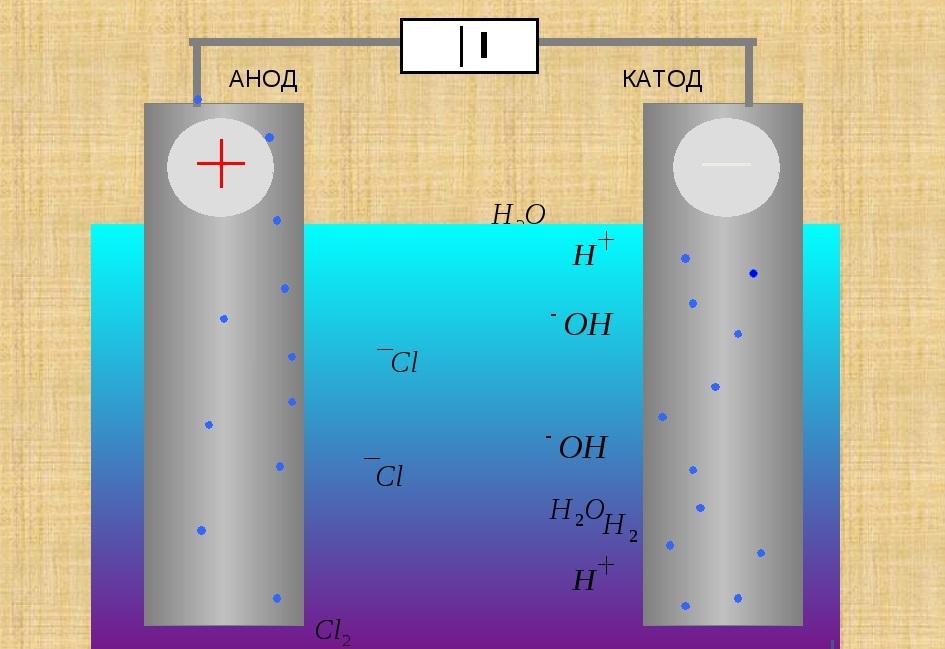
Понятие катода и анода
В электрической технике вывод, присоединяемый к положительной клемме источника питания (ИП), называют анодом (А). Электрод, присоединённый к минсовому выводу ИП, – катодом (К). В переводе с греческого языка анод – «восхождение, движение вверх», катод – «нисхождение, движение вниз». С этими названиями можно встретиться в таких разделах физики и химии, как:
- гальванические источники питания;
- электролиз и гальванотехника;
- полупроводники и вакуумная электроника.
Кроме того, этими терминами обозначаются выводы элементов на схемах и знаки их заряда.
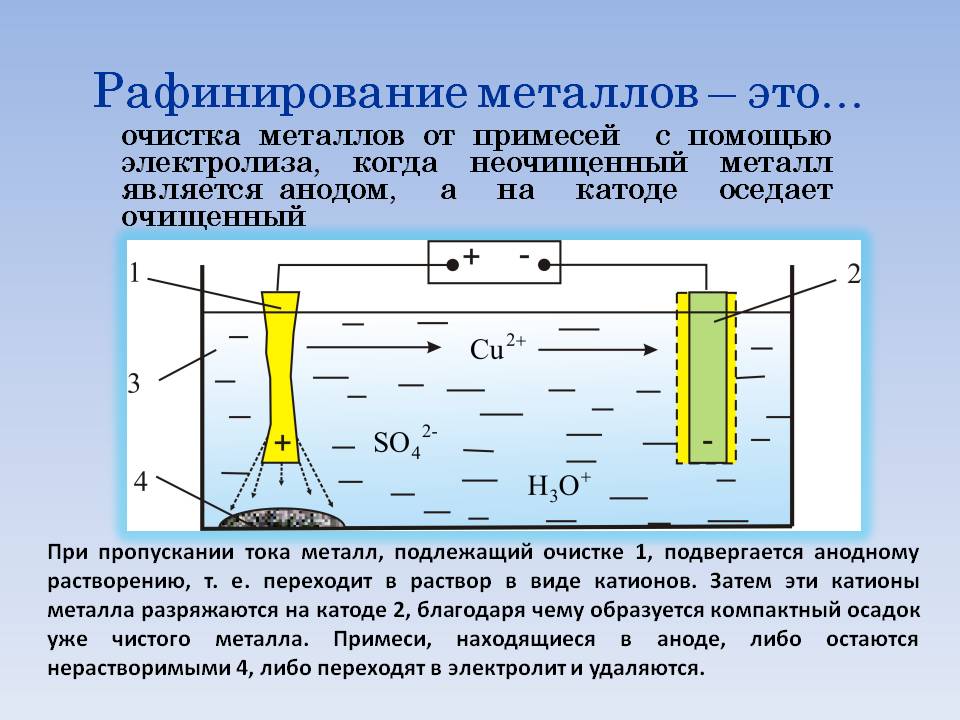
Обозначение в электрохимии и цветной металлургии
Понятие анодов в электролитических процессах применимо в отношении положительно заряженных электродов. Электролиз, с помощью которого выделяются или очищаются различные химические элементы, – это влияние электрического тока на электролит. Электролитом выступают растворы солей или кислот. Другим электродом, участвующим в этой реакции, выступает катод.
Внимание! На отрицательно заряженном катоде (К) осуществляется реакция восстановления, на аноде (А) – процесс окисления. При этом «А» может частично разрушаться, участвуя в очищении металлов от нежелательных добавок.
В металлургической промышленности аноды используют при нанесении защитных слоёв на продукт электрохимическим методом (гальваника) или электро-рафинированием. Электрическое очищение позволяет растворять на «А» черновой металл (с примесями) и осаждать его на «К» уже в очищенном виде.
Ряд часто применяемых анодов – изготовленные из металлов:
- цинка;
- меди;
- никеля;
- кадмия;
- свинцовые (сплав свинца с сурьмой);
- серебра;
- золота;
- платины.
Никелирование, оцинкование и прочее нанесение защитных или эстетически востребованных покрытий на изделия выполняются в основном из недрагоценных металлов.
С помощью «А» из драгметаллов повышают электропроводность компонентов электрических изделий и наносят слои благородных металлов на ювелирные украшения.
К сведению. Осаждаемый на катоде чистый металл также называют «катодом». Например, чистая медь полученная таким образом именуется «медный катод». Дальше её используют для изготовления медной фольги, проволоки и прочего.
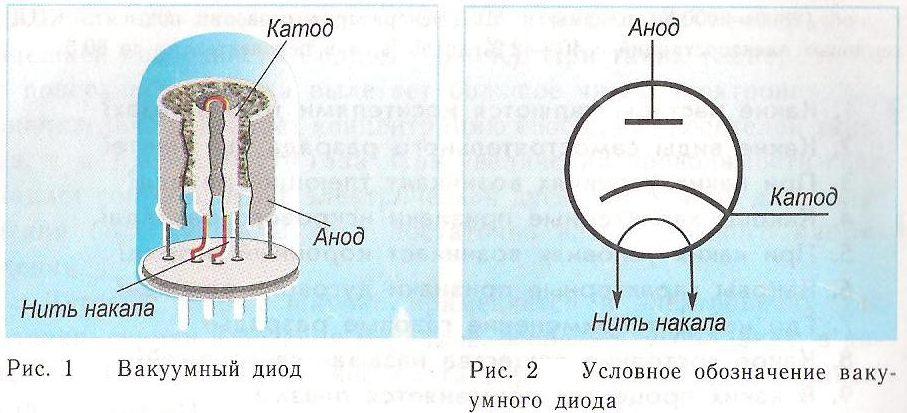
Анод и катод в вакуумных электронных приборах
Электронная лампа является простейшим вакуумным устройством. Она состоит из следующих деталей:
Три этих элемента составляют вакуумный диод. У него «К» цилиндрической формы, внутри которого располагается нить накаливания. Она подогревает «К» для увеличения термоэлектронной эмиссии. В таких приборах электроны покидают «К» и в вакууме направляются к «А», тем самым создавая электрический ток. Анод – это электрод лампы с положительным потенциалом. Он выполняется в виде короба окружающего сетку и «К». Может быть из молибдена, тантала, графита, никеля. Его конструкция различна, порой имеет рёбра для теплоотвода.
Сетка – элемент, расположенный посередине, управляет потоком частиц. Чаще всего она выполнена в виде спирали, обвивающей катод.
Важно! Чем больше площадь поверхности катода, и чем сильнее он разогрет, тем больший ток протекает через лампу.
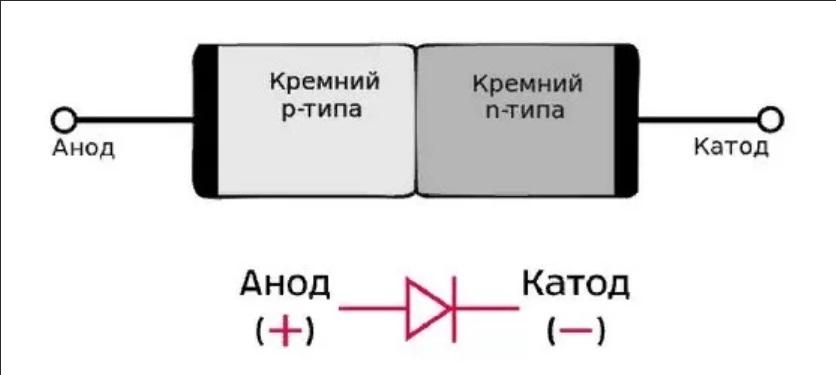
Анод и катод у полупроводниковых приборов
Полупроводниковые элементы проводят электричество в определённом направлении. Если рассматривать полупроводниковый диод, то его электроды также носят название «катод» и «анод». При прикладывании к нему прямого напряжения: положительный заряд к аноду, диод открыт. Если положительный потенциал приходит на катод, диод закрыт. Такой диод имеет p-n переход между двумя этими областями и требователен к приложенной полярности. Вывод элемента из p-области именуется «А», из n-области – «К».
Знак анода и катода
Каким знаком обозначается «К», каким «А», зависит от того, какая процедура и в какой области рассматривается. В электрохимии есть два устройства, имеющие различие в обозначении знаками: электролизёр и гальванический элемент.
При электролизе (окислительно-восстановительном химическом взаимодействии под влиянием внешнего ИП) минусом «-» обозначают катод. Именно на нём восстанавливаются металлы, из-за избытка электронов. Плюсом «+», в свою очередь, маркируют анод (положительный электрод), где металлы окисляются из-за недостатка отрицательно заряженных частиц.
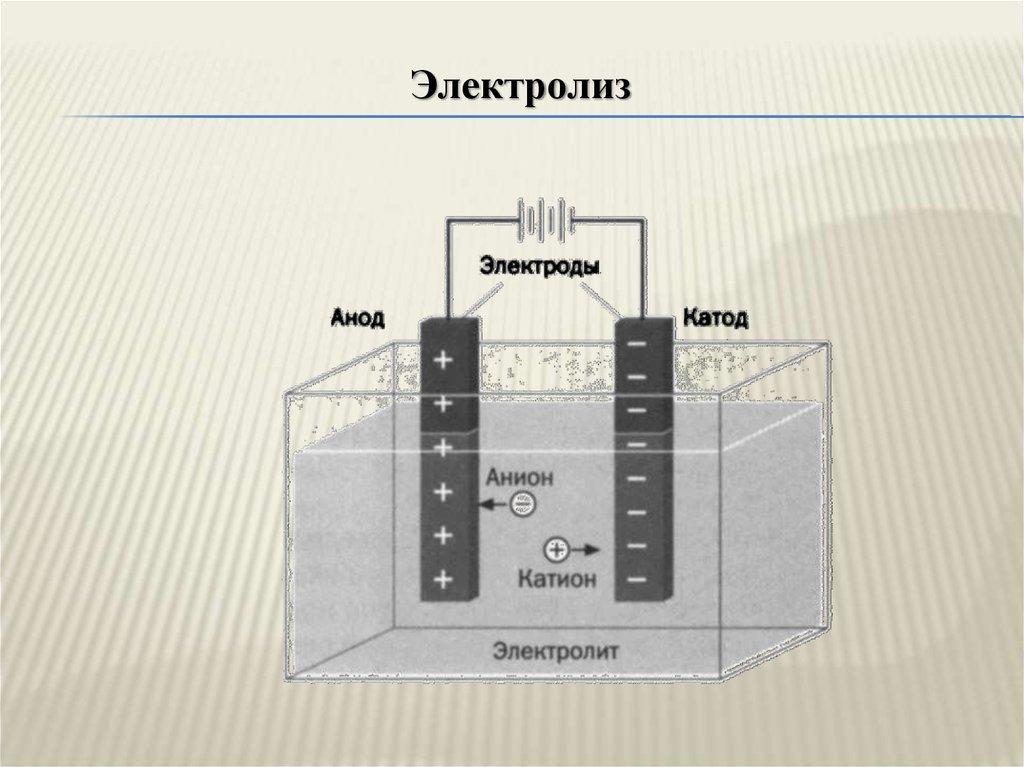
В гальваническом элементе окисление происходит без внешнего воздействия электричества. Если взять в качестве примера медно-цинковую батарею, то большое количество электронов (минус) скапливается на аноде. Они при продвижении по внешней цепи участвуют в восстановлении меди. Значит, в этом случае положительным электродом будет катод.
Внимание! У гальванических элементов плюсом является катод, минусом – анод. У электролизёров наоборот – плюсом считают анод, минусом – катод.
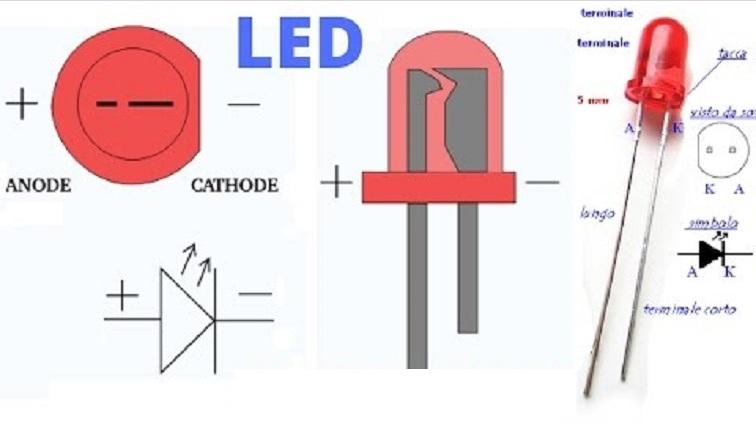
У полупроводниковых приборов, как знак, так и термин, чётко закреплены за выводами детали. Анод – это «плюс», катод – это «минус» диода.
Почему существует путаница
Всё происходит от того, что нет чёткой привязки минуса и плюса к компонентам, которые называются «К» и «А». Ещё Майкл Фарадей придумал простое правило маркировки полярности для этой пары электродов. Что такое анод, по его объяснениям? Учёный при запоминании определения предлагал проводить аналогию с Солнцем. Куда ток входит (восход) – это анод, куда ток выходит (закат) – это катод. У аккумуляторов полярность на аноде и катоде изменяется от того, работает он как гальванический элемент (при разряде) или как электролизёр (при заряде).
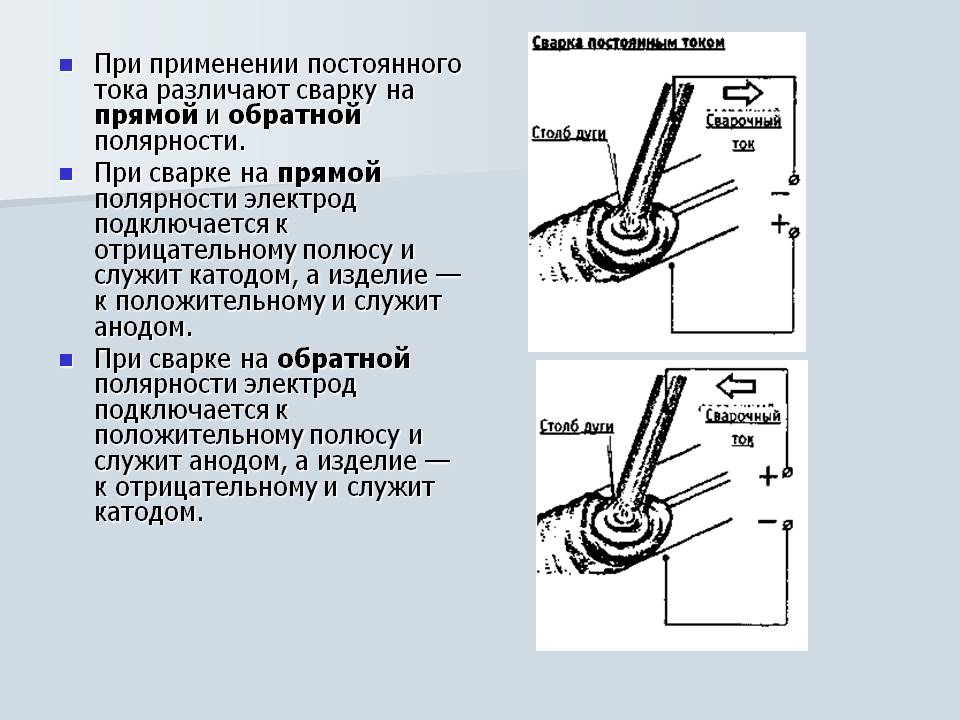
Сварка постоянным током также неоднозначно определяет «А» и «К» при зажигании дуги прямой или обратной полярностью.
Как определить анод и катод
Что это такое катод и анод, выясняют в частных моментах: при определении выводов у полупроводниковых элементов или при идентификации электродов в электрохимических процессах.
Полупроводниковый диод требует позиционного размещения в электросхемах. Для правильного соединения необходимо отождествить выводы. Это можно сделать по следующим признакам:
- маркировка, нанесённая на корпус элемента;
- длина выводов детали;
- показания тестера при измерениях в режиме омметра или проверки диодов;
- использование источника тока с известной полярностью.
Маркировка полупроводников такого типа может быть выполнена при помощи нанесения на корпус графического обозначения диода. Тогда минус (К) – это вывод со стороны вертикальной линии, в которую упирается контур стрелки. Ножка диода, от которой выходит стрелка, – это плюс (А). Так графически указано прямое направление тока – от «А» к «К».
Другим способом обозначения анода у диодного элемента могут быть нанесённые на корпус одна или две цветные точки или пара узких колец. Существуют конструктивно выполненные диоды, у которых минусовой (катодный) вывод обозначен широким серебряным кольцом. Диод 2А546А-5 (ДМ) служит таким примером.
Длина ножек светодиодов, ни разу не паянных в платы, также может указывать на полярность выводов. У led-диодов длинная ножка – это положительный электрод, короткая – отрицательный вывод. К тому же форма корпуса (обрез края окружности) может служить ориентиром.
При определении мультиметром полярности контактных выводов полупроводника подключают его в режиме тестирования диодов. Если на дисплее появились цифры, значит, диод подключён в прямом направлении. При этом красный щуп подсоединён к аноду «+», чёрный – к катоду «-».
Если под рукой нет тестера, определить названия выводов диода можно, собрав последовательную цепь из батарейки, лампочки и диода. При прямом включении лампочка загорится, значит, плюс батарейки – на аноде и аналогично минус – на другом электроде.
Информация. Электроды светодиода можно идентифицировать с помощью постоянного ИП с заведомо известной полярностью и включенного последовательно резистора, ограничивающего ток. Свечение элемента укажет на прямое включение. Для этой цели можно взять батарейку RG2032 на 3 вольта и резистор сопротивлением 1кОм.
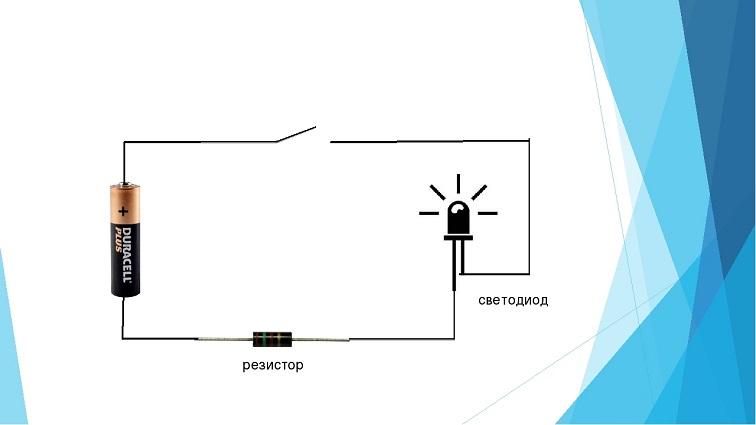
Что касается полупроводников, всегда существует строгое соответствие наименований. В других случаях правильное определение проходящих электрохимических реакций поможет чётко ориентироваться в отождествлении электродов.
Видео
Читайте также:
