Каковы характерные свойства металлов и чем они определяются
Обновлено: 28.09.2024
свойства металлов [properties of metals] — характеристики металлов и сплавов, а также изделий (полуфабрикатов) из них, преимущественно определяется их атомно-кристаллическим строением, химическим составом, количеством и свойствами отдельных фазовых составляющих, их распределением, структурой, субструктурой и другими параметрами; различными физическими, химическими, механическими и технологическими свойствами металлов. Физические свойства металлов, которые определяют поведение металлических материалов в тепловых, гравитационных, электромагнитных и радиационных полях, в свою очередь, подразделяются на тепловые, объемные, электрические и магнитные свойства. Тепловые свойства металлов определяются тепловым колебанием атомов и зависят от их атомно-кристаллического строения. При высоких температураx свойства металлов удовлетворяют описываемыми законами классической физики, при низких — с помощью элементов квантовой статистики. Границей обычно служит температура Дебая (ϴ), параметр, связанный с наивысшей частотой колебаний атомов данного вещества. ϴ = hvm/k, где h — постоянная Планка, k — постоянная Больцмана, νm — наибольшая частота колебания атомов, зависящая от массы атомов и сил межатомной связи (Смотри Тепловое расширение, Теплоемкость, Теплопроводность, Теплота фазового перехода). Объемные свойства металлов (плотность и термическое расширение) тесно связанный со структурой и атомным строением металла. Плотность определяется по формуле ρ = m/V, где m — масса; V — объем материала. Нагрев приводит к непрерывному расширению металла и соответственно к уменьшению его плотности. Общее увеличение объема в интервале от Т = О до tпл составляет у многих металлов с ГЦК решеткой около 7 %. Объемный коэффициент расширения ρ связан с линейным а соотношением ρ ≈ За (Смотри также Термический коэффициент линейного расширения). Электрические свойства металлов связаны с движением в металле электронов. Так, в образце, помещенном в электрическое поле напряженностью Е, возникает электрический ток, плотность которого j определяется количеством коллективизированных электронов N в единице объема, добавляется скорость u, приобретенная электроном, и его зарядом e: j = Nue (Смотри также Электропроводность, Электросопротивление ). Магнитные свойства металлов характеризуются зависимостями магнитной индукции ферро- и ферастворимагнетиков В и намагниченности М от напряженности магнитного поля H, а также зависимостями удельных потерь на перемагниченный Р от магнитной индукции и частоты F. Графические зависимости В (или М) от H называются кривыми намагниченности. При циклическом перемагничивании кривая намагниченность образует петлю гистерезиса. Основными харрактеристиками петли гистерезиса являются остаточная индукция Вr, коэрцитивная сила Нc и плотность петли, характеризующая потери на гистерезис Рr за цикл перемагничивания. Потери на гистерезис при перемагничивании материала с частотой f(Гц) и отнесенные к единице объема вещества — удельные потери, выраженные в Вт/кг. Химические свойства металлов характеризуют способность их вступать в химические взаимодействия с другими веществами, сопротивляемость окислению, проникновению газов и химически активных веществ. Характерным примером химического взаимодействия металла и внешней среды является коррозия (Смотри также Коррозия, Жаростойкость ). Механические свойства металлов, которыми в первую очередь руководствуются при конструировании металлических изделий и сооружений, определяют сопротивление деформации или разрушению, деформацию и вязкость под действием приложенной внешней нагрузки (статической, длительной статической, циклической, динамическ и т. п.). Имеют значение также напряженное состояние и способ нагружения (растяжение, сжатие, изгиб, кручение и др.), температура нагружения и агрессивность внешней среды. Технологические свойства металлов характеризуют их способность подвергатся горячему и холодному деформированию, обработке резанием, термической обработке, и особенно сварке (Смотри Термическая обработка, Свариваемость ).
Смотри также:
— Свойства
Энциклопедический словарь по металлургии. — М.: Интермет Инжиниринг . Главный редактор Н.П. Лякишев . 2000 .
Полезное
Смотреть что такое "свойства металлов" в других словарях:
Литейные свойства металлов — совокупность свойств, характеризующих способность расплавленного металла образовывать качественные отливки. Понятие литейных свойств металла расширяется введением в него, кроме «традиционных» литейных свойств металла (усадки, ликвации,… … Металлургический словарь
МЕТАЛЛОВ МЕХАНИЧЕСКИЕ СВОЙСТВА — Когда на металлический образец действует сила или система сил, он реагирует на это, изменяя свою форму (деформируется). Различные характеристики, которыми определяются поведение и конечное состояние металлического образца в зависимости от вида и… … Энциклопедия Кольера
Свойства — [properties] характеристики вещества (предмета), которые обусловливают его различие или общность с другими веществами и обнаруживают в его отношении к ним. Всякое свойство относительно и не существует вне отношении к другим свойствам и веществам … Энциклопедический словарь по металлургии
МЕТАЛЛОВ ТЕРМИЧЕСКАЯ ОБРАБОТКА — определенный временной цикл нагрева и охлаждения, которому подвергают металлы для изменения их физических свойств. Термообработка в обычном смысле этого термина проводится при температурах, не достигающих точки плавления. Процессы плавления и… … Энциклопедия Кольера
МЕТАЛЛОВ ЛИТЬЕ — получение металлических изделий (отливок) путем заливки расплавленного металла в литейную форму. Рабочая часть литейной формы представляет собой полость, в которой материал, затвердевая при охлаждении, приобретает конфигурацию и размеры нужного… … Энциклопедия Кольера
МЕТАЛЛОВ ОБРАБОТКА ДАВЛЕНИЕМ — формование металлических материалов механическими средствами без снятия стружки. Наряду с формообразованием обработка давлением может улучшать качество и механические свойства металла. Обработка металлов давлением производится либо в горячем… … Энциклопедия Кольера
Свойства материалов — Термины рубрики: Свойства материалов Агрегация материала Активация материалов Активность вещества Анализ вещественный … Энциклопедия терминов, определений и пояснений строительных материалов
МЕТАЛЛОВ ИСПЫТАНИЯ — Цель испытания материалов состоит в том, чтобы оценить качество материала, определить его механические и эксплуатационные характеристики и выявить причины потери прочности. Химические методы. Химические испытания обычно состоят в том, что… … Энциклопедия Кольера
СВОЙСТВА МАТЕРИАЛОВ — совокупность показателей, характеризующих все стороны материала. Различают следующие свойства материалов (например, для металлов): механические, физические (плотность, тепловые, электрические, магнитные и тому подобные свойства), химические… … Металлургический словарь
Свойства некоторых ядер магнитных изотопов и относительная чувствительность определения их ЯМР-спектроскопией — Изотоп Спин Природное содержание, % Чувствительность 1H 1/2 100 1900 2D … Химический справочник
Что такое металлы и их строение
Определение металлов можно дать с позиций химии, физики и техники.
В химии металлы — это химические элементы, находящиеся в левой части периодической системы элементов Д. И. Менделеева, которые обладают особым механизмом взаимодействия валентных электронов (ионов) с ядром как в самих металлах, так и при вступлении в химические реакции с другими элементами, в том числе с металлами.
Физика характеризует металлы как твердые тела, обладающие цветом, блеском, способностью к плавкости (расплавлению) и затвердеванию (кристаллизации), тепло- и электропроводностью, магнитными и другими свойствами.
В технике металлы — это конструкционные материалы, обладающие высокой обрабатываемостью (ковкостью, штампуемостью, обрабатываемостью резанием, паяемостью, свариваемостью и др.), прочностью, твердостью, ударной вязкостью и рядом других ценных свойств, благодаря которым они находят широкое применение.
Русский ученый М. В. Ломоносов (1711 — 1765), исследуя металлы и неметаллы в своем труде «Первые основания металлургии или рудных дел», дал металлам определение: «Металлом называется светлое тело, которое ковать можно. Таких тел находим только шесть: золото, серебро, медь, олово, железо и свинец». Это определение М. В. Ломоносов дал в 1773 г., когда известны были только шесть металлов.
Из металлов, добываемых из недр земли, получают большую группу конструкционных материалов, применяемых в различных отраслях промышленности. В природе одни металлы встречаются в чистом, самородном виде, другие — в виде оксидов (соединений металла с кислородом), нитридов и сульфидов, из которых состоят различные руды этих металлов.
Самыми распространенными металлами, применяемыми в качестве конструкционных материалов, являются железо, алюминий, медь и сплавы на основе этих металлов.
К металлам относятся более 80 элементов периодической системы Менделеева. Все эти металлы подразделяются на две большие группы: черные металлы и цветные металлы.
Характерными признаками черных металлов являются темно-серый цвет, блеск, высокие плотность и температура плавления, твердость, прочность, вязкость и полиморфизм (аллотропия). По физикохимическим свойствам черные металлы подразделяют на пять групп:
- железистые (железо, кобальт, никель, марганец);
- тугоплавкие (вольфрам, рений, тантал, молибден, ниобий, ванадий, хром, титан и др.);
- урановые — актиниды (уран, торий, плутоний и др.);
- редкоземельные — лантаниды (лантан, церий, иттрий, скандий и др.);
- щелочно-земельные (литий, натрий, калий, кальций и др.).
Из этих пяти групп черных металлов особенно широкое применение в промышленном производстве находят железистые и тугоплавкие металлы.
Железистые металлы, кроме марганца, называют еще ферромагнетиками. Ферромагнетики способны намагничиваться и притягивать металлы своей группы.
К тугоплавким относятся металлы, которые имеют температуру плавления выше температуры плавления железа (1 539 °С): титан — 1 667 °С, ванадий — 1 902 °С, хром — 1 903 °С, молибден — 2 615 °С, ниобий — 2 460 °С, тантал — 2 980 °С, вольфрам — 3 410 °С. Тугоплавкие металлы в основном применяются как легирующие элементы в производстве жаропрочных, жаростойких, теплостойких и специальных сплавов, в том числе твердых сплавов и высоколегированных сталей.
2. Строение металлов
Атомно-кристаллическая структура металлов. Как известно, все вещества состоят из атомов, в том числе и металлы. Каждый металл (химический элемент) может находиться в газообразном, жидком или твердом агрегатных состояниях. Каждое агрегатное состояние будет иметь свои особенности, отличные друг от друга. В газообразном металле расстояние между атомами велико, силы взаимодействия малы и атомы хаотично перемещаются в пространстве; газ стремится к расширению в сторону большего объема. При понижении температуры и давления вещество переходит в жидкое состояние. Свойства жидкого вещества резко отличаются от свойств газообразного. В жидком металле атомы сохраняют лишь так называемый ближний порядок атомов, т. е. в объеме расположено небольшое количество атомов, а не атомы всего объема. При понижении температуры жидкий металл переходит в твердое состояние, которое имеет строгую закономерность расположения атомов.
Если условно провести вертикальные и горизонтальные линии связи через центры атомов, можно увидеть, что у металлов в твердом состоянии атомы расположены в строго определенном порядке и представляют собой множество раз повторяющиеся элементарные геометрические фигуры — параллелепипеды (рис. 1). Наименьшую геометрическую фигуру называют элементарной ячейкой. Элементарные ячейки, расположенные на горизонтальных и вертикальных кристаллографических плоскостях (рис. 2), образуют пространственную кристаллическую решетку.
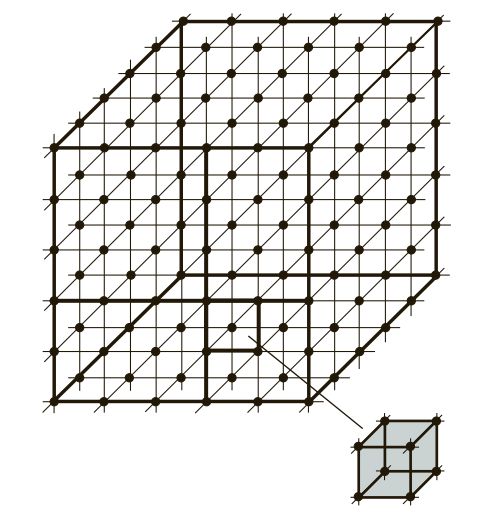
Рис. 1. Схема расположения элементарных геометрических ячеек в атомных решетках металлов и сплавов
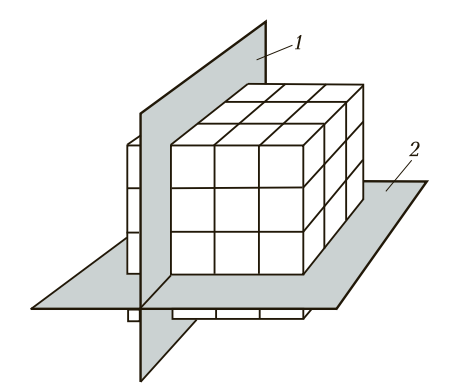
Рис. 2. Расположение кристаллографических плоскостей: 1 и 2 — соответственно горизонтальная и вертикальная кристаллографические плоскости
Элементарные кристаллические решетки характеризуют следующие основные параметры: расстояние между атомами по осям координат (по линиям связи), углы между линиями связи, координационное число — число атомов, находящихся на наиболее близком и равном расстоянии от любого атома в решетке. Форму элементарной ячейки рассматривают по кристаллографическим плоскостям в трех измерениях.
Таким образом, любой металл можно представить не как однородную цельную массу, а как массу, сложенную из множества элементарных ячеек. Блок элементарных атомных кристаллических ячеек образует атомно-кристаллическую ячейку (решетку). Если выделить эту элементарную ячейку, то в зависимости от металла получим следующие типы кристаллических ячеек (рис. 3): куб (К), объемно-центрированный куб (ОЦК), гранецентрированный куб (ГЦК), гексагональная плотноупакованная ячейка (ГПУ), гексагональная простая ячейка (Г) и др.
Простая кубическая ячейка (рис. 3, а) характерна для неметаллов, которые обладают наибольшими плотностью и удельным весом, и имеет восемь атомов, которые расположены в каждой вершине куба.
Объемно-центрированная кубическая ячейка (рис. 3, б ) состоит из восьми атомов, которые расположены по одному атому в каждой вершине куба, и одного, находящегося в центре куба на равных расстояниях от его граней. Эту форму атомной кристаллической ячейки имеют железо модификации Fe-α, ванадий, вольфрам, молибден, тантал и хром, т. е. в основном черные металлы.
Гранецентрированная кубическая ячейка (рис. 3, в) имеет 14 атомов — по одному атому в каждой вершине куба (восемь атомов) и по одному атому в центре каждой грани (шесть атомов). Гранецентрированную кубическую ячейку имеют алюминий, железо модификации Fe-γ, золото, кобальт, медь, никель, платина и серебро, в основном это цветные металлы и часть черных металлов.
Гексагональная плотноупакованная ячейка (рис. 3, г) состоит из 17 атомов. Форма геометрического тела, которую образуют эти атомы, является шестигранной призмой. При этом по шесть атомов расположены в каждой вершине верхнего и нижнего оснований, по одному атому в центре этих оснований и три атома в центре одной их трех граней (через грань). Гексагональную плотноупакованную ячейку имеют бериллий, кадмий, магний, ванадий, тантал.
Простая гексагональная ячейка (рис. 3, д) состоит из 12 атомов, которые расположены в вершинах верхнего и нижнего оснований шестигранной призмы. Такую кристаллическую ячейку имеют ртуть и цинк.
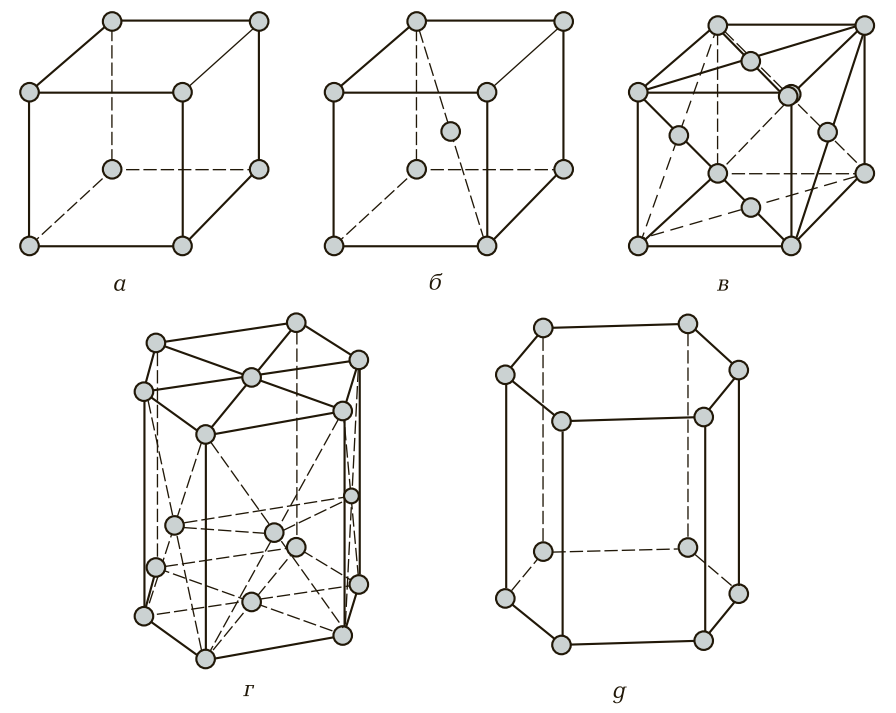
Рис. 3. Геометрические формы элементарных кристаллических ячеек: а — куб; б — объемно-центрированный куб; в — гранецентрированный куб; г — гексагональная плотноупакованная ячейка; д — гексагональная простая ячейка
Связь между атомами в кристаллической решетке и между решетками осуществляется за счет так называемой металлической связи. От прочности этой связи зависят прочность и твердость металлов. Чем выше эта связь, тем бо´льшую прочность и твердость имеют металлы. Механизм связи между атомами в решетке и между решетками имеет сложную физико-химическую природу.
В практике идеальное расположение кристаллических решеток обычно не наблюдается. Кристаллы, образуемые кристаллическими решетками, имеют искаженную геометрическую форму и различную величину.
Анизотропия металлов. Анизотропия (от гр. anisos — неравный и tropos — направление) — неодинаковость физических свойств среды (тела) в различных направлениях. Анизотропия предполагает зависимость свойств металлов от направления по плоскостям атомно-кристаллических решеток. Чем больше в плоскости атомов, тем выше свойства металлов. В горизонтальных плоскостях в любой форме атомно-кристаллических решеток больше, чем в вертикальных плоскостях. Следовательно, прочность металлов, испытанная в горизонтальном направлении, выше, чем в вертикальном. Анизотропия проявляется в процессе обработки конструкционных материалов давлением (проката, волочения, штамповки и других технологических способов получения заготовок и изделий).
На рис. 2 кристаллографические плоскости совпадают с линиями связи, проходящими через атомы металла. Форма элементарной кристаллической ячейки, расстояние между атомами и прочность металлической связи определяют физические, механические и технологические свойства металлов. Если исследуемый металл рассматривать по трем кристаллографическими плоскостям, по линиям связи между атомами, то можно заметить, что свойства по этим трем измерениям будут различны. Число атомов в этих плоскостях неодинаково. Металлическая связь между горизонтально и вертикально расположенными атомами также неодинакова. Это, в свою очередь, приводит к различной прочности металлов в продольном и поперечном направлениях. Например, предел прочности меди в продольном направлении будет в 2 раза больше, чем в поперечном.
Все металлы анизотропны, так как они состоят из кристаллов. Кристаллическое строение металлов обусловливает пластическую деформацию, т. е. изменение внешней формы и размеров под действием нагрузок без разрушения. Способность металлов и сплавов пластически деформироваться положена в основу их обработки давлением (прокатка, волочение, ковка, штамповка и прессование). При обработке давлением, например прокатке (рис. 4, а), происходит перемещение одного слоя атомных решеток по другому по кристаллографическим плоскостям (рис. 4, б).
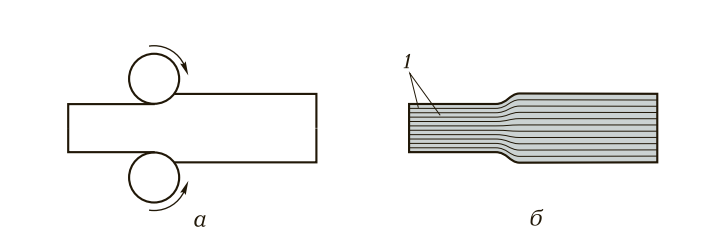
Рис. 4. Схема деформации металлов и сплавов (прокатка): а — деформация; б — скольжение металлов по кристаллографическим плоскостям в процессе деформации; 1 — кристаллографические плоскости
В процессе деформации металла при прокатке происходит не только изменение поперечных и продольных размеров заготовок, но и изменение микроструктуры металла.
Зерна под действием давления прокатных валков искажаются, приобретая продолговатую или пластинчатую форму, а затем преобразуются в волокна. Изменение микроструктуры металла в процессе деформации условно показано на рис. 5.
Процесс кристаллизации. Рассмотрим, как происходит образование кристаллов у чистых металлов. Установлено, что процесс кристаллизации металлов из жидкого состояния в твердое идет в две стадии:
- образование центров кристаллизации;
- рост кристаллов вокруг этих центров (рис. 6).
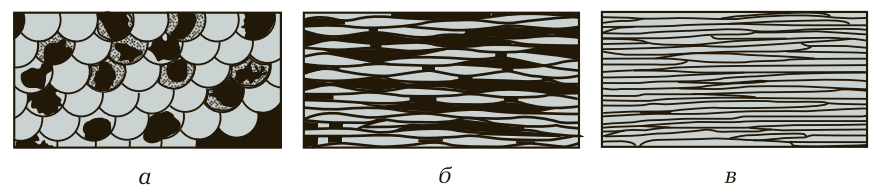
Рис. 5. Изменение микроструктуры металла в процессе деформации: а — микроструктура металла до деформации; б — микроструктура металла после первой операции деформации; в — микроструктура металла после окончательной деформации
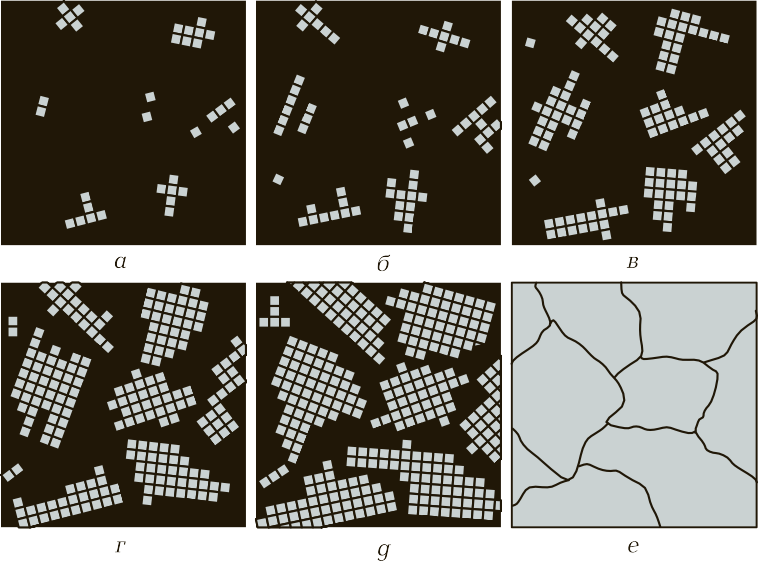
Рис. 6. Процесс кристаллизации металлов и сплавов: а — е — последовательные этапы процесса
Далее вновь появляются новые центры, и происходит рост твердой фазы вокруг первичных и вторичных центров. Процесс происходит до того момента, пока образованные таким образом кристаллы не будут соприкасаться друг с другом и не будет наличия жидкой фазы металла (см. рис. 6, г — е). Когда образование кристалла идет в жидкой фазе (в расплавленном металле), он будет иметь правильную форму, т. е. состоять из определенных геометрических фигур правильной формы. Когда кристаллы начинают соприкасаться друг с другом, а процесс затвердевания еще не закончен, тогда происходят искажения формы зерен. В практике замечено, что когда идет быстрое охлаждение, образуются мелкие зерна — мелкозернистая структура. При медленном охлаждении появление новых центров кристаллизации замедляется, но происходит рост зерна вокруг первичных центров кристаллизации. В этом случае металл будет иметь крупнозернистую структуру.
Процесс образования кристаллов в жидком состоянии и перехода металла в твердое состояние называется первичной кристаллизацией. Величина и форма зерна влияет на механические свойства металлов. Чем зерна мельче и чем правильнее их форма, тем большую твердость и прочность будет иметь металл. Чем зерна больше и чем искаженнее их форма, тем ниже твердость и прочность металла.
Аллотропия металлов. Такие металлы, как железо, кобальт, никель и др., обладают способностью изменять кристаллическую решетку при нагревании в твердом состоянии. Процесс изменения кристаллических решеток в твердом состоянии называется вторичной кристаллизацией, или аллотропией, а состояние вещества (металла) при наличии нескольких кристаллических решеток при изменении параметров (давления, температуры) — аллотропическими модификациями, или полиморфизмом. Такие металлы, как железо, молибден, вольфрам, литий в твердом состоянии при нормальной температуре имеют объемно-центрированную кубическую ячейку; алюминий, медь, серебро в твердом состоянии при нормальной температуре имеют форму гранецентрированной кубической ячейки.
На рис. 7 представлены кривые нагрева и охлаждения металла (на примере марганца). Аллотропные состояния (модификации), имеющие те или иные кубические ячейки, обозначаются греческими буквами. Первоначальное аллотропное состояние при нормальной температуре обозначается буквой α, при дальнейших повышении температуры и перекристаллизации металла — буквами β, γ, δ и т. д. При охлаждении металлов и сплавов процесс аллотропного превращения происходит в обратном порядке, как правило при тех же температурах.
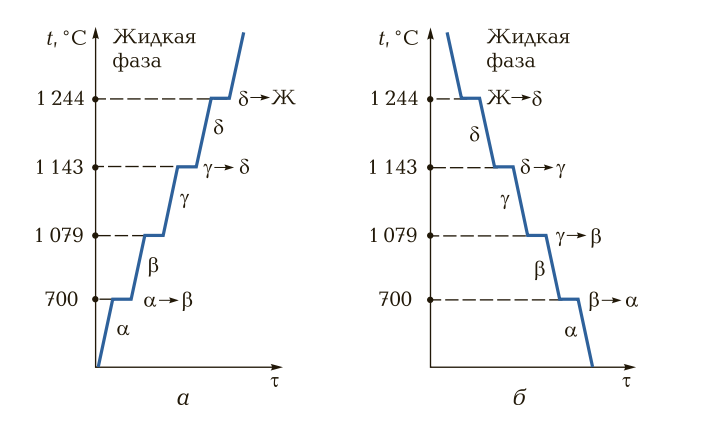
Рис. 7. Кривые нагрева (а) и охлаждения (б) марганца: t — температура; τ — время
Свойства металлов: химические, физические, технологические

Не секрет, что все вещества в природе делятся на три состояния: твердые, жидкие и газообразные. А твердые вещества в свою очередь делятся на металлы и неметаллы, разделение это нашло свое отображение и в таблице химических элементов великого химика Д. И. Менделеева. Наша сегодняшняя статья о металлах, занимающих важное место, как в химии, так и во многих других сферах нашей жизни.
Химические свойства
Все мы, так или иначе, но сталкиваемся с химией в нашей повседневной жизни. Например, во время приготовления еды, растворение поваренной соли в воде является простейшей химической реакцией. Вступают в разнообразные химические реакции и металлы, а их способность реагировать с другими веществами это и есть их химические свойства.
Среди основных химических свойств или качеств металлов можно выделить их окисляемость и коррозийную стойкость. Реагируя с кислородом, металлы образуют пленку, то есть проявляют окисляемость.
Аналогичным образом происходит и коррозия металлов – их медленное разрушение по причине химического или электрохимического взаимодействия. Способность металлов противостоять коррозии называется их коррозийной стойкостью.

Физические свойства
Среди основных общих физических свойств металлов можно выделить:
- Плавление.
- Плотность.
- Теплопроводность.
- Тепловое расширение.
- Электропроводность.
Важным физическим параметром металла является его плотность или удельный вес. Что это такое? Плотность металла – это количество вещества, которое содержится в единице объема материала. Чем меньше плотность, тем металл более легкий. Легкими металлами являются: алюминий, магний, титан, олово. К тяжелым относятся такие металлы как хром, марганец, железо, кобальт, олово, вольфрам и т. д. (в целом их имеется более 40 видов).
Способность металла переходить из твердого состояния в жидкое, именуется плавлением. Разные металлы имеют разные температуры плавления.

Скорость, с которой в металле проводится тепло при нагревании, называется теплопроводностью металла. И по сравнению с другими материалами все металлы отличаются высокой теплопроводностью, говоря по-простому, они быстро нагреваются.
Помимо теплопроводности все металлы проводят электрический ток, правда, некоторые делают это лучше, а некоторые хуже (это зависит от строения кристаллической решетки того или иного металла). Способность металла проводить электрический ток называется электропроводностью. Металлы, обладающие отличной электропроводностью, это золото, алюминий и железо, именно поэтому их часто используют в электротехнической промышленности и приборостроении.
Механические свойства
Основными механическими свойствами металлов является их твердость, упругость, прочность, вязкость и пластичность.
При соприкосновении двух металлов могут образоваться микро вмятины, но более твердый металл способен сильнее противостоять ударам. Такая сопротивляемость поверхности металла ударам извне и есть его твердость.
Чем же твердость металла отличается от его прочности. Прочность, это способность металла противостоять разрушению под действием каких-либо других внешних сил.
Под упругостью металла понимается его способность возвращать первоначальную форму и размер, после того как нагрузка, вызвавшая деформацию металла устранена.
Способность металла менять форму под внешним воздействием называется пластичностью.
Технологические свойства
Технологические свойства металлов и сплавов важны в первую очередь при их производстве, так как от них зависит способность подвергаться различным видам обработки с целью создания разнообразных изделий.
Среди основных технологических свойств можно выделить:
- Ковкость.
- Текучесть.
- Свариваемость.
- Прокаливаемость.
- Обработку резанием.
Под ковкостью понимается способность металла менять форму в нагретом и холодном состояниях. Ковкость метала, была открыта еще в глубокой древности, так кузнецы, занимающиеся обработкой металлических изделий, превращением их в мечи или орала (в зависимости от потребности) на протяжении многих веков и исторических эпох были одной из самых уважаемых и востребованных профессий.

Способность двух металлических сплавов при нагревании соединяться друг с другом называют свариваемостью.
Текучесть металла тоже очень важна, она определяет способность расплавленного метала растекаться по заготовленной форме.
Свойство металла закаливаться называется прокаливаемостью.
Интересные факты
- Самым твердым металлом на Земле является хром. Этот голубовато-белый метал был открыт в 1766 году под Екатеринбургом.
- И наоборот, самыми мягкими металлами являются алюминий, серебро и медь. Благодаря своей мягкости они нашли широкое применение в разных областях, например, в электроаппаратостроении.
- Золото – которое на протяжении веков было самим драгоценным металлом имеет и еще одно любопытное свойство – это самый пластичный металл на Земле, обладающий к тому же отличной тягучестью и ковкостью. Также золото не окисляется при нормальной температуре (для этого его нужно нагреть до 100С), обладает высокой теплопроводностью и влагоустойчивостью. Наверняка все эти физические характеристики делают настоящее золото таким ценным.
- Ртуть – уникальный металл, прежде всего тем, что он единственный из металлов, имеющий жидкую форму. Причем в природных условиях ртути в твердом виде не существует, так как ее температура плавления -38С, то есть в твердом состоянии она может существовать в местах, где просто таки очень холодно. А при комнатной температуре 18С ртуть начинает испаряться.
- Вольфрам интересен тем, что это самый тугоплавкий металл в мире, чтобы он начал плавиться нужна температура 3420С. Именно по этой причине в электрических лампочках нити накаливания, принимающие основной тепловой удар, изготовлены из вольфрама.
Видео
И в завершение образовательное видео по теме нашей статьи.
Автор: Павел Чайка, главный редактор журнала Познавайка
Основные свойства металлов и способы их определения
Из вышеизложенного становится понятным, что такое металл. К ним относится железо и алюминий, медь и свинец, титан и вольфрам, и еще множество элементов. Какой из них лучше, что следует применять в тех или иных условиях эксплуатации? Каждый материал обладает только ему присущим качеством, независимо от того, оцениваем ли мы его или нет. С другой стороны, качество можно охарактеризовать множеством свойств, которые нам кажутся наиболее важными в той или иной ситуации. По внешнему виду, например, алюминий выглядит светло-серебристым, а медь - красной. Магний, алюминий и титан по первому ощущению кажутся легкими, свинец и вольфрам тяжелыми. При нагревании свинец из кристаллического (твердого) состояния превращается в жидкость уже при 324 ˚С, тогда как вольфрам остается твердым до температур в 10 раз более высоких (температура плавления вольфрама 3400 ˚С).
Поэтому то или иное отдельно взятое свойство еще не может охарактеризовать качество материала. Поэтому, для более или менее полной характеристики качества определяют несколько свойств, наиболее важных для конкретных условий их применения. Все основные свойства материалов условно можно подразделить на следующие группы: химические, физические и механические.
К химическим характеристикам материалов относят:
химический состав, в том числе наличие примесей, легирующих элементов; способность к химическому взаимодействию с кислотами и щелочами; коррозионная стойкость, определяемая в различных условиях химически активной воздействующей на материал среды, и некоторые другие свойства.
К физическим свойствам относят:
плотность (удельный вес) и способность материала изменять ее и размеры изделия при температурном воздействии (тепловое расширение); электропроводность и электросопротивление; комплекс магнитных характеристик, таких, например, как коэрцитивная сила, намагниченность насыщения, магнитная проницаемость и др.; комплекс теплофизических свойств, таких как теплоемкость, теплопроводность, коэффициент теплоизлучения, степень черноты поверхности и др.
К механическим свойствам относят:
твердость, определяемая различными методами, в том числе по Бринеллю, Роквеллу, микротвердость вдавливанием, царапанием и др.; комплекс механических свойств, определяемых при растяжении (сжатии, кручении, изгибе) образцов, включающий (при растяжении) значения временного сопротивления разрыву (или предела прочности), предела пропорциональности, предела упругости, предела текучести, характеристик относительного удлинения и относительного сужения; предел выносливости, как характеристика, определяемая при многократных знакопеременных нагрузках при растяжении-сжатии, кручении и изгибе; ударная вязкость, определяемая при динамическом нагружении изгибом; жаропрочность; износостойкость и др.
Химические свойства
Химический состав материалов определяет их строение, в том числе их фазовый состав, структуру и их свойства. В связи с этим различают сплавы на основе железа: стали и чугуны, сплавы на основе алюминия: силумины, дуралюмины, сплавы на основе меди: латуни и бронзы и т.д.
При дальнейшем изучении курса мы познакомимся с классификацией сталей и сплавов, но уже здесь можно назвать стали углеродистые и легированные, например, хромистые, хромо-никелевые, хромо-никель-молибденовые и др. Наличие примесей в стали или сплаве резко изменяет свойства сплавов, в связи с чем количество примесей резко ограничивается. В связи с этим, например, различают стали обычного качества, стали качественные и стали повышенного качества. Металлы могут быть химически чистыми, технически чистыми с различной степенью чистоты.
Химический состав металлов и сплавов строго регламентируется требованиями Государственных стандартов, которые являются обязательными для заводов-изготовителей этих материалов. В последнее время, в связи с интеграционными процессами, большое количество материалов у нас в стране изготавливается для поставок на экспорт, что требует оценки их химического состава и свойств согласно требованиям зарубежных стандартов.
Каждому материалу по государственным стандартам присваиваются марки, используя которые можно всегда определить их химический состав. Например, алюминий технический различной степени чистоты обозначается А5; А7; А8; А9; А99; А999, что соответствует содержанию примесей не более (соответственно) 0,05%; 0,3%; 0,2%; 0,1%; 0,01%; 0,001%.
Стали марок 10, 15, 20, 30, 40, 45 и т.д. соответствуют содержанию углерода в сталях 0,1%, 0,15%; 0,2%; 0,3%; 0,4%; 0,45% и т.д. Марки не всегда определяют химический состав стали или сплава, а бывают просто условными обозначениями, например, сталь марки Ст3. Здесь цифра 3 - просто номер. Такие же примеры из области алюминиевых сплавов АЛ5; АЛ4; АЛ9. Здесь цифры - номер сплава по ГОСТ. То же в титановых сплавах: ВТ3; ВТ5; ВТ6; ВТ22; ВТ14.
Определение химического состава сплавов производится чисто химическими методами - аналитической химии, а также методами физико-химического: спектрального, рентгеноспектраотного, спектрально-флюоресцентного, атомно-абсорбционного и др. Методы микрорентгеноспектрального анализа позволяют определять не только средний химический состав материала, но и содержание компонентов в каждой частице структуры сплава, что очень важно для гетерогенных материалов, в том числе композиционных. Распределение элементов в материале может быть определено радиометрическими методами - так называемым методом "меченых атомов", с применением радиоактивных изотопов.
Способность к взаимодействию с кислотами и щелочами - это еще одно химическое свойство материалов, которое широко используется в технологиях получения микросхем на полупроводниковых приборах, методах электрохимической обработки поверхности, а также для выявления структуры материалов при металлографическом травлении.
Коррозионная стойкость материала - его эксплуатационное свойство. Она характеризует устойчивость материала в условиях эксплуатации при воздействии внешней агрессивной среды: атмосферного воздуха, влаги, морской воды и др.
Высокая коррозионная стойкость обеспечивается определенным химическим составом сплава, его структурой, что, в свою очередь определяется способом и режимами термической обработки. Поэтому коррозионная стойкость является одним из важнейших химических свойств материалов, потому что ее повышение часто становится главной задачей при создании новых сплавов, материалов и покрытий.
Определение коррозионной стойкости чаще всего производят в условиях, близких к условиям эксплуатации реальных изделий. Важнейшими характеристиками коррозионной стойкости являются сопротивление общей коррозии, склонность к межзеренному разрушению (межкристаллитная коррозия), склонность к коррозии под напряжением, жаростойкость, окалиностойкость и др.
Читайте также:
