Какую роль играют металлы в овр
Обновлено: 04.10.2024
Простые вещества – металлы в окислительно-восстановительных реакциях, в связи с особым строением их атомов, могут быть только восстановителями, и наименьшей степенью окисления для них является ноль (Ме 0 ).
Катионы металлов в ОВР могут выполнять различные функции:
– в промежуточной степени окисления катионы металлов могут проявлять окислительно-восстановительную двойственность, например Mn +6 в молекуле K2MnO4, Mn +4 в MnO2 и т. п.
Факторы, влияющие на ОВР с участием металлов в растворах электролитов:
1. Электрохимическая активность металла, определяемая по значению стандартного электродного потенциала E 0 в электрохимическом ряду напряжений металлов (табл. А-6, приложение А).
2. Природа, концентрация и количество окислителя.
3. Температура среды.
4. Наличие на поверхности металла защитных пленок и их природа.
При стандартных условиях окисление металла конкретным окислителем возможно, если соблюдается неравенство: ∆Е > 0,
где ∆Е = Е 0 окислителя – Е 0 Ме 0 /Ме n+ , В.
В соответствии с положением в ряду напряжений металлы подразделяются на три группы: активные, средней активности, малоактивные.
Восстановительная способность металла тем выше, а окислительная способность его катиона в растворе тем ниже, чем левее расположен металл в ряду напряжений, т.е. чем более отрицательно значение его электродного потенциала.
Металл способен вытеснять из растворов солей других металлов только те металлы (т.е. окисляться их катионом), которые стоят в ряду напряжений правее него.
Металлы, расположенные левее водорода, способны вытеснять его из растворов кислот, условно называемых кислотами-«неокислителями», т.е. окисляться катионом водорода такой кислоты.
Всегда соблюдается закономерность: чем выше восстановительная способность металла, тем ниже окислительная способность его катиона.
Наиболее распространенными окислителями металлов являются:
– водород в молекуле воды (при рН ≥ 7);
– катион водорода (протон) в растворах кислот-«неокислителей»: галогеноводородных кислот, Н3РО4, Н2S, НСΝ, органических кислот и некоторых других;
– протон в разбавленных растворах H2SO4;
– катион менее активного металла в растворах его солей;
– HNO3 любой концентрации, в молекуле которой окислителем металлов выступает азот в с.о. +5 (N +5 ), но не водород этой кислоты;
– конц. H2SO4, в молекуле которой в концентрированном состоянии окислителем является сера в с.о. +6 (S +6 ), но не водород.
Конц. H2SO4 и HNO3 любой концентрации могут окислять ряд малоактивных металлов. В случае их окисления этими кислотами справедливо неравенство ∆Е 0 > 0. При этом из малоактивных (неактивных) металлов с HNO3 любой концентрации реагируют только Cu, Hg, Ag, а с конц. H2SO4 только Cu, Hg и, при кипячении, Ag. В связи с особенностями такого действия HNO3 и конц. H2SO4 называют кислотами- «окислителями».
Общая схема реакции металлов с кислотами- «окислителями»:
Mе + HNO3 → Mе(NO3)x + H2O + преобладающий продукт восстановления
При окислении металлов конц. H2SO4 и HNO3 любой концентрации образуется смесь продуктов восстановления частиц S +6 и N +5 . В зависимости от активности металла и условий окисления в этой смеси имеется преобладающий продукт (с.73, табл. 7.1).
В ряде случаев металлы или вообще не окисляются данным окислителем, или процесс окисления начинается, но быстро прекращается по ниже приведённым причинам:
1. В конц. H2SO4 устойчивы Al, Cr и Fe вследствие пассивации (реакция начинается, а затем прекращается из-за образования на поверхности пассивирующего слоя оксидов).
2. В конц. HNO3 при нормальной температуре устойчивы из-за пассивации Al, Fe, Cо, Ni, Cr (они начинают реагировать, а затем окисление прекращается из-за образования на поверхности пассивирующего слоя оксидов).
3. Не окисляются HNO3 любой концентрации:
из-за термодинамической устойчивости – Au, Ru, Os, Pd, Pt, Rh, Jr;
из-за пассивации – Ti, Ta, Zr, Hf, Νb.
4. Разб. H2SO4 и НСl не окисляют Рb из-за пассивации его поверхности образующимися нерастворимыми солями (реакция начинается, а затем прекращается).
5. Вода при рН=7 имеет электродный потенциал -0,413 В. Окисляются водой при рН=7 металлы от LiдоМg(Мg при нагревании). Однако в нейтральной среде водой не окисляются Bе, Al, Mn, Zn, Cr, Fe, имеющие более отрицательный электродный потенциал, чем -0,413 В, но покрытые оксидной плёнкой, нерастворимой в воде.
6. На поверхности ряда металлов (Be, Al, Sn, Zn, Pb) образуются нерастворимые амфотерные оксиды, поэтому они не окисляются H2O в нейтральной среде, но окисляются водой в щелочном растворе. У существующих на их поверхности амфотерных оксидов, а затем образующихся в ходе реакции окисления амфотерных гидроксидов преобладают кислотные свойства, вследствие чего они взаимодействуют со щелочью, образуя растворимые соли. Поверхность металла при этом освобождается и окисляется водой. Взаимодействие со щелочью поверхностных оксидов проходит до начала окисления металла, а взаимодействие гидроксидов со щелочью многократно повторяется до полного растворения металла в растворе щелочи в результате его окисления водой.
Таблица 7.1 – Преобладающий состав продуктов восстановления молекул кислот-окислителей при окислении металлов в зависимости от концентрации кислот и активности металла
| Кислота и ее концентрация | Активные металлы: отLiдоМnи Zn (при комнатной тем-пературе) | Металлы средней активности: от Zn (при наг-ревании)до водо-рода | Малоактивные металлы: стоят в ряду напряжений металловпосле водорода |
| конц. H2SO4 | H2S | S | SО2 (окисляются только Сu и Hg) |
| HNO3 : | |||
| конц. | NO2 | NO2 | NO2 (окисляются только Сu, Hg, Ag) |
| разб. | N2 | N2O | NO |
| очень. разб | NH4NO3 | N2 | NO |
Металлы со стабильной высшей степенью окисления при окислении конц. HNO3 могут в качестве преобладающих продуктов реакции давать кислоты с высшей степенью окисления металла, например:
Рекомендуемая литература по теме 7: [1], гл. 9, § 9.1-9.3; гл. 11, § 11.3.2, 11.3.3; [2], гл. 9, § 9.1, 9.4; [3], гл. 10, § 1-6; [4], гл. 10, § 10.7; [5], гл. 8, § 1-6.
Лабораторная работа № 7.1 Окислительно-восстановительные реакции и их использование в химическом анализе (с элементами УИРС)
Внимание! Все опыты в лабораторной работе 7.1 выполняются капельным методом и оформляются в соответствии со следующим заданием:
1. Проведите опыт по данной методике.
2. Отметьте в лабораторном журнале все наблюдения (изменение цвета реакционной среды, образование осадка, выделение газа, образование гомогенной или гетерогенной среды, разогрев и т.п.)
3. Составьте или допишите химическое уравнение наблюдаемой реакции.
4. Для всех реакций приведите уравнения электронного баланса с указанием окислителя, восстановителя и процессов, проходящих в данной ОВР.
5. После проведения опытов напишите выводы.
В выводах отразите:
– почему наблюдаемая окислительно-восстановительная реакция оказалась возможной (укажите окислитель, восстановитель, за счет чего они таковыми являются, и какое значение по отношению к нулю имеет в этой реакции ∆Е);
– к какому типу в соответствии с классификацией ОВР относится данная реакция и почему;
– что в данной реакции является аналитическим сигналом;
– какие частицы (молекулы, атомы или ионы) и почему можно обнаружить методом химической идентификации с помощью конкретного аналитического реактива, использованного в каждом из проведенных опытов.
Цель работы: изучение окислительно-восстановительных реакций разных типов с участием неметаллов и сложных веществ, имеющих в своем составе элементы в различных степенях окисления. Ознакомление с возможностями использования ОВР в химическом анализе.
Тема 9. Окислительно-восстановительные реакции и их использование в химическом анализе.
Выясните, какие реакции относятся к окислительно-восстановительным, в чем их отличие от реакций обменного разложения. Дайте определение окислителя и восстановителя, объясните их роль в окислительно-восстановительных процессах. Вспомните понятие степени окисления и способ ее определения для элементов, входящих в состав молекул и ионов. Рассмотрите взаимосвязь окислительно-восстановительных свойств атомов и ионов элементов с положением данного элемента в периодической таблице. Объясните, по какому признаку определяют возможную роль какой либо молекулы или иона в ОВР (в каких случаях они проявляют только окислительные свойства, либо только восстановительные свойства, либо окислительно-восстановительную двойственность?). Изучите правила составления уравнений окислительно-восстановительных реакций методом электронного баланса. Рассмотрите разновидности окислительно-восстановительных реакций (межмолекулярные, внутримолекулярные, реакции диспропорционирования). Рассмотрите, внешние признаки протекания окислительно-восстановительных реакций, которые можно испльзовать в качестве аналитического сигнала при проведении химического анализа. Охарактеризуйте расположение металлов в Периодической системе Д.И.Менделеева. Обратите внимание на особенности электронной структуры атомов металлов и кристаллической структуры металлов, выявите их взаимосвязь с физическими и химическими свойствами металлов. Проанализируйте закономерности изменения восстановительных свойств и степеней окисления металлов в периодах и подгруппах Периодической системы. Выявите сходство и различие между химической активностью атомов металлов как восстановителей и их электрохимической активностью, определяемой по ряду стандартных электродных потенциалов. Изучите химические (восстановительные) свойства металлов в их реакциях с неметаллами, водой, растворами солей, кислотами-неокислителями и кислотами-окислителями, водными растворами щелочей. Выясните условия, при которых возможно или невозможно протекание этих реакций.
Литература: [1, 251-259; 341-381]; [2, 221-228]; [3,184-190;356 – 384]; [9,43-48]; [11, 37-48].
Вопросы для самопроверки:
1. Какие реакции называются окислительно-восстановительными, в чем их принципиальное отличие от реакций обменного разложения?
2. Объясните сущность понятий "окислитель" и "окисление", "восстановитель" и "восстановление". Какую роль в ОВР играют окислители и восстановители?
3. Что понимают под степенью окисления элемента, как она определяется? С чем связано изменение степени окисления при протекании окислительно-восстановительных реакций?
4. Какие атомы, молекулы или ионы могут выступать в роли только окислителей, какие – в роли только восстановителей?
5. Какие вещества и частицы могут проявлять окислительно- восстановительную двойственность?
6. Каковы правила уравнивания окислительно-восстановительных реакций методом электронного баланса (рассмотрите на конкретных применрах)?
7. В чем состоит различие между межмолекулярными и внитримолекулярными ОВР? Какие разновидности этих реакций Вам известны?
8. Чем определяются химические свойства металлов? Какая величина является количественной характеристикой металлических свойств элемента?
9. Какую роль играют атомы металлов в окислительно-восстановительных реакциях? Какую роль в них могут играть ионы металлов, и от какого условия эта роль зависит?
10. Каковы особенности, условия протекания и продукты реакций металлов с неметаллами?
11. Каковы особенности, условия протекания и продукты реакций металлов с водой и водными растворами солей?
12. По какому признаку все кислоты по их отношению к металлам делятся на кислоты-неокислители и кислоты-окислители? Приведите различные примеры кислот обоих типов.
13. Каковы особенности, условия протекания и продукты реакций металлов с кислотами-неокислителями (рассмотрите на примере конкретной реакции)?
14. Каковы особенности, условия протекания и продукты реакций металлов с кислотами-окислителями (рассмотрите на примере конкретных реакций)? От каких факторов зависит состав продуктов восстановления металлами концентрированной серной кислоты и азотной кислоты любой концентрации?
15. Что представляет собой явление пассивации металлов? Приведите конкретные примеры. Какую роль играет это явление в практической деятельности?
16. Каковы особенности, условия протекания и продукты реакций металлов с водными растворами щелочей (рассмотрите на примере конкретной реакции)? В чем заключается сущность каждой из реакций, последовательно протекающих в этом процессе?
17. Каковы особенности, условия протекания и продукты реакций металлов со щелочными расплавами солей-окислителей?
Химические свойства металлов

Свойства металлов начинают изучать на уроках химии в 8–9 классе. В этом материале мы подробно разберем химические свойства этой группы элементов, а в конце статьи вы найдете удобную таблицу-шпаргалку для запоминания.
О чем эта статья:
8 класс, 9 класс, ЕГЭ/ОГЭ
Металлы — это химические элементы, атомы которых способны отдавать электроны с внешнего энергетического уровня, превращаясь в положительные ионы (катионы) и проявляя восстановительные свойства.
В окислительно-восстановительных реакциях металлы способны только отдавать электроны, являясь сильными восстановителями. В роли окислителей выступают простые вещества — неметаллы (кислород, фосфор) и сложные вещества (кислоты, соли и т. д.).
Металлы в природе встречаются в виде простых веществ и соединений. Активность металла в химических реакциях определяют, используя электрохимический ряд, который предложил русский ученый Н. Н. Бекетов. По химической активности выделяют три группы металлов.
Ряд активности металлов
Металлы средней активности
Общие химические свойства металлов
Взаимодействие с неметаллами
Щелочные металлы сравнительно легко реагируют с кислородом, но каждый металл проявляет свою индивидуальность:
оксид образует только литий
натрий образует пероксид
калий, рубидий и цезий — надпероксид
Остальные металлы с кислородом образуют оксиды:
2Zn + O2 = 2ZnO (при нагревании)
Металлы, которые в ряду активности расположены левее водорода, при контакте с кислородом воздуха образуют ржавчину. Например, так делает железо:
С галогенами металлы образуют галогениды:
Медный порошок реагирует с хлором и бромом (в эфире):
При взаимодействии с водородом образуются гидриды:
Взаимодействие с серой приводит к образованию сульфидов (реакции протекают при нагревании):
Реакции с фосфором протекают до образования фосфидов (при нагревании):
Основной продукт взаимодействия металла с углеродом — карбид (реакции протекают при нагревании).
Из щелочноземельных металлов с углеродом карбиды образуют литий и натрий:
Калий, рубидий и цезий карбиды не образуют, могут образовывать соединения включения с графитом:
С азотом из металлов IA группы легко реагирует только литий. Реакция протекает при комнатной температуре с образованием нитрида лития:
Взаимодействие с водой
Все металлы I A и IIA группы реагируют с водой, в результате образуются растворимые основания и выделяется H2. Литий реагирует спокойно, держась на поверхности воды, натрий часто воспламеняется, а калий, рубидий и цезий реагируют со взрывом:
Металлы средней активности реагируют с водой только при условии, что металл нагрет до высоких температур. Результат данной реакции — образование оксида.
Неактивные металлы с водой не взаимодействуют.
Взаимодействие с кислотами
Если металл расположен в ряду активности левее водорода, то происходит вытеснение водорода из разбавленных кислот. Данное правило работает в том случае, если в реакции с кислотой образуется растворимая соль.
2Na + 2HCl = 2NaCl + H2
При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.


Металлы IА группы:
Металлы IIА группы
Такие металлы, как железо, хром, никель, кобальт на холоде не взаимодействуют с серной кислотой, но при нагревании реакция возможна.
Взаимодействие с солями
Металлы способны вытеснять из растворов солей другие металлы, стоящие в ряду напряжений правее, и могут быть вытеснены металлами, расположенными левее:
Zn + CuSO4 = ZnSO4 + Cu
На металлы IА и IIА группы это правило не распространяется, так как они реагируют с водой.
Реакция между металлом и солью менее активного металла возможна в том случае, если соли — как вступающие в реакцию, так и образующиеся в результате — растворимы в воде.
Взаимодействие с аммиаком
Щелочные металлы реагируют с аммиаком с образованием амида натрия:
Взаимодействие с органическими веществами
Металлы IА группы реагируют со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
Также они могут вступать в реакции с галогеналканами, галогенпроизводными аренов и другими органическими веществами.
Взаимодействие металлов с оксидами
Для металлов при высокой температуре характерно восстановление неметаллов или менее активных металлов из их оксидов.
3Са + Cr2O3 = 3СаО + 2Cr (кальциетермия)
Вопросы для самоконтроля
С чем реагируют неактивные металлы?
С чем связаны восстановительные свойства металлов?
Верно ли утверждение, что щелочные и щелочноземельные металлы легко реагируют с водой, образуя щелочи?
Методом электронного баланса расставьте коэффициенты в уравнении реакции по схеме:
Mg + HNO3 → Mg(NO3)2 + NH4NO3 + Н2O
Как металлы реагируют с кислотами?
Подведем итоги
От активности металлов зависит их химические свойства. Простые вещества — металлы в окислительно-восстановительных реакциях являются восстановителями. По положению металла в электрохимическом ряду можно судить о том, насколько активно он способен вступать в химические реакции (т. е. насколько сильно у металла проявляются восстановительные свойства).
Напоследок поделимся таблицей, которая поможет запомнить, с чем реагируют металлы, и подготовиться к контрольной работе по химии.
Таблица «Химические свойства металлов»
Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb
Cu, Hg, Ag, Pt, Au
Восстановительная способность металлов в свободном состоянии
Возрастает справа налево
Взаимодействие металлов с кислородом
Быстро окисляются при обычной температуре
Медленно окисляются при обычной температуре или при нагревании
Взаимодействие с водой
Выделяется водород и образуется гидроксид
При нагревании выделяется водород и образуются оксиды
Водород из воды не вытесняют
Взаимодействие с кислотами
Вытесняют водород из разбавленных кислот (кроме HNO3)
Не вытесняют водород из разбавленных кислот
Реагируют с концентрированными азотной и серной кислотами
С кислотами не реагируют, растворяются в царской водке
Взаимодействие с солями
Не могут вытеснять металлы из солей
Более активные металлы (кроме щелочных и щелочноземельных) вытесняют менее активные из их солей
Взаимодействие с оксидами
Для металлов (при высокой температуре) характерно восстановление неметаллов или менее активных металлов из их оксидов
Окислительно-восстановительные реакции

Разбираться в ОВР важно, чтобы хорошо сдать ЕГЭ по химии. Какие реакции называются окислительно-восстановительными, их типы, а также примеры окислителей и восстановителей — в нашей подробной статье.
11 класс, ЕГЭ/ОГЭ
Что такое ОВР
Окислительно-восстановительная реакция (ОВР) — это реакция, которая протекает с изменением степеней окисления.
В такой реакции всегда участвуют вещество-окислитель и вещество-восстановитель. Другие вещества могут выступать в качестве среды, в которой протекает данная реакция.
Конечно, в каждом правиле есть исключения. Например, реакция диспропорционирования галогенов в горячем растворе щелочи выглядит так: Br2 + KOH = KBrO3 + KBr + H2O. Здесь и окислителем, и восстановителем является простое вещество бром (Br2).
Теперь посмотрим внимательнее на вещества — участники окислительно-восстановительных реакций.
Окислитель — вещество, в состав которого входит ион или атом, который в процессе реакции будет принимать электроны, тем самым понижая свою степень окисления.
Восстановитель — вещество, в состав которого входит ион или атом, который в процессе реакции будет отдавать электроны, тем самым повышая свою степень окисления.
Из определений понятно, что реакция включает два противоположных по действиям явления: процесс окисления и процесс восстановления. Процесс восстановления — это процесс принятия электронов, а процесс окисления — процесс отдачи электронов. Оба процесса протекают одновременно: окислитель восстанавливается, а восстановитель окисляется.
Вот мы и узнали общие закономерности протекания окислительно-восстановительных реакций. Теперь давайте разберемся, какие вещества могут быть окислителями, а какие — восстановителями, и может ли одно вещество проявлять те и другие свойства.
Примеры веществ-окислителей
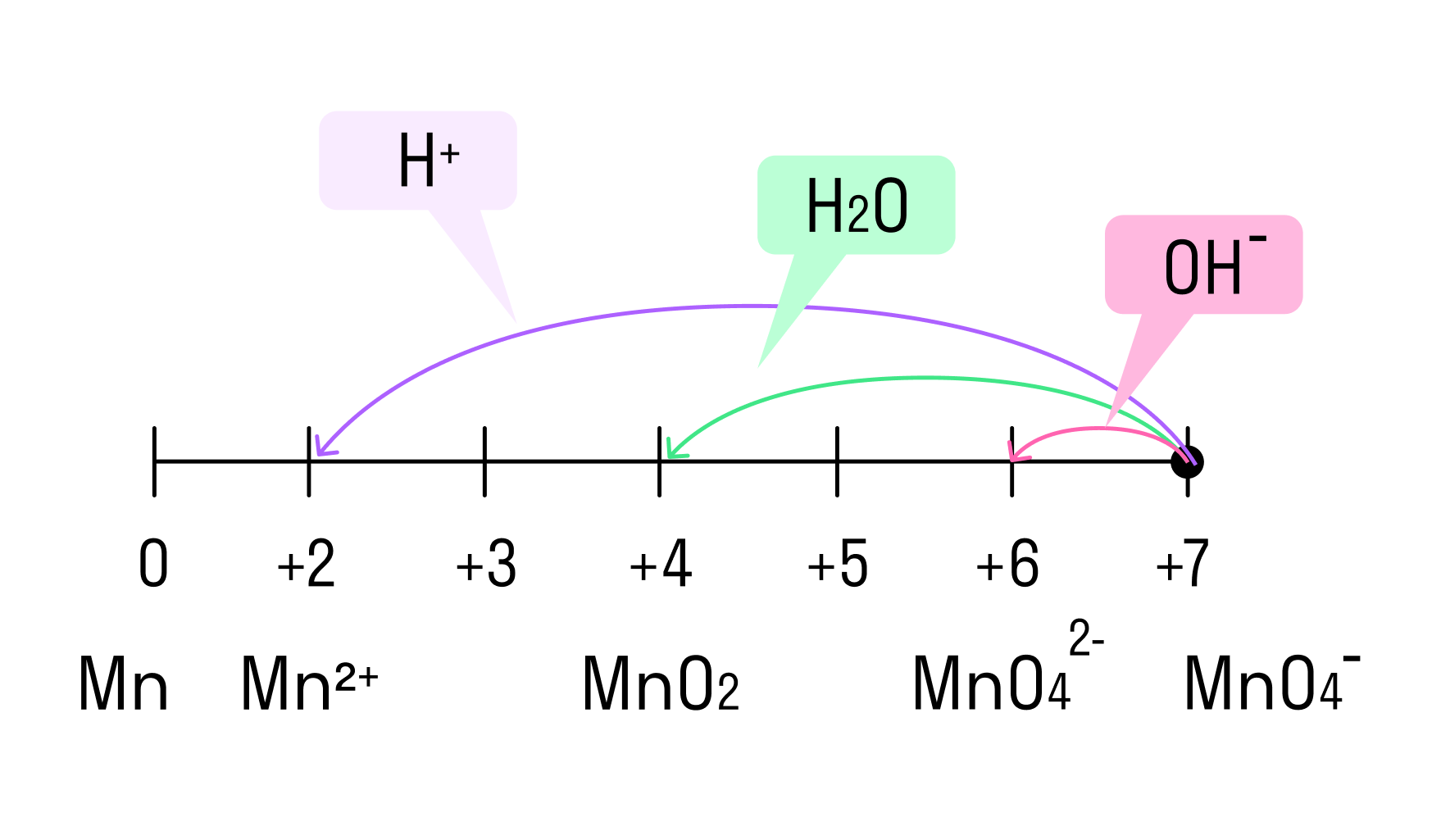
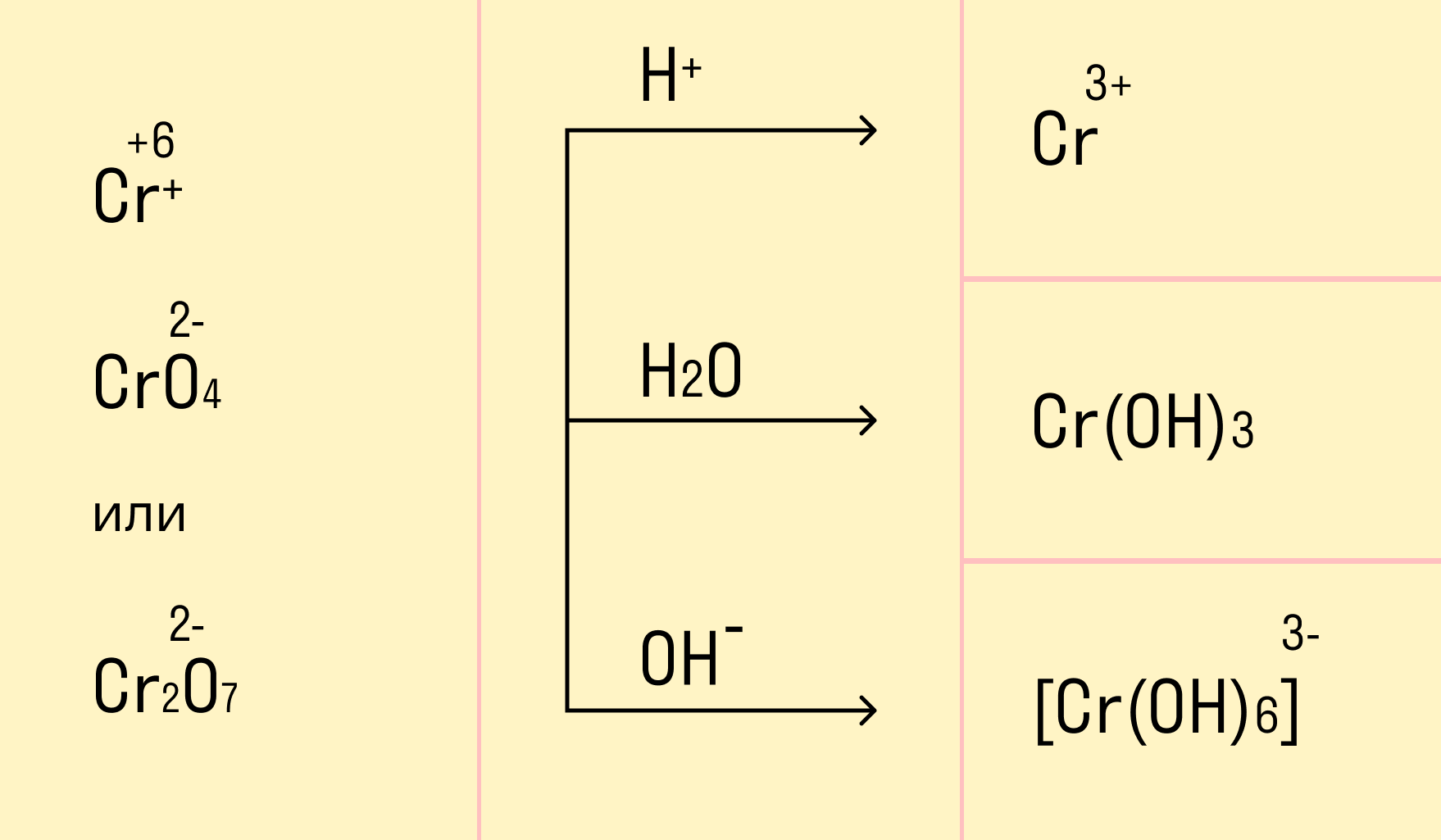
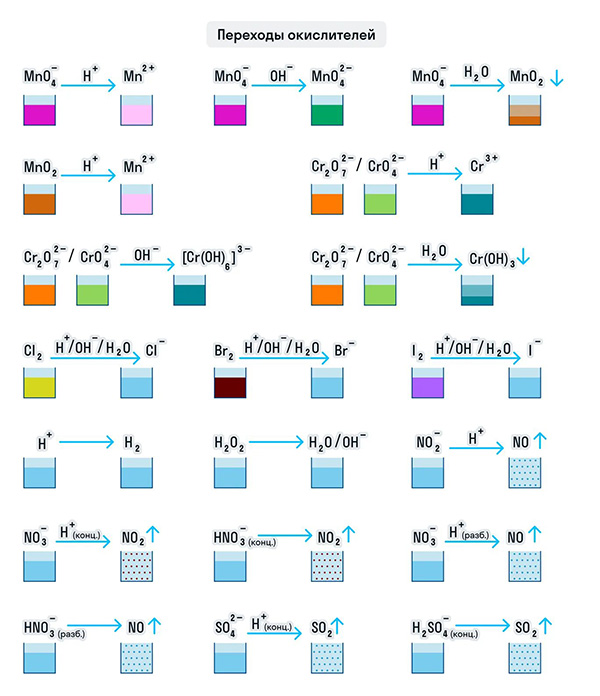
И марганец, и хром в кислой среде (H + ) образуют соли той кислоты, которая образовывала среду. В нейтральной среде (H2O) марганец превращается в оксид бурого цвета, а хром — в серо-зеленый нерастворимый в воде гидроксид. В щелочной среде (OH − ) марганец превращается в манганат (MnO4 2− ), а хром — в комплексное соединение светло-зеленого цвета.
Только окислителями могут быть простые вещества-неметаллы. Например, представители VIIA группы — галогены. Проявляя окислительные свойства в кислой среде, галогены восстанавливаются до соответствующих им галогеноводородных кислот: HF, HCl, HBr, HI. В щелочной среде образуются соли галогеноводородных кислот.
Кислород превращается в анион с устойчивой степенью окисления −2. А сера ведет себя как окислитель по отношению к водороду и металлам, образуя при этом сероводород и сульфиды.
Только окислителями могут быть и протон водорода (H + ) и катионы металлов в их высших степенях окисления при нескольких возможных. Ион Н + при взаимодействии с восстановителями переходит в газообразный водород (H2), а катионы металлов — в ионы с более низкой степенью окисления: 2CuCl2 + 2KI = CuCl + 2KCl + I2.
Рассмотрим как ведут себя сильные кислоты-окислители — азотная и серная. В зависимости от их концентрации меняются и продукты реакции.
Разбавленная азотная кислота никогда не реагирует с металлами с выделением водорода в отличие от разбавленной серной кислоты. Обе эти кислоты реагируют с металлами, стоящими в ряду активности после водорода.
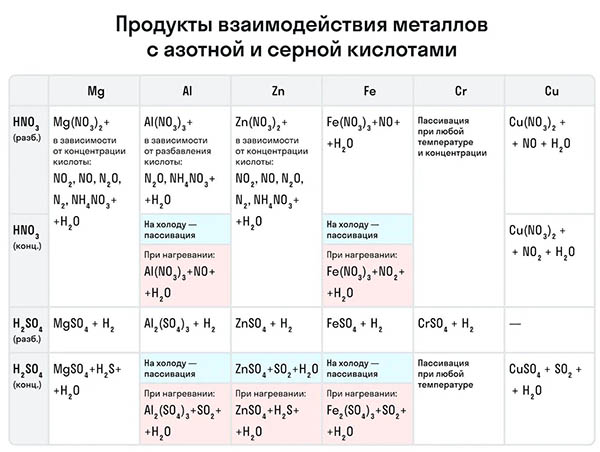
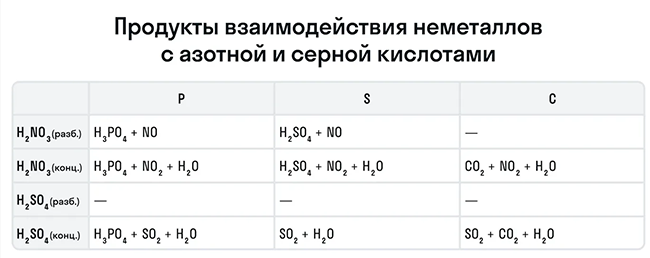
Эти кислоты проявляют окислительные способности и с некоторыми неметаллами, окисляя их до соответствующих кислот в высшей степени окисления неметалла-восстановителя.
Для удобства мы собрали цвета переходов важнейших веществ-окислителей в одном месте.
Примеры веществ-восстановителей
Типичными восстановителями могут быть щелочные (IA) и щелочноземельные (IIA) металлы, цинк и алюминий, а также катионы металлов в своих низших степенях окисления при нескольких возможных. Например:
Типичными восстановителями также могут быть бескислородные кислоты и их соли. Например, H2S + 4Cl2 + 4H2O = 8HCl + H2SO4.
Гидриды активных металлов (щелочных и щелочноземельных) тоже являются типичными восстановителями. Например, NaH + H2O = NaOH + H2.
Для удобства мы собрали цвета переходов важнейших веществ-восстановителей в одном месте.

Окислительно-восстановительная двойственность
Окислительно-восстановительная двойственность — это способность атома проявлять как свойства окислителя, так и свойства восстановителя в зависимости от условия протекания химической реакции.
Разберем вещества, атомы которых обладают окислительно-восстановительной двойственностью.
По отношению к водороду и металлам сера играет роль окислителя: S + H2 = H2S.
При взаимодействии с сильными окислителями повышает свою степень окисления до +4 или +6: S + KMnO4 = K2SO4 + MnO2.
Кислородсодержащие соединения серы в степени окисления +4
Сера в сульфитах и сернистой кислоте при взаимодействии с сильными окислителями повышает степень окисления до +6: SO2 + 2HNO3 (конц) = H2SO4 + 2NO2.
С восстановителями соединения серы проявляют окислительные свойства, восстанавливаясь до степени окисления 0 или −2: SO2 + C = CO2 + S.
Пероксид водорода
Атом кислорода в пероксиде водорода находится в промежуточной степени окисления –1, и в присутствии восстановителей может понижать степень окисления до –2: 4H2O2 + PbS = PbSO4 + 4H2O.
Атом кислорода в пероксиде водорода находится в промежуточной степени окисления –1, и в присутствии окислителей может повышать степень окисления до 0: 3H2O2 + 2KMnO4 = 3O2 + 2MnO2 + 2KOH + 2H2O.
Простое вещество йод
Окислительная способность проявляется у йода в реакции с такими восстановителями, как сероводород, фосфор и металлы: I2 + H2S = S + 2HI.
Йод при взаимодействии с более сильными окислителями играет роль восстановителя: I2 + 5Cl2 + 6H2O = 2HIO3 + 10HCl.
Азотистая кислота и нитриты
При взаимодействии с более сильными окислителями азот повышает степень окисления до +5 и превращается либо в азотную кислоту из азотистой, либо в нитрат-анион из нитрит-аниона: 5NaNO2 + 2KMnO4 + 3H2SO4 = 5NaNO3 + 2MnSO4 + K2SO4 + 3H2O.
При взаимодействии с сильными восстановителями обычно происходит восстановление до NO (иногда до других соединений азота в более низких степенях окисления): 2HNO2 + 2HI = 2NO + I2 + 2H2O.
Для удобства мы собрали представителей типичных окислителей и восстановителей в одну схему.

Классификация окислительно-восстановительных реакций
Окислительно-восстановительные реакции можно поделить на четыре типа:
Рассмотрим каждую по отдельности.
Межмолекулярная ОВР — это реакция, окислитель и восстановитель которой являются различными веществами.
2KI + Br2 = 2KBr + I2, где Br2 — окислитель, а KI — восстановитель (за счёт I −1 ).
Внутримолекулярная ОВР — это реакция, в которой один атом является окислителем, а другой восстановителем в рамках одного соединения.
Пример такой окислительно-восстановительной реакции:
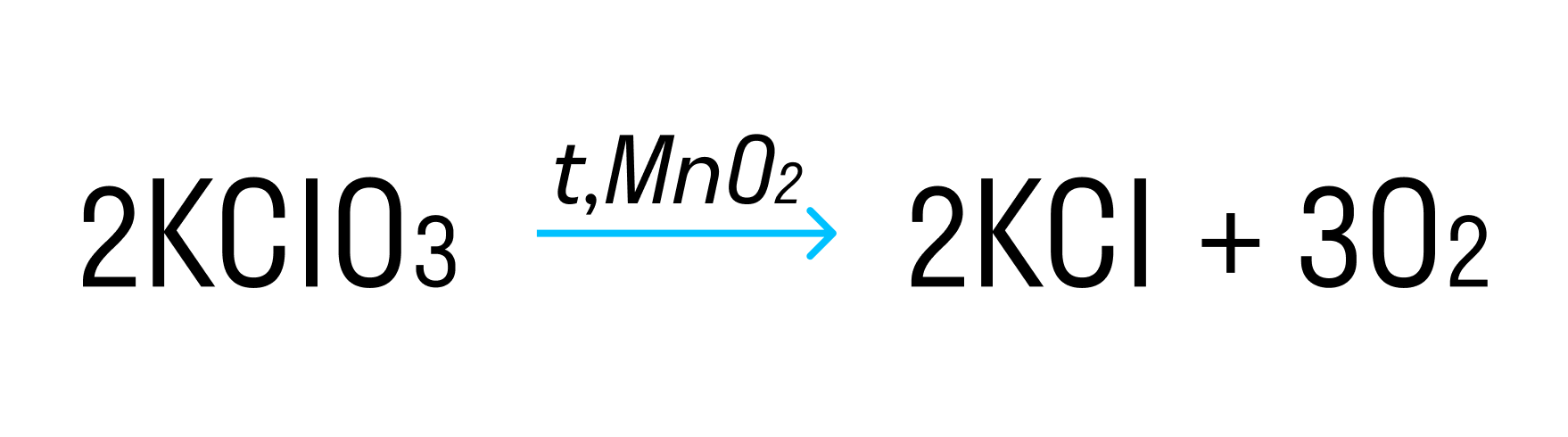
где Cl +5 — окислитель, а O −2 — восстановитель.
Термическое разложение нитратов — это внутримолекулярная ОВР. Вот схема разложения нитратов в зависимости от металла, входящего в состав соли.
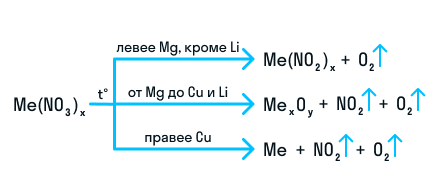
Исключение — разложение нитрата железа (II): 4Fe(NO3)2 = 2Fe2O3 + 8NO2 + O2. Здесь железо окисляется до +3 вопреки правилам. Иначе разлагается при нагревании и нитрат аммония: NH4NO3 = N2O + 2H2O.
Окислительно-восстановительная реакция диспропорционирования — это реакция, в ходе которой один и тот же атом является и окислителем, и восстановителем. Например, 3HNO2 = HNO3 + 2NO + H2O, где N +3 переходит в N +5 , являясь восстановителем, и N +3 переходит в N +2 , являясь окислителем.
Окислительно-восстановительная реакция контрпропорционирования — это реакция, в которой атомы одного и того же химического элемента в разных степенях окисления входят в состав разных веществ, при этом образуя новые молекулы одного и того же продукта.
Основные правила составления ОВР
Подобрать среди исходных веществ окислитель и восстановитель, а также вещество, которое отвечает за среду — при необходимости. Для этого нужно расставить степени окисления элементов и сравнить их окислительно-восстановительные свойства.
Составить уравнение реакции и записать продукты реакции. Следует помнить, что в кислой среде образуются соли одно-, двух- и трехзарядных катионов, а для создания среды чаще всего используют серную кислоту. В кислой среде невозможно образование оснóвных оксидов и гидроксидов, так как они вступят в реакцию с кислотой. В щелочной среде не могут образовываться кислоты и кислотные оксиды, а образуются соли.
Уравнять методом электронного баланса или методом полуреакций.
Составим алгоритм для уравнивания окислительно-восстановительных реакций методом электронного баланса.
Главное условие протекания ОВР — общее число электронов, отданных восстановителем, должно быть равно общему числу электронов, принятых окислителем.
Определите атомы, которые меняют свои степени окисления в ходе реакции.
Выпишите, сколько электронов принял окислитель и отдал восстановитель. Если восстановителей несколько, выписываем все.
Найдите НОК для суммарно отданных/принятых электронов.
Расставьте первые полученные коэффициенты перед окислителем и одним или несколькими восстановителями.
Уравняйте все присутствующие металлы в уравнении реакции.
Уравняйте кислотные остатки.
Уравняйте водород — в обеих частях его должно быть одинаковое количество.
Урок 7. Понятие об окислительно-восстановительных реакциях

При изучении строения атома, описании свойств некоторых элементов, химической связи неоднократно упоминалось о том, что атомы принимают или отдают электроны. Очевидно, существуют химические реакции, в ходе которых одни атомы отдают электроны другим атомам, которые их принимают.
Процесс отдачи электронов называется окислением, а процесс приёма электронов — восстановлением. Оба процесса происходят одновременно, так как не могут отданные электроны исчезнуть в «никуда» — должна существовать частица, которая их присоединит, и наоборот. Поэтому процессы окисления и восстановления, протекающие одновременно, называются окислительно-восстановительными реакциями. При этом атом*, отдающий электроны, называется восстановителем, а атом, принимающий электроны, — окислителем.
* В окислительно-восстановительной реакции участвует реальная частица, входящая в понятие химического элемента, — атом, ион, радикал.
Что же происходит с такими атомами? Пусть атом меди в каком-то процессе отдаст два электрона:
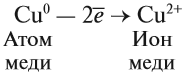
Если эта реакция происходит в растворе, то можно увидеть, как жёлто-красный металл медь уменьшится в размерах, а раствор приобретает голубую окраску, характерную для ионов меди. Очевидно, что свойства исходного простого вещества, состоящего из атомов, и полученных ионов — различно.
Этот же процесс может происходить и при окислении меди кислородом:

Но ионов здесь не образуется, хотя признак реакции (изменение цвета) налицо. В таких случаях изменение состояния окисленности обозначают при помощи степени окисления. Так, атому кислорода, который для завершения внешнего энергетического (электронного) уровня должен присоединить 2 электрона, почти во всех соединениях приписывают степень окисления –2. Поскольку молекула СuО электронейтральна — атом меди приобретает степень окисления +2.
Заметьте: заряд иона записывается так:
сбоку, сначала число, потом заряд (причём цифра 1 не пишется). Степень окисления записывают по-другому:
над символом элемента, сначала заряд, потом число (причём не только пишется цифра 1, но может быть даже дробное число).
Этой формой записи подчеркивают различие этих понятий:
- заряд иона — реальный заряд реальной, устойчивой частицы, которая входит в состав твёрдых веществ, определяет свойства некоторых растворов и т. д.;
- степень окисления — условный заряд воображаемого иона; этот заряд рассчитывается, исходя из предположения, что вещество состоит только из ионов (а это чаще всего не так). Степень окисления можно определить, исходя из строения атома данного химического элемента.
Величины этих зарядов могут совпадать, но очень часто они различаются. Рассчитаем, например, степени окисления элементов в химической формуле, соответствующей серной кислоте. При этом степень окисления кислорода равна –2, а водорода +1 (так как он может отдать только один электрон):
Суммарный заряд двух атомов водорода равен +2, а четырёх атомов кислорода:
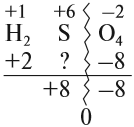
Видно, что для того, чтобы молекула была электронейтральна, не хватает положительных зарядов, следовательно, степень окисления серы в серной кислоте равна +6. (Такого иона серы вообще не существует!)
При расчёте степеней окисления следует руководствоваться следующими правилами:
1. Степень окисления атомов химических элементов в простом веществе равна нулю:
2. Степени окисления атомов металлов в соединениях всегда положительны и равны их валентности:
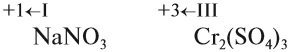
3. Степени окисления постоянны у F: –1; у Н: +1 (кроме гидридов — Li +1 H -1 ); у О: –2 (кроме Н2 +1 О2 –1 , F2 –1 О +2 ).
4. Степень окисления химических элементов в кислотном остатке соли такие же, как в соответствующей кислоте:
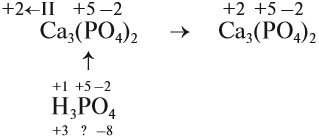
5. Алгебраическая сумма степеней окисления в любом соединении равна нулю.
Задание 7.1. Расставьте степени окисления химических элементов в соединениях:
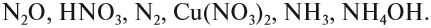
Если вы испытываете затруднения при расстановке степеней окисления, рекомендуется составлять простейшие математические уравнения.
Известные степени окисления
Суммарные степени окисления: +2 + 2х –14 = 0 (математическое уравнение, которое решается относительно «х»)
х = 6, т. е. степень окисления атома хрома в этом соединении равна +6.
Определив степени окисления элементов в уравнении реакции, можно определить, какой атом является окислителем, какой — восстановителем:
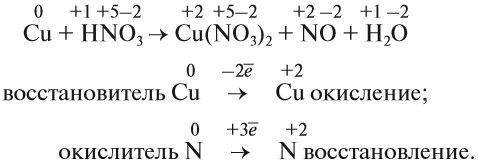
Задание 7.2. Определите окислитель и восстановитель в уравнениях реакций:
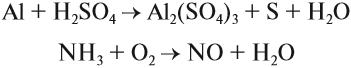
Из этих примеров видно, что число электронов, принятых окислителем, может отличаться от числа электронов, отданных восстановителем. Но этого быть не должно(!), так как при этом нарушается закон сохранения материи. Значит, число отданных электронов должно равняться числу принятых электронов. А для этого следует изменить число атомов окислителя и восстановителя, поставив соответствующие коэффициенты. Например, в данном случае:
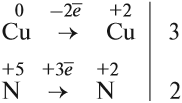
Эти коэффициенты (3 и 2) означают, что три атома меди отдают шесть электронов, а два атома азота принимают шесть электронов:
Или в краткой форме:
Теперь осуществлён баланс (равенство) электронов, поэтому именно эти коэффициенты из электронного баланса (3 и 2) должны быть в уравнении реакции
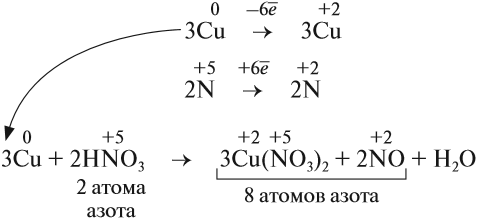
Но теперь не осуществляется баланс по азоту! Где же допущена ошибка? Дело в том, что в электронном балансе учитываются только электронные процессы окисления и восстановления, т. е. учитываются только те атомы, которые меняют степени окисления, а часть атомов не изменила ее:
Отсюда правило: коэффициенты электронного баланса ставят только к тем атомам, которые с данной степенью окисления встречаются в химическом уравнении один раз.
Исправим ошибку и уравняем атомы остальных элементов:
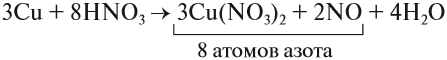
Проверим по кислороду:
- до реакции: 8 · 3 = 24 атома;
- после реакции: 3 · 3 · 2 + 2 + 4 = 24 атома.
Правила расстановки коэффициентов методом электронного баланса
1. Расставить степени окисления.
2. Выписать элементы, изменившие степени окисления, указав число отданных и принятых электронов. Определить окислитель и восстановитель.
3. Поставить дополнительные коэффициенты, уравняв число отданных и принятых электронов.
4. Проверить эти коэффициенты: они должны соответствовать числу атомов данного элемента в молекуле. Например, если дополнительный коэффициент нечётный, а в молекуле чётное число атомов (например, Сl2), то оба дополнительных коэффициента удваиваются.
5. Проверенные коэффициенты переносят в уравнение, считая атомы, к тем элементам, которые с данной степенью окисления встречаются в уравнении ОДИН раз.
6. Затем уравнивают атомы:
- металлов;
- неметаллов;
- водорода.
7. Проверяют по кислороду.
Рассмотрим эти правила на примере. Требуется уравнять (т. е. расставить коэффициенты в уравнении реакции):
1, 2, 3.
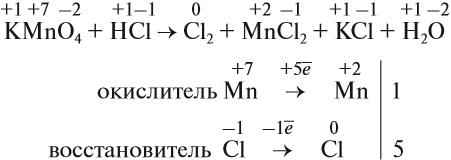
4. Поскольку число атомов хлора в молекуле чётное (2), а коэффициент к хлору нечётный (5), удвоим оба дополнительных коэффициента:
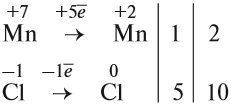
5. Переносим коэффициенты к атомам марганца и хлора, кроме Сl –1 , которые встречаются в уравнении реакции три раза:
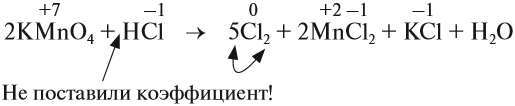
Обратите внимание, что перед молекулой хлора поставлен коэффициент 5, а не 10, так как нужно считать атомы хлора: 5 · 2 = 10 атомов.
6. Уравняем остальные атомы:
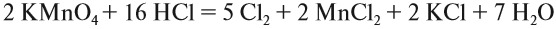
7. Атомы кислорода до и после реакции пересчитайте сами.
Задание 7.3. Уравнять методом электронного баланса:
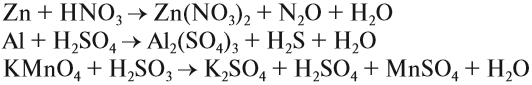
Вы можете проверить степень усвоения материала этой главы, выполнив упражнения ЕГЭ из разделов 4, 28 и частично 36.

Выводы
Окислительно-восстановительные реакции (ОВР) — это процессы, в которых изменяются степени окисления атомов. Степени окисления атомов изменяются потому, что один атом (окислитель) принимает электрон от атома восстановителя. При этом число принятых и отданных электронов должно быть одинаковым. На этом основан метод электронного баланса, при помощи которого расставляют коэффициенты в уравнениях ОВР.
Читайте также:
