Карбиды металлов химические свойства
Обновлено: 16.05.2024
КАРБИДЫ (от латинского carbo – уголь) – соединения углерода с металлами, а также с бором и кремнием. Эти соединения обладают удивительным разнообразием физических и химических свойств. Так, карбид золота Au2C2 взрывается уже при попытке пересыпать его с листочка фильтровальной бумаги, на котором он был высушен. С другой стороны, карбиды некоторых элементов (например, бора и тантала) не разлагаются даже при температуре белого каления и настолько химически инертны, что на них не действует царская водка, а по твердости они приближаются к алмазу!
Впервые необычное соединение металла с углеродом (К2С2) получил в 1809 знаменитый английский химик Гемфри Дэви. В 1863 французский химик Марселен Бертло изучил свойства другого карбида – очень неустойчивого и легко взрывающегося карбида одновалентной меди Cu2C2. В 1878 немецкий металлург Ф.Мюллер, растворив образцы стали в разбавленной серной кислоте, выделил карбид железа Fe3C. Но только в конце 19 в. французский химик Анри Муассан, прославившийся получением фтора, синтезировал многие из этих необычных соединений и изучил их свойства. Он получал карбиды, нагревая до очень высокой температуры смеси древесного угля с разными металлами, их оксидами или карбонатами. Для этого он использовал жар вольтовой дуги в электрической печи собственной конструкции.
Карбиды, как оказалось, можно получить не только в лаборатории. Еще до работ Муассана австрийский ученый Э.Вайнсхенк в 1889 открыл в метеоритах минерал когенит, представляющий собой смешанный карбид железа, кобальта и никеля состава (FeNiCo)3C. А сам Муассан в 1904 обнаружил в метеорите, привезенном из каньона Диабло в штате Аризона, темно-зеленый минерал, представляющий собой карбид кремния SiC. Этот минерал в честь ученого назвали муассанитом.
Раньше карбиды классифицировали по их устойчивости к действию воды и кислот, а также по тому, какие газы выделяются при их разложении. Современная классификация учитывает тип химической связи между атомами в карбидах – именно от этого зависят в основном физические и химические свойства. В соответствии с этой классификацией, карбиды можно разделить на три группы, которые довольно сильно отличаются по своим свойствам.
К первой группе относятся так называемые солеобразные карбиды с ионной связью. Эти карбиды образуют щелочные и щелочноземельные металлы, алюминий, редкоземельные элементы, а также актиноиды. Их состав иногда соответствует типичным валентностям металлов (Al4C3), а иногда – нет (Ве2С). Многие ионные карбиды можно получить непосредственно из элементов (Са + 2С ® СаС2) или восстановлением оксидов углеродом (СаО + 3С ® СаС2 + СО). Ионный характер связи приводит к высокой температуре плавления; например, карбид кальция СаС2 плавится при 2300° С, карбид тория ThC2 – при 2655° С. Водой или разбавленными кислотами ионные карбиды легко разлагаются – гидролизуются. При этом образуются различные углеводороды и гидроксид металла. Самый известный пример – получение ацетилена гидролизом карбида кальция: СаС2 + 2Н2О ® Ca(OH)2 + С2Н2. Ацетилен выделяется также при гидролизе Na2C2, К2С2 и др. Поэтому такие карбиды можно рассматривать как производные ацетилена, в которых атомы водорода замещены атомами металла. При этом катионы металла и анионы С2 –2 размещаются в соответствующих узлах кристаллической решетки. Солеобразный характер этих карбидов подтверждается возможностью их электролиза в расплавленном состоянии. Интересно отметить, что чистый карбид кальция – бесцветные кристаллы, хотя увидеть их непросто, так как обычный технический продукт имеет цвет от бурого до черного.
Взаимодействие карбидов щелочных металлов с водой протекает исключительно бурно. Так, если карбид калия просто облить водой, произойдет бурная реакция, которая сопровождается взрывом такой силы, что выделяющийся ацетилен сразу же разлагается с выделением угля. Чтобы провести реакцию К2С2 + 2Н2О ® 2КОН + С2Н2, надо медленно пропускать над карбидом водяной пар.
В ряде случаев карбиды ионного типа образуются непосредственно при пропускании ацетилена через растворы солей металлов. Так карбиды серебра, меди(I), золота и ртути, которые чаще называют ацетиленидами. Ацетилениды щелочных металлов можно получить действием ацетилена на свободные металлы. В сухом виде ацетилениды тяжелых металлов легко разлагаются со взрывом. Гидролиз ионных карбидов других металлов показывает, что они «происходят» из других углеводородов. Например, при гидролизе карбида алюминия выделяется метан: Al4C3 + 12H2O ® 4Al(OH)3 + 3CH4 (так же гидролизуется карбид бериллия Ве2С), а при гидролизе карбида магния получается метилацетилен: Mg2C3 + 4H2O ® 2Mg(OH)2+ НС≡С–СН3. Интересно, что карбид магния другого состава, MgC2, дает при гидролизе только ацетилен. Иногда при гидролизе ионных карбидов углеводороды выделяются совместно с водородом, который частично гидрирует непредельные углеводороды. С выделением почти равных количеств водорода и метана разлагается карбид марганца: Mn3C + 6H2O ® 3Mn(OH)2 + CH4 + H2. Карбиды редкоземельных металлов и тория при разложении разбавленными кислотами выделяют не чистый ацетилен, а его смесь с метаном, этиленом и другими углеводородами. Например, при гидролизе карбида церия СеС2 получается смесь ацетилена с метаном в соотношении 4:1, а также немного этилена и жидких и твердых углеводородов (состав продуктов зависит от условий проведения реакции). Еще больше жидких и твердых углеводородов дает при гидролизе карбид урана.
Выделение углеводородов при гидролизе карбидов позволило Д.И.Менделееву выдвинуть так называемую карбидную теорию происхождения нефти в глубинах Земли из неорганических веществ. По представлению Менделеева, в глубинах земного шара должны быть расплавленные металлы, в основном железо, которое с углеродом дает карбид. Во время горообразования в земной коре образуются трещины, по которым в глубины проникает вода. Воздействуя на карбид железа и карбиды других металлов, вода (в виде пара) образует углеводороды, например: 2FeC + 3H2O ® Fe2O3 + C2H4. Газообразные углеводороды по тем же трещинам поднимаются ближе к поверхности, где скапливаются в пористых пластах. Однако когда в 60-е гг. 20 в. был подробно изучен состав углеводородов нефти, оказалось, что смесь «искусственных углеводородов», образующихся при гидролизе карбидов, по своему составу резко отличается от природной смеси. Кроме того, все нефти, полученные неорганическим путем, оптически неактивны, тогда как природная нефть оптически активна. На основании этих, а также ряда других фактов неорганическая теория происхождения нефти была подвергнута критике, и в настоящее время многие ученые полагают, что нефть имеет биологическое происхождение.
Ко второй группе относятся карбиды, которые образуют переходные металлы IV–VII групп, а также кобальт, железо и никель. Это металлоподобные соединения с другой структурой. В них атомы углерода, имеющие небольшие размеры, не связаны друг с другом и располагаются в пустотах между атомами металлов. Различная упаковка атомов металла в кристаллической решетке приводит к разному составу карбидов даже для одного и того же металла; например, хром образует карбиды состава Cr3C2, Cr4C, Cr7C3 и др. Эти карбиды (их называют карбидами внедрения) часто отличаются большой твердостью и очень высокими температурами плавления. Например, карбиды тантала и гафния TaC и HfC – наиболее тугоплавкие из известных веществ (плавятся при 3985 и 3890° С соответственно).
Металлоподобные карбиды обладают высокой электропроводностью и очень высокой химической стойкостью к агрессивным средам (многие из них не растворяются даже в царской водке). Они используются для упрочнения чугуна и стали (карбиды железа, хрома, вольфрама, молибдена), а также для производства очень твердых сплавов, которые применяют для обработки металлов резанием (карбиды WC, TiC, TaC, VC, Cr3C2). Например, твердые наконечники резцов, сверл делают из победита – спеченного порошка карбида вольфрама WC с добавкой металлического кобальта. Очень важную роль играет карбид железа Fe3C (цементит) – твердые кристаллы, входящие в структуру чугуна и стали.
Карбид вольфрама WC используют также для изготовления буровых коронок, деталей аппаратуры для производства синтетических алмазов, для нанесения износостойких покрытий на поверхности металлов. Карбид титана интересен ярким проявлением нестехиометрии: состав этого соединения выражается формулой TiCх, где х колеблется в пределах от 0,49 до 1 (см. СТЕХИОМЕТРИЯ). Это вещество, как и карбид вольфрама, используют как компонент жаропрочных, жаростойких и твердых сплавов, для получения износостойких покрытий, для изготовления тугоплавких тиглей, в которых можно плавить почти любые металлы (сам карбид плавится при 3257° С). Карбидом титана выкладывают внутренние стенки высокотемпературных печей.
К третьей группе относятся ковалентные карбиды. Их образуют кремний и бор – соседи углерода по периодической таблице, близкие к нему как по размеру атомов, так и по электроотрицательности. Карбид кремния SiC (техническое название – карборунд) в чистом виде – бесцветные кристаллы, но примеси часто окрашивают его в различные цвета, вплоть до черного. По своей структуре это соединение аналогично алмазу; решетку карбида кремния можно получить, если в немного расширенной решетке алмаза заменить половину атомов углерода на атомы кремния. Это вещество обладает очень высокой твердостью; помимо этого оно имеет свойства полупроводника. Из него делают шлифовальные бруски и круги, огнеупорные материалы для печей и литейных машин, нагревательные элементы для электропечей, полупроводниковые диоды.
Бор образует по два карбида с точно известной структурой – В4С и В13С2. Наибольшее значение имеет первый из них – черные блестящие кристаллы, которые по твердости уступают лишь алмазу и нитриду бора BN. Этот карбид применяют для изготовления абразивных и шлифовальных материалов и в качестве полупроводника. Карбид, обогащенный изотопом 10 В, используется как поглотитель нейтронов в ядерных реакторах.
Свойства и особенности карбидов металлов
В природе металлы активно вступают в химические реакции с кислотами, щелочами и атмосферным кислородом. В большинстве случаев для этого не требуется дополнительная обработка (химическая, термическая). При сильном нагреве металлы начинают активно вступать в реакцию с углеродом, что приводит к образованию сложных соединений под названием карбиды. Эти соединения отличаются рядом необычных свойств — высокая прочность, тугоплавкость, химическая инертность. Какие бывают карбиды металлов? Как эти соединения применяются в промышленности? Какие вещества получили наибольшее применение?

Краткие сведения
Карбиды — это химические соединения, которые состоят из углерода (C) и другого элемента. Обычно в качестве второго элемента выступают металлы — это может быть железо (Fe), титан (Ti), хром (Cr), гафний (Hf) и другие. В карбидных соединениях углерод более высокой электроотрицательностью (в сравнении со вторым элементом). Поэтому карбиды нельзя отнести к оксидам, галогенидам и другим химическим соединениям. Карбиды металлов — в основном твердые тугоплавкие вещества, которые отличаются очень высокой прочностью и почти не вступают в реакции с химически активными веществами.
Благодаря этим необычным свойствам карбиды часто применяют в качестве абразивов для обработки различных сплавов (это может быть чугун, сталь, соединения на основе алюминия). Из них делают электроды для сварки, огнеупорные стержни, элементы электрических систем. Первые карбиды на основе калия, железа и магния были открыты и получены совсем недавно — в XIX веке. Однако со временем были получены и новые карбидные соединения — на основе хрома, титана, гафния, вольфрама, кальция.
Физические свойства, особенности
- Высокая твердость. Атомы углерода и металлов образуют твердую кристаллическую решётку, для разрушения которой потребуется большое механическое усилие. Поэтому с помощью ударов разрушить карбидные вещества будет крайне сложно. Благодаря высокой твердости материалы нашли широкое распространение в различных технических сферах (от военного машиностроения до строительства).
- Высокая температура плавления. Плотная кристаллическая решетка обеспечивает устойчивость вещества при сильном нагреве или охлаждении. Средняя температура плавления карбидов находится в пределах от 1500 до 2000 градусов. Поэтому такой материал без проблем выдержит длительное воздействие экстремальных температур (скажем, его можно использовать в печах, металлургических ковшах для расплавления других материалов).
- Устойчивость к химическим веществам и коррозии. Внешние электронные оболочки веществ-карбидов являются полностью заполненными. Поэтому такой материал будет редко вступать в химические реакции с другими веществами (он устойчив к воздействию кислот, щелочей, солей). Вещества не вступают в реакцию с водой и атмосферным кислородом, поэтому они не покрываются ржавчиной, что обеспечивает их высокий срок годности.
- Повышенная износоустойчивость. Изделия на основе карбидов долгое время сохраняют свою форму даже в случае удара, деформации или воздействия высоких температур. Поэтому они обладают повышенной износоустойчивостью, что делает их срок годности большим. Благодаря повышенной устойчивости материал часто применяют для изготовления абразивных и шлифовальных изделий, которыми можно пользоваться в течение большого срока.
Стоит обратить внимание, что далеко не все карбидные соединения обладают перечисленными свойствами. Скажем, карбид золота (I) чрезвычайно взрывоопасен (тогда как большинство других карбидов металлов — нет). Он может взорваться даже в случае неаккуратного пересыпания вещества на бумажную поверхность. Поэтому при рассмотрении физических и химических свойства карбидов нужно по отдельности рассматривать каждое соединение, поскольку карбидные материалы могут обладать уникальными необычными свойствами.

Разновидности карбидов
- Материалы с ковалентной решеткой. Вещества с таким способом связи возможны только в том случае, если в качестве второго элемента выступает бром или кремний. На атомарном уровне соединение образуется за счет sp, sp-2 или sp-3 гибридизации. В веществе атомарный металл заменяет собой углерод, что позволяет формировать прочное устойчивое вещество, которое устойчиво к механическим ударам, высоким температурам, химическим веществам. С точки зрения электропроводности вещество является полупроводником (хотя использование карбидов в качестве полупроводниковых элементов невыгодно с практической точки зрения).
- Металлоподобные материалы. В эту группу входят соединения, у которых металлических элемент является железом, кобальтом, никелем либо относится к переходной группе (IV-VII). У таких карбидных соединений металлические атомы располагаются не на месте атомов углерода, а в различных пустотах кристаллических решеток (поэтому часто такие вещества называют карбидами внедрения). Такое необычное расположение делает вещество устойчивым, крепким, надежным, оно не будет разрушаться под воздействием высоких температур или при воздействии химически активных веществ (кислоты, щелочи, соли и другие).
- Материалы с ионной связью. В эту группу входит множество карбидов, у которых в качестве металлического элемента выступает алюминий, редкоземельные металлы либо элементы I или II группы периодической таблицы. По химической структуре вещества похожи на соединения с ковалентной решеткой с той лишь разницей, что здесь металлы обычно теряют один или несколько электронов на внешнем уровне, что приводит к образованию веществ-ионов. По химико-физическим свойствам ионные карбиды аналогичны стандартным соединениям — отличная прочность, высокая температура плавления. Единственное крупное отличие — вещества активно взаимодействуют с кислотами (обычно с образованием металла или подобных веществ).

Применение материалов
Карбиды металлов применяются производстве (в основном — в тяжелом). Перечислим основные варианты применения:
- Простые карбидные соединения на основе железа могут добавлять в металлический сплав (чугун, сталь, чистое железо), чтобы улучшить его физико-химические свойства. Дополнительные компоненты улучшают прочность, повышают химическую инертность, минимизируют риск коррозии под действием воды или атмосферного воздуха. Еще одно полезное свойство — увеличение температуры плавления, что удобно в случае изготовления тугоплавких запчастей или деталей.
- Карбиды на основе титана или вольфрама отличаются сверхвысокой прочностью, а плавятся они при сверхвысоких температурах. Поэтому из них делают режущие и абразивные инструменты, которые отличаются высоким сроком годности. Подобные соединения можно использовать в качестве огнеупорных материалов (скажем, при производстве печей), для изготовления сварочных стержней.
- Карбид кальция обладает необычным свойством — при контакте с водой происходит ряд химических реакций, что в конечном счете приводит к образованию ацетилена. Это вещество широко применяется для кислородной сварки, резки или напайки. Поэтому такое карбидное соединение может использоваться для изготовления соответствующих деталей (электроды для сварочных инструментов, напайка и другие). Ацетилен при горении выделяет большое количество тепла, поэтому к работам нужно подойти осторожно.
Основные металлические карбиды
На практике широко применяется множество карбидных соединений. Рассмотрим основные из них.
Карбид гафния
Встречается в виде только одного вещества — HfC. В нормальных условиях обладает кристаллической структурой, окрашено в серый цвет. плавится при температуре 3900 градусов — интересно, что его закипание происходит уже при температуре 4160 градусов. Поэтому к расплавлению нужно подходить аккуратно, чтобы не испарить его. При нагреве до 2000 градусов начинает взаимодействовать с металлами (молибден, вольфрам). Вещество не обладает полной химической инертностью — оно вступает в реакцию с кислотами (в азотной или серной кислоте оно способно полностью раствориться).

Карбиды хрома
Встречается в виде нескольких веществ; основные — Cr23C6, Cr3C2, Cr7C3. Отличаются высокой химической инертностью (хотя могут реагировать с цинком при сильном нагреве). Не вступают в контакт с водой, атмосферным воздухом, кислотами, щелочами, солями, другими карбидными соединениями. Температура плавления не слишком высокое — большинство соединений плавятся уже при температуре 1500-1700 градусов. У соединения Cr7C3 при нагреве до 800 градусов происходит ряд эндотермических реакций и превращений, что приводит к превращению вещества в Cr23C6.
Карбид титана
Встречается в виде одного стабильного соединения — TiC. При нормальных условиях обладает серым цветом с характерным металлическим блеском. Плавится при температуре 3100 градусов, кипит — при 4305 градусах. Обладает высокой устойчивостью, прочностью. Химическая инертность средняя — в нормальном состоянии может вступать в реакцию с кислотами и щелочами (хотя реакция идет слабо). При нагреве до 2500 градусов может вступать в реакцию с азотом (в том числе — атмосферным). При нагреве до 1200 градусов может окисляться и/или вступать в реакцию с углекислым газом.
Карбиды вольфрама
Встречается в виде двух устойчивых соединений — WC и W2C. Оба карбида отличаются приблизительно одинаковыми химико-физическими свойствами. Вид — мелкий порошок серовато-черного цвета (со слабым металлическим блеском или без него). Вещества плавятся при температуре около 2720 градусов, однако при более низких температурах начинается их активных контакт с атмосферным воздухом, азотом или углекислым газом. Соединения легко растворяются в разогретых до температуре кипения серных и азотных кислотах.
Карбид кальция
Основное устойчивое соединение — CaC2. Вид — крупные прозрачные кристаллы, которые могут обладать светло-голубым оттенком. При наличии примесей может окрашиваться в другие цвета — серый, желтый, коричневый, черный и другие (в зависимости от типа примеси и ее концентрации). Соединение плавится при температуре порядка 2500 градусов, однако при комнатной температуре оно активно вступает в реакцию с водой с активным выделением ацетилена. Поэтому вещество нуждается в особых безопасных способах хранения (ацетилен является токсичным для человека).
Карбид циркония
Основное соединение — ZrC. Стандартное состояние — небольшие кристаллы серого цвета, обладающие металлическим блеском. Температура плавления — 3530 градусов, однако при нагреве до 1200 градусов вещество начинает активно вступать в реакцию с атмосферным кислородом, что приводит к образованию оксидов. Вещество слабо реагирует с кислотами, щелочами и солями, однако может вступать в реакцию с атомизированным азотом в составе сложных веществ, что приводит к образованию нитритов. Поэтому вещество нуждается в особых способах хранения.

Заключение
Подведем итоги. Карбиды металлов — соединения, в состав которых входит углерод и какой-либо дополнительный металл. Это может быть железо, хром, цирконий, вольфрам и другие. Соединение может образовывать сложную прочную кристаллическую решетку (ковалентную, металлическую, ионную). Карбиды из-за особенностей своего строения отличаются высокой прочностью, устойчивостью к механической деформации, химической инертностью. Вещества обычно не вступают в реакцию с кислотами, щелочами, солями, атмосферными газами (кислород, азот, углекислый газ).
Из карбидов делают абразивные или шлифовальные инструменты, поскольку они не деформируются, не портятся со временем, могут деформировать другие прочные соединения. Из них делают электроды для сварочных инструментов, термоустойчивые стержни, элементы электрических инструментов. Некоторые виды карбидов могут проявлять необычные свойства. Скажем, карбид золота взрывается при легком контакте, а карбид кальция может вступать в реакцию с водой при комнатной температуре с образованием ацетилена.
Карбиды
В обычных условиях углерод (особенно алмаз) очень инертен и вступает во взаимодействие только с очень энергичными окислителями. При нагревании химическая активность углерода повышается. В аморфном виде уголь и кокс легко горят на воздухе, образуя углекислый газ CO2. При недостатке кислорода углерод окисляется только до СО. Алмаз способен гореть лишь в чистом кислороде при 700 - 800ºС. Эта способность углерода окисляться при нагревании используется при восстановлении многих металлов из их оксидов.
C другими галогенами углерод непосредственно не соединяется, а соответствующие соединения получают косвенным путем. Четыреххлористый углерод получают пропусканием хлора через сероуглерод при 60ºС в присутствии катализатора FeS: CS2 + 2Cl2 = CCl4 + 2S.
При высокой температуре углерод взаимодействует с серой, азотом и кремнием:
С металлами углерод реагирует при высоких температурах, образуя карбиды. Карбиды также можно получить при взаимодействии угля с оксидами металлов:
3C + CaO = CaC2 + CO.
Углерод взаимодействует, как восстановитель, и с оксидами других металлов при нагревании: C + 2PbO = 2Pb + CO2.
Углерод растворяется только в кислотах-окислителях при нагревании:
Углеводороды являются достаточно стабильными, так как перекрывание малых по размеру валентных орбиталей велико, различие в электроотрицательностях углерода и водорода мало, поэтому образуются прочные ковалентные связи С−Н.
Прямой синтез метана (простейшего углеводорода) можно осуществить только в присутствии катализатора, например мелкодисперсного никеля. Разнообразие углеводородных соединений объясняется способностью углерода к образованию бесконечных линейных и разветвленных цепочек (−С−С−, >С=С< и −C≡C−) замыканию их в циклы с одинарными или кратными связями между атомами углерода как в гомоатомных, так и в гетероатомных соединениях (ароматические соединения с делокализованными π-связями).
Сам метан не реагирует с водой, кислотами и щелочами, с кислородом взаимодействует только при поджигании. Ненасыщенные углеводороды являются более реакционноспособными, чем углеводороды ряда метана. Их примеси могут служить причиной самовоспламенения болотного газа (метана) в природных условиях.
С менее электроотрицательными элементами углерод образует соединения, которые называют карбидами. Их можно разделить на 3 группы.
Ионно-ковалентные карбиды (солеподобные) –к ним относят метаниды и ацетилениды. Метаниды можно рассматривать как производные метана, содержащие ион С −4 , например карбид бериллия Be2C или карбид алюминия Al4C3. Это тугоплавкие кристаллические вещества, которые реагируют с разбавленными кислотами с выделением метана:
Ацетилениды- производные ацетилена состава М +1 2С2, М +2 С2 и М +3 2(С2)3, содержат ион С2 −2 (где М – это s- и d-металлы I и II группы периодической системы или Al +3 ). Ацетилениды детонируют даже в сухом виде, разлагаются водой и разбавленными кислотами:
Солеподобные карбиды получают при взаимодействии оксидов металлов с графитом при высокой температуре:
Ацетилениды можно получить обменным взаимодействием ацетилена с солью соответствующего металла.
Металлоподобные карбиды – это карбиды d-металлов IV – VIII групп нестехиометрического состава, который изменяется в широких пределах; проявляют металлические свойства: металлический блеск, высокую твердость, высокие температуры плавления. Карбиды титана, ванадия, ниобия, молибдена и вольфрама характеризуются еще и высокой коррозионной устойчивостью.
Металлоподобные карбиды получают непосредственным взаимодействием металлов или их оксидов с углеродом в электропечах при высокой температуре:
Карбиды состава M3C (где металл имеет небольшой радиус) термически и химически менее устойчивы, например, разлагаются разбавленными кислотами, выделяя смесь углеводородов с достаточно длинными цепями.
Ковалентные карбиды с атомной кристаллической решеткой – B4C и SiC – продукты частичного замещения атомов углерода в структуре алмаза на атомы бора или кремния. Карбид бора очень тверд, царапает алмаз, химически достаточно инертен. Карборунд по твердости близок к алмазу, но более хрупок, химически стоек и окисляется кислородом только при температуре свыше 1000ºС. При сплавлении со щелочью в присутствии кислорода карборунд разрушается с образованием карбоната и силиката. SiC растворяется только в смеси концентрированных плавиковой и азотной кислот, в царской водке.
Такие карбиды получают в электропечах при очень высокой температуре из смесей соответственно SiO2 или B2O3 с коксом, графитом или сажей.
Применение. Металлические карбиды придают сталям и чугунам твердость, износоустойчивость. Карбиды вольфрама и тантала используют для изготовления режущих инструментов и получения сверхтвердых сплавов. Карборунд используют как абразивный материал, как компонент огнеупорных материалов, в качестве стержней сопротивления в электронагревательных приборах.
Карбиды в легированных сталях
По степени сродства легирующих элементов к углероду по сравнению со сродством к нему железа различают карбидообразующие и некарбидообразующие легирующие элементы.
К карбидообразующим относятся переходные металлы с недостроенной d-электронной оболочкой. Чем меньше электронов на оболочке, тем больше сродство к углероду. В процессе карбидообразования углерод отдает свои валентные электроны на заполнение d-электронной полосы атома металла, тогда как у металла валентные электроны образуют металлическую связь, обусловливающую металлические свойства карбидов.
В сталях карбидообразующими являются следующие элементы: Fе, Мn, Сг, Мо, W, V, NЬ, Тi (элементы перечислены в порядке возрастания их карбидообразующей способности). Некарбидообразующие элементы (Cu, Ni, Co, Si, Al) карбидов в стали не образуют.
При соотношении атомных радиусов углерода и металла менее 0,59 сильные карбидообразователи (Мо, W, V, Nb, Тi) образуют с углеродом фазы внедрения. При этом чаще всего карбиды имеют формулу МеС, т.е. на один металлический атом приходится один атом углерода. При известных условиях W и Мо образуют карбиды, более богатые металлом (Ме2С, Mo2C, WC, VC, TiC, TaC, W2C) имеют простую кристаллическую решетку, отличаются очень высокой тугоплавкостью, практически нерастворимы в аустените.
При соотношении атомных радиусов углерода и металла более 0,59 образуются типичные химические соединения: Fe3C, Cr23C6, Cr7C3, Fe3W3C, которые имеют сложную кристаллическую решетку и при нагреве растворяются в аустените.
Все карбиды обладают высокой твердостью и температурой плавления.
4.6. Классификация и маркировка сталей
4.6.1. Классификация сталей
Стали классифицируются по множеству признаков.
По химическому составу:
Если содержание Fe меньше 45 %, то это сплав, если больше – сталь. Основа сплава – элемент самого высокого содержания.
По назначению:
1) конструкционные – применяются для изготовления деталей машин и механизмов;
2) инструментальные – применяются для изготовления различных инструментов;
3) с особыми свойствами: электротехнические, с особыми магнитными свойствами и др.
По структуре в равновесном состоянии:
По основной структуре после нагрева до 900 ºC с последующим охлаждением на воздухе: перлитные, бейнитные, мартенситные, ферритные, аустенитные.
Также могут быть смешанные классы: феррито-перлитный и т.д. (при наличии не менее 10 % перлита).
По качеству. Количественным показателем качества является содержания вредных примесей: серы и фосфора, % (не более):
обыкновенного качества………………….S≤0,05, P≤0,04
качественные стали……………………….S, P ≤0,035
высококачественные……………………. S, P ≤0,025
По способу выплавки:
1) в мартеновских печах;
2) в кислородных конверторах;
3) в электрических печах: электродуговых, индукционных и др.
4.6.2. Маркировка сталей
В России принято буквенно-цифровое обозначение сталей.
Углеродистые стали обыкновенного качества. Стали содержат повышенное количество серы и фосфора.
Маркируются Ст.2кп, БСт.3кп, ВСт.3пс, ВСт.4сп.
Ст – индекс данной группы стали. Цифры от 0 до 6 – это условный номер марки стали. С увеличением номера марки возрастает прочность и снижается пластичность стали. По гарантиям при поставке существует три группы сталей – А, Б и В. Для сталей группы А при поставке гарантируются механические свойства, в обозначении индекс группы А не указывается. Для сталей группы Б гарантируется химический состав. Для сталей группы В при поставке гарантируются и механические свойства, и химический состав.
Индексы кп, пс, сп указывают степень раскисленности стали: кп – кипящая; пс – полуспокойная; сп – спокойная.
Качественные углеродистые стали. Качественные стали поставляют с гарантированными механическими свойствами и химическим составом (группа В). Степень раскисленности в основном спокойная.
Конструкционные качественные углеродистые стали. Маркируются двухзначным числом, указывающим среднее содержание углерода в сотых долях процента. Указывается степень раскисленности, если она отличается от спокойной.
Сталь 08, сталь 10 пс, сталь 45.
Содержание углерода соответственно 0,08; 0,10; 0,45 %.
Инструментальные качественные углеродистые стали маркируются буквой У (углеродистая инструментальная сталь) и числом, указывающим содержание углерода в десятых долях процента.
Сталь У8, сталь У13.
Содержание углерода соответственно 0,8 и 1,3 %.
Инструментальные высококачественные углеродистые стали. Маркируются аналогично качественным инструментальным углеродистым сталям, только в конце марки ставят букву А, для обозначения высокого качества стали.
Легированные стали. Обозначение буквенно-цифровое. Легирующие элементы имеют условные обозначения. Обозначаются буквами русского алфавита.
Обозначения легирующих элементов:
А – азот ( указывается в
Легированные конструкционные стали. В начале марки указывается двухзначное число, показывающее содержание углерода в сотых долях процента. Далее перечисляются легирующие элементы. Число, следующее за условным обозначением элемента, показывает его содержание в процентах. Если число не стоит, то содержание элемента не превышает 1,5 %.
В указанной марке стали содержится около 0,30 % углерода, 2 % хрома, менее 1 % молибдена.
Для обозначения высококачественных легированных сталей в конце марки указывается символ А.
Легированные инструментальные стали. В начале марки указывается однозначное число, показывающее содержание углерода в десятых долях процента. При содержании углерода более 1 % число не указывается.
Далее перечисляются легирующие элементы с указанием их содержания.
Некоторые стали имеют нестандартные обозначения.
Сталь 9ХС, сталь ХВГ.
Быстрорежущие инструментальные стали. Р – индекс данной группы сталей (от rapid – скорость), далее число, указывающее содержание основного легирующего элемента – вольфрама. Содержание углерода более 1 %. Во всех быстрорежущих сталях содержится около 4 % хрома, поэтому он не указывается. Если стали содержат легирующие элементы, то их содержание указывается после обозначения соответствующего элемента.
В указанной стали содержание вольфрама – 5 %,молибдена – 3 %.
Шарикоподшипниковые стали. Ш – индекс данной группы сталей. Х – указывает на наличие в стали хрома. Последующее число показывает содержание хрома в десятых долях процента. Содержание углерода более 1 %.
Сталь ШХ6, сталь ШХ15ГС.
В указанных сталях, соответственно, 0,6 и 1,5 %хрома.
Буква А в конце марки обозначает высококачественную сталь (30ХГСА), в середине марки – азот, в конце марки – сталь автоматная (А35Г2).
Высоколегированные стали сложного состава иногда обозначают по порядковому номеру разработки и освоения на заводе (ЭИ, ЭП – «Электоросталь»).
1. Материаловедение / под ред. Б.Н. Арзамасова. М.: Изд-во. МГТУ им. Н.Э. Баумана, 2001. 648 с.
2. Гольдштейн М.И. Специальные стали / М.И. Гольдштейн, С.В. Грачев, Ю.Г. Векслер. М.: МИСиС, 1999. 408 с.
3. Гуляев А.П. Металловедение: учебник / А.П. Гуляев М.: Металлургия, 1986. 644 с.
Взаимодействие легирующих элементов с углеродом и азотом в стали. Карбиды и нитриды в стали
Добавленные в сталь легирующие элементы могут образовывать твердые растворы или химические соединения с железом и между собой. В большинстве случаев для сталей важную роль имеет взаимодействие ЛЭ с углеродом и азотом. Способность ЛЭ к образованию карбидов или нитридов в стали, где основу составляет железо, определяется их сродством к С и N. Если сродство ЛЭ к С и N больше, чем у железа, то будет образовываться карбид на основе ЛЭ, а не цементит.
Так как закономерности образования карбидов и нитридов в стали имеют одинаковый характер и углерод чаще применяется при легировании, чем азот, обычно рассматривают закономерности карбидообразования.
Все легирующие элементы можно разделить на две группы: карбидообразующие и не образующие карбидов в стали.
Карбиды и нитриды относятся к фазам внедрения, которые и образуются между d-переходными металлами и соответственно углеродом и азотом. Активность карбидообразующих элементов тем больше и устойчивость карбидных фаз тем выше, чем менее достроена d-электронная оболочка у данного металла. На рис. 77 приведен фрагмент таблицы Д. И. Менделеева, где расположены карбидо- и нитридообразующие элементы.
Co и Ni, представленные на рис. 77, не образуют карбиды и нитриды в стали, так как они имеют более совершенное электронное строение, чем железо.
В периодах сродство к углероду возрастает справа налево (Fe Ti), а в группах – сверху вниз (Cr W). Таким образом, самым активным из представленных в таблице элементов будет Hf. С увеличением содержания легирующего элемента в стали образуется карбид более высокого класса (с бóльшим содержанием ЛЭ). Например, для хрома: (Cr,Fe)3C Cr7C 3Cr23C6.
Рис. 77. Структуры d–переходных металлов, карбидов и нитридов, образуемых в стали
В некоторых карбидах легирующих элементов может растворяться железо. Так, например, в карбидах Cr3c и Мn3С железо растворяется неограниченно. Карбиды Cr7C3 и Mn23C6 образуют ограниченные твердые растворы с железом.
Прочность связи между атомами металла и неметалла в карбидах и нитридах характеризуются теплотой образования 298К, кДж/(г-атом) и свободной энергией образования фаз ( 298к, кДж/(г-атом), температурой их плавления и структурно-нечувствительными упругими свойствами. Наиболее высокие значения из указанных свойств имеют карбиды и нитриды элементов IV и V групп. По мере увеличения номера группы свойства изменяются в сторону уменьшения прочности связи атомов в карбиде и нитриде или, как говорят, прочности или стойкости карбидов и нитридов.
Следовательно, переходные металлы по их сродству к углероду и азоту, прочности и стойкости карбидов и нитридов, их устойчивости к распаду можно расположить в следующий убывающий ряд: Hf, Zr, Тi, Та, Nb, V, Мо, Сr, Мn, Fе.
Карбид Сr7С3 образуется чаще всего в конструкционных сталях с относительно невысоким содержанием хрома (до 3 – 4%). Этот карбид имеет сложную гексагональную решетку с 80 атомами на одну элементарную ячейку (56 атомов металла и 24 атома углерода).
В сталях этот карбид может содержать от 30 до 50 % Сr, т. е. его формула должна быть в пределах Fе4Сr3С3 и Fе2Сr5С3. Обычно такой карбид обозначают (Сr, Fе)7С3 или Me7C3.
Карбид Сr23С6 образуется в высоколегированных хромистых сталях при большом содержании хрома (выше 5 – 8 %). Он имеет сложную г. ц. к. решетку, элементарная ячейка которой содержит 116 атомов, в том числе металла 92 атома и углерода – 24. В сталях карбид Сr23С6 в чистом виде не встречается, часть атомов хрома в нем замещается карбидообразующими элементами, входящими в состав стали (Fе, Мо, W).
В зависимости от характера легирования атомы металла могут содержать два или несколько элементов. Так, в высокохромистых сталях содержание железа в карбиде может повышаться до 35 %, т. е. часть атомов хрома замещается железом, при этом формула карбида имеет, например, вид Fе8Сr15С6. При меньшем содержании хрома возможно образование карбида Fе12Сr11С6. В общем виде такой карбид в сталях принято обозначать формулой (Сr, Fе)23С6 или Me23C6. В сталях с молибденом формула карбида будет Fе20Мо2С6, а в сталях с несколькими легирующими элементами (Сr, Мо, W и др.) все они могут входить в состав карбида.
Железо широко замещает в этом карбиде хром, но так как размер атомов железа несколько меньше размера атомов хрома, то начиная с определенного момента (после замещения ~30% Сr) эти узлы становятся слишком “просторными”, и для устойчивости решетки необходимо присутствие крупных атомов W (или Мо). Атомы W (Мо) занимают также определенные позиции в решетке карбида Ме23С6, поэтому их максимальное число в элементарной ячейке составляет 8 из 92 атомов металла. Дальнейшее увеличение в стали концентрации вольфрама и молибдена в выделяющейся фазе сверх этого предела приводит к переходу Ме23С6 Þ Ме6С, как к следующему карбиду, который может вместить большее количество W и Mo.
Этот карбид образуется только при сложном легировании, поэтому он является комплексным карбидом. Его преимущество перед другими карбидами на основе Mo, W и других тугоплавких элементов заключается в том, что он имеет более низкую температуру диссоциации, что позволяет переводить Мо и W при нагреве при закалке в твердый раствор (аустенит).
Однако этот карбид метастабильный и при высокой температуре и длительных выдержках он превращается в стабильные карбиды типа МеС или Ме2С. По этой причине высоколегированные стали, содержащие в больших количествах Cr, W, Mo и V не подвергают смягчающему отжигу с нагревом и длительной выдержкой при температурах 1100. 1200 о С. При закалке из этой области температур длительность выдержки строго регламентирована.
Л 5.2. Влияние легирующих элементов на С–образные кривые.
Влияние легирующих элементов на критические точки и свойства стали
Легирующие элементы значительно влияют на температурное положение критических точек в сталях. В частности, они могут интенсивно смещать точку Ас1. Подобное влияние легирующих элементов связано с двумя факторами.
| Рис. 78. Влияние легирующих элементов на положение критической точки Ас1 (а) и содержание углерода в эвтектоиде (б) |
Как известно, критическая температура Ас1 в углеродистой стали отвечает превращению эвтектоидной смеси перлита +Fе3С в аустенит путем фазового перехода a®g, диссоциации карбида и растворению углерода в g-железе. С одной стороны, легирующие элементы изменяют температуру –прeвращения для феррита, входящего в состав эвтектоида (перлита), и, с другой стороны, влияют на температуру диссоциации эвтектоидных карбидов и последующее растворение углерода и легирующих элементов в g-железе. Как правило, карбидообразующие элементы повышают температуру диссоциации карбидов, и, если при этом они также повышают температуру -превращения, то влияние их на точку Ас1 сказывается особенно сильно (рис. 78).
Некарбидообразующие элементы, растворяясь в цементите, несколько понижают температуру диссоциации карбида. При этом никель и марганец понижают температуру -перехода и, следовательно, снижают точку Ас1. Своеобразно влияние хрома на точку Ас1. Он до 12–13 % сравнительно слабо повышает точку Ас1, а при содержании его более 14 % наблюдается резкое повышение температуры Ас1. Подобное влияние объясняется тем, что при содержании хрома до 12 – 13 % он понижает температуру -перехода, а наблюдаемое при этих содержаниях хрома повышение точки Ас1 обусловлено более сильным влиянием диссоциации эвтектоидных карбидов при этих температурах. Закономерности влияния элементов на критические точки в основном сохраняются и в сталях, содержащих одновременно несколько легирующих элементов.
Легирующие элементы значительно влияют и на положение эвтектоидной точки S (рис. 79), и на предельную концентрацию углерода в аустените (точку Е). Некарбидообразующие элементы (никель, кобальт, кремний), растворяясь в феррите и замещая часть атомов железа в его решетке, тем самым уменьшают содержание железа в эвтектоиде и смещают точку S в сторону меньших концентраций углерода. Аналогично влияют и карбидообразующие элементы, которые в большом количестве растворяются в феррите. Их карбиды участвуют в образовании эвтектоида (например, Мп и Сr). Такие элементы, как Мо и W, сначала уменьшают, а затем увеличивают содержание углерода в эвтектоиде.
Имеются сведения, что сильные карбидообразующие элементы Тi, Nb и V, незначительно растворяющиеся в феррите и образующие стойкие карбиды, которые не участвуют в образовании эвтектоида, уменьшают количество эвтектоида в стали и увеличивают содержание углерода в эвтектоиде, т. е. смещают точку S в сторону больших концентраций углерода. В то же время, если Тi, Nb и V растворены в аустените, то они снижают содержание углерода в эвтектоиде.
Большинство легирующих элементов понижает предел растворимости углерода в -железе и, следовательно, смещает точку Ена диаграмме Fе–Fе3С в сторону меньших концентраций углерода.
| Рис. 79. Изменение содержания углерода в эвтектоиде и эвтектике при легировании |
Легирующие элементы смещают не только критические точки равновесных систем, но и изменяют кинетику распада аустенита. Кинетика распада аустенита определяет поведение стали при термической обработке. Влияние же легирующих элементов на кинетику превращения аустенита очень велико.
Элементы, которые только растворяются в феррите или цементите, не образуя специальных карбидов, оказывают лишь количественное влияние на процессы превращения (изменяют длительность инкубационного периода). Они или ускоряют превращение (к таким элементам относится только кобальт), или замедляют его (большинство элементов, в том числе марганец, никель, медь и др.).
| Рис. 80. Диаграммы изотермического превращения аустенита: доэвтектоидной (а), эвтектоидной (б) и заэвтектоидной (с) углеродистой стали |
Карбидообразующие элементы вносят не только количественные, но и качественные изменения в кинетику изотермического превращения. Так, легирующие элементы, образующие растворимые в аустените карбиды, при разных температурах по-разному влияют на скорость распада аустенита: при 700 – 500 о С (образование перлита) – замедляют превращение, а при 500 – 400 о С – весьма значительно замедляют превращение; при 400 – 300 о С (образование бейнита) – ускоряет превращение при малых концентрациях и замедляют при больших.
Таким образом, в сталях, легированных карбидообразующими элементами (хром, молибден, вольфрам), наблюдаются два максимума скорости изотермического распада аустенита, разделенных областью высокой устойчивости переохлажденного аустенита. Изотермический распад аустенита имеет два явно выраженных интервала превращений – превращение в пластинчатые кристаллиты (перлитное превращение) и превращение в игольчатые кристаллиты (бейнитные превращения).
Диаграммы изотермического распада представлены на рис. 80 и 81. Видно, что увеличение содержания углерода понижает температуры начала и конца мартенситного превращения; форма кривых начала и конца перлитного превращения принципиально не изменяется.
При легировании карбидообразующими элементами диаграмма приобретает другой вид (рис. 81). Причины изменения формы диаграммы подробно изучаются в дисциплине “Теория термической обработки”. Следует обратить внимание на тот факт, что положение бейнитной области зависит от содержания углерода и ЛЭ-карбидообразователя.
В легированных сталях в зависимости от положения линий начала перлитного превращения и точки Мн можно получить стали перлитного, мартенситного, бейнитного или аустенитного классов. Увеличение инкубационного периода при легировании позволяет создавать стали с высокой прокаливаемостью.
| Рис. 81. Схемы диаграмм изотермического распада аустенита, легированного карбидообразующими элементами: а – малоуглеродистая сталь; б – высокоуглеродистая сталь |
Легирующие элементы не влияют на кинетику мартенситного превращения, которая, по-видимому, похожа во всех сталях. Их влияние сказывается исключительно на положении температурного интервала мартенситного превращения, а это в свою очередь отражается и на количестве остаточного аустенита, которое фиксируется в закаленной стали.
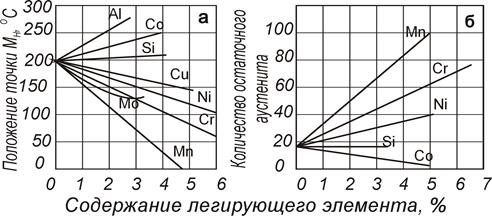 Рис. 82. Влияние ЛЭ на Мн и содержание остаточного аустенита в стали с 1 % углерода |
Некоторые элементы повышают мартенситную точку и уменьшают количество остаточного аустенита (алюминий, кобальт), другие не влияют на нее (кремний), но большинство снижает мартенситную точку и увеличивает количество остаточного аустенита (рис. 82). Из диаграммы видно, что 5% Мn снижает мартенситную точку до 0 о С, следовательно, при таком (или большем) содержании этого легирующего элемента можно зафиксировать аустенитное состояние посредством быстрого охлаждения..
Л 5.3. Влияние легирования на вязкость, прочность, Тх , размер зерна.
Читайте также:
