Катионы металлов из растворов их солей если
Обновлено: 16.05.2024
Металлы восстанавливают катионы металлов из растворов их солей если :

1)восстанавливать металлы из солей могут металлы, расположенные в электрохимическом ряду левее этого металла, т.
Е. медь не может вытеснить цинк, например.
2) для реакции нельзя брать щелочные и щелочно - земельные металлы (литий, натрий, калий, кальций, барий).
Реакция идет в водном растворе, а перечисленные металлы будут с водой в растворе реагировать
а больше и не знаю.
Извини, написал что знал.

Металлы восстанавливают кислород образуя по составу?
Металлы восстанавливают кислород образуя по составу.

Металлы восстанавливают :1) ?
(по составу) соединения ;
2) кислород, образуя по составу : .
, (примеры) ; по свойствам : .
3) катионы водорода из растворов кислот, если : - .
4) катионы металлов из растворов их солей, если : - .
5) водород из воды.
В общем виде уравнения для металлов групп IA и IIA (начиная с Ca) :
6) катионы металлов из их оксидов : .
(название процесса), например : .

В водном растворе электролита присутствуют катионы металлов Fe²⁺, Pt²⁺, Cu²⁺, K⁺?
В водном растворе электролита присутствуют катионы металлов Fe²⁺, Pt²⁺, Cu²⁺, K⁺.
Какой металл будет первым восстанавливаться на катоде при электролизе этого раствора (pH = 7) и составьте последовательность выделения металлов.
Соль + металл = новоя соль + металл?
Соль + металл = новоя соль + металл.
Почему в процессе электролиза растворов солей щелочных металлов на угольном катоде выделяется не металл, а водород?
Почему в процессе электролиза растворов солей щелочных металлов на угольном катоде выделяется не металл, а водород.

Укажите металл, восстанавливающий цинк из растворов солей : 1)Cu 2)Ca 3)Sn 4)Fe?
Укажите металл, восстанавливающий цинк из растворов солей : 1)Cu 2)Ca 3)Sn 4)Fe.
Пожалуйста, объясните фразу "щелочные металлы, взаимодействуя с пастворами солей, вытесняют водород из воды, но не восстанавливают ионы металлов"?
Пожалуйста, объясните фразу "щелочные металлы, взаимодействуя с пастворами солей, вытесняют водород из воды, но не восстанавливают ионы металлов".

Металл вытесняет другие металлы стоящие в ряду напряжений правее из растворов их солей?
Металл вытесняет другие металлы стоящие в ряду напряжений правее из растворов их солей.
Верно высказывание или нет?

Какой металл вытесняет никель , но не вытесняет цинк из растворов солей?
Какой металл вытесняет никель , но не вытесняет цинк из растворов солей.

Какие металлы могут вытеснить железо из раствора солей?
Какие металлы могут вытеснить железо из раствора солей.
Я про алюминийАлюминий – легкий, прочный и пластичный металл. Это один из самых востребованных металлов, и по темпам роста потребления он давно и с большим отрывом оставил позади сталь, никель, медь и цинк. Алюминий без преувеличений можно назвать ..
Тому що рН показує ступінь концентрації катіонів гідрогену у воді, що є дуже важливим для косметики.
1. дано N(NH3) = 4. 816 * 10 ^ 23 - - - - - - - - - - - - - - - - - - - - - - - - - - - - - V(NH3) - ? N(NH3) / N(A) = V(NH3) / Vm V(NH3) = N(NH3) * Vm / N(A) = 4. 816 * 10 ^ 23 * 22. 4 / 6. 02 * 10 ^ 23 = 15. 58 L ответ 15. 58 л 2) дано m(O2)..
Соотвественно правильным ответом будет являться : 4) KCl ; 5) AgCl ; 6) NH4Cl.

Дано W(O) = 47 % - - - - - - - - - - - - - - - - E - ? Е - это неизвестный элемент W(O) = Ar(O) * n / M(X2O3) * 100% 47% = 16 * 3 / 2x + 48 * 100% 94x + 2256 = 4800 X = 27 - это алюминий Al2O3 ответ алюминий.
Напиши нормально не понятно или сфоткай.
В SO3 32 / (32 + 3 * 16) = 0, 4 или 40 %.
Реакции есть на фотографии.
4HCl + MnO2 = MnCl2 + Cl2 + 2H2O соляная кислота отдаёт в свободном виде половину имеющегося хлора. M(Cl общ. ) = 1000 * 0, 365 * 0, 9726 = 355 г масса выделившегося хлора = 355 / 2 = 177, 5 г.

Типы химической реакции соединение, разложение замещение.
© 2000-2022. При полном или частичном использовании материалов ссылка обязательна. 16+
Сайт защищён технологией reCAPTCHA, к которой применяются Политика конфиденциальности и Условия использования от Google.
Катионы металлов из растворов их солей если

Тема 8. Металлы. Положение металлов в Периодической системе Д. И. Менделеева. Строение атомов и кристаллов. Физические свойства.
1. Положение металлов (М) в Периодической системе Д. И. Менделеева.
Условная диагональ от В к At через элементы А групп: IV → V → VI. На диагонали и над ней расположены неметаллы, а под ней – металлы.
Только из М состоят В группы. Всего из 110 элементов к металлам относят 88 элементов.
IA группа – это щелочные металлы.
IIA группа – это щелочноземельные металлы.
2. Особенности строения атомов М:
1) число е во внешнем слое атома 1-3;
2) R атома – большие размеры.
3. Относительность деления элементов на М и НМ (приведите примеры):
1) серое олово – НМ, белое олово – М.
2) графит – НМ, но электропроводный.
3) Cr, Zn, Al – М, но амфотерные.
4. Металлическая химическая связь – это связь в металлах и сплавах между атом-ионами посредством обобществлённых е.
Общая схема образования металлической связи:
5. Заполните таблицу «Строение и свойства металлов».

6. Запишите признаки, по которым можно различить пластины, изготовленные:
а) из алюминия и меди – цвет, плотность, электро- и теплопроводность
б) из свинца и алюминия – цвет, плотность, температура плавления
в) из серебра и графита – цвет, форма, электропроводность.
7. Используя рисунки, заполните пропуски, чтобы получилась последовательность: название металла (ов), свойства (о), область (и) применения.
а) чугунная батарея - чугун, теплопроводность, прочность, износостойкость. В хозяйстве, быту, металлургии.
б) алюминиевая фольга – алюминий, легко раскатывается, пластичность, высокая электро- и теплопроводность, коррозионная стойкость. В пищевой промышленности, производство сплавов.
в) стальные кнопки и скрепки – сталь, «мягкая» сталь, эластична, легко гнется, не ржавеет, прочная и твердая. Во всех отраслях народного хозяйства.
г) металлическая опора – железо (сталь), прочны, твердые, не подвергаются действию среды. Во всех отраслях народного хозяйства.
д) купола – золото, инертное, внешний вид. Используется в строительстве – прокатка, в ювелирном деле.
е) термометр – ртуть (жидкий металл), расширяется при нагревании, в медицинских термометрах. Получение сплавов, для добычи золота. Лампы.
8. Заполните таблицу «Классификация металлов».
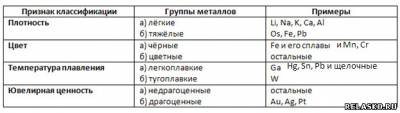
9. Сплав – это – это однородный металлический материал, состоящий из смеси двух или большего числа химических элементов с преобладанием металлических компонентов.
10. Чёрные сплавы:
1) чугун, содержание углерода >2%
2) сталь, содержание углерода
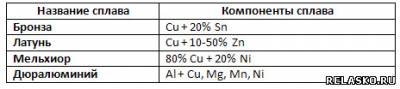
11. Заполните таблицу «Сплавы и их компоненты».
12. Подпишите названия сплавов, из которых могут быть сделаны изображённые на рисунках предметы.
а) сталь
б) мельхиор
в) дюралюминий
г) бронза
д) бронза
е) чугун
1. Атомы металлов, имеющие во внешнем слое:
а) 5е – Sb (сурьма), Bi (висмут)
б) 6е – Po (полоний)
Почему?
Они расположены в 5 и 6 группах соответственно
2. Атом металла, имеющий во внешнем слое 3е, - бор.
Почему?
Он расположен в 3 группе.
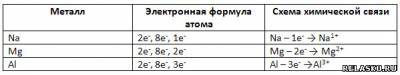
3. Заполните таблицу «Строение атома и химическая связь».
4. Исключите «лишний элемент».
4) Si
5. Какая из следующих групп элементов содержит только металлы?
Нет правильного ответа
6. Какое физическое свойство не является общим для всех металлов?
3) твёрдое агрегатное состояние при стандартных условиях
7. Какое утверждение верно?
4) атомы металлов и металлы – простые вещества проявляют только восстановительные свойства.
8. Все элементы главных подгрупп являются металлами, если они расположены в Периодической системе ниже диагонали:
3) бор – астат
9. Число электронов на внешнем электронном уровне атома металла, находящегося в главной подгруппе Периодической системы, не может быть равно:
4) 7
1. Атомы и простые вещества – металлы проявляют только восстановительные свойства. Общая схема этого утверждения:
2. М восстанавливают:
1) неметаллы, образуя бинарные соединения;
2) кислород, образуя:
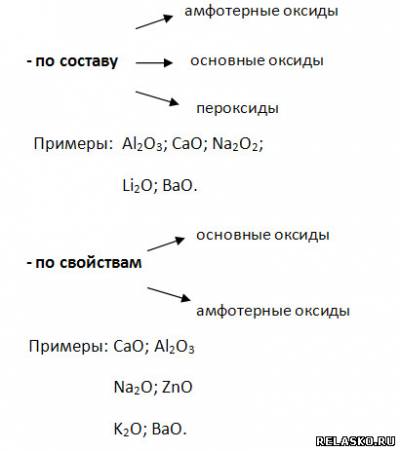
3) катионы водорода из растворов кислот, если:
1) металл находится в ряду напряжений до H2
2) если образуется растворимая соль
3) исключения: щелочные M, концентрированные HNO3 и H2SO4
4) катионы металлов из растворов их солей, если:
- металл соли находится правее самого металла;
- сам вытесняется из раствора соли более сильным металлом.
- если образуется растворимая соль; исключение: щелочные M.
5) водород из воды. В общем виде уравнения для металлов групп IA и IIA (начиная с Ca):
2M+2HOH →2MOH+H2 (для IA)
M+2HOH → M(OH)2+H2 (для IIA)
6) катионы металлов из их оксидов: металлотермия
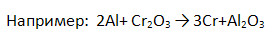
3. Заполните таблицу «Химические свойства металлов», записав уравнения возможных реакций.
4. Подчеркните вещества, с которыми взаимодействует железо:
Хлор, сера, серная кислота (разб.), раствор сульфата меди (II).

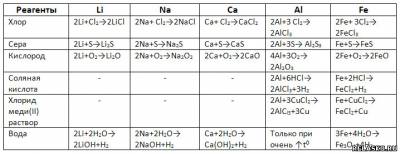
1. Подчеркните вещества, с которыми взаимодействует алюминий:
Углерод, оксид железа (III), серная кислота (разб.).

2. Из перечисленных металлов наиболее активно взаимодействует с водой:
3) калий
3. Образование основного оксида происходит при горении в кислороде:
2) кальция
4. При обычных условиях с водой не взаимодействует:
4) железо
5. Восстановить водород при взаимодействии с раствором серной кислоты способен каждый металл ряда:
3) Fe, Mn, Cr
6. Металлы «Б» и «В» можно получить, вытесняя из водных растворов их солей металлом «А», в группе:
4) «А» - Mg «Б» - Pb «В» - Mn
7. Сокращённым ионным уравнением
описывается взаимодействие с магнием:
2) соляной кислоты
8. Напишите синквейн о металлах.
1) Металлы
2) Блестящие и серебристые
3) Электро-, теплопроводны, пластичны
4) Используются в промышленности
5) Сплавы
1. Металлы в природе встречаются:
1) только в самородном виде Pt, Ag, Au
2) и в свободном, и в виде соединений Cu, Hg
3) только в виде соединений: большинство, а также активные М (минералы Zn, Pb, Na, Li и др.)
Обобщение этих утверждений оформите с помощью ряда активности металлов, используя фигурные скобки:

2. Минералы – это различные природные соединения, включающие в себя М в связанном состоянии.
Заполните таблицу «Названия и формулы минералов металлов».

3. Руды – это природные образования, содержащие минералы, в которых М находятся в количествах, пригодных для получения их самих.
4. Металлургия – это наука о методах и процессах производства металлов из руд и других металлосодержащих продуктов.
5. Заполните таблицу «Классификация общих способов получения металлов».

1. Отделение пустой породы от руды – это обогащение.
2. Заполните таблицу «Восстановители в пирометаллургии».
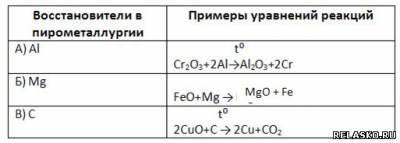
3. Дополните схему:

Это пример электрометаллургии.
4. Сырьём для получения алюминия являются:
а) алюмосиликаты
б) боксит, корунд
в) оксид алюминия.
5. Нарисуйте и опишите схему электролитического получения алюминия.
Процесс получения алюминия электролизом проводят в электролитических ваннах в присутствии расплавленного криолита; из оксида алюминия;

6. Напишите синквейн о металлургии.
1) Металлы
2) Способ получения
3) Пиро-, электро-, гидрометаллургия
4) Основа промышленности
5) Получение.
7. Нарисуйте и опишите схему доменного процесса.
Сущность доменного процесса состоит в восстановлении железа из оксидов и получении науглероженного металла (чугуна) и шлака, которые легко отделяются друг от друга из-за различия в плотностях.
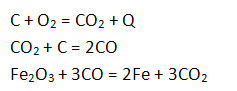
Полученное в результате реакции железо каплями стекает по раскаленному коксу вниз, насыщаясь углеродом, в результате чего получается сплав, содержащий 2,14 – 6,67 % углерода (чугун). Кроме углерода в него входят небольшая доля кремния и марганца. В количестве десятых долей процента в состав чугуна входят также вредные примеси — сера и фосфор. Кроме чугуна в горне образуется и накапливается шлак, в котором собираются все вредные примеси.
1. Коррозия – это самопроизвольное разрушение металлов и сплавов под действием окружающей среды.
3.Условия протекания электрохимической коррозии:
1) Влага
2) Кислород атмосферный
4. Вред, который наносит коррозия:
а) страдает экология;
б) теряется 25% всего произведенного железа;
в) портятся металлические изделия;
г) страдает здоровье людей.
5. Заполните таблицу «Защита металлов от коррозии».
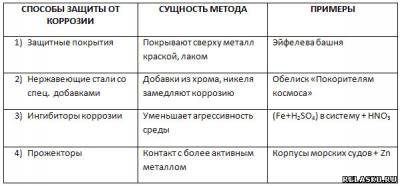
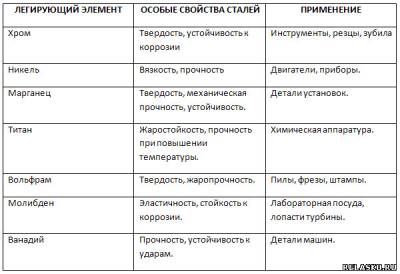
1. Запишите уравнение реакций, протекающих на воздухе с литием, лишённым вазелиновой защиты.

2. «По крыше выложили жесть» (В. В. Маяковский). Опишите процессы, происходящие с белой жестью при нарушении оловянной защиты.
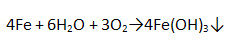
3. Заполните таблицу «Свойства некоторых легированных сталей и их примесей».
4. Опишите, какие способы защиты металлов от коррозии используются у вас в ванной комнате и на кухне.
Эмаль, лаки, краски.
5. Напишите синквейн о коррозии металлов.
а) Коррозия
б) Вредный, портящий
в) Разрушает, мешает, портит
г) Вредный процесс, разлагает
д) Металлы
6. Перечислите наиболее часто используемые способы защиты от коррозии изделий, изображенных на рисунках.
а) Покрытие сплавом мельхиора.
б) Эмаль
в) Легирование стали ванадием.
г) Легирование хромом
д) Лужение оловом
е) Легирование титаном
7. Приведите примеры электрохимических процессов (электрохимической коррозии), приносящих людям пользу.
1) Гальванотехника – нанесение покрытия в виде металлов и сплавов.
2) Электрофорез, электродиализ, электроосмос.
1. Заполните таблицу «Изменение свойств щелочных металлов».

2. Схема химической связи: М-1е=М+1
связь металлическая.
3. Общие химические свойства.
Дополните уравнения реакций щелочных металлов с различными соединениями, записав окислительно-восстановительный баланс к ним.

4. Получение – электролиз расплавов хлоридов или гидроксидов.

1. Дополните цепочку переходов. Запишите уравнения реакцией, с помощью которых можно осуществить превращения по схеме. Рассмотрите их с позиций окисления-восстановления, а последний переход представьте в свете ТЭД.
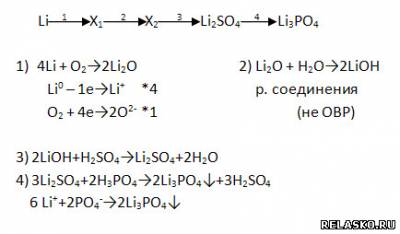
2. Дополните цепочку переходов. Запишите уравнения реакций, с помощью которых можно осуществить превращения по схеме. Рассмотрите переходы как ОВР, а два последних перехода представьте в свете ТЭД.
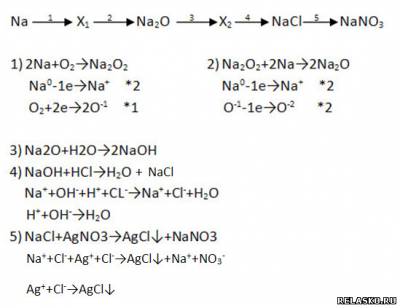
3. Сравните способы защиты от коррозии Li и Na.
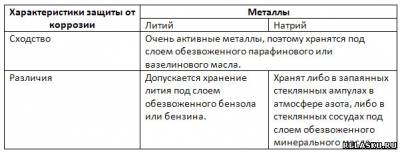
4. Рассчитайте массу натрия и объём хлора, полученных в результате электролиза 585 кг хлорида натрия, содержащего 12% примесей.

5. Какой объём займёт водород, выделившейся при растворении в 0,5 л воды 69 г натрия? Какова массовая доля щёлочи в полученном растворе?

Литий был открыт в 1817 году шведским химиком и минералогом Иоганном Арфведсоном сначала в минерале петалите. Металлический литий впервые получил Гемфри Дэви в 1825 году.
Свое название литий получил из-за того, что был обнаружен в «камнях» (от греч. литий – камень). Основные минералы лития — слюда лепидолит.
Литий — серебристо-белый металл, мягкий и пластичный, тверже натрия, но мягче свинца. Из всех щелочных металлов литий характеризуется самыми высокими температурами плавления и кипения, у него самая низкая плотность при комнатной температуре среди всех металлов.
Литий является наименее активным щелочным металлом, с сухим воздухом при комнатной температуре практически не реагирует. По этой причине литий является единственным щелочным металлом, который не хранят в керосине, он может непродолжительное время храниться на воздухе. Литий и его соли окрашивают пламя в карминово-красный цвет.
• Термоэлектрические материалы
• Химические источники тока
• Ракетное топливо
• Лазерные материалы
• Сплавы – в авиации и космонавтике
• Оптический материал в радиоэлектронике, аккумуляторы
• Металлургия – восстановления методами металлотермии редких металлов
• Ядерная энергетика
• В медицине
• В качестве смазочных материалов
• Прочие области применения: соединения лития используются в текстильной промышленности (отбеливание тканей), пищевой (консервирование) и фармацевтической (изготовление косметики).
Электролиз расплавов и растворов

Электролиз расплавов и растворов встречается в заданиях на ЕГЭ, а значит, если вы планируете сдавать экзамен по химии, эту тему нужно знать на отлично. Наша статья поможет узнать или повторить, что такое электролиз, его правила и схема протекания.
О чем эта статья:
11 класс, ЕГЭ/ОГЭ
Электролиз — это окислительно-восстановительная реакция, которая протекает на электродах и основана на пропускании электрического тока через раствор или расплав.
Не менее важными участниками электролиза являются электроды: катод и анод. Если вы вдруг забыли, что такое катод и анод в химии, напомним.
Катод — это отрицательно заряженный электрод, который притягивает положительно заряженные ионы (катионы). А анод — это положительно заряженный электрод, который притягивает к себе отрицательно заряженные ионы (анионы). Таким образом, на катоде всегда происходит процесс восстановления, а на аноде всегда происходит процесс окисления.
Электроды бывают растворимые и инертные. Растворимые изготавливаются из металлов, например, меди и подвергаются химическим превращениям в ходе электролиза. А вот инертные или нерастворимые электроды не подвергаются химическим превращениям и остаются в неизменном виде как до реакции, так и после нее. Как правило, такие электроды изготавливают из графита или платины.
Виды электролиза
Различают два вида электролиза:
Электролиз водного раствора.
Прежде чем мы рассмотрим каждый процесс отдельно, давай познакомимся с общими для двух видов процессами на электродах.
Процесс на катоде K (−)
Катион принимает электроны и восстанавливается:
Me +n + ne − → Me 0 (восстановление).
Процесс на аноде A (+)
Анион отдает электроны и окисляется:
неMe −n − ne − → неMe 0 (окисление).
Процессы, протекающие при электролизе в общем случае:
К − : Ме +n + ne − → Ме 0 ;
А + : неМе −n − ne − → неМе 0 .
Суммарное уравнение электролиза:

Электролиз расплава
Рассмотрим электролиз расплава пищевой соли — хлорида натрия. При сильном нагревании кристаллический твердый хлорид натрия плавится. Полученный расплав содержит подвижные ионы хлора и натрия, освободившиеся из кристаллической решетки, и проводит электрический ток.
К − : 2Na + + 2e − = 2Na 0
А + : 2Cl − − 2e − = Cl2
При опускании в расплав угольных (инертных) электродов, присоединенных к источнику тока, ионы приобретают направленное движение: катионы движутся к отрицательно заряженному электроду (катоду), анионы — к положительно заряженному электроду (аноду) и отдают электроны.
Теперь давайте рассмотрим электролиз расплава гидроксида калия.
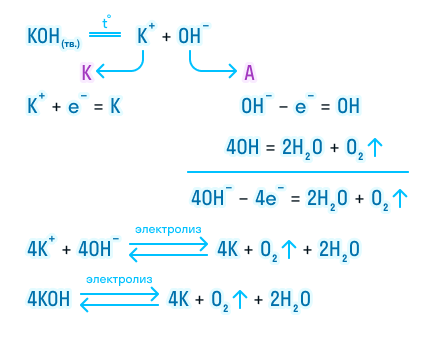
На катоде происходит восстановление калия за счет принятия электронов. А на аноде протекает более сложная реакция. Гидроксогруппы отдают свой электрон и становятся нейтральными, но такое состояние для них крайне невыгодно, так как неустойчиво, и они объединяются в группы, чтобы потом разложиться с выделением газообразного кислорода и воды
Итог электролиза расплава — металлический калий на катоде, газообразный кислород и пары воды на аноде.
Электролиз раствора
Основным отличием водного раствора от расплава является присутствие молекул воды и ионов H + и OH - как продуктов диссоциации воды. В связи с этим возле катода и анода скапливаются ионы, которые конкурируют как друг с другом, так и с молекулами воды. Рассмотрим электролиз на примере водного раствора KF:
К − : 4H2O + 4e − = 2H2 0 + 4OH −
Как видно, ни калий, ни фтор не фигурируют в продуктах электролиза. Почему так происходит?
Наиболее активные металлы — сильные восстановители. Калий — как раз такой металл, поэтому обратный процесс восстановления активных металлов из соединений осуществить сложно. При электролизе водных растворов солей активных металлов на катоде протекает восстановление не катионов этих металлов, а воды с образованием водорода.
Разберем порядок восстановления катионов металлов на катоде в зависимости от их активности.
Последовательность разрядки катионов зависит от положения металла в электрохимическом ряду напряжения.

Если у катода накапливаются молекулы воды и катионы металла, который находится в ряду напряжения после водорода, то восстанавливаются ионы металла.
Если у катода накапливаются молекулы воды и катионы металла, который стоит в начале ряда напряжения от лития до алюминия включительно, то восстанавливаются ионы водорода из молекул воды. Катионы металла не восстанавливаются, остаются в растворе.
Если у катода накапливаются молекулы воды и катионы металла, который расположен в ряду напряжения между алюминием и водородом, то восстанавливаются и ионы металла, и частично ионы водорода из молекул воды.
Если в растворе находится смесь катионов разных металлов, то сначала восстанавливаются катионы менее активного металла.
При электролизе раствора кислоты на катоде восстанавливаются катионы водорода до газообразного водорода.
Для удобства мы собрали информацию об электролизе в таблице:

Теперь разберемся, что происходит с анионами в водных растворах при электролизе. Для начала познакомимся с последовательностью восстановления анионов на аноде:

Чем меньше выражена восстановительная активность, тем хуже анионы могут окисляться на аноде. К тому же процесс на аноде зависит от материала анода и от природы аниона.
Если анод инертный или нерастворимый, то на нем протекают следующие реакции:
При электролизе растворов солей бескислородных кислот (кроме фторидов!), на аноде происходит процесс окисления аниона.
При электролизе растворов солей кислородсодержащих кислот и фторидов на аноде выделяется газообразный кислород вследствие окисления молекул воды. Анион при этом не окисляется, оставаясь в растворе.
При электролизе растворов щелочей происходит окисление гидроксид-ионов.
Если анод растворимый, то на нем всегда происходит окисление металла анода — независимо от природы аниона.

Исключением является электролиз солей карбоновых кислот. Таблица выше не описывает происходящее на аноде. Давайте рассмотрим, что же там происходит.
В результате электролиза водных растворов солей щелочных металлов карбоновых кислот происходит образование углеводородов вследствие рекомбинации углеводородных радикалов.
В общем виде электролиз солей карбоновых кислот можно записать так:
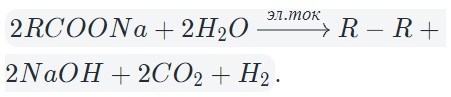
На катоде образуется газообразный водород, а на аноде — углекислый газ, углеводород, полученный удвоением радикала. В катодном пространстве накапливается щелочь.
В случае разделения катодного и анодного пространства углекислый газ реагирует со щелочью с образованием гидрокарбоната.
Применение электролиза
А теперь самое главное: зачем вообще нужен электролиз? Рассмотрим применение этого вида ОВР:
С помощью электролиза расплавов природных соединений в металлургической промышленности получают активные металлы (калий, натрий, бериллий, кальций, барий). С помощью электролиза растворов солей — цинк, кадмий, кобальт и другие.
В химической промышленности электролиз используют для получения фтора, хлора, водорода, кислорода, щелочей, бертолетовой соли и других веществ.
Электролиз с растворимым анодом используют для нанесения металлических покрытий (из хрома, золота, никеля, серебра), что предохраняет металлические изделия от коррозии и придает им декоративный вид.
Вопросы для самопроверки
1. Выберите верное продолжение фразы «катод — это. »:
Положительно заряженный электрод, к которому притягиваются положительно заряженные ионы.
Положительно заряженный электрод, к которому притягиваются отрицательно заряженные ионы.
Отрицательно заряженный электрод, к которому притягиваются положительно заряженные ионы.
Отрицательно заряженный электрод, к которому притягиваются отрицательно заряженные ионы.
2. Продолжите фразу «электролиз — это…»:
ОВР с применением тока.
Реакция без изменения степеней окисления с применением тока.
ОВР с применением катализаторов.
3. Как заряжен анион?
Не имеет заряда.
4. Чем отличается электролиз раствора от электролиза расплава?
В расплаве плавится твердое.
Присутствием молекул воды и продуктов ее диссоциации.
5. Если металл стоит в ряду активности металлов между алюминием и водородом, что выделится на катоде?
Химические свойства солей

Впервые школьники знакомятся с химическими свойствами солей в 8 классе, и для понимания дальнейшего материала без этой темы никуда. Наша статья поможет освежить знания перед контрольной или экзаменом: вспомним, какие бывают соли и как они образуются, рассмотрим типичные реакции с ними.
Соли — это сложные вещества, в состав которых входят катионы металла и анионы кислотного остатка. Иногда в состав солей входят водород или гидроксид-ион.
Классификация и номенклатура солей
Так как соли — это продукт полного или частичного замещения металлом атома водорода в кислоте, по составу их можно классифицировать следующим образом.
Кислые соли
Образованы неполным замещением атомов водорода на металл в кислоте.
В наименованиях кислых солей указывают количество водорода приставками «гидро-» или «дигидро-», название кислотного остатка и название металла. Если металл имеет переменную валентность, то в скобках указывают валентность.
Примеры кислых солей и их наименования:
LiHCO3 — гидрокарбонат лития,
NaHSO4 — гидросульфат натрия,
NaH2PO4 — дигидрофосфат натрия.
Средние соли
Образованы полным замещением атомов водорода в кислоте на металл.
Наименования средних солей складываются из названий кислотного остатка и металла. При необходимости указывают валентность.
Примеры средних солей с названиями:
CuSO4 — сульфат меди (II),
CaCl2 — хлорид кальция.
Основные соли
Продукт неполного замещения гидроксогрупп на кислотный остаток.
В наименованиях основных солей указывают количество гидроксид-ионов приставкой «гидроксо-» или «дигидроксо-», название кислотного остатка и название металла с указанием валентности.
Пример: Mg(OH)Cl — гидроксохлорид магния.
Двойные соли
В состав входят два разных металла и один кислотный остаток.
Наименование складывается из названия аниона кислотного остатка и названий металлов с указанием валентности (если металл имеет переменную валентность).
Примеры двойных солей и их наименования:
KNaSO4 — сульфат калия-натрия,
Смешанные соли
Содержат один металл и два разных кислотных остатка.
Наименования смешанных солей складываются из названия кислотных остатков (по усложнению) и названия металла с указанием валентности (при необходимости).
Примеры смешанных солей с наименованиями:
CaClOCl — хлорид-гиполхорит кальция,
PbFCl — фторид-хлорид свинца (II).
Комплексные соли
Образованы комплексным катионом или анионом, связанным с несколькими лигандами.
Называют комплексные соли по схеме: координационное число + лиганд с окончанием «-о» + комплексообразователь с окончанием «-ат» и указанием валентности + внешняя сфера, простой ион в родительном падеже.
Пример: K[Al(OH)4] — тетрагидроксоалюминат калия.
Гидратные соли
В состав входит молекула кристаллизационной воды.
Число молекул воды указывают численной приставкой к слову «гидрат» и добавляют название соли.
Пример: СuSO4∙5H2O — пентагидрат сульфата меди (II).
Получение солей
Получение средних солей
Средние соли можно образовать в ходе следующих реакций:
Так получают только соли бескислородных кислот.
Металл, стоящий левее H2 в ряду активности, с раствором кислоты:
Mg + 2HCl = MgCl2 + H2
Металл с раствором соли менее активного металла:
Основный оксид + кислотный оксид:
Основный оксид и кислота:
Основание с кислотным оксидом:
Основание с кислотой (реакция нейтрализации):
Взаимодействие соли с кислотой:
Взаимодействие возможно, если одним из продуктов реакции будет нерастворимая соль, вода или газ.
Реакция раствора основания с раствором соли:
Взаимодействие растворов двух солей с образованием новых солей:
Получение кислых солей
Кислые соли образуются при взаимодействии:
Кислот с металлами:
Кислот с оксидами металлов:
Гидроксидов металлов с кислотами:
Кислот с солями:
Аммиака с кислотами:
Получение кислых солей возможно, если кислота в избытке.
Также кислые соли образуются в ходе реакции основания с избытком кислотного оксида:
Получение основных солей
Взаимодействие кислоты с избытком основания:
Добавление (по каплям) небольших количеств щелочей к растворам средних солей металлов:
Взаимодействие солей слабых кислот со средними солями:
Получение комплексных солей
Реакции солей с лигандами:
Получение двойных солей
Двойные соли получают совместной кристаллизацией двух солей:
Химические свойства средних солей
Растворимые соли являются электролитами, следовательно, могут распадаться на ионы. Средние соли диссоциируют сразу:
Нитраты разлагаются в зависимости от активности металла соли:
| Металл | Левее Mg, кроме Li | От Mg до Cu | Правее Cu |
| Продукты | MeNO3 + O2 | MexOy + NO2 + O2 | Me + NO2 + O2 |
| Пример | 2NaNO3 = 2NaNO2 + O2 | 2Cu(NO3)2 = 2CuO + 4NO2 + O2 | 2AgNO3= 2Ag + 2NO2 + O2 |
Соли аммония разлагаются с выделением азота или оксида азота (I), если в составе анион, проявляет окислительные свойства. В остальных случаях разложение солей аммония сопровождается выделением аммиака:
Взаимодействие солей с металлами:
Более активные металлы вытесняют менее активные металлы из растворов солей.
Некоторые соли подвержены гидролизу:
Обменные реакции соли и кислоты, соли с основаниями и взаимодействие солей с солями:
Окислительно-восстановительные реакции, обусловленные свойствами катиона или аниона:
Химические свойства кислых солей
Диссоциация. Кислые соли диссоциируют ступенчато:
Термическое разложение с образованием средней соли:
Взаимодействие солей со щелочью. В результате образуется средняя соль:
Химические свойства основных солей
Реакции солей с кислотами — образование средней соли:
Диссоциация — так же как и кислые соли, основные соли диссоциируют ступенчато.
Химические свойства комплексных солей
Избыток сильной кислоты приводит к разрушению комплекса и образованию двух средних солей и воды:
Недостаток сильной кислоты приводит к образованию средней соли активного металла, амфотерного гидроксида и воды:
Взаимодействие слабой кислоты с солью образует кислую соль активного металла, амфотерный гидроксид и воду:
При действии углекислого или сернистого газа получаются кислая соль активного металла и амфотерный гидроксид:
Реакция солей, образованных сильными кислотами с катионами Fe3+, Al3+ и Cr3+, приводит к взаимному усилению гидролиза. Продукты реакции — два амфотерных гидроксида и соль активного металла:
Разлагаются при нагревании:
Вопросы для самопроверки
С чем взаимодействуют средние соли?
Назовите типичные реакции солей.
Из предложенного списка солей выберите те, которые не реагируют с цинком: нитрит калия, бромид железа, карбонат цезия, сульфат меди.
Химические свойства металлов

Свойства металлов начинают изучать на уроках химии в 8–9 классе. В этом материале мы подробно разберем химические свойства этой группы элементов, а в конце статьи вы найдете удобную таблицу-шпаргалку для запоминания.
8 класс, 9 класс, ЕГЭ/ОГЭ
Металлы — это химические элементы, атомы которых способны отдавать электроны с внешнего энергетического уровня, превращаясь в положительные ионы (катионы) и проявляя восстановительные свойства.
В окислительно-восстановительных реакциях металлы способны только отдавать электроны, являясь сильными восстановителями. В роли окислителей выступают простые вещества — неметаллы (кислород, фосфор) и сложные вещества (кислоты, соли и т. д.).
Металлы в природе встречаются в виде простых веществ и соединений. Активность металла в химических реакциях определяют, используя электрохимический ряд, который предложил русский ученый Н. Н. Бекетов. По химической активности выделяют три группы металлов.
Ряд активности металлов
Металлы средней активности
Общие химические свойства металлов
Взаимодействие с неметаллами
Щелочные металлы сравнительно легко реагируют с кислородом, но каждый металл проявляет свою индивидуальность:
оксид образует только литий
натрий образует пероксид
калий, рубидий и цезий — надпероксид
Остальные металлы с кислородом образуют оксиды:
2Zn + O2 = 2ZnO (при нагревании)
Металлы, которые в ряду активности расположены левее водорода, при контакте с кислородом воздуха образуют ржавчину. Например, так делает железо:
С галогенами металлы образуют галогениды:
Медный порошок реагирует с хлором и бромом (в эфире):
При взаимодействии с водородом образуются гидриды:
Взаимодействие с серой приводит к образованию сульфидов (реакции протекают при нагревании):
Реакции с фосфором протекают до образования фосфидов (при нагревании):
Основной продукт взаимодействия металла с углеродом — карбид (реакции протекают при нагревании).
Из щелочноземельных металлов с углеродом карбиды образуют литий и натрий:
Калий, рубидий и цезий карбиды не образуют, могут образовывать соединения включения с графитом:
С азотом из металлов IA группы легко реагирует только литий. Реакция протекает при комнатной температуре с образованием нитрида лития:
Взаимодействие с водой
Все металлы I A и IIA группы реагируют с водой, в результате образуются растворимые основания и выделяется H2. Литий реагирует спокойно, держась на поверхности воды, натрий часто воспламеняется, а калий, рубидий и цезий реагируют со взрывом:
Металлы средней активности реагируют с водой только при условии, что металл нагрет до высоких температур. Результат данной реакции — образование оксида.
Неактивные металлы с водой не взаимодействуют.
Взаимодействие с кислотами
Если металл расположен в ряду активности левее водорода, то происходит вытеснение водорода из разбавленных кислот. Данное правило работает в том случае, если в реакции с кислотой образуется растворимая соль.
2Na + 2HCl = 2NaCl + H2
При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.


Металлы IА группы:
Металлы IIА группы
Такие металлы, как железо, хром, никель, кобальт на холоде не взаимодействуют с серной кислотой, но при нагревании реакция возможна.
Взаимодействие с солями
Металлы способны вытеснять из растворов солей другие металлы, стоящие в ряду напряжений правее, и могут быть вытеснены металлами, расположенными левее:
Zn + CuSO4 = ZnSO4 + Cu
На металлы IА и IIА группы это правило не распространяется, так как они реагируют с водой.
Реакция между металлом и солью менее активного металла возможна в том случае, если соли — как вступающие в реакцию, так и образующиеся в результате — растворимы в воде.
Взаимодействие с аммиаком
Щелочные металлы реагируют с аммиаком с образованием амида натрия:
Взаимодействие с органическими веществами
Металлы IА группы реагируют со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
Также они могут вступать в реакции с галогеналканами, галогенпроизводными аренов и другими органическими веществами.
Взаимодействие металлов с оксидами
Для металлов при высокой температуре характерно восстановление неметаллов или менее активных металлов из их оксидов.
3Са + Cr2O3 = 3СаО + 2Cr (кальциетермия)
Вопросы для самоконтроля
С чем реагируют неактивные металлы?
С чем связаны восстановительные свойства металлов?
Верно ли утверждение, что щелочные и щелочноземельные металлы легко реагируют с водой, образуя щелочи?
Методом электронного баланса расставьте коэффициенты в уравнении реакции по схеме:
Mg + HNO3 → Mg(NO3)2 + NH4NO3 + Н2O
Как металлы реагируют с кислотами?
Подведем итоги
От активности металлов зависит их химические свойства. Простые вещества — металлы в окислительно-восстановительных реакциях являются восстановителями. По положению металла в электрохимическом ряду можно судить о том, насколько активно он способен вступать в химические реакции (т. е. насколько сильно у металла проявляются восстановительные свойства).
Напоследок поделимся таблицей, которая поможет запомнить, с чем реагируют металлы, и подготовиться к контрольной работе по химии.
Таблица «Химические свойства металлов»
Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb
Cu, Hg, Ag, Pt, Au
Восстановительная способность металлов в свободном состоянии
Возрастает справа налево
Взаимодействие металлов с кислородом
Быстро окисляются при обычной температуре
Медленно окисляются при обычной температуре или при нагревании
Взаимодействие с водой
Выделяется водород и образуется гидроксид
При нагревании выделяется водород и образуются оксиды
Водород из воды не вытесняют
Взаимодействие с кислотами
Вытесняют водород из разбавленных кислот (кроме HNO3)
Не вытесняют водород из разбавленных кислот
Реагируют с концентрированными азотной и серной кислотами
С кислотами не реагируют, растворяются в царской водке
Взаимодействие с солями
Не могут вытеснять металлы из солей
Более активные металлы (кроме щелочных и щелочноземельных) вытесняют менее активные из их солей
Взаимодействие с оксидами
Для металлов (при высокой температуре) характерно восстановление неметаллов или менее активных металлов из их оксидов
Читайте также:
