Катионы металлов проявляют только окислительные свойства
Обновлено: 04.10.2024
Для протекания химической ОВР необходимо присутствие атомов, молекул или ионов, взаимно противоположных по способности отдавать или присоединять электроны.
Окислительно-восстановительные свойства элементов зависят от их положения в периодической системе элементов Д. И. Менделеева и от их степени окисления в составе веществ.
В периодах системы Д. И. Менделеева с повышением порядкового номера элемента восстановительные свойства простых веществ понижаются, а окислительные возрастают и становятся максимальными у галогенов. Так, в 3-м периоде натрий – самый активный восстановитель , а хлор- самый активный окислитель. Объясняется это строением атомов элементов (раздел 2.13).
В группах периодической системы Д. И. Менделеева с повышением порядкового номера элемента, т. е. сверху вниз, возрастают восстановительные свойства простых веществ, а окислительные - убывают. Так, в главной подгруппе VI группы кислород – окислитель, сера проявляет слабые окислительные свойства, а теллур в некоторых реакциях уже является восстановителем. Это объясняется возрастанием сверху вниз числа энергетических уровней атомов, их радиус становится больше и, следовательно, внешние электроны слабее удерживаются.
Атомы металлов присоединять электроны не могут, они обладают только восстановительными свойствами, поэтому металлы часто называют элементами - восстановителями. Атомы металлических элементов содержат на внешнем уровне главным образом по 1-2 электрона. Таковыми являются элементы главных подгрупп 1-2 группы, элементы побочных подгрупп, лантаноиды и актиноиды.
Для неметаллов более характерно присоединение электронов, поэтому часто неметаллы называют элементами – окислителями. Атомы неметаллических элементов содержат на внешнем уровне 4-7 электронов, как правило. Наиболее активно присоединяют электроны атомы фтора, который имеет саму высокую электроотрицательность, является самым сильным окислителем и в реакциях не отдаёт электронов. За ним по величине электроотрицательности и, следовательно, по окислительной способности идёт кислород, атомы которого могут отдавать электроны только атомам фтора. Другие неметаллы могут не только принимать, но и отдавать электроны, а значит, проявляют не только окислительные, но и восстановительные свойства. Последние, однако, у них выражены много слабее, чем окислительные. Все зависит от того, с каким веществом вступает в реакцию данный неметалл. Если это восстановитель, то атом неметалла проявляет окислительные свойства. Например, сера является окислителем в реакции взаимодействия с железом; при взаимодействии с кислородом, наоборот, сера проявляет свойства восстановителя:
Наиболее ярко восстановительные и окислительные свойства выражены у атомов элементов «крайних» групп периодической системы – щелочных металлов и галогенов. Лучшие восстановители – щелочные металлы и наиболее активный из них - франций. Лучшие окислители – галогены и наиболее активный из них фтор. По мере приближения к середине периодической системы, к 4 группе, как восстановительные, так и окислительные свойства атомов становятся менее ярко выраженными.
Элементы в составе соединений, находящиеся в высшей степени окисления, могут в ОВР выступать только в качестве окислителей, степень окисления элемента может в этом случае только понижаться. Соответственно молекулы, ионы, содержащие атомы элементов (металлов и неметаллов) в высшей степени окисления, также являются окислителями.
Например, MnO4 - , Cr2O7 2- , NO3 - , CO2 и др. Элементарные ионы металлов (Na + , Ca 2+ , Fe 3+ , Сu 2+ , и т.д.) в высшей степени окисления могут обладать только окислительными свойствами, которые тем сильнее выражены, чем меньше активность металла. Катионы щелочных и щелочно-земельных металлов почти не проявляют окислительных свойств. Напротив, ионы малоактивных металлов в высшей степени окисления (Ag + , Au 3+ , и т.д.) – окислители.
Элементы в составе соединений, находящиеся в низшей степени окисления, могут быть, наоборот, только восстановителями; здесь степень окисления может только повышаться. Элементарные анионы проявляют только восстановительные свойства. Например, СI, Br, I, S 2- , теряя в процессе реакции электроны, окисляются, соответственно, в свободный хлор, бром, йод, серу. Чем активнее неметаллы как окислители, тем менее активны их элементарные анионы как восстановители. Так, в ряду СI, Br, I, восстановительная способность возрастает. Ионы металлов в низшей степени окисления Mn 2+ , Fe 2+ , Сu + , Sn 2+ также могут проявлять восстановительные свойства.
Если же элемент находится в промежуточной степени окисления, то его атомы могут, в зависимости от условий, как принимать, так и отдавать электроны. В первом случае степень окисления элемента будет понижаться, во втором – повышаться. Поэтому соединения, содержащие элементы в промежуточных степенях окисления, обладают окислительно-восстановительной двойственностью – способностью вступать в реакции как с окислителями, так и восстановителями. Например, азотистая кислота HNO2 и ее соли, где степень окисления азота равна (+3), вступают в реакции как с сильными окислителями, так и с сильными восстановителями. В качестве примеров окислительно-восстановительной двойственности азотистой кислоты и ее солей можно привести реакции:
Наиболее часто применяемые восстановители и окислители приведены в табл. 9.1.
Химические свойства металлов

Свойства металлов начинают изучать на уроках химии в 8–9 классе. В этом материале мы подробно разберем химические свойства этой группы элементов, а в конце статьи вы найдете удобную таблицу-шпаргалку для запоминания.
О чем эта статья:
8 класс, 9 класс, ЕГЭ/ОГЭ
Металлы — это химические элементы, атомы которых способны отдавать электроны с внешнего энергетического уровня, превращаясь в положительные ионы (катионы) и проявляя восстановительные свойства.
В окислительно-восстановительных реакциях металлы способны только отдавать электроны, являясь сильными восстановителями. В роли окислителей выступают простые вещества — неметаллы (кислород, фосфор) и сложные вещества (кислоты, соли и т. д.).
Металлы в природе встречаются в виде простых веществ и соединений. Активность металла в химических реакциях определяют, используя электрохимический ряд, который предложил русский ученый Н. Н. Бекетов. По химической активности выделяют три группы металлов.
Ряд активности металлов
Металлы средней активности
Общие химические свойства металлов
Взаимодействие с неметаллами
Щелочные металлы сравнительно легко реагируют с кислородом, но каждый металл проявляет свою индивидуальность:
оксид образует только литий
натрий образует пероксид
калий, рубидий и цезий — надпероксид
Остальные металлы с кислородом образуют оксиды:
2Zn + O2 = 2ZnO (при нагревании)
Металлы, которые в ряду активности расположены левее водорода, при контакте с кислородом воздуха образуют ржавчину. Например, так делает железо:
С галогенами металлы образуют галогениды:
Медный порошок реагирует с хлором и бромом (в эфире):
При взаимодействии с водородом образуются гидриды:
Взаимодействие с серой приводит к образованию сульфидов (реакции протекают при нагревании):
Реакции с фосфором протекают до образования фосфидов (при нагревании):
Основной продукт взаимодействия металла с углеродом — карбид (реакции протекают при нагревании).
Из щелочноземельных металлов с углеродом карбиды образуют литий и натрий:
Калий, рубидий и цезий карбиды не образуют, могут образовывать соединения включения с графитом:
С азотом из металлов IA группы легко реагирует только литий. Реакция протекает при комнатной температуре с образованием нитрида лития:
Взаимодействие с водой
Все металлы I A и IIA группы реагируют с водой, в результате образуются растворимые основания и выделяется H2. Литий реагирует спокойно, держась на поверхности воды, натрий часто воспламеняется, а калий, рубидий и цезий реагируют со взрывом:
Металлы средней активности реагируют с водой только при условии, что металл нагрет до высоких температур. Результат данной реакции — образование оксида.
Неактивные металлы с водой не взаимодействуют.
Взаимодействие с кислотами
Если металл расположен в ряду активности левее водорода, то происходит вытеснение водорода из разбавленных кислот. Данное правило работает в том случае, если в реакции с кислотой образуется растворимая соль.
2Na + 2HCl = 2NaCl + H2
При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.


Металлы IА группы:
Металлы IIА группы
Такие металлы, как железо, хром, никель, кобальт на холоде не взаимодействуют с серной кислотой, но при нагревании реакция возможна.
Взаимодействие с солями
Металлы способны вытеснять из растворов солей другие металлы, стоящие в ряду напряжений правее, и могут быть вытеснены металлами, расположенными левее:
Zn + CuSO4 = ZnSO4 + Cu
На металлы IА и IIА группы это правило не распространяется, так как они реагируют с водой.
Реакция между металлом и солью менее активного металла возможна в том случае, если соли — как вступающие в реакцию, так и образующиеся в результате — растворимы в воде.
Взаимодействие с аммиаком
Щелочные металлы реагируют с аммиаком с образованием амида натрия:
Взаимодействие с органическими веществами
Металлы IА группы реагируют со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
Также они могут вступать в реакции с галогеналканами, галогенпроизводными аренов и другими органическими веществами.
Взаимодействие металлов с оксидами
Для металлов при высокой температуре характерно восстановление неметаллов или менее активных металлов из их оксидов.
3Са + Cr2O3 = 3СаО + 2Cr (кальциетермия)
Вопросы для самоконтроля
С чем реагируют неактивные металлы?
С чем связаны восстановительные свойства металлов?
Верно ли утверждение, что щелочные и щелочноземельные металлы легко реагируют с водой, образуя щелочи?
Методом электронного баланса расставьте коэффициенты в уравнении реакции по схеме:
Mg + HNO3 → Mg(NO3)2 + NH4NO3 + Н2O
Как металлы реагируют с кислотами?
Подведем итоги
От активности металлов зависит их химические свойства. Простые вещества — металлы в окислительно-восстановительных реакциях являются восстановителями. По положению металла в электрохимическом ряду можно судить о том, насколько активно он способен вступать в химические реакции (т. е. насколько сильно у металла проявляются восстановительные свойства).
Напоследок поделимся таблицей, которая поможет запомнить, с чем реагируют металлы, и подготовиться к контрольной работе по химии.
Таблица «Химические свойства металлов»
Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb
Cu, Hg, Ag, Pt, Au
Восстановительная способность металлов в свободном состоянии
Возрастает справа налево
Взаимодействие металлов с кислородом
Быстро окисляются при обычной температуре
Медленно окисляются при обычной температуре или при нагревании
Взаимодействие с водой
Выделяется водород и образуется гидроксид
При нагревании выделяется водород и образуются оксиды
Водород из воды не вытесняют
Взаимодействие с кислотами
Вытесняют водород из разбавленных кислот (кроме HNO3)
Не вытесняют водород из разбавленных кислот
Реагируют с концентрированными азотной и серной кислотами
С кислотами не реагируют, растворяются в царской водке
Взаимодействие с солями
Не могут вытеснять металлы из солей
Более активные металлы (кроме щелочных и щелочноземельных) вытесняют менее активные из их солей
Взаимодействие с оксидами
Для металлов (при высокой температуре) характерно восстановление неметаллов или менее активных металлов из их оксидов
Окислительно-восстановительные реакции

Разбираться в ОВР важно, чтобы хорошо сдать ЕГЭ по химии. Какие реакции называются окислительно-восстановительными, их типы, а также примеры окислителей и восстановителей — в нашей подробной статье.
11 класс, ЕГЭ/ОГЭ
Что такое ОВР
Окислительно-восстановительная реакция (ОВР) — это реакция, которая протекает с изменением степеней окисления.
В такой реакции всегда участвуют вещество-окислитель и вещество-восстановитель. Другие вещества могут выступать в качестве среды, в которой протекает данная реакция.
Конечно, в каждом правиле есть исключения. Например, реакция диспропорционирования галогенов в горячем растворе щелочи выглядит так: Br2 + KOH = KBrO3 + KBr + H2O. Здесь и окислителем, и восстановителем является простое вещество бром (Br2).
Теперь посмотрим внимательнее на вещества — участники окислительно-восстановительных реакций.
Окислитель — вещество, в состав которого входит ион или атом, который в процессе реакции будет принимать электроны, тем самым понижая свою степень окисления.
Восстановитель — вещество, в состав которого входит ион или атом, который в процессе реакции будет отдавать электроны, тем самым повышая свою степень окисления.
Из определений понятно, что реакция включает два противоположных по действиям явления: процесс окисления и процесс восстановления. Процесс восстановления — это процесс принятия электронов, а процесс окисления — процесс отдачи электронов. Оба процесса протекают одновременно: окислитель восстанавливается, а восстановитель окисляется.
Вот мы и узнали общие закономерности протекания окислительно-восстановительных реакций. Теперь давайте разберемся, какие вещества могут быть окислителями, а какие — восстановителями, и может ли одно вещество проявлять те и другие свойства.
Примеры веществ-окислителей
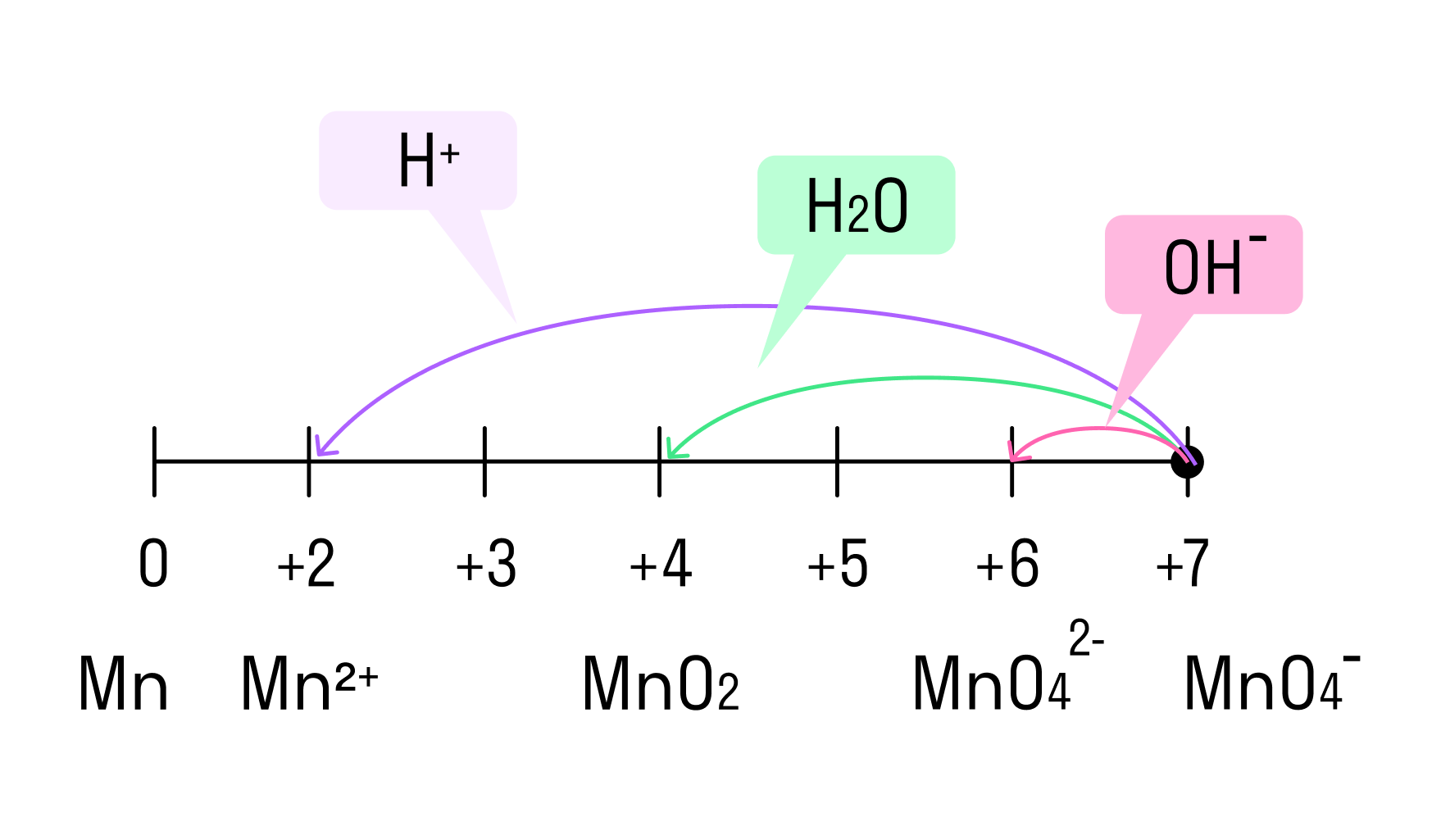
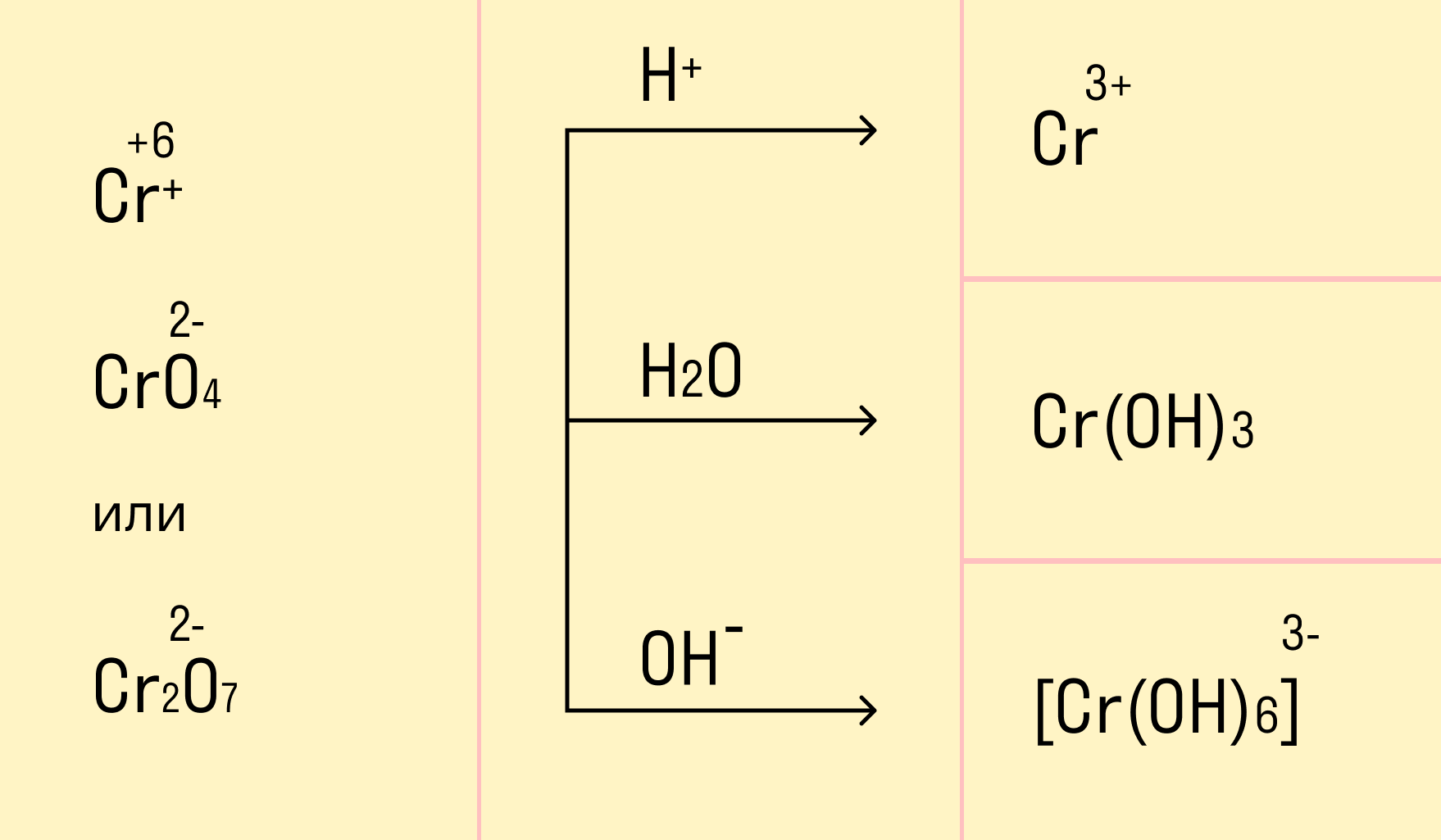
И марганец, и хром в кислой среде (H + ) образуют соли той кислоты, которая образовывала среду. В нейтральной среде (H2O) марганец превращается в оксид бурого цвета, а хром — в серо-зеленый нерастворимый в воде гидроксид. В щелочной среде (OH − ) марганец превращается в манганат (MnO4 2− ), а хром — в комплексное соединение светло-зеленого цвета.
Только окислителями могут быть простые вещества-неметаллы. Например, представители VIIA группы — галогены. Проявляя окислительные свойства в кислой среде, галогены восстанавливаются до соответствующих им галогеноводородных кислот: HF, HCl, HBr, HI. В щелочной среде образуются соли галогеноводородных кислот.
Кислород превращается в анион с устойчивой степенью окисления −2. А сера ведет себя как окислитель по отношению к водороду и металлам, образуя при этом сероводород и сульфиды.
Только окислителями могут быть и протон водорода (H + ) и катионы металлов в их высших степенях окисления при нескольких возможных. Ион Н + при взаимодействии с восстановителями переходит в газообразный водород (H2), а катионы металлов — в ионы с более низкой степенью окисления: 2CuCl2 + 2KI = CuCl + 2KCl + I2.
Рассмотрим как ведут себя сильные кислоты-окислители — азотная и серная. В зависимости от их концентрации меняются и продукты реакции.
Разбавленная азотная кислота никогда не реагирует с металлами с выделением водорода в отличие от разбавленной серной кислоты. Обе эти кислоты реагируют с металлами, стоящими в ряду активности после водорода.
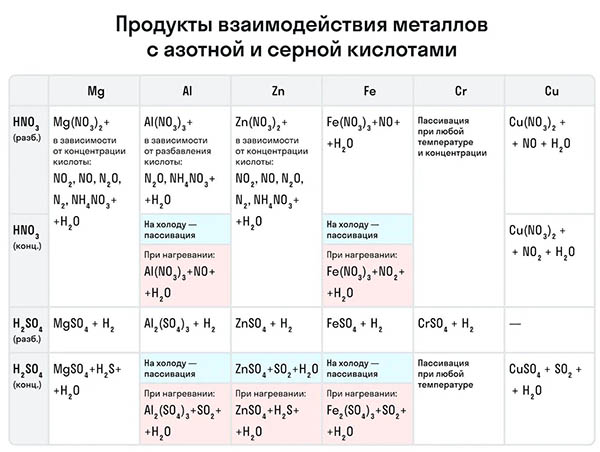
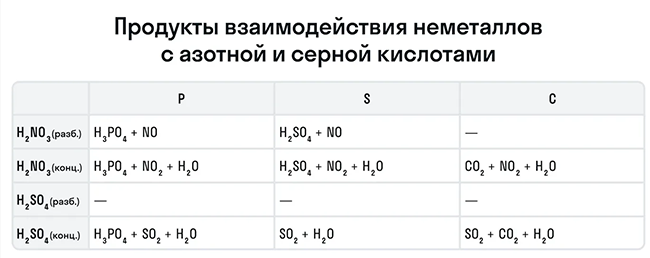
Эти кислоты проявляют окислительные способности и с некоторыми неметаллами, окисляя их до соответствующих кислот в высшей степени окисления неметалла-восстановителя.
Для удобства мы собрали цвета переходов важнейших веществ-окислителей в одном месте.
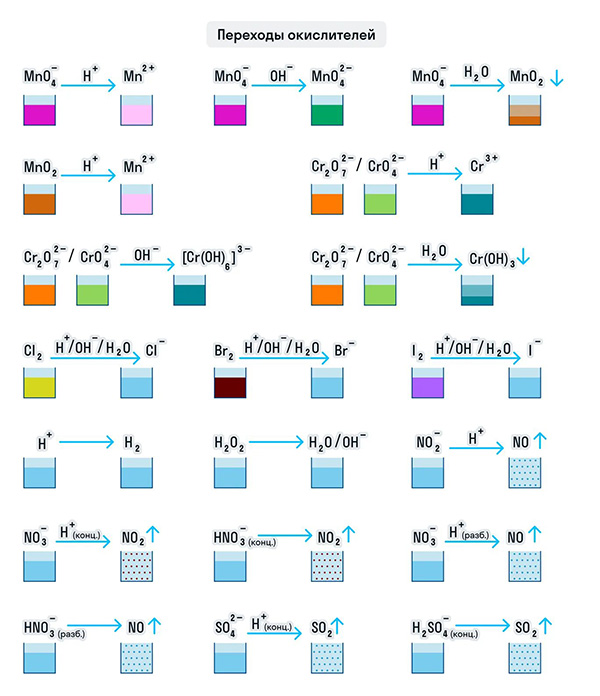
Примеры веществ-восстановителей
Типичными восстановителями могут быть щелочные (IA) и щелочноземельные (IIA) металлы, цинк и алюминий, а также катионы металлов в своих низших степенях окисления при нескольких возможных. Например:
Типичными восстановителями также могут быть бескислородные кислоты и их соли. Например, H2S + 4Cl2 + 4H2O = 8HCl + H2SO4.
Гидриды активных металлов (щелочных и щелочноземельных) тоже являются типичными восстановителями. Например, NaH + H2O = NaOH + H2.
Для удобства мы собрали цвета переходов важнейших веществ-восстановителей в одном месте.

Окислительно-восстановительная двойственность
Окислительно-восстановительная двойственность — это способность атома проявлять как свойства окислителя, так и свойства восстановителя в зависимости от условия протекания химической реакции.
Разберем вещества, атомы которых обладают окислительно-восстановительной двойственностью.
По отношению к водороду и металлам сера играет роль окислителя: S + H2 = H2S.
При взаимодействии с сильными окислителями повышает свою степень окисления до +4 или +6: S + KMnO4 = K2SO4 + MnO2.
Кислородсодержащие соединения серы в степени окисления +4
Сера в сульфитах и сернистой кислоте при взаимодействии с сильными окислителями повышает степень окисления до +6: SO2 + 2HNO3 (конц) = H2SO4 + 2NO2.
С восстановителями соединения серы проявляют окислительные свойства, восстанавливаясь до степени окисления 0 или −2: SO2 + C = CO2 + S.
Пероксид водорода
Атом кислорода в пероксиде водорода находится в промежуточной степени окисления –1, и в присутствии восстановителей может понижать степень окисления до –2: 4H2O2 + PbS = PbSO4 + 4H2O.
Атом кислорода в пероксиде водорода находится в промежуточной степени окисления –1, и в присутствии окислителей может повышать степень окисления до 0: 3H2O2 + 2KMnO4 = 3O2 + 2MnO2 + 2KOH + 2H2O.
Простое вещество йод
Окислительная способность проявляется у йода в реакции с такими восстановителями, как сероводород, фосфор и металлы: I2 + H2S = S + 2HI.
Йод при взаимодействии с более сильными окислителями играет роль восстановителя: I2 + 5Cl2 + 6H2O = 2HIO3 + 10HCl.
Азотистая кислота и нитриты
При взаимодействии с более сильными окислителями азот повышает степень окисления до +5 и превращается либо в азотную кислоту из азотистой, либо в нитрат-анион из нитрит-аниона: 5NaNO2 + 2KMnO4 + 3H2SO4 = 5NaNO3 + 2MnSO4 + K2SO4 + 3H2O.
При взаимодействии с сильными восстановителями обычно происходит восстановление до NO (иногда до других соединений азота в более низких степенях окисления): 2HNO2 + 2HI = 2NO + I2 + 2H2O.
Для удобства мы собрали представителей типичных окислителей и восстановителей в одну схему.

Классификация окислительно-восстановительных реакций
Окислительно-восстановительные реакции можно поделить на четыре типа:
Рассмотрим каждую по отдельности.
Межмолекулярная ОВР — это реакция, окислитель и восстановитель которой являются различными веществами.
2KI + Br2 = 2KBr + I2, где Br2 — окислитель, а KI — восстановитель (за счёт I −1 ).
Внутримолекулярная ОВР — это реакция, в которой один атом является окислителем, а другой восстановителем в рамках одного соединения.
Пример такой окислительно-восстановительной реакции:
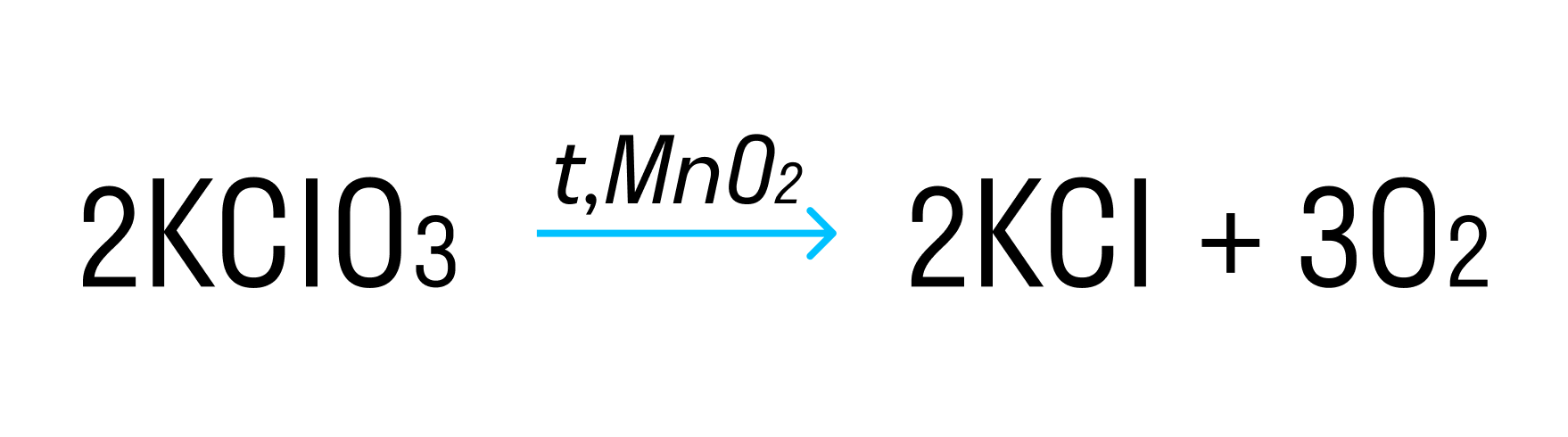
где Cl +5 — окислитель, а O −2 — восстановитель.
Термическое разложение нитратов — это внутримолекулярная ОВР. Вот схема разложения нитратов в зависимости от металла, входящего в состав соли.
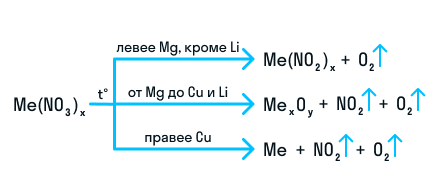
Исключение — разложение нитрата железа (II): 4Fe(NO3)2 = 2Fe2O3 + 8NO2 + O2. Здесь железо окисляется до +3 вопреки правилам. Иначе разлагается при нагревании и нитрат аммония: NH4NO3 = N2O + 2H2O.
Окислительно-восстановительная реакция диспропорционирования — это реакция, в ходе которой один и тот же атом является и окислителем, и восстановителем. Например, 3HNO2 = HNO3 + 2NO + H2O, где N +3 переходит в N +5 , являясь восстановителем, и N +3 переходит в N +2 , являясь окислителем.
Окислительно-восстановительная реакция контрпропорционирования — это реакция, в которой атомы одного и того же химического элемента в разных степенях окисления входят в состав разных веществ, при этом образуя новые молекулы одного и того же продукта.
Основные правила составления ОВР
Подобрать среди исходных веществ окислитель и восстановитель, а также вещество, которое отвечает за среду — при необходимости. Для этого нужно расставить степени окисления элементов и сравнить их окислительно-восстановительные свойства.
Составить уравнение реакции и записать продукты реакции. Следует помнить, что в кислой среде образуются соли одно-, двух- и трехзарядных катионов, а для создания среды чаще всего используют серную кислоту. В кислой среде невозможно образование оснóвных оксидов и гидроксидов, так как они вступят в реакцию с кислотой. В щелочной среде не могут образовываться кислоты и кислотные оксиды, а образуются соли.
Уравнять методом электронного баланса или методом полуреакций.
Составим алгоритм для уравнивания окислительно-восстановительных реакций методом электронного баланса.
Главное условие протекания ОВР — общее число электронов, отданных восстановителем, должно быть равно общему числу электронов, принятых окислителем.
Определите атомы, которые меняют свои степени окисления в ходе реакции.
Выпишите, сколько электронов принял окислитель и отдал восстановитель. Если восстановителей несколько, выписываем все.
Найдите НОК для суммарно отданных/принятых электронов.
Расставьте первые полученные коэффициенты перед окислителем и одним или несколькими восстановителями.
Уравняйте все присутствующие металлы в уравнении реакции.
Уравняйте кислотные остатки.
Уравняйте водород — в обеих частях его должно быть одинаковое количество.
Особенности окислительно-восстановительных реакций с участием металлов
Простые вещества – металлы в окислительно-восстановительных реакциях, в связи с особым строением их атомов, могут быть только восстановителями, и наименьшей степенью окисления для них является ноль (Ме 0 ).
Катионы металлов в ОВР могут выполнять различные функции:
– в промежуточной степени окисления катионы металлов могут проявлять окислительно-восстановительную двойственность, например Mn +6 в молекуле K2MnO4, Mn +4 в MnO2 и т. п.
Факторы, влияющие на ОВР с участием металлов в растворах электролитов:
1. Электрохимическая активность металла, определяемая по значению стандартного электродного потенциала E 0 в электрохимическом ряду напряжений металлов (табл. А-6, приложение А).
2. Природа, концентрация и количество окислителя.
3. Температура среды.
4. Наличие на поверхности металла защитных пленок и их природа.
При стандартных условиях окисление металла конкретным окислителем возможно, если соблюдается неравенство: ∆Е > 0,
где ∆Е = Е 0 окислителя – Е 0 Ме 0 /Ме n+ , В.
В соответствии с положением в ряду напряжений металлы подразделяются на три группы: активные, средней активности, малоактивные.
Восстановительная способность металла тем выше, а окислительная способность его катиона в растворе тем ниже, чем левее расположен металл в ряду напряжений, т.е. чем более отрицательно значение его электродного потенциала.
Металл способен вытеснять из растворов солей других металлов только те металлы (т.е. окисляться их катионом), которые стоят в ряду напряжений правее него.
Металлы, расположенные левее водорода, способны вытеснять его из растворов кислот, условно называемых кислотами-«неокислителями», т.е. окисляться катионом водорода такой кислоты.
Всегда соблюдается закономерность: чем выше восстановительная способность металла, тем ниже окислительная способность его катиона.
Наиболее распространенными окислителями металлов являются:
– водород в молекуле воды (при рН ≥ 7);
– катион водорода (протон) в растворах кислот-«неокислителей»: галогеноводородных кислот, Н3РО4, Н2S, НСΝ, органических кислот и некоторых других;
– протон в разбавленных растворах H2SO4;
– катион менее активного металла в растворах его солей;
– HNO3 любой концентрации, в молекуле которой окислителем металлов выступает азот в с.о. +5 (N +5 ), но не водород этой кислоты;
– конц. H2SO4, в молекуле которой в концентрированном состоянии окислителем является сера в с.о. +6 (S +6 ), но не водород.
Конц. H2SO4 и HNO3 любой концентрации могут окислять ряд малоактивных металлов. В случае их окисления этими кислотами справедливо неравенство ∆Е 0 > 0. При этом из малоактивных (неактивных) металлов с HNO3 любой концентрации реагируют только Cu, Hg, Ag, а с конц. H2SO4 только Cu, Hg и, при кипячении, Ag. В связи с особенностями такого действия HNO3 и конц. H2SO4 называют кислотами- «окислителями».
Общая схема реакции металлов с кислотами- «окислителями»:
Mе + HNO3 → Mе(NO3)x + H2O + преобладающий продукт восстановления
При окислении металлов конц. H2SO4 и HNO3 любой концентрации образуется смесь продуктов восстановления частиц S +6 и N +5 . В зависимости от активности металла и условий окисления в этой смеси имеется преобладающий продукт (с.73, табл. 7.1).
В ряде случаев металлы или вообще не окисляются данным окислителем, или процесс окисления начинается, но быстро прекращается по ниже приведённым причинам:
1. В конц. H2SO4 устойчивы Al, Cr и Fe вследствие пассивации (реакция начинается, а затем прекращается из-за образования на поверхности пассивирующего слоя оксидов).
2. В конц. HNO3 при нормальной температуре устойчивы из-за пассивации Al, Fe, Cо, Ni, Cr (они начинают реагировать, а затем окисление прекращается из-за образования на поверхности пассивирующего слоя оксидов).
3. Не окисляются HNO3 любой концентрации:
из-за термодинамической устойчивости – Au, Ru, Os, Pd, Pt, Rh, Jr;
из-за пассивации – Ti, Ta, Zr, Hf, Νb.
4. Разб. H2SO4 и НСl не окисляют Рb из-за пассивации его поверхности образующимися нерастворимыми солями (реакция начинается, а затем прекращается).
5. Вода при рН=7 имеет электродный потенциал -0,413 В. Окисляются водой при рН=7 металлы от LiдоМg(Мg при нагревании). Однако в нейтральной среде водой не окисляются Bе, Al, Mn, Zn, Cr, Fe, имеющие более отрицательный электродный потенциал, чем -0,413 В, но покрытые оксидной плёнкой, нерастворимой в воде.
6. На поверхности ряда металлов (Be, Al, Sn, Zn, Pb) образуются нерастворимые амфотерные оксиды, поэтому они не окисляются H2O в нейтральной среде, но окисляются водой в щелочном растворе. У существующих на их поверхности амфотерных оксидов, а затем образующихся в ходе реакции окисления амфотерных гидроксидов преобладают кислотные свойства, вследствие чего они взаимодействуют со щелочью, образуя растворимые соли. Поверхность металла при этом освобождается и окисляется водой. Взаимодействие со щелочью поверхностных оксидов проходит до начала окисления металла, а взаимодействие гидроксидов со щелочью многократно повторяется до полного растворения металла в растворе щелочи в результате его окисления водой.
Таблица 7.1 – Преобладающий состав продуктов восстановления молекул кислот-окислителей при окислении металлов в зависимости от концентрации кислот и активности металла
| Кислота и ее концентрация | Активные металлы: отLiдоМnи Zn (при комнатной тем-пературе) | Металлы средней активности: от Zn (при наг-ревании)до водо-рода | Малоактивные металлы: стоят в ряду напряжений металловпосле водорода |
| конц. H2SO4 | H2S | S | SО2 (окисляются только Сu и Hg) |
| HNO3 : | |||
| конц. | NO2 | NO2 | NO2 (окисляются только Сu, Hg, Ag) |
| разб. | N2 | N2O | NO |
| очень. разб | NH4NO3 | N2 | NO |
Металлы со стабильной высшей степенью окисления при окислении конц. HNO3 могут в качестве преобладающих продуктов реакции давать кислоты с высшей степенью окисления металла, например:
Рекомендуемая литература по теме 7: [1], гл. 9, § 9.1-9.3; гл. 11, § 11.3.2, 11.3.3; [2], гл. 9, § 9.1, 9.4; [3], гл. 10, § 1-6; [4], гл. 10, § 10.7; [5], гл. 8, § 1-6.
Лабораторная работа № 7.1 Окислительно-восстановительные реакции и их использование в химическом анализе (с элементами УИРС)
Внимание! Все опыты в лабораторной работе 7.1 выполняются капельным методом и оформляются в соответствии со следующим заданием:
1. Проведите опыт по данной методике.
2. Отметьте в лабораторном журнале все наблюдения (изменение цвета реакционной среды, образование осадка, выделение газа, образование гомогенной или гетерогенной среды, разогрев и т.п.)
3. Составьте или допишите химическое уравнение наблюдаемой реакции.
4. Для всех реакций приведите уравнения электронного баланса с указанием окислителя, восстановителя и процессов, проходящих в данной ОВР.
5. После проведения опытов напишите выводы.
В выводах отразите:
– почему наблюдаемая окислительно-восстановительная реакция оказалась возможной (укажите окислитель, восстановитель, за счет чего они таковыми являются, и какое значение по отношению к нулю имеет в этой реакции ∆Е);
– к какому типу в соответствии с классификацией ОВР относится данная реакция и почему;
– что в данной реакции является аналитическим сигналом;
– какие частицы (молекулы, атомы или ионы) и почему можно обнаружить методом химической идентификации с помощью конкретного аналитического реактива, использованного в каждом из проведенных опытов.
Цель работы: изучение окислительно-восстановительных реакций разных типов с участием неметаллов и сложных веществ, имеющих в своем составе элементы в различных степенях окисления. Ознакомление с возможностями использования ОВР в химическом анализе.
Периодический закон
Периодический закон — это фундаментальный закон, который был сформулирован Д.И. Менделеевым в 1869 году.
В формулировке Дмитрия Ивановича Менделеева периодическ ий закон звучал так: « Свойства элементов, формы и свойства образуемых ими соединений находятся в периодической зависимости от величины их атомной массы .» Периодическое изменение свойств элементов Менделеев связывал с атомной массой. Понимание периодичности изменения многих свойств позволило Дмитрию Ивановичу определить и описать свойства веществ, образованных еще не открытыми химическими элементами, предсказать природные рудные источники и даже места их залегания.

Более поздние исследования показали, что свойства атомов и их соединений зависят в первую очередь от электронного строения атома. А электронное строение определяется свойствами атомного ядра. В частности, зарядом ядра атома .
Поэтому современная формулировка периодического закона звучит так:
« Свойства элементов, форма и свойства образованных ими соединений находятся в периодической зависимости от величины заряда ядер их атомов «.
Следствие периодического закона – изменение свойств элементов в определенных совокупностях, а также повторение свойств по периодам, т.е. через определенное число элементов. Такие совокупности Менделеев назвал периодами.
Периоды – это горизонтальные ряды элементов с одинаковым количеством заполняемых электронных уровней. Номер периода обозначает число энергетических уровней в атоме элемента. Все периоды (кроме первого) начинаются щелочным металлом ( s -элементом), а заканчиваются благородным газом.
Группы – вертикальные столбцы элементов с одинаковым числом валентных электронов, равным номеру группы. Различают главные и побочные подгруппы. Главные подгруппы состоят из элементов малых и больших периодов, валентные электроны которых расположены на внешних ns— и np— подуровнях.
1. Периодическая система химических элементов Д.И. Менделеева
Периодическая система элементов Д. И. Менделеева состоит из семи периодов, которые представляют собой горизонтальные последовательности элементов, расположенные по возрастанию заряда их атомного ядра.
Каждый период (за исключением первого) начинается атомами щелочных металлов (Li, Na, К, Rb, Cs, Fr) и заканчивается благородными газами (Ne, Ar, Kr, Xe, Rn), которым предшествуют типичные неметаллы.
В периодах слева направо возрастает число электронов на внешнем уровне.
В периодах слева направо постепенно ослабевают металлические и усиливаются неметаллические свойства.
1) Li 2) Ca 3) Cs 4) N 5) S
Ответ: 154
1) Be 2) Ba 3) Mg 4) N 5) F
Ответ: 541
В первом периоде имеются два элемента – водород и гелий. При этом водород условно размещают в IA или VIIA подгруппе, так как он проявляет сходство и со щелочными металлами, и с галогенами. Как и щелочные металлы, водород является восстановителем. Отдавая один электрон, водород образует однозарядный катион H + . Как и галогены, водород – неметалл, образует двухатомную молекулу H2 и может проявлять окислительные свойства при взаимодействии с активными металлами:
2Na + H2 → 2NaH
В четвертом периоде вслед за Са расположены 10 переходных элементов (от скандия Sc до цинка Zn), за которыми находятся остальные 6 основных элементов периода ( от галлия Ga до криптона Кr). Аналогично построен пятый период. Переходными элементами обычно называют любые элементы с валентными d– или f–электронами.
Шестой и седьмой периоды имеют двойные вставки элементов. За элементом Ва расположены десять d–элементов (от лантана La — до ртути Hg), а после первого переходного элемента лантана La следуют 14 f–элементов — лантаноидов (Се — Lu). После ртути Hg располагаются остальные 6 основных р-элементов шестого периода (Тl — Rn).
В седьмом (незавершенном) периоде за Ас следуют 14 f–элементов- актиноидов (Th — Lr). В последнее время La и Ас стали причислять соответственно к лантаноидам и актиноидам. Лантаноиды и актиноиды помещены отдельно внизу таблицы.
В Периодической системе каждый элемент расположен в строго определенном месте, которое соответствует его порядковому номеру .
Элементы в Периодической системе разделены на восемь групп (I – VIII), которые в свою очередь делятся на подгруппы — главные , или подгруппы А и побочные , или подгруппы Б. Подгруппа VIIIБ-особая, она содержит триады элементов, составляющих семейства железа (Fе, Со, Ni) и платиновых металлов (Ru, Rh, Pd, Os, Ir, Pt).
Внутри каждой подгруппы элементы проявляют похожие свойства и схожи по химическому строению. А именно:
В главных подгруппах сверху вниз усиливаются металлические свойства и ослабевают неметаллические.
В зависимости от того, какая энергетическая орбиталь заполняется в атоме последней, химические элементы можно разделить на s-элементы, р-элементы, d- и f-элементы.
У атомов s-элементов заполняются s-орбитали на внешних энергетических уровнях. К s-элементам относятся водород и гелий, а также все элементы I и II групп главных подгрупп (литий, бериллий, натрий и др.). У p-элементов электронами заполняются p-орбитали. К ним относятся элементы III-VIII групп, главных подгрупп. У d-элементов заполняются, соответственно, d-орбитали. К ним относятся элементы побочных подгрупп.
Номер периода соответствует числу заполняемых энергетических уровней.
Номер группы, как правило, соответствует числу валентных электронов в атоме (т.е. электроном, способных к образованию химической связи).
Номер группы, как правило, соответствует высшей положительной степени окисления атома. Но есть исключения!
О каких же еще свойствах говорится в Периодическом законе?
Периодически зависят от заряда ядра такие характеристики атомов, как орбитальный радиус, энергия сродства к электрону, электроотрицательность, энергия ионизации, степень окисления и др.
2. Радиус атома
Рассмотрим, как меняется атомный радиус . Вообще, атомный радиус – понятие довольно сложное и неоднозначное. Различают радиусы атомов металлов и ковалентные радиусы неметаллов.
Радиус атома металла равен половине расстояния между центрами двух соседних атомов в металлической кристаллической решетке. Атомный радиус зависит от типа кристаллической решетки вещества, фазового состояния и многих других свойств.
Мы говорим про орбитальный радиус изолированного атома .
Орбитальный радиус – это теоретически рассчитанное расстояние от ядра до максимального скопления наружных электронов.
Орбитальный радиус завит в первую очередь от числа энергетических уровней, заполненных электронами.
Чем больше число энергетических уровней, заполненных электронами, тем больше радиус частицы.
Например , в ряду атомов: F – Cl – Br – I количество заполненных энергетических уровней увеличивается, следовательно, орбитальный радиус также увеличивается.

Если количество заполняемых энергетических уровней одинаковое, то радиус определяется зарядом ядра частицы.
Чем больше заряд ядра, тем сильнее притяжение валентных электронов к ядру.
Чем больше притяжение валентных электронов к ядру, тем меньше радиус частицы. Следовательно:
Чем больше заряд ядра атома (при одинаковом количестве заполняемых энергетических уровней), тем меньше атомный радиус.
Например , в ряду Li – Be – B – C количество заполненных энергетических уровней, заряд ядра увеличивается, следовательно, орбитальный радиус также уменьшается.

В группах сверху вниз увеличивается число энергетических уровней у атомов. Чем больше количество энергетических уровней у атома, тем дальше расположены электроны внешнего энергетического уровня от ядра и тем больше орбитальный радиус атома.
В главных подгруппах сверху вниз увеличивается орбитальный радиус.
В периодах же число энергетических уровней не изменяется. Зато в периодах слева направо увеличивается заряд ядра атомов. Следовательно, в периодах слева направо уменьшается орбитальный радиус атомов.
В периодах слева направо орбитальный радиус атомов уменьшается.

1) O 2) Se 3) F 4) S 5) Na
Решение:
В одной группе Периодической системы находятся элементы кислород O, селен Se и сера S.
В группе снизу вверх атомный радиус уменьшается, а сверху вниз – увеличивается. Следовательно, правильный ответ: O, S, Se или 142.
Ответ: 142
1) K 2) Li 3) F 4) B 5) Na
Решение:
В одном периоде Периодической системы находятся элементы литий Li, фтор F и натрий Na.
В периоде слева направо атомный радиус уменьшается, а справа налево – увеличивается. Следовательно, правильный ответ: Li, B, F или 243.
Ответ: 243
1) Ca 2) P 3) N 4) О 5) Ti
p-элементы это фосфор Р, азот N, кислород О.
В периоде слева направо атомный радиус уменьшается, а справа налево – увеличивается. В группе — сверху вниз увеличивается. Следовательно, правильный ответ: P, N, O или 234.
Ответ: 234
Рассмотрим закономерности изменения радиусов ионов : катионов и анионов.
Катионы – это положительно заряженные ионы. Катионы образуются, если атом отдает электроны.
Радиус катиона меньше радиуса соответствующего атома. С увеличением положительного заряда иона радиус уменьшается.
Например , радиус иона Na + меньше радиуса атома натрия Na:

Анионы – это отрицательно заряженные ионы. Анионы образуются, если атом принимает электроны.
Радиус аниона больше радиуса соответствующего атома.
Радиусы ионов также зависят от числа заполненных энергетических уровней в ионе и от заряда ядра.
Например , радиус иона Cl – больше радиуса атома хлора Cl.
Изоэлектронные ионы – это ионы с одинаковым числом электронов. Для изоэлектронных частиц радиус также определяется зарядом ядра: чем больше заряд ядра иона, тем меньше радиус.
Например : частицы Na + и F ‒ содержат по 10 электронов. Но заряд ядра натрия +11, а у фтора только +9. Следовательно, радиус иона Na + меньше радиуса иона F ‒ .
3. Электроотрицательность
Еще одно очень важное свойство атомов – электроотрицательность (ЭО).
Электроотрицательность – это способность атома смещать к себе электроны других атомов при образовании связи. Оценить электроотрицательность можно только примерно. В настоящее время существует несколько систем оценки относительной электроотрицательности атомов. Одна из наиболее распространенных – шкала Полинга.

По Полингу наиболее электроотрицательный атом – фтор (значение ЭО≈4). Наименее элекроотрицательный атом –франций (ЭО = 0,7).
В главных подгруппах сверху вниз уменьшается электроотрицательность.
В периодах слева направо электроотрицательность увеличивается.
1) Mg 2) P 3) O 4) N 5) Ti
Элементы-неметаллы – это фосфор Р, кислород О и азот N.
Электроотрицательность увеличивается в группах снизу вверх и слева направо в периодах. Следовательно, правильный ответ: P, N, O или 243.
Читайте также:
