Классификация берцелиуса на металлы и неметаллы
Обновлено: 16.05.2024
История открытия периодического закона: накопление фактологического материала, классификация Берцелиуса, съезд химиков в Карлсруэ. Открытие Д.И. Менделеевым периодической системы и ее структура. Основные сведения о строении электронных оболочек атомов.
| Рубрика | Химия |
| Вид | реферат |
| Язык | русский |
| Дата добавления | 22.11.2010 |
| Размер файла | 116,1 K |
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
АЛТАЙСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
РЕФЕРАТ
Иванова Галина.
Проверил: Сидельников С.Б
I. Вступление
II. История открытия Периодического закона
Накопление фактологического материала
Классификация Берцелиуса
Триады Деберейнера
Спираль Шанкуртуа
Октавы Ньюлендса
Классификация Мейера
Съезд химиков в Карлсруэ
III. Периодический закон и Периодическая система химических элементов
Открытие Д.И. Менделеевым Периодического закона
Структура Периодической системы
IV. Периодический закон и строение атома
Основные сведения о строении атома
Изменения в составе ядер атомов химических элементов. Изотопы
Строение электронных оболочек атомов
V. Значение Периодического закона и Периодической системы химических элементов Д.И. Менделеева
Периодический закон и Периодическая система химических элементов Д. И. Менделеева - основа современной химии. Они относятся к таким научным закономерностям, которые отражают явления, реально существующие в природе, и поэтому никогда не потеряют своего значения.
Их открытие было подготовлено всем ходом истории развития химии, однако потребовалась гениальность Д. И. Менделеева, его дар научного предвидения, чтобы эти закономерности были сформулированы и графически представлены в виде таблицы.
Основные периоды открытия химических элементов с древнейших времен до 1869 г. - года установления Дмитрием Ивановичем Менделеевым (1834-1907) Периодического закона: "1. Древнейший период (от V тысячелетия до н.э. и до 1200 г. н.э.). К этому длительному периоду относится знакомство человека с 7 металлами древности - золотом, серебром, медью, свинцом, оловом, железом и ртутью. Кроме этих элементарных веществ в древности были известны сера и углерод, встречающиеся в природе в свободном состоянии. 2. Алхимический период. В этот период (от 1200 до 1600 г.) было установлено существование нескольких элементов, выделенных либо в процессе алхимических поисков путей трансмутации металлов, либо в процессах производства металлов и переработки различных руд ремесленниками-металлургами. Сюда относятся мышьяк, сурьма, висмут, цинк, фосфор. 3. Период возникновения и развития технической химии (конец XVII в.-1751 г.). В это время в результате практического изучения особенностей различных металлических руд и преодоления трудностей, возникавщих при выделении металлов, а также открытий в процессе минералогических экспедиций было установлено существование платины, кобальта, никеля. 4. Первый этап химико-аналитического периода в развитии химии (1760-1805 гг.). В этот период с помощью качественного и весового количественного анализов был открыт ряд элементов, причем часть из них лишь в виде "земель": магний, кальций (установление различия извести и магнезии), марганец, барий (барит), молибден, вольфрам, теллур, уран (окисел), цирконий (земля), стронций (земля), титан (окисел), хром, бериллий (окисел), иттрий (земля), тантал (земля), церий (земля), фтор (плавиковая кислота), палладий, родий, осмий и иридий. 5. Этап пневматической химии. В это время (1760-1780 гг.) были открыты газообразные элементы - водород, азот, кислород и хлор (последний считался сложным веществом - окисленной соляной кислотой до 1809 г.). 6. Этап получения элементов в свободном состоянии путем электролиза (Г.Дэви, 1807-1808 гг.) и химическим путем: калий, натрий, кальций, стронций, барий и магний. Все они, впрочем, и ранее были известны в виде "огнепостоянных" (едких) щелочей и щелочных земель, или мягких щелочей. 7. Второй этап химико-аналитического периода в развитии химии (1805-1850 гг.). В это время в результате усовершенствования методов количественного анализа и разработки систематического хода качественного анализа были открыты бор, литий, кадмий, селен, кремний, бром, алюминий, иод, торий, ванадий, лантан (земля), эрбий (земля), тербий (земля), рутений, ниобий. 8. Период открытия элементов с помощью спектрального анализа, непосредственно вслед за разработкой и введением этого метода в практику (1860-1863 гг.): цезий, рубидий, таллий и индий." Как известно, первая в истории химии "Таблица простых тел" была составлена А.Лавуазье в 1787 г. Все простые вещества были разделены на четыре группы: "I. Простые вещества, представленные во всех трех царствах природы, которые можно рассматривать как элементы тел: 1) свет, 2) теплород, 3) кислород, 4) азот, 5) водород. II. Простые неметаллические вещества, окисляющиеся и дающие кислоты: 1) сурьма, 2) фосфор, 3) уголь, 4) радикал муриевой кислоты, 5) радикал плавиковой кислоты, 6) радикал борной кислоты. III. Простые металлические вещества, окисляемые и дающие кислоты: 1) сурьма, 2) серебро, 3) мышьяк, 4) висмут, 5) кобальт, 6) медь, 7) олово, 8) железо, 9) марганец, 10) ртуть, 11) молибден, 12) никель, 13) золото, 14) платина, 15) свинец, 16) вольфрам, 17) цинк. IV. Простые вещества, солеобразующие и землистые: 1) известь (известковая земля), 2) магнезия (основание сульфата магния), 3) барит (тяжелая земля), 4) глинозем (глина, квасцовая земля), 5) кремнезем (кремнистая земля)". Эта таблица легла в основу химической номенклатуры, разработанной Лавуазье. Д.Дальтон ввел в науку важнейшую количественную характеристику атомов химических элементов - относительный вес атомов или атомный вес. При отыскании закономерностей в свойствах атомов химических элементов ученые прежде всего обратили внимание на характер изменения атомных весов. В 1815-1816 гг. английский химик У.Праут (1785-1850) опубликовал в "Анналах философии" две анонимные статьи, в которых была высказана и обоснована идея, что атомные веса всех химических элементов являются целочисленными (т.е. кратными атомному весу водорода, который принимался тогда равным единице): "Если взгляды, которые мы решились высказать, правильны, то мы почти можем считать, что первоматерия древних воплощена в водороде. ". Гипотеза Праута была очень заманчивой и вызвала постановку многих экспериментальных исследований с целью возможно более точного определения атомных весов химических элементов.
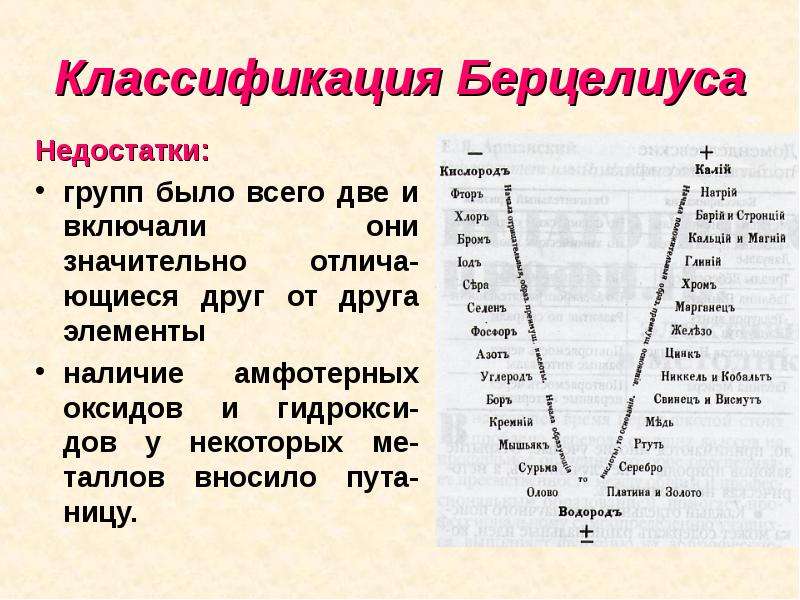
Выдающийся шведский химик Берцелиус разделил все элементы на металлы неметаллы на основе различий в свойствах, образованных ими простых веществ и соединений. Он определил, что металлам соответствуют основные оксиды и основания, а неметаллам - кислотные оксиды и кислоты.
Но групп было всего две, они были велики включали значительно отличающиеся друг от друга элементы. Наличие амфотерных оксидов и гидроксидов у некоторых металлов вносило путаницу. Классификация была неудачной.
Триады Деберейнера (1816г)
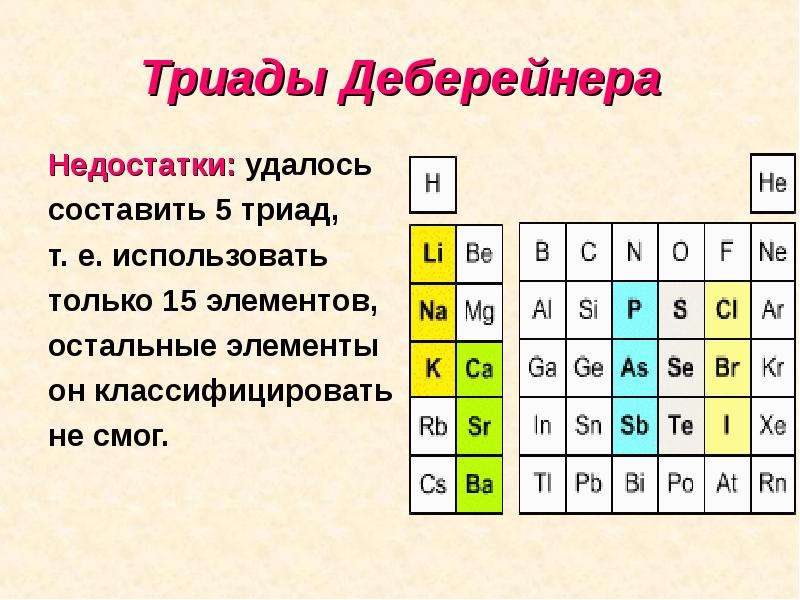
Немецкий химик И. В. Деберейнер разделил элементы по три на основе сходства в свойствах образуемых м веществ и так, чтобы величина которую мы сейчас понимаем как относительную атомную массу среднего элемента, была равна среднему арифметическому двух крайних. Примеры триад:
Периодический закон и Периодическая система химических элементов Д.И. Менделеева

Берцелиус разделил все элементы на металлы и неметаллы, определил, что металлам соответствуют основные оксиды и основания, а неметаллам – кислотные оксиды и кислоты.

- - триады Деберейнера
- В 1817 году немецкий ученый И. Деберейнер располагает все известные элементы отдельными триадами:
- 1) Li, Na, K;
- 2)Ca, Sr, Ba;
- 3) P, As, Sb;
- 4) S, Se, Te;
- 5) Cl, Br, J;
- и обнаруживает интересную закономерность: масса атома среднего элемента равна среднеарифметическому из масс крайних элементов, например: ArNa = (Ar Li + Ar K)/2 = (6, 94 + 39,1)/2 = 23.
Сходные элементы расположились
Выявленные закономерности он назвал

- - спираль Шанкуртуа
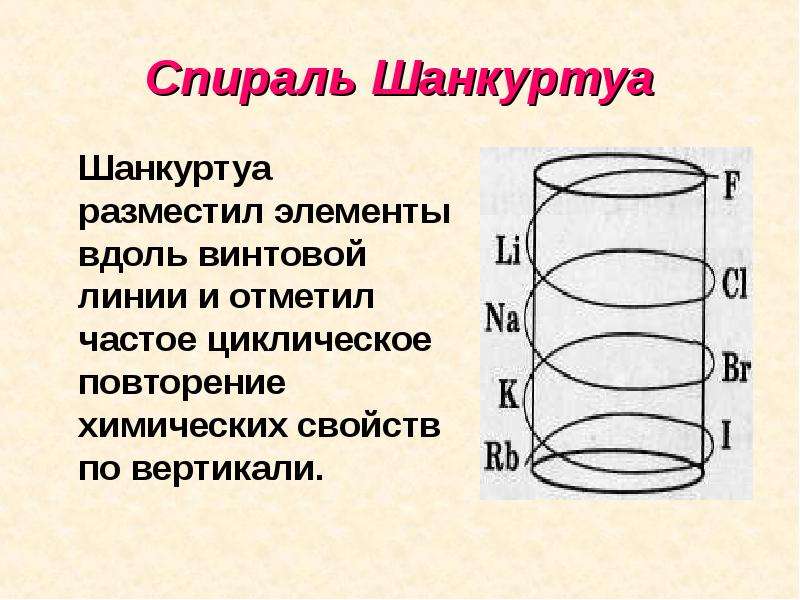
- Шанкуртуа располагает 50 элементов по винтовой линии на поверхности цилиндра, помещая их на линии, в соответствии с атомным весом.
- Т.к. система заканчивалась теллуром, то эту систему назвали “теллуровый винт”.
- Многие сходные элементы на цилиндре оказались друг под другом по вертикалям.
- Это построение графически правильно выражало идею диалектического развития материи.

- - кривая Мейера
- Таблица Лотара Мейера основана на сходстве элементов по их валентности по водороду.
- Мейер подмечает, что разность между относительными атомными массами соседних по каждому столбцу элементов отличается на закономерно возрастающие числа: 16, 16, 45, 45, 90.
- Он так же отмечает, что разность между Ar (Si) и Ar (Sn) ненормально велика (90 вместо 45).

- 3. Участие Д.И. Менделеева в съезде химиков в Карлсруэ (1860 г.), где утвердились идеи атомистики и понятие «атомный вес», которое сейчас известно под названием «относительная атомная масса».
- 4. Личностные качества Д.И. Менделеева.
Энциклопедичность знаний, научная интуиция, умение обобщать, постоянное стремление к познанию неведомого, дар научного предвидения Д.И. Менделеева.
🗊Предпосылки открытия Периодического закона Д. И. Менделеевым













Вы можете ознакомиться и скачать Предпосылки открытия Периодического закона Д. И. Менделеевым. Презентация содержит 16 слайдов. Презентации для любого класса можно скачать бесплатно. Если материал и наш сайт презентаций Вам понравились – поделитесь им с друзьями с помощью социальных кнопок и добавьте в закладки в своем браузере.

Слайд 1

Слайд 2
I. Накопление фактологичес- I. Накопление фактологичес- кого материала Ко времени открытия Периодического закона было известно 63 химических элемента, описаны состав и свойства их многочисленных соединений.

Слайд 3
II.Работы ученых – предшественников Д.И.Менделеева Классификация Берцелиуса Он разделил все элементы на металлы и неметаллы на основе различий в свойствах образованных ими простых веществ и соединений. Йенс Якоб Берцелиус (1779 – 1848 гг.)

Слайд 4
Классификация Берцелиуса Недостатки: групп было всего две и включали они значительно отлича- ющиеся друг от друга элементы наличие амфотерных оксидов и гидрокси- дов у некоторых ме- таллов вносило пута- ницу.

Слайд 5
Триады Дёберейнера В 1829 году Деберейнер опубликовал найденный им «закон триад»: атомный вес многих элементов бли- зок к среднему арифмети- ческому двух других эле- ментов, близких к исходно- му по химическим свойст- вам (стронций, кальций и Иоганн Вольфганг барий; хлор, бром и йод и Дёберейнер др.). (1780-1849 гг.)

Слайд 6
Триады Деберейнера Недостатки: удалось составить 5 триад, т. е. использовать только 15 элементов, остальные элементы он классифицировать не смог.

Слайд 7
Спираль Шанкуртуа В 1862 году первую попытку расположить элементы в порядке возрастания атомных весов предпринял Шанкуртуа. Александр Эмиль Шанкуртуа (1820-1886 гг.)

Слайд 8
Спираль Шанкуртуа Шанкуртуа разместил элементы вдоль винтовой линии и отметил частое циклическое повторение химических свойств по вертикали.

Слайд 9
Октавы Ньюлендса В 1865 году свой вариант периодической системы предложил химик и музы- кант Джон Александр Ньюлендс, модель кото- рого («закон октав») внешне немного напоми- нала менделеевскую. Джон Александр Рейна Ньюлендс (1837-1898 гг.)

Слайд 10
Октавы Ньюлендса Недостатки: модель была скомпрометирова- на настойчивыми попытками автора найти в таблице мистическую музы- кальную гармонию; при таком расположении без пропусков исключалась возможность открытия новых элементов и многие элементы попадали на несоответствующие им места.

Слайд 11
Таблица Мейера В этом же десятилетии по- явились ещё несколько по- пыток систематизации хими- ческих элементов; ближе всего к окончательному ва- рианту подошёл Мейер (1864). Он расположил хими- ческие элементы в порядке возрастания их атомных Юлиус Лотар масс. Мейер (1830-1895 гг)

Слайд 12
Таблица Мейера Недостатки: в его таблицу вошли лишь 28 элементов размещенных в шесть столбцов, т.е. меньше половины известных в то время. При этом структура таблицы была очень не- определенной и не отражала периодичности свойств.

Слайд 13

Слайд 14
Съезд химиков в Карлсруэ На данном съезде окончательно утвердилось атомно-молекулярное учение, были приняты первые единые определения понятий молекулы и атома, а также атомного веса (атомной массы). Именно это понятие как неизменную характеристику атомов Д.И. Менделеев положил в основу своей классификации.

Слайд 15
Дмитрий Иванович Менделеев (1834-1907 гг.) «Масса вещества есть именно такое свойство его, от которого должны находиться в зависимости все остальные свойства. Поэтому ближе и естественнее всего искать зависимость между свойствами и сходствами элементов, с одной стороны, и атомными весами их, с другой стороны»

Слайд 16
IV. Личностные качества Д.И.Менделеева энциклопедичность знаний, научная интуиция, умение обобщать, постоянное стремление к познанию неведомого, дар научного предвидения.
§ 5.1. Предпосылки открытия Периодического закона Д. И. Менделеевым
Периодический закон и Периодическая система химических элементов Д. И. Менделеева — основа современной химии. Они относятся к таким научным закономерностям, которые отражают явления, реально существующие в природе, и поэтому никогда не потеряют своего значения.
Их открытие было подготовлено ходом истории развития химии, однако потребовалась гениальность Д. И. Менделеева, его дар научного предвидения, чтобы эти закономерности были сформулированы и графически представлены в виде таблицы. Мы будем пользоваться современными синонимами тех терминов, которые применял великий русский химик.
Ко времени открытия Периодического закона было известно 63 химических элемента, описаны состав и свойства их многочисленных соединений.
Ученые неоднократно предпринимали попытки классифицировать химические элементы, привести сведения о них в систему. К концу 60-х гг. XIX в. насчитывалось более 50 различных вариантов классификации химических элементов (среди них: классификация Берцелиуса на металлы и неметаллы, триады Деберейнера, спираль Шанкуртуа, октавы Ньюлендса, таблица Мейера и др.).
Большинство ученых пытались выявить связь между химическими свойствами элементов и их соединений и атомной массой. Но создать классификацию, включающую все известные в то время химические элементы, не удалось. Ни одна из попыток не привела к созданию системы, отражающей взаимосвязь элементов и выявляющей природу их сходства и различия. Открытие Периодического закона и построение Периодической системы химических элементов — заслуга великого русского ученого Д. И. Менделеева.

Рис. 8.
Первоначальный вариант Периодической системы, воспроизведенный на здании в Санкт-Петербурге, где работал Д. И. Менделеев
Третьей предпосылкой открытия Периодического закона послужили решения международного съезда химиков в г. Карлсруэ в 1860 г., когда окончательно утвердилось атомно-молекулярное учение, были приняты первые единые определения понятий молекулы и атома, а также атомного веса, который мы теперь называем относительной атомной массой (Аr). Именно это понятие как неизменную характеристику атомов химических элементов Д. И. Менделеев положил в основу своей классификации. Он писал: «Масса вещества есть именно такое свойство его, от которого должны находиться в зависимости все остальные свойства. Поэтому ближе или естественнее всего искать зависимость между свойствами и сходствами элементов, с одной стороны, и атомными их весами — с другой».
Предшественники Д. И. Менделеева сравнивали между собой только сходные элементы, а поэтому и не смогли открыть Периодический закон. В отличие от них, Д. И. Менделеев обнаружил периодичность в изменении свойств химических элементов, расположенных в порядке возрастания величин их атомных масс, сравнивая между собой все известные ему, в том числе и несходные, элементы.
- общее неизменное свойство атомов всех химических элементов — их атомная масса;
- свойства химических элементов зависят от их атомных масс;
- форма этой зависимости — периодическая.
Рассмотренные выше предпосылки можно назвать объективными, т. е. не зависящими от личности ученого, так как они были обусловлены историческим развитием химии как науки.
Но без личностных качеств великого химика, которые составляют четвертую, субъективную предпосылку открытия Периодического закона, вряд ли он был бы открыт в 1869 г. Если бы его открыл какой-нибудь другой химик, вероятно, это произошло бы намного позже. Энциклопедичность знаний, научная интуиция, умение обобщать, постоянное стремление к познанию неведомого, дар научного предвидения Д. И. Менделеева сыграли свою немалую роль в открытии Периодического закона.
🗊Классификация химических элементов Й. Я. Берцелиус – выдающийся шведский ученый разделил все элементы на металлы и неметаллы.





















Вы можете ознакомиться и скачать Классификация химических элементов Й. Я. Берцелиус – выдающийся шведский ученый разделил все элементы на металлы и неметаллы.. Презентация содержит 24 слайдов. Презентации для любого класса можно скачать бесплатно. Если материал и наш сайт презентаций Вам понравились – поделитесь им с друзьями с помощью социальных кнопок и добавьте в закладки в своем браузере.

Классификация химических элементов Й. Я. Берцелиус – выдающийся шведский ученый разделил все элементы на металлы и неметаллы.






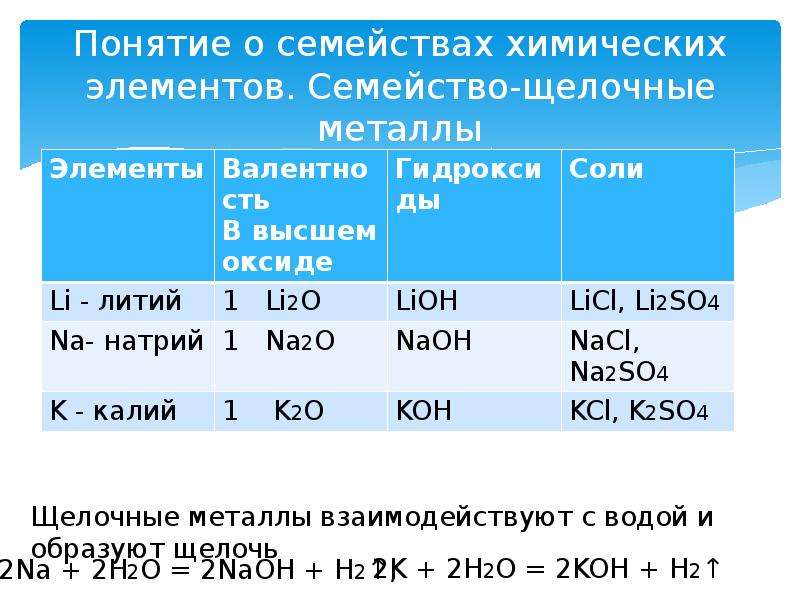
Классификация химических элементов на металлы и неметаллы оказалась неполной Есть элементы, которые образуют оксиды и гидроксиды, проявляющие амфотерные свойства. Амфотерными называют оксиды и гидроксиды, которые взаимодействуют и с кислотами и со щелочами, образуя соль и воду: ZnO – Zn(OH)2, Al2O3 – Al(OH)3, Cr2O3 – Cr(OH)3, BeO – Be(OH)2, PbO – Pb(OH)2.

1.Амфотерные свойства оксида и гидроксида цинка. Оксид цинка взаимодействует с кислотами образуя соль и воду: ZnO + H2SO4 = ZnSO4, следовательно, оксид цинка проявляет свойства основного оксида. Гидроксид цинка тоже реагирует с кислотой, образуя соль и воду: Zn(OH)2 + 2HCl = ZnCl2 + 2H2O, т.е. проявляет свойства основания.

2.Амфотерные свойства оксида и гидроксида цинка Оксид и гидроксид цинка взаимодействуют с сильными щелочами и образуют соль и воду: ZnO + 2NaOH = Na2ZnO2 + H2O оксид цинка проявляет свойства кислотного оксида H2ZnO2 цинкат натрия Zn(OH)2 + 2NaOH = Na2ZnO2 + 2H2O гидроксид цинка проявляет свойства кислоты Эти реакции протекают при сплавлении твердых веществ.




Открытие периодического закона Многие химики: немецкие ученые И. Деберейнер и Л. Мейер, англичанин Дж. Ньюлендс, француз А. Шанкуртуа и другие – предлагали различные варианты классификации химических элементов. Только открытие русским ученым Д. И. Менделеевым одного из фундаментальных законов природы – периодического закона химических элементов – позволило создать единую систему химических элементов.




Слайд 17

Слайд 18

Слайд 19

Слайд 20

Слайд 22
Д. И. Менделеев сформулировал периодический закон так: Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов

Слайд 23
Возникают вопросы: Почему свойства химических элементов, расположенных в порядке возрастания относительных атомных масс, изменяются периодически? Почему в некоторых случаях (Ar –K, Co-Ni, Te-I) расположены не по возрастанию Ar? Д. И. Менделеев предполагал, что вопросы будут решены при выявлении сложной структуры атома.

Слайд 24
Читайте также:
