Классификация металлов химия 9 класс
Обновлено: 02.07.2024
Загрузить презентацию (550 кБ)
Цели урока: познакомить учащихся с основными понятиями темы, со значением металлов в практической жизни человека
Планируемые результаты обучения:
- понятие металлической связи и металлической решетки;
- физические свойства металлов;
- роль металлов в уральском регионе, нахождение металлов в природе и значимость металлов в жизни человека;
- Давать общую характеристику металлов как элемента по положению в периодической системе и строению атома;
- Объяснять физические свойства металлов исходя из строения металлической кристаллической решетки.
Оборудование: презентация, наборы металлов (цинк, медь, алюминий), атласы с картой Свердловской области.
Ход урока
Сегодня мы приступаем к изучению нового раздела неорганической химии – химии металлов. (слайд 1)
М.В. Ломоносов также посвятил металлам вдохновенные строки:
«Металлы подают укрепление и красоту важнейшим вещам, в обществе потребным. Ими защищаемся от нападения неприятеля, ими утверждаются корабли и силою их связаны. Металлы отверзают недро земное к плодородию, служат нам в ловлении земных и морских животных для пропитания нашего…. И кратко сказать, ни едино художество, ни едино ремесло простое употребление металлов миновать не может». (слайд 2)
I. Актуализация знаний
- Что вы знаете о металлах?
- Что вы хотите узнать? (какими свойствами физическими обладают и от чего они зависят? Как на практике используются металлы?)
- Для чего вам это нужно знать? (слайд 3)
Ребята отвечают на вопросы учителя, формируются цели урока
Цели: (слайд 4)
- Выяснить особенности строения металлов
- Познакомиться с физическими свойствами металлов
- Выяснить, от чего зависят физические свойства
- Познакомиться, как связаны физические свойства и использование металлов
Чтобы ответить на эти вопросы мы должны с вами выполнить большую работу по изучению нового материала и приобретению знаний.
II. Изучение нового материала
О каких металлах идет речь:
К группе черных отношусь,
В тяжелой металлургии – главный.
Своею ролью я горжусь –
и в эритроцитах содержусь.
(железо)
Царем металлов меня считают
И благородным называют,
Пленяю я блестящей желтизной,
Ничто не сравнится с моей красотой
(золото)
Свободный – я красный,
В растворах солей – голубой,
В сельском хозяйстве я встречусь с тобой,
Мягко и быстро коваться могу.
Чтобы меня угадать,
Состав малахита и бронзы надо знать.
(медь)
С древних времён по средние века были известны только 7 металлов, которые соотносились с известными тогда планетами: Солнце – золото (Au), Юпитер – олово (Sn), луна – серебро (Ag), Марс – железо (Fe), Меркурий – ртуть (Hg), Сатурн – свинец (Pb), Венера – медь (Cu). (слайд 5)
Древние алхимики говорили: «Семь металлов создал свет по числу семи планет», – и полагали, что под влиянием лучей планет в недрах Земли и рождаются металлы. Само слово «металл», по-видимому, происходит от греческого «металлон», что означает «шахта», «копи».
Не зря в истории человечества выделяют века: медный, бронзовый, железный (слайд 6)
- почему именно в таком порядке?
- в каком веке мы живем?
- какие металлы добываются и перерабатываются на Урале? (слайд 7)
- по карте определите основные месторождения металлических руд и покажите их на карте
На Урале известны многочисленные месторождения высококачественных железных руд (горы Магнитная, Высокая, Благодать, Качканар), медных руд (Медногорск, Карабаш, Сибай, Гай), редких цветных металлов, золота, серебра, платины, лучших в стране бокситов, каменных и калийных солей (Соликамск, Березники, Берёзовское, Важенское, Ильецкое) (слайд 8)
Но металлы есть не только на нашей планете. Так на Луне обнаружено большое количество самородного железа. А где расположены металлы в периодической системе?
Пользуясь ПСХЭ, ответьте на вопрос:
Каких элементов больше: металлов или неметаллов?
Изобразите строение атома:
- группа – литий
- группа – магний
- группа – алюминий
Каковы особенности строения атомов металлов? (слайд 9)
- На внешнем уровне 1–3 электрона – но почему полоний, висмут тоже металлы?
- Большие атомные радиусы. Какой способностью восстановительной или окислительной обладают атомы металлов?
- Легко отдают валентные электроны (восстановительная способность)
Как располагаются металлы в периодической системе? (слайд 10)
1 группа – щелочные металлы(слайд 11)
2 группа – щелочноземельные металлы, (слайд 12)
Как изменяются свойства металлов в ПС?
От чего зависят свойства металлов?
Металлическими называют решётки, в узлах которых находятся атомы и ионы металла, между ними свободные электроны. (Слайд 13)
Учитель: Итак, металл – это вид атомов, способных легко отдавать при химических реакциях электроны, входить в состав химических соединений в виде положительно заряженных ионов, а также образовывать простые вещества с характерными для металлов физическими свойствами. Рассмотрите образцы металлов (на столах пластинки трех металлов – медь, алюминий и цинк)
- в каком агрегатном состоянии находятся металлы?
1. Твердые (исключение ртуть – жидкий металл при комнатной температуре)
- найдите среди предложенных металлов медь. Считается, что металлический цвет – это серебристо – белый или серый. Но все ли металлы такого цвета? Назовите «цветные» металлы.
А алюминий и цинк можно отличить по цвету? А как отличим?
Пластичность – способность изменять свою форму при ударе, прокатываться в тонкие листы, вытягиваться в проволоку.
В чем причина пластичности металлов? В этом нам поможет разобраться следующий опыт: две стеклянные пластинки смачиваем водой и прижимаем друг к другу. Они легко скользят друг по другу, но их трудно разъединить. Прослойка воды имитирует свободные электроны, а значит причина пластичности – также особое строение кристаллической решетки.
Какие еще свойства присущи металлам? электропроводность, теплопроводность, металлический блеск, твердость.
Учитель: Как можно объяснить наличие общих физических свойств у такого большого числа разнообразных простых веществ?
Учащиеся делают вывод: причина в особенностях металлической связи, структуре кристаллов металлического типа.
Учитель: Действительно, электрическая проводимость металлов объясняется движением свободных электронов. Почему при нагревании электрическая проводимость металлов уменьшается? (стр. 30 учебника Габриеляна, 9 класс)
- в чем причина электропроводности металлов, какие металлы самые лучшие проводники тока, что такое сверхпроводимость? – отвечают на вопросы)
Чем обусловлена теплопроводность, и как она изменяется при нагревании? (стр30).
металлический блеск (из-за отражения света от их поверхности). (слайд 14)
Как блеск может применяться на практике?
Высокая отражающая способность позволяет использовать металлы при производстве зеркал, оптических линз, кровельных изделий. Алюминий используется для создания помех в радиолокации, для производства теплостойкой защитной одежды для пожарных.
Другие свойства (слайд 15)
плотность:
Как это свойство применяется на практике?
Многие лёгкие металлы используются для производства лёгких сплавов в машиностроении, авиа – и судостроении. Снижение массы машины даёт преимущества в скорости, дальности, высоте. Тяжёлые металлы для производства гирь, монет, решёток, цепей, тяжёлых машин.
температура плавления:
Тугоплавкие металлы используются для изготовления нитей накаливания электроламп, при производстве жаропрочных сталей.
Твердость
Твердые и мягкие
Ковкость (слайд 16), где используется?
Итак, какими физическими свойствами обладают металлы? (слайд 17) Почему?
III. Закрепление
– Поясните, почему металлы использованы именно таким образом, а не наоборот (слайд 18)
- какие металлы относят к черным, цветным, драгоценным?
- какие металлы самые распространенные на земле? (алюминий, железо, кальций)
IV. Подведение итогов
Металлы

К металлам относится большая часть элементов периодической системы – 82 химических элементов. Какими свойствами они обладают, и чем отличаются от неметаллов?
Общая характеристика
Металлами называют группу элементов, в виде простых веществ, которые обладают металлическими свойствами (пластичность, ковкость, блеск, электронная проводимость и т. д.)
Основное отличие элементов-металлов – они обладают только восстановительными свойствами, а в реакциях могут только окисляться. В соединениях они могут иметь только положительные степени окисления как в элементарных положительно заряженных ионах, так и в сложных ионах, где они образуют положительные центры.
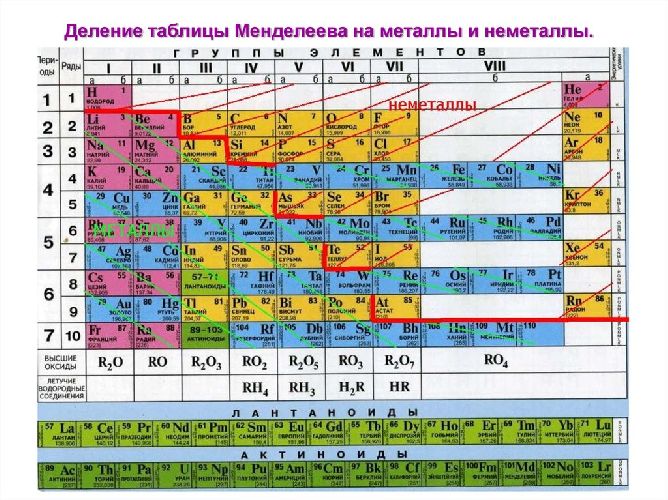
Рис. 1. Список металлов.
Как правило, на внешнем уровне элементов металлов находится небольшое число электронов (1-3), значения электроотрицательности невысокие. К металлам относятся все s-элементы (кроме водорода и гелия), d- и f-элементы, а также p-элементы под чертой бор-астат. Для типичных металлов характерен большой размер атомов, что способствует легкости отдачи валентных электронов. Образующиеся положительные ионы устойчивы, так как имеют завершенную внешнюю электронную оболочку.
Физические и химические свойства
Все металлы, кроме ртути, при нормальных условиях в виде простых веществ находятся в твердом агрегатном состоянии и образуют металлическую кристаллическую решетку.

Рис. 2. Металлы в таблице Д.И. Менделеева.
Таблица «Металлы»
В следующей таблицы представлены группы основных металлов:
| Группа металлов | Металл |
| Щелочные | литий, натрий, калий и т.д. |
| Щелочноземельные | кальций, стронций, барий и т.д. |
| Переходные | уран, титан, железо, платина и т.д. |
| постпереходные | алюминий, свинец, олово и т.д. |
| Тугоплавкие | молибден, вольфрам |
| Цветные | медь, титан, магний и т.д. |
| Благородные | золото, серебро и т.д. |
Металлы пластичны и ковки, особенно если на внешнем электронном уровне атомов по одному электрону: слои атомов перемещаются относительно друг друга без разрушения кристаллической решетки (щелочные металлы, медь, серебро, золото). В атомах непластичных хрупких металлов хрома и марганца – большое число валентных электронов.
Плотность, твердость, температура плавления металлов изменяются в широком диапазоне и зависят от атомной массы, строения атома и геометрии кристаллической решетки. Самый легкий металл – литий (плотность 0,53 г/см 3 ), самый тяжелый – осмий (плотность 22,5 г/см 3 ). Металлы с плотностью больше 5 г/см 3 относят к тяжелым, меньше 5 г/см 3 – к легким металлам.
Самая низкая температура плавления у ртути (-39 градусов по Цельсию), самый тугоплавкий металл – вольфрам (температура плавления 3410 градусов по Цельсию.) Энергия атомизации вольфрама составляет 836 кДж/моль, а температура кипения его 5930 градусов.
Металлы вступают в реакцию как с простыми, так и со сложными веществами. Как типичные восстановители металлы реагируют почти со всеми неметаллами-окислителями (кислород, сера, азот и т. д.):
Также металлы реагируют с такими сложными веществами, как оксиды и гидроксиды, разбавленные растворы кислот, с растворенными в воде щелочами.
В пределах одного и того же периода металлические свойства ослабевают, а неметаллические усиливаются; в пределах одной и той же группы (в главной подгруппе) металлические свойства усиливаются, а неметаллические ослабевают

Рис. 3. Металлы главных подгрупп.
Нахождение металлов и способы их получения
Самый распространенный на земле элемент-металл – алюминий. За ним следуют железо, кальций, натрий.
Некоторые металлы встречаются в природе в самородном состоянии (золото, ртуть, платина), но в основном они находятся в природе в виде оксидов и солей.
Получение металлов происходит с помощью металлургии (получение из руд), пирометаллургии (получение с помощью реакции восстановления при высокой температуре), гидрометаллургии (извлечение из руд в виде растворимых соединений), электрометаллургии (получение металлов электролизом расплавов и растворов их соединений).
Что мы узнали?
Металлы – вещества, которые обладают высокой электро- и теплопроводностью, ковкостью, пластичностью и металлическим блеском. В данной статье по химии 9 класса рассматриваются их физические и химические свойства, формулы класса металлов, а также способы получения.
Физические свойства металлов

Физические свойства металлов отличают их от неметаллов. Все металлы, кроме ртути, – твёрдые кристаллические вещества, являющиеся восстановителями в окислительно-восстановительных реакциях.
Положение в таблице Менделеева
Металлы занимают I-II группы и побочные подгруппы III-VIII групп. Металлические свойства, т.е. способность отдавать валентные электроны или окисляться, увеличиваются сверху вниз по мере увеличения количества энергетических уровней. Слева направо металлические свойства ослабевают, поэтому наиболее активные металлы находятся в I-II группах, главных подгруппах. Это щелочные и щелочноземельные металлы.
Определить степень активности металлов можно по электрохимическому ряду напряжений. Металлы, стоящие до водорода, наиболее активны. После водорода стоят слабоактивные металлы, не вступающие в реакцию с большинством веществ.
Строение
Вне зависимости от активности все металлы имеют общее строение. Атомы в простом металле расположены не хаотично, как в аморфных веществах, а упорядоченно – в виде кристаллической решётки. Удерживает атомы в одном положении металлическая связь.
Такой вид связи осуществляется за счёт положительно заряженных ионов, находящихся в узлах кристаллической ячейки (единицы решётки), и отрицательно заряженных свободных электронов, которые образуют так называемый электронный газ. Электроны отделились от атомов, превратив их в ионы, и стали перемещаться в решётке хаотично, скрепляя ионы вместе. Без электронов решётка бы распалась за счёт отторжения одинаково заряженных ионов.
Различают три типа кристаллической решётки. Кубическая объемно-центрированная состоит из 9 ионов и характерна хрому, железу, вольфраму. Кубическая гранецентрированная включает 14 ионов и свойственная свинцу, алюминию, серебру. Из 17 ионов состоит гексагональная плотноупакованная решётка цинка, титана, магния.
Свойства
Строение кристаллической решётки определяет основные физические и химические свойства металлов. Металлы блестят, плавятся, проводят тепло и электричество. Промышленность и металлургия нашли применение физическим свойствам металлов в изготовлении деталей, фольги, корпусов машин, зеркал, бытовой и промышленной химии. Особенности металлов и их использование представлены в таблице физических свойств металлов.
Свойства
Особенности
Примеры
Применение
Способность отражать солнечный свет
Наиболее блестящими металлами являются Hg, Ag, Pd
Лёгкие – имеют плотность меньше 5 г/см 3
Na, K, Ba, Mg, Al. Самый лёгкий металл – литий с плотностью 0,533 г/см 3
Изготовление облицовки, деталей самолётов
Тяжёлые – имеют плотность больше 5 г/см 3
Sn, Fe, Zn, Au, Pb, Hg. Самый тяжёлый – осмий с плотностью 22,5 г/см 3
Использование в сплавах
Способность изменять форму без разрушений (можно раскатать в тонкую фольгу)
Наиболее пластичные – Au, Cu, Ag. Хрупкие – Zn, Sn, Bi, Mn
Формовка, сгибание труб, изготовление проволоки
Мягкие – режутся ножом
Изготовление мыла, стекла, удобрений
Твёрдые – сравнимы по твёрдости с алмазом
Самый твёрдый – хром, режет стекло
Изготовление несущих конструкций
Легкоплавкие – температура плавления ниже 1000°С
Hg (38,9°С), Ga (29,78°С), Cs (28,5°С), Zn (419,5°C)
Производство радиотехники, жести
Тугоплавкие – температура плавления выше 1000°С
Cr (1890°С), Mo (2620°С), V (1900°С). Наиболее тугоплавкий – вольфрам (3420°С)
Изготовление ламп накаливания
Способность передавать тепло другим телам
Лучше всего проводят ток и тепло Ag, Cu, Au, Al
Приготовление пищи в металлической посуде
Способность проводить электрический ток за счёт свободных электронов
Передача электричества по проводам
Из урока 9 класса узнали о физических свойствах металлов. Кратко рассмотрели положение металлов в периодической таблице и особенности строения кристаллической решётки. Благодаря строению металлы обладают пластичностью, твёрдостью, способностью плавиться, проводить электрический ток и тепло. Свойства металлов неоднородны. Различают лёгкие и тяжёлые металлы, лёгкоплавкие и тугоплавкие, мягкие и твёрдые. Физические свойства используются для изготовления сплавов, электрических проводов, посуды, мыла, стекла, конструкций различной формы.
Классификация металлов химия 9 класс
Положение в периодической системе
1. Типичные металлы – s - элементы: IА - IIА группы (искл.Н)
2. Нетипичные металлы: р-элементы: IIIА гр. (кроме В), IV гр – Ge , Sn , Pb ; V гр.- Sb , Bi ; VI гр.- Po .
3. Переходные металлы: d -элементы – все элементы побочных подгрупп; f - элементы: лантоноиды, актиноиды.
У атомов металлов небольшое количество электронов (ē) на внешнем энергетическом уровне и большие радиусы атомов ( R )
Кристаллическая решетка – металлическая: состоит из чередующихся в пространстве атомов и положительных ионов, внутри-общие электроны– «электронный газ».
Тип химической связи – металлическая.
Металлические (восстановительные) свойства в группе (А п/гр) усиливаются (растет R атома , и электроны легче отрываются), в периоде – ослабляются (растет заряд ядра, электроны внешнего уровня сильнее удерживаются).
Восстановительные свойства уменьшаются (активность металлов уменьшается)
Li, Cs,Rb,K, Ba, Ca, Na, Mg, Al, Mn, Cr, Zn, Fe, Cd, Co, Sn, Ni, Pb, H2, Cu, Ag, Hg, Pt, Au
Физические свойства
Наличие свободных электронов обуславливает:
- Металлический блеск (непрозрачность)-ē отражают световые лучи, большинство металлов в порошкообразном состоянии теряют свой блеск, за исключением алюминия и магния.
- Цвет Большинство металлов светло-серого цвета (Исключение: золото - желтое, медь- красная, цезий - светло-желтый)
- Электропроводность (свободные ē приобретают направленное движение) Лучшие проводники электричества: Cu , Ag , далее Au , Al , Fe. С повышением температуры – электропроводность понижается, т.к. усиливаются колебания атомов, электронам трудно перемещаться.
- Теплопроводность
- Пластичность
- Плотность ( Самый легкий - Li , самые тяжелые - Os и Ir)
- Температура плавления ( самый легкоплавкий - Hg −39 °C , самый тугоплавкий – W 3410 °C )
- Твердость (щелочные металлы можно резать ножом, самый твердый – Cr) Большинство металлов твердые, за исключением ртути и ,условно, франция.
Получение
· Пирометаллургия- получение из руд при высоких температурах при взаимодействии с хорошими восстановителями (H2, CO,C и др.)
Выделяют два этапа: 1) Обжиг металлсодержащей руды; 2) Получение чистого металла
· Металлотермия- восстановление металлами (алюминотермия, кальцийтермия, магнийтермия и т.д.):
· Гидрометаллургия- соединения металлов переводят в раствор и восстанавливают:
· Электрометаллургия – электролиз растворов и расплавов:
Запомнить: Алюминий получают из оксида (глинозема, бокситов и т.д.) в расплаве криолита Na 3 AlF 6
Запомнить: Металлы никогда не вытесняют из Н N О3(к) H 2 SO 4(к) водород; они пассивируют Al , Cr , Fe
в) Взаимодействие с солями ( более активные металлы вытесняют менее активные из растворов их солей )
CuCl 2 + Fe = FeCl 2 + Cu;
- но если металл взаимодействует с водой, то
CuCl 2 +2К +2 H 2 O = 2К Cl + Cu (ОН)2↓+ Н2↑; т.к.: 1) 2К + 2 H 2 O = 2КОН+ Н2
2) CuCl 2 +2КОН= Cu (ОН)2↓+ 2К Cl
г) Взаимодействуют с оксидами металлов и неметаллов:
е)Другое:
Между собой образуют интерметаллические соединения, сплавы: Na 2 Sb
С органическими веществами ( со спиртами, фенолами, карбоновыми кислотами и др. )
Читайте также:
