Коэффициент выхода металла по току
Обновлено: 30.06.2024
Основными показателями электролиза являются выход по току, удельный расход электроэнергии, и расход углерода на получение алюминия.
Выход по току. Между количеством прошедшего через раствор электричества и количеством выделяющегося элемента существует строго определенное соотношение. Это связано с тем, что ионы имеют разные заряды. Например, для восстановления иона водорода требуется один электрон, а для иона алюминия - три электрона:
Фарадей установил, что количество выделенного при электролизе вещества прямо пропорционально силе тока Iи времени его прохождения τ, т.е. прямопропорционально количеству прошедшего электричества:
Это первый закон Фарадея.
Фарадей определил также, что при прохождении через растворы электролитов одинакового количества электричества масса выделившегося вещества пропорциональна его химическому эквиваленту. Это второй закон Фарадея. Для получения одного химического эквивалента вещества, выраженного в граммах, требуется пропустить 96500 кулон электричества. Это количество электричества называют числом Фарадея или сокращенно "фарадеем".
Количество вещества в граммах, получающееся в результате деления атомной массы элемента на валентность, называется грамм-эквивалентом. Например для алюминия, атомная масса которого равна 27, а валентность 3, грамм-эквивалент равен 27 / 3 = 9г. Ели поделить грамм-эквивалент на 96500 к, то получаем электрохимический эквивалент данного вещества. Для алюминия он составляет:
j = 9/ 96500 = 0,0000933 г/к.
Практически чаще пользуются электрохимическим эквивалентом, выраженным в граммах на один ампер-час. 1 ампер-час равен 3600 кулонам. Следовательно, один фарадей содержит:
96500 / 3600 = 26,8 а-ч.
Тогда электрохимический эквивалент алюминия, выраженный в г/А-ч, будет равен:
9 / 26,8 = 0,336 г/А-ч.
Таким образом, при прохождении тока силой 1A в течении 1 сек выделяется 0,336 г алюминия.
Зная законы Фарадея, можно подсчитать теоретическое количество вещества М, которое должно выделиться при электролизе в течении определенного времени:
где I - сила тока,А;
j - электрохимический эквивалент, г/А-ч;
τ - время электролиза, час.
Но на практике количество вещества выделяется меньше, чем по закону Фарадея. Отношение количества практически полученного вещества к количеству теоретическому называется ВЫХОДОМ ПО ТОКУ.
Следовательно, выход по току определяется по формуле:
Наличие рассмотренных выше побочных процессов приводит к потере части электроэнергии, подаваемой на электролизер, и снижает выход по току. Поэтому на алюминиевых электролизерах выход по току составляет 85 – 90%. Рассмотрим условия, которые могут повышать и снижать выход по току.
Температура электролита. Повышение температуры приводит к снижению выхода по току, так как в этом случае увеличивается растворение алюминия в электролите, возрастает циркуляция металла и электролита, увеличивается скорость окисления алюминия анодными газами. Практические данные показывают, что при повышении температуры на 1°С выход по току снижается на 0,2 - 0,3%. Поэтому процесс электролиза необходимо вести при возможно низкой температуре.
Плотность тока существенно влияет на выход по току. Это связано с тем, что с повышением плотности тока увеличивается выделение металла на катоде, т.е. повышается производительность электролизера, а потери, связанные с протеканием побочных процессов, остаются примерно на прежнем уровне. Поэтому относительные потери металла уменьшаются. Кроме того, при низкой плотности тока возможен частичный разряд ионов алюминия:
Такое частичное восстановление алюминия приводит к дополнительным потерям тока. Практически установлено, что повышение плотности тока на 0,1A/см 2 при сохранении температуры электролиза на одном уровне приводит к увеличению выхода по току примерно на 2%.
Межполюсное расстояние. С увеличением МПР выход по току повышается, так как затрудняется перенос растворенного алюминия от катода к аноду и его окисление, установлено, что уменьшение межполюсного расстояния на I см приводит к снижению выхода по току примерно на 3%.
Таким образом, на электролизере для достижения высокого выхода по току необходимо увеличивать плотность тока и МПР. Но эти параметры можно повышать только до определенного значения, чтобы не вызвать повышения температуры электролита и расхода электроэнергии. Поэтому анодную плотность тока, в зависимости от типа электролизера, поддерживают в пределах 0,6 - 1,1 А/см 2 , а МПР в пределах 4,2 - 5,5 см.
Состав электролита влияет на изменение температуры плавления электролита, которая уменьшается за счет добавок солей магния, кальция, лития и снижения криолитового отношения (NaF/AlF6).Поэтому добавки фторсолей следует вводить в электролит в пределах, предусмотренных технологической инструкцией.
Высота слоя металла. Чем выше плотность тока при одинаковых конструктивных размерах электролизера, тем большим должен быть уровень металла. Высокий уровень металла способствует выравниванию теплового поля под анодом электролизера за счет высокой теплопроводности алюминия и отвода тепла через боковые стороны катодного устройства. Уменьшение уровня металла при прочих равных условиях приводит к снижению выхода по току.
Влияние на выход по току таких факторов, как конструктивные особенности и геометрические размеры электролизера, способы его обслуживания, обусловлено влиянием этих факторов на анодную и (особенно) катодную плотность тока. Практика эксплуатации электролизеров с предварительно обожженными анодами показывает, что при прочих равных условиях выход по току при работе на электролизерах этой конструкции выше, чем на электролизерах с самообжигающимся анодом. Это объясняется лучшими условиями теплоотдачи и более равномерным температурным полем в междуэлектродной зоне.
Большое влияние на величину выхода по току оказывают боковые настыли в шахте ванны, отсутствие которых приводит к утечкам тока, и, следовательно, к снижению выхода по току.
Выход по энергии. На получение одной тонны алюминия расходуется 16000 - 17000кВт*ч. Расход электроэнергии на одну тонну алюминия (g, кВт*ч) может быть определен отношением количества затраченной энергии (А, кВт*ч) к полученному при этом количеству алюминия (Q ,т).
Если: А = I*U*τ *10 -3 ;
то: g = I*U*τ*10 -3 / [0,336*I*τ* ηT*10 -3 ] = U*10 3 / [0,336* ηT],
где I - сила тока, А;
U- среднее напряжение, В;
Hа практике часто пользуются показателем расхода электроэнергии называемым выходом по энергии.
За выход по энергии принимают количество алюминия, полученное на каждый киловатт-час затраченной электроэнергии (ηэн г/кВт*ч):
т.е. выход по энергии прямопропорционален выходу по току, и обратно пропорционален среднему напряжению на ванне.
Основные показатели процесса электролиза
Порядок назначения режимов электрохимической обработки.
Цель работы: назначить режимы ЭХО при прошивании глухого отверстия. Варианты заданий приведены в таблице 4.
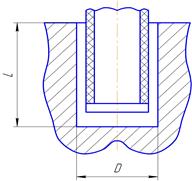
1. Выбрать электролит и выписать его характеристики (см. приложения 1 и 2).
Для стали принимают электролиты NaCl с концентрацией 8…18% или NaNO3 с концентрацией 5…15%
Для титановых сплавов принимают электролиты NaCl 5…15% с подогревом до tэл = 40…50ºС
2. Выбрать материал ЭИ из предложенных в таблице 2.
3. Рассчитать удельную проводимость электролита:
χ = χ0 ( 1 + α ( T – 291),
χ0 - удельная проводимость электролита при 18ºС; см.приложения 3 и 4.
4. Выбрать напряжение на электродах.
Для стали принимаем U = 9…18В, для титановых сплавов – U = 25…30 В.
5. Выбрать межэлектродный промежуток.
Значение межэлектродного промежутка выбираем из диапазона
6. Рассчитать среднюю плотность тока:
где F – площадь поперечного сечения электрода-инструмента.
7. Рассчитать скорость подачи электрода-инструмента, м/мин, по формуле
8. Рассчитать основное время обработки отверстия, мин:
9. Выбрать оборудование, пользуясь приложением 6.
Таблица 4. Варианты заданий.
| № варианта | Форма и размер сечения отверстия, мм | Глубина отверстия L, мм | Габариты детали, мм | Материал детали |
| 1. | Круг 50 | 60 | 150×150×80 | ВТ8 |
| 2. | Круг 20 | 50 | 100×300×70 | 45 |
| 3. | Круг 25 | 60 | 100×150×80 | 40Х |
| 4. | Круг 28 | 30 | 150×300×70 | 12ХГН3 (незакаленная) |
| 5. | Круг 30 | 40 | 150×400×100 | У10 (незакаленная) |
| 6. | Круг 35 | 70 | 160×300×50 | У10 (закаленная) |
| 7. | Круг 40 | 100 | 160×200×80 | 12Х18Н9Т |
| 8. | Круг 35 | 80 | 160×250×120 | 30Х10Г10 |
| 9. | Квадрат 45 | 40 | 100×100×100 | 5ХНВА (незакаленная) |
| 10. | Квадрат 50 | 60 | 120×120×100 | 3Х2В8 (незакаленная) |
| 11. | Квадрат 70 | 80 | 120×120×100 | 35ХГС |
| 12. | Квадрат 30 | 100 | 150×200×150 | ШХ15 (закаленная) |
| 13. | Квадрат 25 | 30 | 200×200×100 | ВТ8 |
| 14. | Квадрат 32 | 40 | 150×300×60 | ВТ14 |
| 15. | Правильный шестиугольник 40 | 100 | 300×200×150 | Al |
| 16. | Правильный шестиугольник 100 | 100 | 200×200×200 | ХН62ВНКЮ |
| 17. | Правильный шестиугольник 150 | 200 | 300×300×220 | 12ХН3А |
| 18. | Правильный шестиугольник 50 | 200 | 300×400×250 | 35ХГС (закаленная) |
| 19. | Правильный шестиугольник 105 | 20 | 220×200×50 | ВТ3-1 |
| 20. | Равносторонний треугольник 200 | 100 | 300×250×120 | ВТ6 |
| 21. | Равносторонний треугольник 100 | 200 | 300×200×250 | 12Х18Н9Т |
| 22. | Равносторонний треугольник 50 | 100 | 100×100×150 | ШХ15 |
| 23. | Равносторонний треугольник 80 | 150 | 100×100×200 | ВК15 |
| 24. | Круг 100 | 100 | 150×150×120 | ВК10 |
| 25. | Круг 180 | 100 | 200×200×130 | Al |
| 26. | Круг 300 | 200 | 400×400×250 | ШХ15 (закаленная) |
| 27. | Круг 400 | 150 | 450×450×180 | ВТ8 |
| 28. | Равносторонний треугольник 30 | 50 | 100×100×100 | ВТ14 |
Приложение 1. Удельная электропроводность х (См/м) электролитов в зависимости от концентрации компонентов при tэ = 18 °С
Значение χ при концентрации компонентов, %
Примечание. В скобках указано фактическое значение концентрации компонентов, которое отличается от взятого за основу (в заголовке таблицы).
Приложение 2. Максимальные значения удельной электропроводности к некоторых электролитов при tэ=18°С.
Выход по току и по энергии при электролизе криолито-глиноземных расплавов
Выходом по току называют отношение количества металла, фактически полученного при электролизе, к его количеству, теоретически ожидаемому согласно закону Фарадея (за то же время).
На выход по току при электролизе криолито-глиноземных расплавов оказывают влияние следующие факторы, температура электролита, междуполюсное расстояние, плотность тока, состав электролита, качество обслуживания ванн.
Влияние температуры. Температура электролита является наиболее важным фактором, влияющим на выход по току. Повышение температуры на каждые 10° С понижает выход по току в заводских условиях на 3—4%.

На рис. 53 показана кривая зависимости выхода по току от температуры. Согласно этой кривой, при температуре 940° С выход по току достигает 95%. При повышении температуры до 980° С выход по току падает до 74%. Эти результаты были получены в лабораторных условиях. Аналогичные результаты дает исследование зависимости выхода по току от температуры электролита и на промышленных ваннах.
Отсюда следует, что процесс электролиза следует вести при возможно низкой температуре, не допуская перегрева электролита. Такой температурой является 940—975° С. Дальнейшее снижение температуры электролита может привести к нарушению нормальной работы ванны.
Влияние между полюсного расстояния. В алюминиевой ванне расстояние между нижней поверхностью анода и зеркалом металла на катоде называют междуполюсным расстоянием.
Зависимость выхода по току от междуполюсного расстояния при постоянной плотности тока 1 а/см2 и температуре 1000° C приведена на рис. 54, на котором видно, что с увеличением междуполюсного расстояния выход по току возрастает. Наоборот, сильное уменьшение междуполюсного расстояния (до 3 см и ниже) приводит к резкому уменьшению выхода по току. Увеличение междуполюсного расстояния до величины более 6 см, как видно на рис. 54, нецелесообразно, так как при дальнейшем увеличении междуполюсного расстояния выход по току возрастает незначительно.
С другой стороны, от величины междуполюсного расстояния зависит падение напряжения в электролите, которое может быть выражено следующим образом:
где ρ — сопротивление электролита, ом. см;
D — плотность тока в электролите, а/см2;
l — междуполюсное расстояние, см.
Согласно этому выражению, с увеличением междуполюсного расстояния увеличивается падение напряжения в электролите и, следовательно, увеличивается расход электроэнергии. Поэтому с точки зрения снижения расхода электроэнергии, следует работать с малым междуполюсным расстоянием. Обычно работают с междуполюсным расстоянием 4—6 см.
Влияние плотности тока. Зависимость выхода по току от плотности тока при постоянном между полюсном расстоянии 5 см и температуре 1000° С показана на рис. 55.

Выход по току, как видно па рис. 55, возрастает с повышением плотности тока. Кроме того, чем выше плотность тока (при данной величине тока), тем меньше размеры ванн и ниже стоимость их сооружения.
С другой стороны, с увеличением плотности тока увеличивается напряжение на ванне.
Поэтому, с точки зрения снижения расхода электроэнергии, выгоднее работать на пониженных плотностях тока.
В современной практике анодную плотность тока в зависимости от конструкции ванн принимают в пределах 17—1,1 а/см2.
Практика последних лет показала возможность значительного увеличения величины тока на действующих ваннах. Это вместе с усовершенствованием технологии процесса электролиза позволило значительно увеличить производительность действующих заводов с одновременным улучшением основных показателей процесса (выхода по току и выхода по энергии).
Влияние состава электролита. Большое влияние на выход по току оказывает состав электролита. Молекулярное отношение фтористого натрия ко фтористому алюминию в криолите равно 3.
В электролите алюминиевой ванны оно меньше трех и составляет, примерно 2,2—2,6.
Избыток фтористого алюминия уменьшает вероятность разряда ионов натрия на катоде, несколько снижает растворимость алюминия в электролите и температуру плавления электролита. Все это оказывает благоприятное влияние на выход по току.
Благоприятное влияние на выход по току оказывает добавка фтористого кальция в количестве до 7%. Фтористый кальций снижает температуру плавления электролита и позволяет вести процесс при более низкой температуре. Кроме того, он снижает растворимость алюминия в электролите, что также улучшает выход по току.
Аналогичное влияние на выход по току оказывает добавка фтористого магния.
Влияние качества обслуживания ванн. Необходимым условием достижения высоких показателей при электролизе является тщательное соблюдение технологического режима. Любое нарушение нормальной работы ванны может привести к снижению выхода по току.
Во избежание утечек тока через боковую угольную футеровку ванны футеровка должна быть защищена гарниссажем. При отсутствии последнего часть тока идет через боковую футеровку и так как разряд ионов алюминия непосредственно на угольной поверхности приводит к образованию карбида, а не металлического алюминия, то эта часть тока проходит через ванну бесполезно.
В нижней части рабочего пространства ванны боковой гарниссаж переходит в подовые настыли, которые приводят к уменьшению площади катода и повышению катодной плотности тока.
С уменьшением поверхности катода уменьшается количество металла, растворяющегося в электролите в единицу времени, и выход по току возрастает.
Положительное влияние на выход по току оказывает также высокий уровень металла в ванне. Чем больше металла в ванне, тем лучше происходит усреднение температур в ней и уменьшаются местные перегревы. Кроме того, чем толще слой металла в ванне, тем больше она может отдать тепла в окружающую среду, что позволяет работать при более высокой плотности тока. Последняя, как мы знаем, обеспечивает и более высокий выход по току.
Оптимальный уровень металла в ванне определяется технологической инструкцией в зависимости от конструкции ванны и технологического режима. В ваннах с непрерывными самообжигающимися анодами он должен быть не ниже 20—25 см, в многоанодных ваннах, где имеются лучшие условия охлаждения, уровень металла может быть ниже.
Уменьшение выхода по току может произойти также вследствие коротких замыканий анода и катода. Такие замыкания происходят через отколовшиеся куски анода, угольную пену при ее накоплении под анодом и т. п.
Угольная пена, оседая на гарниссаже ванны, делает его электропроводным, что также может вызвать утечки тока.
Выход по энергии. Под выходом по энергии обычно понимают степень использования электрической энергии при производстве данного продукта. Эта величина равна отношению теоретического удельного расхода электроэнергии к фактическому ее расходу (и часто выражается в процентах).
Однако в производственной практике при получении алюминия выход по энергии выражают несколько иначе, а именно — количеством граммов алюминия, полученных на каждый киловатт-час затраченной электроэнергии. В этом случае его определяют по формуле
где ηэ — выход по энергии, г/квт*ч;
ηт — выход по току, %;
V — среднее напряжение на ванне, в.
Из выражения выхода по энергии видно, что он тем выше, чем выше выход по току и чем ниже напряжение на ванне. Следовательно, борьба за повышение выхода по энергии должна идти как по пути повышения выхода по току, так и по пути снижения напряжения на ванне.
Выход по току при получении алюминия и влияние на него различных факторов мы кратко уже рассмотрели. Чем определяется величина напряжения на ванне — будет рассмотрено ниже.
Следует отметить, что по приведенной выше формуле определяется так называемый выход по энергии постоянного тока, т. е. при учете только электроэнергии, затраченной непосредственно в ванне.
Однако электростанция, подающая электроэнергию на подстанцию электролизного цеха, должна выработать больше энергии, чем ее расходуется непосредственно в ваннах. Объясняется это тем, что часть энергии переменного тока, подаваемого электростанцией, теряется в трансформаторах и ртутных выпрямителях подстанции. Поэтому, если учесть и эти потери, то выход алюминия на 1 квт*ч переменного тока будет несколько ниже, чем определяемый по приведенной формуле.
Чтобы найти выход на 1 квт*ч переменного тока, надо выход по энергии постоянного тока умножить на суммарный коэффициент полезного действия понижающей и ртутно-преобразовательной подстанций. Обычно он бывает порядка 0,92—0,94.
Законы Фарадея. Выход продукта по току
Количество веществ, образующихся при электролизе на электродах, можно рассчитать, пользуясь двумя законами электролиза, установленными Фарадеем в 1833 г. которые с учетом современной терминологии можно сформулировать в следующем виде:
1) количество вещества, испытавшего электрохимические превращения на электроде, прямо пропорционально количеству прошедшего электричества;
2) массы прореагировавших на электродах веществ при постоянном количестве электричества относятся друг к другу как молярные массы их эквивалентов.
Для расчетов используют математическое выражение обобщенного закона Фарадея:
| где: | Э – эквивалентная масса вещества (молярная масса эквивалента); F– постоянная Фарадея, равная 96500 Кл/моль;. I – сила тока, А; t – время проведения электролиза, с; М – молярная масса вещества; n – число отданных или принятых электронов; К – электрохимический эквивалент вещества. |
Практический расход тока при электролизе вследствие протекания побочных процессов (взаимодействие полученных веществ с электродом или электролитом) превышает его количество, рассчитанное согласно закону Фарадея. Следовательно, практическая масса полученных веществ отличается от теоретически рассчитанной. Отношение массы практически полученного вещества к теоретически рассчитанной массе, выраженное в процентах, называется выходом вещества по току:
Примеры решения типовых задач.
Пример 1.Ряд активности металлов, электродных потенциалов.
Задача 1. Медная пластинка массой 10 г была погружена в раствор нитрата серебра, затем промыта водой и высушена. Масса ее оказалась равной 11,0 г. Сколько серебра из раствора выделилось на пластинке?
Решение. Для решения этой задачи необходимо знать стандартные электродные потенциалы металлов, т.е. место их в ряду напряжений (ряду активности металлов Бекетова).
Из этих положительных потенциалов стандартный электродный потенциал меди менее положителен, следовательно, пойдёт реакция вытеснения:
Для того чтобы вычислить количество серебра, выделившегося на медной пластинке, надо помнить, что медная пластинка в этой реакции и сама растворяется, теряя в массе.
Обозначим количество растворившейся меди через x г, тогда масса медной пластинки с учётом её растворения будет (10-х) г, масса выделившегося серебра на основе реакции:
64,0 г Cu – 2 ∙ 108 г Ag
х г Cu – (1+х) г Ag
216х =64+64х, 152x=64, x=0,42 г.
Таким образом, в течение реакции растворилось 0,42 г меди и выделилось 1,0 + 0,42 = 1,42 г серебра.
Пример 2.Работа гальванического элемента и расчёт ЭДС.
Задача 1. Напишите уравнения реакций, происходящих при работе гальванического элемента, состоящего из цинковой и серебряной пластин, опущенных в растворы своих солей с концентрацией катионов, равной 1 моль/л.
Решение. Стандартные электродные потенциалы цинкового и серебряного электродов соответственно равны:
Металл, имеющий более отрицательное значение электродного потенциала при работе гальваничеcкого элемента, является анодом. В данном случае протекают реакции:
т.е. цинк, являясь анодом, растворяется при работе гальваничеcкого элемента, а серебро осаждается в виде металла на катоде. ЭДС гальванического элемента равна
Пример 3. Зависимость электродных процессов от концентрации.
Задача 1. Рассчитайте, чему равна ЭДС элемента, составленного из медной и магниевой пластин, опущенных в растворы своих солей, если концентрация катиона у анода равна 0,1 моль/л, а у катода – 0,001 моль/л.
Решение. Стандартные электродные потенциалы магниевого и медного электродов соответственно равны:
Следовательно, анодом будет магниевый электрод, катодом – медный. Электродный потенциал металла, опущенного в раствор с любой концентрацией катиона в растворе, определяют по формуле Нернста:
где: с – концентрация катиона, моль/л;
п – число электронов, принимающих участие в реакции.
Отсюда потенциал магниевого электрода
= –2,38 + lg10 –1 = –2,38 + 0,029(–1) = –2,409 В.
Потенциал медного электрода
= +0,34 + lg10 –3 = +0,34 + 0,029(–3) = +0,253 В.
Тогда для гальванического элемента
Пример 4. Определение возможности протекания реакции в гальвани-ческом элементе.
Задача 1. Исходя из величины стандартных электродных потенциалов и значения энергии Гиббса ΔG о 298, укажите, можно ли в гальваническом элементе осуществить следующую реакцию:
Fe 0 + Cd 2+ = Fe 2+ + Cd 0 .
Решение. Надо составить схему гальванического элемента, отвечающего данной реакции. В этой реакции происходит восстановление ионов кадмия и окисление атомов железа:
Fe 0 – 2е = Fe 2+
Cd 2+ + 2е = Cd 0 .
Пользуясь таблицей стандартных электродных потенциалов, определяем ЭДС этого гальваничекого элемента:
Изменение величины энергии Гиббса с величиной ЭДС связано соотношением:
где: – изменение величины энергии Гиббса;
n – число электронов, принимающих участие в реакции;
F–число Фарадея;
– ЭДС гальванического элемента.
Находим = –2∙96500∙0,04= – 7720 Дж.
Пример 5. Расчет количества вещества, выделившегося при электролизе.
Задача 1. Какая масса меди осаждается на катоде при прохождении тока силой 2 А через раствор медного купороса в течение 15 минут?
Решение. Сначала нужно узнать количество электричества, прошедшее через раствор, выразив его в кулонах (1Кл=А . с). Количество электричества Q=I =2 . 15 . 60=1800 Кл. Молярная масса эквивалента меди (II) равна 64,0/2=32 г/моль. Следовательно:
| 96500 Кл – 32 г |
| 1800 Кл – х г |
Пример 6. Определение электрохимического эквивалента и выхода по току.
Задача 1. При электролизе водного раствора AgNO3 в течение 50 минут при силе тока 3А выделилось 9,6 г серебра. Электролиз проводился с растворимым анодом. Напишите уравнение реакций катодного и анодного процессов и определите электрохимический эквивалент серебра в г/Кл и г/А . ч и выход по току.
Решение. Нитрат серебра диссоциирует:
Процессы, протекающие на электродах:
Молярная масса эквивалента Ag О =108 г/моль.
Определяем массу серебра, которая выделилась бы теоретически при прохождении через раствор данного количества электричества:
Читайте также:
