Концентрация валентных электронов в металлах таблица
Обновлено: 04.10.2024
Проведено сопоставление физико-химических свойств 72 металлов в жидком состоянии со средней электронной плотностью валентных электронов. Показано, что такие свойства, как температура кипения, теплота испарения, температура, при которой давление пара достигает заданной величины, вязкость и ее энергия активации, поверхностное натяжение и его тем пературный коэффициент, температурный коэффициент электропроводности и плотности, сжимаемость, число ядер и число валентных электронов в единице объема, изменение объе ма при плавлении, коэффициент объемного расширения, удовлетворительно коррелируют со средней электронной плотностью валентных электронов. Не обнаружено корреляции со сред ней электронной плотностью валентных электронов у таких свойств, как плотность, теплои электропроводность и теплоемкость.
Похожие темы научных работ по физике , автор научной работы — Л. Т. Бугаенко, С. М. Рябых
Анизотропия, температурный и барический коэффициенты поверхностной энергии полиморфных фаз щелочных металлов
Поверхностная и межфазная энергии граней кристаллов p-металлов на границах с собственными паром и расплавом
Расчет поверхностной энергии граней кристаллов полиморфных фаз щелочноземельных металлов и ее температурного и барического коэффициентов
Текст научной работы на тему «Средняя электронная плотность атомных валентных электронов и физико-химические свойства элементов. II. Свойства металлов в жидком состоянии»
РАДИАЦИОННАЯ ХИМИЯ УДК 541.1
СРЕДНЯЯ ЭЛЕКТРОННАЯ ПЛОТНОСТЬ АТОМНЫХ ВАЛЕНТНЫХ ЭЛЕКТРОНОВ И ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА ЭЛЕМЕНТОВ. II. СВОЙСТВА МЕТАЛЛОВ В ЖИДКОМ СОСТОЯНИИ
Л. Т. Бугаенко, С. М. Рябых*
(лаборатория радиационной химии)
Проведено сопоставление физико-химических свойств 72 металлов в жидком состоянии со средней электронной плотностью валентных электронов. Показано, что такие свойства, как температура кипения, теплота испарения, температура, при которой давление пара достигает заданной величины, вязкость и ее энергия активации, поверхностное натяжение и его температурный коэффициент, температурный коэффициент электропроводности и плотности, сжимаемость, число ядер и число валентных электронов в единице объема, изменение объема при плавлении, коэффициент объемного расширения, удовлетворительно коррелируют со средней электронной плотностью валентных электронов. Не обнаружено корреляции со средней электронной плотностью валентных электронов у таких свойств, как плотность, тепло- и электропроводность и теплоемкость.
В работе [1] было показано, что средняя электронная плотность атомных валентных электронов металлов является таким параметром, который позволяет рассматривать физико-химические свойства твердых металлов, не подразделяя элементы на различные подгруппы Периодической системы Д. И. Менделеева. Было продемонстрировано, что большинство свойств металлов (тепловые, термодинамические, кинетические, структурные, электрические и др.) удовлетворительно коррелируют со средней электронной плотностью валентных электронов рвн, определенной следующим образом:
где пе - число валентных электронов в атоме (это число выбиралось наименьшим), Кат и Кион - объемы атома и иона данной валентности. Для расчетов объемов использовали значения металлических и ионных радиусов из [2]. Предложенная модель определения рвн является, конечно, упрощенной, поскольку ограничивается шаровым приближением, поэтому коэффициент корреляции невысок [1], но в то же время качественно была показана определенная связь перечисленных выше свойств с электронной плотностью металлов. В то же время такие свойства металлов, как магнитные, сверхпроводимость, отражательная способность, не показали корреляции со средней элект-
ронной плотностью, определенной вышеуказанным способом, что, вероятно, связано с наличием пространственной структуры электронной плотности, не сводимой к шаровой.
В расплавах металлов сохраняются ближний порядок и металлическая связь [3, 4], «металлический» радиус атома металла может быть экспериментально определен, поэтому, в принципе, можно распространить представление о средней электронной плотности Рвн и на жидкие металлы. Представляет интерес вопрос о корреляции физико-химических свойств и средней электронной плотности в расплавах металлов.
При повышении температуры межатомные расстояния возрастают, поэтому величина рвн понижается. Однако достаточно определенной информации о металлических радиусах в расплавах не имеется. Ионные радиусы в этом интервале температур практически не должны изменяться. Поэтому мы для расплавов металлов использовали те же значения средней электронной плотности, что и для металлов в твердом состоянии при комнатной температуре. Для металлов, находящихся в плотнейших упаковках, межатомное расстояние при расплавлении возрастает на 3-5%, для элементов, кристаллизующихся в низших синго-ниях, эта величина больше, но не превышает 14% (ва), так что возможная ошибка не превышает неопределенности в величинах рвн (этот вывод сделан по данным 3 для двадцати двух элементов). Для рассматриваемых в на-
* Кафедра химии Кемеровского государственного университета.
Рис. 1. Зависимость: 1 - адиабатической (кД 2 - изотер- Рис. 3. Зависимость температуры кипения от сред-
мической (к) сжимаемости расплавов металлов в точке ней электронной плотности [6, 7]. Обозначения см. в
плавления [6, 7] от средней электронной плотности подписи к рис. 2
Рис. 2. Зависимость числа ядер в 1 см3 от средней электронной плотности при температуре плавления. Решетки: 1 - ГЦК типа Си, 2 - ОЦК типа а-Ш, 3 - ГПУ типа М§, 4 - кубическая типа алмаза, 5 - другие
стоящей работе элементов величины рвн представлены в таблице.
Зависимость различных физико-химических свойств расплавленных металлов (72 элемента) от средней электронной плотности представлены на рис. 1-5 и в таблице. Приведены данные по восемнадцати различным свойствам.
Коэффициент сжимаемости при температуре плавления (рис. 1), как и для твердых металлов, обратно пропорционален средней электронной плотности. Сами коэффи -циенты сжимаемости у расплавов с точностью до 2 такие же, как и у твердых металлов. Аналогичную зависимость имеет и коэффициент линейного расширения в при нагревании (таблица), но диапазон изменения этой величины существенно меньше, чем для твердых металлов.
Плотность й в жидком состоянии известна для большинства металлов (таблица). Из этой величины легко рассчитать концентрацию атомов на единицу объема (рис. 2) и концентрацию валентных электронов на единицу объема, которая линейно возрастает с ростом средней электронной плотности Ыв (таблица). Для ряда металлов известна температурная зависимость изменения плотности (1/й)(йй/йТ). Коэффициент температурного изменения
Физико-химические свойства расплавов металлов
Рвн Элеме нт Решет ка Тр, К Д Н „с„ П Е вяз в ДУУ й (1/а)(а й/йТ) N ср X Р а.ь
0.016 С5 ОЦК 552 66 0.68 4.81 3.41 2.6 1.85 0.344 0.84 7.62 - 36.7 0.114
0.020 № ОЦК 568 69 0.67 5.15 3.39 2.5-2.8 1.49 0.338 1.01 (7.5) - 22.0 0.077
0.022 0.041 К Ыа ОЦК ОЦК 651 707 77 90 0.51 0.68 5.02 5.24 2.80 2.7-2. 9 2.5-2.6 2.5-2.7 0.83 0.93 0.277 0.255 1.27 2.42 7.68 7.61 0.45 0.86 12.97 9.57 0.066 0.038
0.048 Яа ОЦК 1058 132 - - - - - - - - - - -
0.058 8г ОЦК 1010 134 - - - (2.6) 2.48 - 3.84 (7.4) - - -
0.058 Ва ОЦК 1134 151 - - - (1.9) 3.32 0.158 2.90 11.5 - (135) -
0.070 и ОЦК 996 140 0.57 5.56 1.74 1.6-2.4 0.52 0.355 4.54 7.26 0.46 24 -
0.073 Са ОЦК 1081 152 1.22 27.2 - 4.7 1.36 0.162 4.08 7.4 - - -
0.096 Т1 ГПУ 1098 163 2.64 10.5 1.50 2.2-3.3 11.28 0.127 3.31 7.2 0.25 73.1 0.027
0.098 Ей ОЦК 1093 147 - - - - - - - - - - -
0.100 1п Гек 1478 237 1.89 6.65 1.30 2.0-2.4 7.02 0.097 3.67 7.05 - 33.1 0.025
0.108 УЪ ОЦК 1032 130 1.07 - - - - - - - - - -
0.129 Ыв ГПУ 894 130 1.25 30.5 3.80 2.9-4.1 1.59 0.166 7.84 7.80 - 27.4 0.005
0.132 Ьа ОЦК 2429 413 2.45 - - - 5.95 0.040 7.81 (8.3) - - -
0.136 Ас ГЦК - 293 - - - - - - - - - - -
0.141 Се ОЦК 2096 314 2.88 - - 0.3-0.7 6.68 0.034 8.59 9.35 - - -
0.142 Рг ОЦК - 296 2.80 - - - 6.61 0.036 8.43 - - - -
0.142 Ш ОЦК 2651 272 - - - - 6.69 0.080 8.34 11.66 - - -
0.142 РЪ ГЦК 1246 178 - 8.61 1.20 3.5 10.68 0.123 6.18 7.32 0.16 95.0 0.048
0.143 У ОЦК 2048 375 - - - - - - - 10.30 - - -
0.143 ОЦК 1229 166 - - - - - - - - - - -
0.146 оа ОЦК 1199 360 - - - - (7.14) - 8.19 12.57 - - -
0.148 ТЪ ОЦК 2380 331 - - - - - - - - - - -
0.148 су ОЦК 1770 228 - - - - - - - - - - -
0.149 Но ОЦК - 240 - - - - - - - - - - -
0.151 Ег ГПУ - 261 - - - - - - - - - - -
0.151 Ьи ГПУ 1726 356 - - - - - - - - - - -
0.154 Тт ГПУ 191
Рвн Элеме нт Решет ка Тр, К Д Н „ш П Е вяз в ДУУ а (1/<0(Й N ср X Р а.ь
0.166 8п ОЦТ 1886 296 1.85 - 1.0-1.1 2.3-3.5 7.00 0.087 7.08 7.10 0.31 48.0 0.025
0.167 Ы Ром 1040 177 1.80 6.45 1.2-1.4 -3.3 10.07 0.132 8.67 7.6 0.11 128.0 0.057
0.169 еа ГПУ 667 100 2.28 10.9 1.4-1.7 4.0-5.0 8.02 0.145 8.56 7.1 0.44 33.7 -
0.177 нв Ром 398 59 2.10 2.51 1.81 3.66 13.69 0.180 8.18 6.81 0.086 90.96 -
0.181 и ОЦК 24.64 410 5.2 - - - 4.1 0.171 10.3 8.0 - - -
0.187 8с ОЦК 1820 315 - - - - - - - - - - -
0.192 ТИ ОЦК 3082 540 - - - - 10.5 - 10.86 (11.0) - - -
0.198 Ое Куб 2075 369 0.73 - - -(5-6) 5.6 0.112 9.26 - - 71 (0.047)
0.207 Си ГЦК 1886 302 4.00 30.5 1.99 4.1-4.6 8.00 0.100 7.55 (7.5) - 21.1 0.009
0.208 8Ъ Ром 1004 124 1.22 22.0 0.4-1.2 - 6.48 0.087 9.58 7.50 0.21 113.5 0.027
0.226 2п ГПУ 760 115 3.85 12.7 1.47 4.1-4.2 6.57 0.167 12.08 7.5 0.59 37.4 -
0.227 Те Гек 720 51 2.14 - - 4.9 5.71 0.063 10.74 9.0 0.18 600 -
0.235 V ОЦК 2555 474 - - - - 5.7 - 13.42 9.5 - - -
0.253 8е Гек 623 30 24.8 - 2.53 8.6-16.9 3.99 0.36 12.12 7.0 - 2108 -
0.264 Ри ОЦК 2221 351 6.0 5.59 0.50 - 16.64 0.087 12.53 (9.7) - - -
0.269 2г ОЦК 3500 536 8.0 - - - (5.8) - 15.26 8.0 - - -
0.275 И ОЦК 3478 670 - - - - 11.1 - 14.88 - - - -
0.291 и ОЦК 2729 494 6.5 30.4 - - 17.9 0.057 13.53 9.15 - - -
0.293 Оа Ром 1625 255 2.04 4.00 1.26 -(2.9-3.5) 6.09 0.098 15.72 6.65 0.34 25.8 0.019
0.318 № ГЦК 1691 370 4.90 50.2 - 6.3 7.90 0.140 16.16 9.2 - 85.0 0.013
0.321 Бе ОЦК 2660 354 5.5 41.4 - 3.0-3.9 7.01 0.126 15.04 10.50 - 138.6 0.033
0.323 Со ГЦК 1744 375 4.18 44.4 - 1.4 7.76 0.127 15.80 (9.0) - 102 0.061
0.323 Сг ОЦК 1968 338 - - - - 6.28 0.047 14.49 (9.4) - - -
0.325 Мп ОЦК 1565 227 - - - - 5.73 0.122 12.52 (11.0) - 40 -
0.340 Ве ГПУ 1821 2744 - - - 7.0 1.69 0.069 22.48 (7.5) - - -
0.347 ЫЪ ГЦК 3566 661 - - - - (7.8) - 20.24 8.0 - - -
0.355 Ыр ОЦК 2570 422
0.361 Ш1 ГЦК 2793 494 - - - - (10.8) - 18.89 (10.0) - - -
0.393 ■да ОЦК 41.47 850 - - - - (17.6) - 22.97 (8.5) - - -
0.403 Ыо ОЦК 33.75 552 - - - - (9.34) - 23.36 (10.0) - - -
0.404 Р1 ГЦК 2804 510 - - - - 19.0 0.153 23.36 8.3 - - -
0.410 81 Куб 1938 445 0.94 - - -9.6 2.51 0.127 21.46 - - 80 0.113
0.414 ра ГЦК 2240 353 - - - - 10.49 0.120 23.59 (8.3) - - -
0.423 Та ОЦК 3978 744 - - - - (15.0) - 24.88 - - - -
0.426 1г ГЦК 3082 612 - - - - (20.0) - 24.86 (9.3) - - -
0.437 Оз ГПУ 3512 750 1.71 - - - (20.1) - 25.3 (8.3) - - -
0.452 Яи ГПУ 3468 602 - - - - (10.9) - 25.72 (10.0) - - -
0.578 Аи ГЦК 2059 348 5.0 15.9 - 5.1 17.36 0.086 5.28 7.0 - 31.2 0.014
0.590 Яе ГПУ 4036 744 - - - - (18.8) - 36.33 - - - -
0.97 В Ром 2898 3841 - - - - 2.08 - 34.60 - - - -
Примечания. рвн - средняя электронная „лотность (электрон/А ); Т - температура, „ри которой давление „ара над расплавом
достигает величины 1 мм рт. ст. (К); Д Нис„ - теплота испарения „ри температуре „лавления (кДжмоль ) [6, 7]; п - вязкость „ри температуре „лавления, мНсм- К-1 [8], £вяз - энергия активации вязкого течения кДжмоль [8]; в - коэффициент объемного расширения (10-4К-1); ДУ/У — изменение объема „ри „лавлении (%) 5; й - „лотность „ри температуре „лавления (гсм ) [8], (1/й)(йй/йТ) — температурный коэффициент изменения „лотности (К ) [8]; Nе - число валентных электронов на единицу объема
(см 10 ); Ср - теплоемкость расплава „ри температуре „лавления (калг-атом К [3]; X - теплопроводность расплава „ри температуре „лавления (Джсм-1с-1К-1) [3]; р - электросопротивление расплава „ри температуре „лавления (Ом-м-Ю-8) [3]; а1 - температурный коэффициент изменения электросопротивления в расплаве (а1 = (1/р)(йр/йТ), К-1 [3]). Средняя электронная „лотность приведена для комнатной тем„ературы.
В скобках приведены оценочные значения.
для твердых металлов, не имеют явной зависимости от средней электронной плотности. Не имеет явной зависимости и электросопротивление р, но температурный ко -эффициент электросопротивления рьпонижается (таблица) по мере увеличения средней электронной плотности.
Поверхностное натяжение расплавов металлов при температуре плавления практически линейно повышается с ростом средней электронной плотности, как и следовало ожидать, поскольку по мере возрастания электронной плотности взаимодействие между атомами возрастает (рис. 4). В соответствие с этим температурный коэффициент поверхностного натяжения, как показано на рис. 5, понижается по мере роста средней электронной плотности. Так же почти линейно возрастает и вязкость расплавов в точке плавления при увеличении средней электронной плотности п. Аналогично изменяется энергия активации вязкости Евяз.
Интересно провести сопоставление зависимостей различных физико-химических свойств от средней электронной доли для расплавов и для твердых металлов. Как и ранее [1], мы не определяем точный характер зависимости, поскольку нет точных значений средней электронной плотности, не определено однозначно валентное состоя-
Рис. 4. Зависимость поверхностного натяжения в точке плавления от средней электронной плотности (взято среднее значение по данным 6). Обозначения см. в подписи к рис. 2
плотности тем выше, чем ниже средняя электронная плотность. В момент плавления происходит изменение объема (как правило, он возрастает). Коэффициент изменения объема AV/V для большинства элементов возрастает с рвн (таблица). Исключение составляют висмут и галлий - металлы с низкой сингонией кристаллической решетки, хотя для других металлов с такой же низкой син-гонией (ртуть, кадмий, олово и др.) отличия от металлов с плотнейшими упаковками нет.
Температура кипения (рис. 3) возрастает с повышением средней электронной плотности. Такой же характер имеют и зависимости теплоты испарения АНисп и температуры T при которой давление пара достигает заданной величины (таблица). В то же время теплопроводность X и теплоемкость c (таблица) для расплавов, как и
Рис. 5. Зависимость температурного коэффициента поверхностного натяжения при температуре кипения от средней электронной плотности по данным: 1 - [6, 7], 2 - [8], 3 - [9]
ние металла, но качественно характер кривых можно выявить. Можно сделать общее утверждение, что для сопоставимых свойств зависимости от средней электронной плотности одинаковы и для твердых металлов и для их расплавов. Так, удовлетворительная линейная зависимость наблюдается для числа валентных электронов в единице объема (при наименьших возможных валентностях). Возрастание (линейная или параболическая зависимость) наблюдается для температур кипения и плавления, для теп-
лот плавления и испарения, для концентрации ядер, для температуры, при которой давление пара достигает заданной величины. Обратная зависимость от средней электронной плотности проявляется для коэффициентов изотермического сжатия, теплового расширения, температурного коэффициента электросопротивления. А такие свойства, как плотность,теплопроводность, теплоемкость и электросопротивление, явной зависимости от средней плотности не проявляют ни для металлов, ни для их расплавов.
1. Бугаенко Л.Т., Рябых С М. // Вестн. Моск. ун-та. Сер. 2. Химия. 1993. 24. С. 315.
2. Вайнштейн Б.К., Фридкин В.М., Инденбом В.Л. //Современная кристаллография. Т. 2. М., 1979. С. 75.
3. Вилсон Д.Р. Структура жидких металлов и сплавов. М., 1972.
4. Григорович В.К. Металлическая связь и структура металлов. М., 1988.
5. Тонков Е.Ю. // Фазовые превращения соединений при высоком давлении. Справочник. Кн. 2. М., 1988.
6. Таблицы физических величин. Справочник / Под ред. И. К. Кикоина. М., 1976.
7. Физические величины. Справочник / Под ред. И. С. Григорьева, Е. З. Мейлихова. М., 1991.
Валентный электрон - Valence electron
Четыре ковалентные связи . Углерод имеет четыре валентных электрона, а здесь валентность четыре. Каждый атом водорода имеет один валентный электрон и одновалентен.
В химии и физике , А валентный электрон представляет собой электрон на внешней оболочке , связанную с атомом , и что может участвовать в образовании химической связи , если внешняя оболочка не закрыта; в одинарной ковалентной связи оба атома в связи вносят один валентный электрон для образования общей пары .
Наличие валентных электронов можно определить элемент «S химические свойства, такие как его валентность -whether она может связь с другими элементами , и, если да, то как легко и с тем, как много. Таким образом, реакционная способность данного элемента сильно зависит от его электронной конфигурации. Для элемента основной группы валентный электрон может существовать только во внешней электронной оболочке ; для переходного металла валентный электрон также может находиться во внутренней оболочке.
Атом с закрытой оболочкой валентных электронов (соответствующей конфигурации благородного газа ) обычно химически инертен . Атомы с одним или двумя валентными электронами больше, чем закрытая оболочка, обладают высокой реакционной способностью из-за относительно низкой энергии для удаления лишних валентных электронов с образованием положительного иона . Атом с одним или двумя электронами меньше, чем закрытая оболочка, является реактивным из-за его тенденции либо получить недостающие валентные электроны и сформировать отрицательный ион, либо разделить валентные электроны и сформировать ковалентную связь.
Подобно остовному электрону , валентный электрон обладает способностью поглощать или выделять энергию в виде фотона . Увеличение энергии может заставить электрон переместиться (прыгнуть) на внешнюю оболочку; это известно как атомное возбуждение . Или электрон может даже вырваться из оболочки связанного с ним атома; это ионизация с образованием положительного иона. Когда электрон теряет энергию (тем самым вызывая излучение фотона), он может перемещаться во внутреннюю оболочку, которая не полностью занята.
СОДЕРЖАНИЕ
Обзор
Электронная конфигурация
Электроны, определяющие валентность - то, как атом химически реагирует, - обладают наибольшей энергией .
Для элемента основной группы валентные электроны определяются как электроны, находящиеся в электронной оболочке с наивысшим главным квантовым числом n . Таким образом, количество валентных электронов, которое он может иметь, просто зависит от электронной конфигурации . Например, электронная конфигурация фосфора (P) равна 1s 2 2s 2 2p 6 3s 2 3p 3, так что имеется 5 валентных электронов (3s 2 3p 3 ), что соответствует максимальной валентности для P равной 5, как в молекуле PF. 5 ; эта конфигурация обычно сокращается до [Ne] 3s 2 3p 3 , где [Ne] обозначает остовные электроны, конфигурация которых идентична конфигурации благородного газа неона .
Чем дальше вправо в каждой серии переходных металлов, тем ниже энергия электрона в подоболочке и тем меньше у такого электрона валентных свойств. Таким образом, хотя атом никеля в принципе имеет десять валентных электронов (4s 2 3d 8 ), его степень окисления никогда не превышает четырех. Для цинка подоболочка 3d является полной во всех известных соединениях, хотя она вносит вклад в валентную зону в некоторых соединениях.
Подсчет д электронов является альтернативным инструментом для понимания химии переходного металла.
Количество валентных электронов
Количество валентных электронов элемента может быть определено группой периодической таблицы (вертикальный столбец), в которой этот элемент отнесен к категории. За исключением групп 3–12 ( переходные металлы ), цифра единиц номера группы указывает, сколько валентных электронов связано с нейтральным атомом элемента, указанного в этом конкретном столбце.
| Блок периодической таблицы | Группа периодической таблицы | Валентные электроны |
|---|---|---|
| s | Группа 1 (I) ( щелочные металлы ) | 1 |
| Группа 2 (II) ( щелочноземельные металлы ) и гелий | 2 | |
| ж | Лантаноиды и актиниды | 3–16 |
| d | Группы 3-12 ( переходные металлы ) | 3–12 |
| п | Группа 13 (III) ( группа бора ) | 3 |
| Группа 14 (IV) ( углеродная группа ) | 4 | |
| Группа 15 (V) ( пниктогены или азотная группа) | 5 | |
| Группа 16 (VI) ( халькогены или кислородная группа) | 6 | |
| Группа 17 (VII) ( галогены ) | 7 | |
| Группа 18 (VIII или 0) ( благородные газы ), кроме гелия | 8 |
Гелий является исключением: несмотря на то, что он имеет конфигурацию 1s 2 с двумя валентными электронами и, таким образом, имеет некоторое сходство с щелочноземельными металлами с их конфигурациями валентности n s 2 , его оболочка полностью заполнена и, следовательно, он химически очень инертен и обычно помещается в группе 18 с другими благородными газами.
валентной оболочки
Валентная оболочка - это набор орбиталей, которые энергетически доступны для принятия электронов с образованием химических связей .
Для элементов основной группы валентная оболочка состоит из n s и n p орбиталей во внешней электронной оболочке . Для переходных металлов включены орбитали неполной подоболочки ( n - 1) d, а для лантаноидов и актинидов - неполные подоболочки ( n - 2) f и ( n - 1) d. Участвующие орбитали могут находиться во внутренней электронной оболочке и не все соответствуют одной и той же электронной оболочке или главному квантовому числу n в данном элементе, но все они находятся на одинаковом расстоянии от ядра.
Как правило, элемент основной группы (кроме водорода или гелия) имеет тенденцию реагировать с образованием 2 p 6 электронной конфигурации . Эта тенденция называется правилом октетов , потому что каждый связанный атом имеет 8 валентных электронов, включая общие электроны. Точно так же переходный металл имеет тенденцию реагировать с образованием электронной конфигурации ad 10 s 2 p 6 . Эта тенденция называется правилом 18 электронов , потому что каждый связанный атом имеет 18 валентных электронов, включая общие электроны.
Химические реакции
Количество валентных электронов в атоме определяет его связывающее поведение. Следовательно, элементы, атомы которых могут иметь одинаковое количество валентных электронов, сгруппированы вместе в периодической таблице элементов.
Наиболее реакционноспособный вид металлического элемента - это щелочной металл группы 1 (например, натрий или калий ); это потому, что такой атом имеет только один валентный электрон; во время образования ионной связи, которая обеспечивает необходимую энергию ионизации , этот один валентный электрон легко теряется с образованием положительного иона (катиона) с замкнутой оболочкой (например, Na + или K + ). Щелочно - земельный металл из группы 2 (например, магний ) несколько менее реакционноспособный, потому что каждый атом должен потерять два валентных электроны , чтобы сформировать положительный ион с замкнутой оболочкой (например, Mg 2+ ).
Внутри каждой группы (каждого столбца периодической таблицы) металлов реакционная способность увеличивается с каждой нижней строкой таблицы (от легкого элемента к более тяжелому), потому что более тяжелый элемент имеет больше электронных оболочек, чем более легкий элемент; валентные электроны более тяжелого элемента существуют с более высокими главными квантовыми числами (они находятся дальше от ядра атома и, таким образом, имеют более высокие потенциальные энергии, что означает, что они менее тесно связаны).
Неметалла атом имеет тенденцию привлекать дополнительные электроны валентности для достижения полной валентной оболочки; это может быть достигнуто одним из двух способов: атом может либо делить электроны с соседним атомом ( ковалентная связь ), либо удалять электроны с другого атома ( ионная связь ). Наиболее химически активным неметаллическим элементом является галоген (например, фтор (F) или хлор (Cl)). Такой атом имеет следующую электронную конфигурацию: s 2 p 5 ; для этого требуется только один дополнительный валентный электрон, чтобы сформировать замкнутую оболочку. Чтобы образовать ионную связь, атом галогена может удалить электрон из другого атома, чтобы образовать анион (например, F - , Cl - и т. Д.). Чтобы образовать ковалентную связь, один электрон от галогена и один электрон от другого атома образуют общую пару (например, в молекуле H – F линия представляет собой общую пару валентных электронов, один от H, а другой от F).
Внутри каждой группы неметаллов реакционная способность уменьшается с каждой нижней строкой таблицы (от легкого элемента к тяжелому) в периодической таблице, потому что валентные электроны имеют все более высокие энергии и, таким образом, все менее прочно связаны. Фактически, кислород (самый легкий элемент в группе 16) является наиболее реакционноспособным неметаллом после фтора, хотя он и не является галогеном, потому что валентная оболочка галогена имеет более высокое главное квантовое число.
В этих простых случаях, когда соблюдается правило октета, валентность атома равна количеству электронов, полученных, потерянных или разделенных для формирования стабильного октета. Однако есть также много молекул, которые являются исключениями и для которых валентность менее четко определена.
Электрическая проводимость
Валентные электроны также ответственны за электрическую проводимость элемента; в результате элемент может быть классифицирован как металл , неметалл или полупроводник (или металлоид ).
Металл Металлоид Неметалл Неизвестные свойства Цвет фона показывает тенденцию металл – металлоид – неметалл в периодической таблице.
Металлические элементы обычно обладают высокой электропроводностью в твердом состоянии. В каждой строке периодической таблицы металлы расположены слева от неметаллов, и, таким образом, у металла меньше возможных валентных электронов, чем у неметалла. Однако валентный электрон атома металла имеет небольшую энергию ионизации , и в твердом состоянии этот валентный электрон относительно свободен покинуть один атом, чтобы присоединиться к другому, находящемуся поблизости. Такой «свободный» электрон может перемещаться под действием электрического поля , и его движение образует электрический ток ; он отвечает за электропроводность металла. Медь , алюминий , серебро и золото - примеры хороших проводников.
Неметаллический элемент имеет низкую электропроводность; он действует как изолятор . Такой элемент находится справа от таблицы Менделеева, и его валентная оболочка заполнена как минимум наполовину (исключение составляет бор ). Его энергия ионизации велика; электрон не может легко покинуть атом при приложении электрического поля, и, таким образом, такой элемент может проводить только очень небольшие электрические токи. Примеры твердых элементарных изоляторов являются алмазом (ый аллотроп из углерода ) и серы .
Твердое соединение, содержащее металлы, также может быть изолятором, если валентные электроны атомов металла используются для образования ионных связей . Например, хотя элементарный натрий является металлом, твердый хлорид натрия является изолятором, потому что валентный электрон натрия переносится на хлор с образованием ионной связи, и, таким образом, этот электрон не может легко перемещаться.
Полупроводника имеет электрическую проводимость , которая является промежуточной между металлом и что из неметалла; Полупроводник также отличается от металла тем, что проводимость полупроводника увеличивается с температурой . Типичные элементарные полупроводники - это кремний и германий , каждый атом которых имеет четыре валентных электрона. Свойства полупроводников лучше всего объясняются с помощью зонной теории , как следствие небольшой энергетической щели между валентной зоной (которая содержит валентные электроны в абсолютном нуле) и зоной проводимости (в которую валентные электроны возбуждаются тепловой энергией).
Валентные электроны - правила, формулы и примеры определения
В химии валентными электронами (ВЭ) называют те электроны, которые находятся на внешней оболочке атомного ядра. Они имеют важное значение, потому что дают глубокое понимание химических свойств элемента. Например, является ли вещество по своей природе электроположительным или электроотрицательным, или порядок связей может образовываться между двумя атомами.
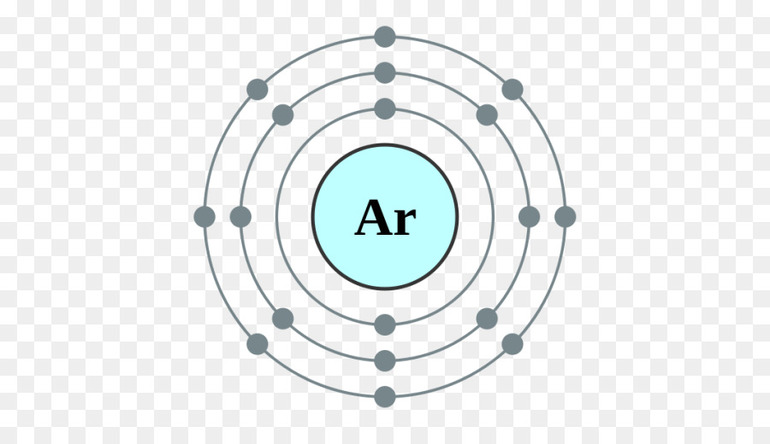
Электроны и валентность
Международный союз теоретической и прикладной химии определил валентность как максимальное число одновалентных атомов (первоначально — водорода или хлора), которые могут объединяться с атомом или фрагментом рассматриваемого элемента.
Современная альтернативная трактовка звучит несколько иначе: валентность — это число атомов водорода, которые могут объединяться с элементом в бинарном гидриде, или удвоенное количество атомов кислорода, объединяющихся с элементом в его оксиде или оксидах. Это определение отличается от формулировки МСТПХ, поскольку большинство веществ имеет более чем одну валентность.
Модель ядерного атома Резерфорда (1911) показала, что внешнюю оболочку атома занимают заряженные частицы, это свидетельствует о том, что электроны ответственны за взаимодействие атомов и образование химических связей.
В 1916 году Гилберт Н. Льюис объяснил валентность и химическую связь с точки зрения тенденции атомов достигать стабильного октета из 8 электронов в валентной оболочке.
Согласно Льюису, ковалентная связь приводит к октетам при совместном использовании электронов, а ионная связь — при передаче электронов от одного атома к другому. Термин ковалентность приписывается Ирвингу Лэнгмюру. Префикс ко- означает «вместе», то есть атомы разделяют валентность. Поэтому определение валентности по формуле соединения стало возможным.
В 1930-х годах Линус Полинг предположил, что существуют также полярные ковалентные связи, которые являются промежуточными, а степень ионного характера зависит от разницы электроотрицательности двух связанных атомов.
Полинг также рассматривал гипервалентные молекулы, в которых элементы имеют кажущиеся валентности, например, в молекуле гексафторида серы (SF6). Учёный считал, что сера образует 6 истинных двух электронных связей с использованием sp 3 d 2 гибридных атомных орбиталей, которые объединяют одну s, три p и две d орбитали.
Для основных элементов в периодической таблице Менделеева валентность может варьироваться от 1 до 7. Многие вещества имеют общую валентность, связанную с их положением в таблице. Для описания ионов в зарядовых состояниях 1, 2, 3 и т. д. (соответственно) используются греческие/латинские цифровые префиксы (моно- / уни- / би- / три-).

Виды с одним зарядом являются одновалентными. Например, Cs + — одновалентный катион, тогда как Ca 2+ является двухвалентным, а Fe 3+ — трёхвалентным. Существуют также поливалентные катионы, которые не ограничены определённым количеством валентных связей.
В отличие от Cs и Ca, Fe может существовать в других зарядовых состояниях, особенно 2+ и 4+, и поэтому известен как многовалентный (поливалентный) ион.
Переходные металлы и металлы, как правило, многовалентны, но, к сожалению, не существует простой схемы, предсказывающей их валентность.
Определение количества
Можно определить количество электронов с помощью специального онлайн-калькулятора. Однако его нахождение под рукой не всегда возможно. Поэтому следующий вариант — обратиться к атомной конфигурации элемента и просто сосчитать число заряженных частиц в самой внешней оболочке атома. Однако это чрезвычайно утомительное занятие, так как, возможно, придётся пролистать много учебников, чтобы найти конфигурации, с которыми исследователь не знаком.

Количество ВЭ элемента и его валентность определить по таблице Менделеева проще всего. Нужно обратить внимание на вертикальный столбец, в котором указана классификация.
Исключением являются переходные металлы — 3−12 группы.
Цифра в порядковом номере группы показывает, сколько валентных электронов связано с нейтральным атомом вещества, указанного в этом конкретном столбце.
Пример в таблице:
| Группа | ВЭ |
|---|---|
| 1 (I) (щелочные металлы) | 1 |
| 2 (II) (щёлочноземельные металлы) | 2 |
| 3−12 (переходные металлы) | 3−12 |
| 13 (III) (борная группа) | 3 |
| 14 (IV) (углеродная) | 4 |
| 15 (V) (группа азота) | 5 |
| 16 (VI) (кислородная группа) | 6 |
| 17 (VII) (галогены) | 7 |
| 18 (VIII или 0) (благородные газы) | 8 |
Надо сказать, что периодическая таблица — это аккуратное расположение всех элементов, которые известны науке на данный момент.
Они располагаются слева направо в порядке возрастания их атомарных номеров или числа протонов (электронов), которые они содержат.
Все вещества в таблице Менделеева делятся на четыре категории:
- элементы основной группы;
- переходные элементы;
- лантаноиды;
- актиниды.
Последние два — это внутренние переходные элементы, образующие мост в группах 2 и 13. Таблица содержит строки — периоды — и 18 столбцов, известных как группы. Есть ещё подтаблица, которая содержит 7 строк и 2 столбца с более редкими веществами.
Номер строки (периода) элемента показывает количество оболочек, окружающих его ядро.
Число электронов, содержащихся во внешней оболочке атома, которая ещё называется валентной, определяет его способность образовывать связи. Поэтому элементы с одинаковым количеством валентных электронов в атоме группируются в периодическую таблицу. Обычно вещества главной группы, исключая гелий и водород, имеют тенденцию вступать в реакцию с образованием замкнутой оболочки, которая соответствует конфигурации электронов s 2 p 6 . Это называется правилом октетов, поскольку у каждого связанного атома будет восемь ВЭ, учитывая общие электроны.
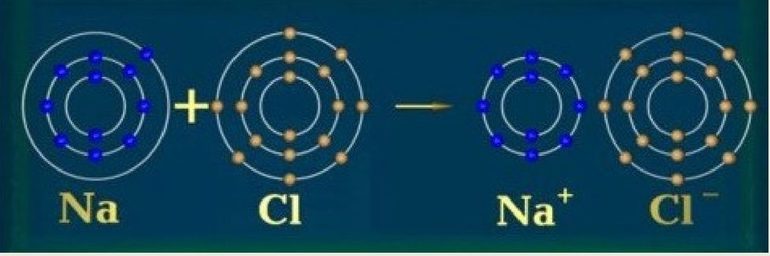
Из металлических элементов наиболее реакционноспособными являются щелочные металлы первой группы, например, калий и натрий. Такой атом имеет только один ВЭ. Эта единственная заряженная частица с лёгкостью теряется во время образования ионной связи, после чего образуется катион (положительный ион), например, K + или Na + , оболочка которого будет закрыта.
Вторая группа — щёлочноземельные металлы, например, магний, — менее реактивны. Чтобы получить положительный ион (Mg 2+ ), каждому их атому нужно отдать два ВЭ.
В любой группе (в столбце таблицы Менделеева) металлов реакционная способность становится больше, если двигаться от лёгкого вещества к более тяжёлому, то есть увеличивается с каждым нижним рядом таблицы. Происходит это просто потому, что у тяжёлых элементов больше оболочек. Их ВЭ приходится существовать в условиях более высоких главных квантовых чисел.
Они находятся дальше от атомного ядра и, следовательно, обладают более высокой потенциальной энергией, это означает, что связь между ними менее тесная.
Атом неметалла настроен привлекать дополнительные ВЭ, чтобы образовать полную валентную оболочку. Это может быть достигнуто одним из двух способов:
- посредством ковалентной связи, то есть атом поделится электронами с соседом;
- будет использована ионная связь, то есть электроны возьмут из другого атома.
Наиболее реактивными видами неметаллических элементов являются галогены. К ним можно отнести хлор (Cl) или, например, фтор (F).
Если двигаться от лёгкого элемента к тяжёлому, в пределах каждой группы неметаллов их реакционная способность будет уменьшаться. Это потому, что ВЭ будут терять тесную связь, поскольку приобретают более высокую энергию. По факту, самый лёгкий элемент в группе 16 — кислород — наиболее реакционноспособный неметалл, после фтора, конечно.
В таких простых случаях, когда соблюдается правило октета, валентность атома равна количеству разделённых электронов, потерянных или полученных для того, чтобы сформировался стабильный октет. Однако есть также много молекул, для которых валентность менее чётко определена, но это скорее исключения.
Электронная конфигурация
Заряженные частицы, определяющие химическую реакцию атома, — это те, чьё среднее расстояние от ядра самое большое, то есть они обладают самой высокой энергией. Для элемента основной группы ВЭ определяются как те, что находятся в электронной оболочке с наибольшим главным квантовым числом n.
Следовательно, число валентных электронов, которое может быть у вещества, зависит от конфигурации самих частиц. Например, чтобы определить валентные электроны фосфора, нужно записать его конфигурацию: 1s 2 2s 2 2p 6 3s 2 3p 3 . Итак, получается 5 ВЭ (3s 2 3p 3 ), что соответствует максимальной валентности для P, равной 5.
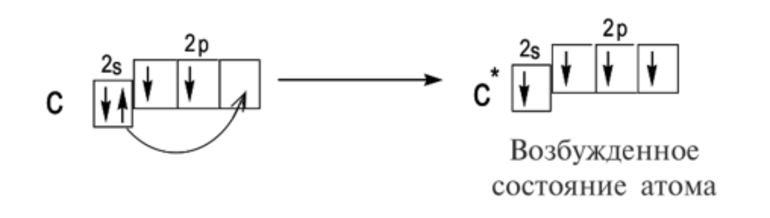
Однако переходные элементы имеют частично заполненные (n — 1) d энергетические уровни, к слову, довольно близкие по энергии к уровню ns. Поэтому, в отличие от веществ основной группы, ВЭ для переходного металла определяется как частица, которая находится вне ядра благородного газа.
Как правило, d-электроны в переходных металлах ведут себя как валентные, хотя они не находятся в оболочке. Например, марганец (Mn) имеет конфигурацию 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 5 , это сокращённо — [Ar] 4s 2 3d 5 , где [Ar] — обозначение конфигурации ядра, идентичной благородному газу — аргону. Электрон 3d этого атома имеет энергию, аналогичную 4s, но превышающую 3s или 3p.
Чем правее вещество расположено в ряду переходных металлов, тем энергия его заряженной частицы в субоболочке ниже, и тем меньше валентных свойств у такого электрона.
Например, хотя обычно у атома никеля десятая валентность (4s 2 3d 8 ), его степень окисления никогда не превышает четырёх. Для цинка 3d-оболочка является полной и ведёт себя подобно электронам ядра.
Поскольку количество ВЭ, участвующих в химических реакциях фактически, предсказать сложно, концепция этой частицы несёт мало пользы для переходных металлов, если сравнивать с элементами из основной группы. Однако подсчёт электронов для понимания химии переходных металлов является альтернативным инструментом.
Ответственность за электрическую проводимость вещества в том числе лежит и на электронах. Вследствие чего элементы классифицируются следующим образом:
В твёрдом состоянии металлические элементы обычно имеют высокую электропроводность. Поскольку валентный электрон металла обладает небольшой энергией ионизации, находясь в твёрдом состоянии, он относительно свободно покидает атом, чтобы связываться с другими.
Когда электрон свободный, он может перемещаться под воздействием электрического поля, то есть создавать электрический ток, отвечая за электропроводность металла. Примером хороших проводников могут служить серебро, равно как и золото, алюминий и, конечно, медь.

Как изолятор действует неметаллический элемент, поскольку имеет низкую электропроводность. В таблице Менделеева такие вещества находятся справа. Их валентная оболочка заполнена наполовину (исключение составляет бор). Когда на атом воздействует некоторое электрическое поле, заряженная частица не может его легко покинуть, поэтому такой элемент может проводить слабый постоянный или переменный электрический ток. Например, сера и алмаз — одни из таких веществ.
Изолятором также может быть твёрдое соединение, которое содержит металлы, если для образования ионных связей используются ВЭ атомов металла. К примеру, натрий, хоть он и представляет собой мягкий металл, однако твёрдый хлорид натрия является изолятором.
Поскольку для образования ионной связи ВЭ натрия переносятся в хлор, электроны не имеют возможности легко перемещаться.
Полупроводники обладают промежуточной между металлами и неметаллами электрической проводимостью. Интересно, что при увеличении температуры у этих веществ улучшается проводимость. Германий и кремний можно отнести к типичным элементарным полупроводникам, каждый их атом имеет 4 ВЭ. Надо сказать, что лучше всего свойства полупроводников объясняются с помощью теории зон.
Как определить валентные электроны
Соавтор(ы): Bess Ruff, MA. Бесс Руфф — аспирантка Университета штата Флорида, работает над получением степени PhD по географии. Получила степень магистра экологии и менеджмента в Калифорнийском университете в Санта-Барбаре в 2016 году. Проводила исследования для проектов по морскому пространственному планированию в Карибском море и обеспечивала научную поддержку в качестве дипломированного участника Группы устойчивого рыболовства.
Валентные электроны находятся на внешней оболочке атома. Их количество определяет число возможных химических соединений, которые атом может образовать. Лучший способ определить количество валентных электронов — воспользоваться периодической таблицей Менделеева.
Непереходные металлы

Используйте периодическую таблицу химических элементов (таблицу Менделеева). Это определенным образом раскрашенная таблица, каждая ячейка которой содержит название химического элемента и другую важную информацию, которую можно использовать для определения количества валентных электронов в конкретном атоме. Таблицу Менделеева можно найти в учебнике по химии или здесь.

- Например, над водородом (Н) напишите цифру 1, так как с него начинается первый столбец, а над гелием (He) напишите цифру 18, так как с него начинается восемнадцатый столбец.

- Например, определим число валентных электронов углерода (С). Его атомный номер 6 и с него начинается четырнадцатая группа.
- В этом подразделе мы не рассматриваем переходные металлы, которые расположены в группах с 3 по 12. Эти элементы немного отличаются от остальных, поэтому описанные здесь методы на них не распространяются. Переходные металлы будут рассмотрены в следующем подразделе.

- Группа 1: 1 валентный электрон
- Группа 2: 2 валентных электрона
- Группа 13: 3 валентных электрона
- Группа 14: 4 валентных электрона
- Группа 15: 5 валентных электрона
- Группа 16: 6 валентных электрона
- Группа 17: 7 валентных электрона
- Группа 18: 8 валентных электрона (за исключением гелия, у которого 2 валентных электрона)
- В нашем примере, так как углерод находится в группе 14, можно заключить, что один атом углерода имеет четыре валентных электрона.
Переходные металлы

- Например, рассмотрим тантал (Ta); его атомный номер 73. Далее мы найдем число его валентных электронов (или, по крайней мере, попробуем это сделать).
- Обратите внимание, что переходные металлы включают лантаноиды и актиноиды (они также называются редкоземельными металлами) — два ряда элементов, которые, как правило, расположены ниже основной таблицы и которые начинаются с лантана и актиния. Все эти элементы относятся к группы 3 периодической таблицы.

- В атоме электроны расположены на электронных орбиталях. Каждая электронная орбиталь может содержать только какое-то определенное число электронов, причем заполняются орбитали, начиная с ближайшей к ядру атома и заканчивая наиболее далекой.
- При заполнении электронами внешней орбитали атома переходного металла они становятся валентными электронами, но на какое-то время, после чего в роль валентных электронов вступают электроны с других орбиталей. Это означает, что число валентных электронов может меняться.
- Для получения детальной информации о валентных электронах прочитайте эту статью. [3] X Источник информации

- Группа 3: 3 валентных электрона
- Группа 4: 2–4 валентных электрона
- Группа 5: 2–5 валентных электронов
- Группа 6: 2–6 валентных электронов
- Группа 7: 2–7 валентных электронов
- Группа 8: 2 или 3 валентных электрона
- Группа 9: 2 или 3 валентных электрона
- Группа 10: 2 или 3 валентных электрона
- Группа 11: 1 или 2 валентных электрона
- Группа 12: 2 валентных электрона
- В нашем примере тантал расположен в группе 5, поэтому можно заключить, что его атом имеет от двух до пяти валентных электрона (в зависимости от ситуации).
- Например, рассмотрим электронную конфигурацию натрия (Na): 1s 2 2s 2 2p 6 3s 1
- Обратите внимание, что электронная конфигурация строится по формуле: (цифра)(буква) (надстрочная цифра) (цифра)(буква) (надстрочная цифра) .
- . и так далее. Здесь (цифра)(буква) — это обозначение электронной орбитали, а (надстрочная цифра) — это число электронов на этой орбитали.
- В нашем примере в атоме натрия 2 электрона на 1s-орбитали плюс 2 электрона на 2s-орбитали плюс 6 электронов на 2р-орбитали плюс 1 электрон на 3s-орбитали. Всего 11 электронов, что верно, так как атомный номер натрия 11.
- Учтите, что подуровни электронных оболочек имеют определенное число электронов. Максимальное количество электронов для орбиталей следующее:
- s: 2 электрона
- p: 6 электронов
- d: 10 электронов
- f: 14 электронов
![Изображение с названием Find Valence Electrons Step 9]()
- Вот полная электронная конфигурация оганесона (Og; атомный номер 118): 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 10 7p 6
- Теперь, чтобы определить электронную конфигурацию любого элемента, вам просто нужно заполнить этот шаблон (до тех пор, пока у вас не останется электронов). Это проще, чем кажется. Например, определите электронную конфигурацию хлора (Cl; атомный номер 17), атом которого имеет 17 электронов: 1s 2 2s 2 2p 6 3s 2 3p 5
- Обратите внимание, что общее число электронов равно 17: 2 + 2 + 6 + 2 + 5 = 17. Вам нужно изменить количество электронов на последней орбитали, так как предыдущие орбитали такие же, как в шаблоне (ибо полностью заполнены электронами).
- Для получения подробной информации об электронных конфигурациях прочитайте эту статью.
![Изображение с названием Find Valence Electrons Step 10]()
- Например, рассмотрим бор (B). Его атомный номер 5, то есть атом бора включает пять электронов, а его электронная конфигурация выглядит следующим образом: 1s 2 2s 2 2p 1 . Так как первая орбитальная оболочка имеет только два электрона, то можно заключить, что у бора только две оболочки: первая с двумя электронами (на 1s-орбитали), а вторая с тремя (на 2s- и 2р-орбиталях).
- В качестве другого примера рассмотрим хлор (Cl), у которого три орбитальные оболочки: первая с двумя электронами на 1s-орбитали, вторая с двумя электронами на 2s-орбитали и шестью электронами на 2р-орбитали, третья с двумя электронами на 3s-орбитали и пятью электронами на 3p-орбитали.
![Изображение с названием Find Valence Electrons Step 11]()
- Например, рассмотрим бор. Так как на внешней оболочке бора находятся три электрона, то можно заключить, что у бора три валентных электрона.
![Изображение с названием Find Valence Electrons Step 12]()
- Например, мы знаем, что у селена четыре орбитальные оболочки, потому что этот элемент расположен в четвертом периоде. Так как это шестой элемент (слева) четвертого периода (без учета переходных металлов), можно заключить, что внешняя четвертая оболочка содержит шесть электронов, и, таким образом, у селена шесть валентных электрона.
- Обратите внимание, что электронные конфигурации могут быть записаны в сокращенном виде с использованием благородных газов (элементы группы 18). Например, электронную конфигурацию натрия можно записать так: [Ne]3s1 — по сути, она напоминает электронную конфигурацию неона, но с одним дополнительным электроном на 3s-орбитали. [5] X Источник информации
- У переходных металлов есть валентные подуровни, незаполненные полностью. Определение точного числа валентных электронов в переходных металлах включает в себя принципы квантовой теории и не рассматривается в данной статье.
- Обратите внимание, что форма (вид) периодической таблицы химических элементов может отличаться в разных странах. Поэтому убедитесь, что вы пользуетесь формой периодической таблицы химических элементов, которая принята в вашей стране (чтобы избежать ошибок).
- Следите за действиями (вычитание или сложение) при нахождении валентных электронов.
Дополнительные статьи
![найти число протонов, нейтронов и электронов]()
![написать электронную конфигурацию атома любого элемента]()
![сделать слоновью зубную пасту]()
![пользоваться таблицей Менделеева]()
![рассчитать концентрацию раствора]()
![определить степень окисления]()
![найти число нейтронов в атоме]()
![рассчитать атомную массу]()
![найти электроны]()
![посчитать pH]()
![написать ионное уравнение]()
![разбавить раствор]()
![сделать сухой лед]()
![рассчитать нормальность раствора]()
Об этой статье
Как написать электронную конфигурацию атома любого элемента
В создании этой статьи участвовала наша опытная команда редакторов и исследователей, которые проверили ее на точность и полноту.
Команда контент-менеджеров wikiHow тщательно следит за работой редакторов, чтобы гарантировать соответствие каждой статьи нашим высоким стандартам качества.
Электронная конфигурация атома — это численное представление его электронных орбиталей. Электронные орбитали — это области различной формы, расположенные вокруг атомного ядра, в которых математически вероятно нахождение электрона. Электронная конфигурация помогает быстро и с легкостью сказать читателю, сколько электронных орбиталей есть у атома, а также определить количество электронов, находящихся на каждой орбитали. Прочитав эту статью, вы освоите метод составления электронных конфигураций.
Найдите атомный номер вашего атома. Каждый атом имеет определенное число электронов, связанных с ним. Найдите символ вашего атома в таблице Менделеева. Атомный номер — это целое положительное число, начинающееся от 1 (у водорода) и возрастающее на единицу у каждого последующего атома. Атомный номер — это число протонов в атоме, и, следовательно, это еще и число электронов атома с нулевым зарядом.
- Например, атом натрия с зарядом -1 будет иметь дополнительный электрон в добавок к своему базовому атомному числу 11. Иначе говоря, в сумме у атома будет 12 электронов.
- Если речь идет об атоме натрия с зарядом +1, от базового атомного числа 11 нужно отнять один электрон. Таким образом, у атома будет 10 электронов.
- s-подуровень (любое число в электронной конфигурации, которое стоит перед буквой "s") содержит единственную орбиталь, и, согласно Принципу Паули, одна орбиталь может содержать максимум 2 электрона, следовательно, на каждом s-подуровне электронной оболочки может находиться 2 электрона.
- p-подуровень содержит 3 орбитали, и поэтому может содержать максимум 6 электронов.
- d-подуровень содержит 5 орбиталей, поэтому в нем может быть до 10 электронов.
- f-подуровень содержит 7 орбиталей, поэтому в нем может быть до 14 электронов.
- g-, h-, i- и k-подуровни являются теоретическими. Атомы, содержащие электроны в этих орбиталях, неизвестны. g-подуровень содержит 9 орбиталей, поэтому теоретически в нем может быть 18 электронов. В h-подуровне может быть 11 орбиталей и максимум 22 электрона; в i-подуровне —13 орбиталей и максимум 26 электронов; в k-подуровне — 15 орбиталей и максимум 30 электронов.
- Запомните порядок орбиталей с помощью мнемонического приема: [1] X Источник информации
Sober Physicists Don't Find Giraffes Hiding In Kitchens (трезвые физики не находят жирафов, скрывающихся на кухнях).
- Вот, например, простейшая электронная конфигурация: 1s 2 2s 2 2p 6 . Эта конфигурация показывает, что на подуровне 1s имеется два электрона, два электрона — на подуровне 2s и шесть электронов на подуровне 2p. 2 + 2 + 6 = 10 электронов в сумме. Это электронная конфигурация нейтрального атома неона (атомный номер неона — 10).
- Электронная конфигурация атома, в котором заполнены все орбитали, будет иметь следующий вид: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 10 7p 6
- Обратите внимание, что приведенная выше запись, когда заполнены все орбитали, является электронной конфигурацией элемента Uuo (унуноктия) 118, атома периодической системы с самым большим номером. Поэтому данная электронная конфигурация содержит все известные в наше время электронные подуровни нейтрально заряженного атома.
- Заполняйте орбитали согласно приведенному выше порядку, пока не достигнете двадцатого электрона. На первой 1s орбитали будут находится два электрона, на 2s орбитали — также два, на 2p — шесть, на 3s — два, на 3p — 6, и на 4s — 2 (2 + 2 + 6 +2 +6 + 2 = 20.) Иными словами, электронная конфигурация кальция имеет вид: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 .
- Обратите внимание: орбитали располагаются в порядке возрастания энергии. Например, когда вы уже готовы перейти на 4-й энергетический уровень, то сначала записывайте 4s орбиталь, а затем 3d. После четвертого энергетического уровня вы переходите на пятый, на котором повторяется такой же порядок. Это происходит только после третьего энергетического уровня.
- В частности, две самые левые колонки содержат атомы, чьи электронные конфигурации заканчиваются s-орбиталями, в правом блоке таблицы представлены атомы, чьи конфигурации заканчиваются p-орбиталями, а в нижней части атомы заканчиваются f-орбиталями.
- Например, когда вы записываете электронную конфигурацию хлора, размышляйте следующим образом: "Этот атом расположен в третьем ряду (или "периоде") таблицы Менделеева. Также он располагается в пятой группе орбитального блока p периодической системы. Поэтому, его электронная конфигурация будет заканчиваться на . 3p 5
- Обратите внимание: элементы в области орбиталей d и f таблицы характеризуются энергетическими уровнями, которые не соответствуют периоду, в котором они расположены. Например, первый ряд блока элементов с d-орбиталями соответствует 3d орбиталям, хотя и располагается в 4 периоде, а первый ряд элементов с f-орбиталями соответствует орбитали 4f, несмотря на то, что он находится в 6 периоде.
- Чтобы понять эту концепцию, полезно будет написать пример конфигурации. Давайте напишем конфигурацию цинка (атомный номер 30), используя сокращение, включающее благородный газ. Полная конфигурация цинка выглядит так: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 . Однако мы видим, что 1s 2 2s 2 2p 6 3s 2 3p 6 — это электронная конфигурация аргона, благородного газа. Просто замените часть записи электронной конфигурации цинка химическим символом аргона в квадратных скобках ([Ar].)
- Итак, электронная конфигурация цинка, записанная в сокращенном виде, имеет вид: [Ar]4s 2 3d 10 .
- Учтите, если вы пишете электронную конфигурацию благородного газа, скажем, аргона, писать [Ar] нельзя! Нужно использовать сокращение благородного газа, стоящего перед этим элементом; для аргона это будет неон ([Ne]).
![Изображение с названием ADOMAH Table v2]()
- В периодической таблице ADOMAH горизонтальные ряды представляют группы элементов, такие как галогены, инертные газы, щелочные металлы, щелочноземельные металлы и т.д. Вертикальные колонки соответствуют электронным уровням, а так называемые "каскады" (диагональные линии, соединяющие блоки s,p,d и f) соответствуют периодам.
- Гелий перемещен к водороду, поскольку оба этих элемента характеризуются орбиталью 1s. Блоки периодов (s,p,d и f) показаны с правой стороны, а номера уровней приведены в основании. Элементы представлены в прямоугольниках, пронумерованных от 1 до 120. Эти номера являются обычными атомными номерами, которые представляют общее количество электронов в нейтральном атоме.
- Обратите внимание на номера от 1 до 8 в основании таблицы. Это номера электронных уровней, или номера колонок. Игнорируйте колонки, которые содержат только вычеркнутые элементы. Для эрбия остаются колонки с номерами 1,2,3,4,5 и 6.
- Обратите внимание: Приведенная выше электронная конфигурация Er записана в порядке возрастания номера электронного подуровня. Ее можно также записать в порядке заполнения орбиталей. Для этого следуйте по каскадам снизу вверх, а не по колонкам, когда вы записываете блоки-колонки: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 12 .
Посчитайте электроны для каждого электронного подуровня. Подсчитайте элементы, в каждом блоке-колонке которые не были вычеркнуты, прикрепляя по одному электрону от каждого элемента, и запишите их количество рядом с символом блока для каждого блока-колонки таким образом: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 4f 12 5s 2 5p 6 6s 2 . В нашем примере это электронная конфигурация эрбия.
Читайте также:



















