Конспект щелочные и щелочноземельные металлы
Обновлено: 01.07.2024
На уроке девятиклассники с помощью проблемного химического эксперимента выясняют способны ли щелочные и щелочноземельные металлы вытеснять ионы других металлов из растворов солей.
| Вложение | Размер |
|---|---|
| vzaimod_aktivnyuh_metallov_s_rastvorami_soley.docx | 29.17 КБ |
Подтяните оценки и знания с репетитором Учи.ру
За лето ребенок растерял знания и нахватал плохих оценок? Не беда! Опытные педагоги помогут вспомнить забытое и лучше понять школьную программу. Переходите на сайт и записывайтесь на бесплатный вводный урок с репетитором.
Вводный урок бесплатно, онлайн, 30 минут
Предварительный просмотр:
Тема: Взаимодействие щелочных и щелочноземельных металлов с растворами солей
Тип урока: урок освоения новых знаний.
- На основе проблемного демонстрационного опыта формировать у учащихся правильное представление о взаимодействии щелочных и щелочно-земельных металлов с растворами различных солей.
- развитие познавательного интереса, коммуникативных качеств, умение сравнивать, обобщать, выделять главное и прогнозировать
- развитие внимания, умения наблюдать, способствовать развитию исследовательских навыков.
- в оспитывать в детях чувства товарищества, умения работать в коллективе, воспитывать интерес у обучающихся к урокам химии, соблюдать технику безопасности при работе с веществами.
Учитель . Вспомните, какие металлы взаимодействуют с растворами солей?
Учитель . Давайте сначала посмотрим опыт:
Взаимодействие раствора сульфата меди (II) с железом
Опыт 1 . Взаимодействие раствора сульфата меди (II) с железом.
Учитель . Какие признаки реакции вы наблюдали?
признак реакции: выделение красной меди, изменение цвета раствора (с течением времени) с голубого на желтоватый
CuSO 4 + Fe = FeCI 2 + Cu
Опыт 2. Взаимодействие раствора сульфата железа (II) с медью
В раствор хлорида железа (II) опускаем медную пластину, через 2-3 минуты вынимаем пластину из раствора. Что вы наблюдаете?
Ответ: никаких изменений с медной пластиной не произошло.
Вывод: Хлорид хлорида железа (II) не вступает в реакцию с медью. Почему?
FeSO 4 + Cu = р. н. и
С растворами солей, реагируют металлы, стоящие в электрохимическом ряду напряжений металлов впереди металла, входящего в состав данной соли. При этом более активный металл вытесняет менее активный из раствора соли.
Задание: допишите уравнения возможных химических реакций
А) Pb(NO 3 ) 2 + Ni →
Учитель. Будут ли щелочные и щелочноземельные металлы взаимодействовать с растворами солей и вытеснять менее активные металлы из растворов этих солей?
Не будем торопиться с составлением уравнения химических реакций. Обратимся сначала к химическому эксперименту.
Опыт 3 . Взаимодействие раствора сульфата меди (II) с литием.
Возьмем для первого эксперимента щелочной металл литий и поместим его небольшой кусочек в раствор соли сульфата меди (II)
В ходе эксперимента наблюдаем, что на поверхности раствора соли протекает энергичная реакция, сопровождающаяся выделением пузырьков газа. Одновременно, идёт образование осадка сначала голубого цвета, который сразу превращается в осадок черного цвета.
Если к пробирке с выделяющимся газом поднести горящую лучинку раздаётся характерный хлопок. Так сгорает газ водород.
Признак реакции – выделение газа, образование черного осадка
Схема: CuSO 4 (раствор) + Li → H 2 ↑ + осадок чёрного цвета
Почему при взаимодействии лития с раствором сульфата меди(II) образуется чёрный осадок?
Давайте рассуждать. Если бы литий вступил в реакцию замещения с сульфатом меди (II), мы наблюдали бы, как и в первом опыте, образование меди в виде красного налёта. Но мы этого не увидели. Следовательно, что можно предположить?
Щелочной металл литий вступает в реакцию не с солью, а с водой.
Рассуждаем дальше . В ходе опыта наблюдается выделение газа, который сгорает с характерным звуком. Этот газ водород. Выделение водорода возможно при взаимодействии щелочного металла лития с водой.
Щелочной металл активно взаимодействует с водой, образуя щелочь гидроксил лития и водород . Эта реакция экзотермична и сопровождается выделением большого количества теплоты.
2 Li + 2H 2 O = 2LiOH + H 2 ↑+ Q t = 70 º
Образующийся в ходе реакции гидроксид лития не дает осадка, так как он растворимый, следовательно, на этом реакции не закончились.
Гидроксид лития вступает в реакцию с сульфатом меди (II), образуя осадок синего цвета гидроксид меди (II), но этот осадок очень быстро превращается в чёрный. Почему?
2LiОН + CuSO 4 = Li 2 SO 4 + Cu(OH) 2
Разложение полученного гидроксида меди (II) (температура выше 50°С): Cu(OH) 2 = CuO + H 2 O
или в обобщенном виде:
2Li + H 2 O + CuSO 4 = Li 2 SO 4 + H 2 ↑ + CuO
Уравнения последовательно протекающих реакций:
2Li + 2H 2 O = 2LiOH + H 2 ↑ + Q
2LiOH + CuSO 4 = Cu(OH) 2 + Li 2 SO 4
Cu(OH) 2 = H 2 O + CuO
В обобщённом виде :
2Li+2H 2 O+CuSO 4 =CuО+H 2 О +H 2 ↑+Li 2 SO 4
Вопрос:
Будут ли щелочноземельные металлы взаимодействовать с растворами солей, так же как и щелочные?
Опыт 4 . Взаимодействие раствора хлорида меди (II) с кальцием.
Рассмотрим взаимодействие щелочноземельного металла кальция с раствором хлорида меди (II)
В ходе эксперимента наблюдаем выделение пузырьков газа и образование осадка голубого цвета. Превращение голубого осадка в чёрный в данной химической реакции не наблюдается.
Са + 2H 2 O = Са(OH) 2 + H 2 ↑
Са(OH) 2 + CuCl 2 = Cu(OH) 2 + СаCl 2
Са(OH) 2 + 2H 2 O+CuCl 2 =CuCl 2 +H 2 ↑+ Cu(OH) 2
Почему при взаимодействии щелочных металлов с растворами солей гидроксид меди (II) разлагается до оксида меди (II), а с щелочноземельными металлами такого не происходит?
Ответ. Дело в том, что кальций менее активный металл, чем литий и его теплоты гидратации недостаточно для разложения гидроксида меди (II).
Вопрос: В чём отличие в свойствах щелочных и щелочноземельных металлов при взаимодействии их с растворами солей от других металлов?
Обобщение и выводы:
Щелочные и щелочноземельные металлы не вытесняют менее активные металлы из растворов солей, а протекают более сложные химические процессы с участием воды.
Вопрос: возможно ли вытеснение активным металлом менее активного из его соли?
Реакцию вытеснения более активным металлом менее активного (стоящего правее) из его соли для этих металлов можно осуществить только в расплаве соли, поскольку с водой они непосредственно и активно взаимодействуют
2 Na+ ZnCl 2 → Zn + 2NaCl
Составьте уравнения реакций между: литием и раствором хлорида магния
Составьте уравнения реакций между: литием и раствором хлорида железа (III)
Конспект урока по химии "Изучение свойств щелочных и щелочноземельных металлов"
-Прежде чем приступить к изучению нового материала, нам необходимо вспомнить:
1. Характеристика металлов по положению в периодической системе химических элементов, на примере Li , Mg .
-Эта информация пригодиться нам сегодня на уроке, и поможет в постановке темы урока.
-Молодцы, сейчас послушайте небольшие исторические сведения, которые также помогут нам в постановке темы урока.
В 1807 г. в Англиий Г. Деви открыл натрий и калий.
«Натрун» - сода, «алкали» - щелочь.
В 1817г. в Швеции А. Арфедсоном был открыт литий.
В 1860 – 1861г.г. в Германии Р.Бунзен и Г.Кирхгоф открыли рубидий «темно-красный» и цезий «небесно-голубой».
В 1939г. во Франции М. Пере открыл радиоактивный элемент франций, который назвал в честь своей страны - Франции.
В 1798 году французский химик Льюис Воклен выделил из берилла окись, в конце 70-х годов 19 века установили вес этого металла и он нашёл своё место в П.С. – бериллий.
В компактной форме и в ощутимых количествах магний был впервые получен в 1828 г. Антуаном Александром Брутом Бусси (1794–1882) путем нагревания смеси
безводного MgCl2 c калием в стеклянной трубке.
-О каких элементах пойдет речь на уроке? (Металлы IA группы и элементы IIB )
-Запишите число и тему урока.
-Как называют металлы I А и II А группы: щелочные и щелочноземельные металлы.
· Составьте электронные формулы для щелочных металлов
· Определите состав атомов щелочных металлов
· Какова общая формула высших оксидов и водородного соединения для металлов 1 А группы и IIA группы?
Закономерности:
· Сходство внешнего электронного слоя.
· Увеличение числа электронных слоев в атоме.
· Радиусы атомов увеличиваются от Li к Cs, следовательно, увеличиваются и восстановительные свойства металлов от Li к Cs, металлические усиливаются, неметаллические ослабевают.
· Степень окисления металлов I группы главной подгруппы в соединениях постоянная и равна +1. (Отдаёт 1 электрон) и +2 (отдаёт 2 электрона).
Физические свойства щелочных металлов
В твёрдом агрегатном состоянии атомы связаны металлической связью. Наличие металлической связи обусловливает общие физические свойства простых веществ-металлов: металлический блеск, ковкость, пластичность, высокую тепло- и электропроводность.
В свободном виде простые вещества, образованные элементами IA группы — это легкоплавкие металлы серебристо-белого (литий, натрий, калий, рубидий) или золотисто-жёлтого (цезий) цвета, обладающие высокой мягкостью и пластичностью.
Наиболее твёрдым является литий, остальные щелочные металлы легко режутся ножом и могут быть раскатаны в фольгу.
Физические свойства щелочноземельных металлов
К щёлочноземельным металлам часто относят только кальций, стронций, барий и радий, реже магний и бериллий. Однако согласно номенклатуре ИЮПАК щёлочноземельными металлами следует считать все элементы 2-й группы.
Первый элемент этой группы, бериллий, по большинству свойств гораздо ближе к алюминию, чем к высшим аналогами группы, в которую он входит.
Второй элемент этой группы, магний, уже обладает некоторыми химическими свойствами, общими для щелочноземельных металлов, но в остальном заметно отличается от них, в частности, значительно меньшей активностью, и рядом свойств напоминает всё тот же алюминий.
Все щёлочноземельные металлы серые, твёрдые при комнатной температуре вещества. В отличие от щелочных металлов, они существенно более твёрдые, и ножом преимущественно не режутся (исключение — стронций). Рост плотности щёлочноземельных металлов наблюдается, только начиная с кальция. Самый тяжёлый — радий, по плотности сравнимый с германием.
Химические свойства щелочных и щелочноземельных металлов.
1. Взаимодействие с кислородом (основные оксиды) Магний горит с выделением вспышки яркой.
4 Li + O 2 =2 Li 2 O (оксид лития)
2 Na + O 2 = Na 2 O 2 (пероксид натрия) 2 Na 2 O 2 +2 NaOH =2 Na 2 O + H 2
2 Ca + O 2 =2 CaO (оксид кальция)
2. Взаимодействие с водой
2 Li +2 H 2 O =2 LiOH + H 2 (гидроксид лития, натрий в жёлтый окрашивает пламя, калий в фиолетовый- активный металлы, больше взрыв)
Ba +2 H 2 O = Ba ( OH )2+ H 2 (гидроксид бария)
3. Взаимодействие с водородом
2 Na + H 2 =2 NaH (гидрид натрия)
Ca + H 2 = CaH 2 (гидрид кальция)
4. Взаимодействие с галогенами
2 Na + Cl 2 =2 NaCl (хлорид натрия)
Ba + Cl 2 = BaCl 2 (хлорид бария)
5. Взаимодействие с кислотами
2 Na +2 HCl =2 NaCl + H 2 (хлорид натрия)
Ba +2 HCl = BaCl 2 + H 2 (хлорид бария)
Получение щелочных и щелочноземельных металлов
Электролиз галогенидов
1. NaCl=Na + +Cl - 2NaCl=2Na+Cl2
Нахождение в природе.
Из щелочных металлов наиболее широко распространены в природе натрий и калий. Но из-за высокой химической активности они встречаются только в виде соединений.
Основными источниками натрия и калия являются:
· каменная соль (хлорид натрия NaCl),
· глауберова соль, или мирабилит — декагидрат сульфата натрия Na2SO4 ⋅ 10H2O,
· сильвин — хлорид калия KCl,
· сильвинит — двойной хлорид калия-натрия KC l ⋅ NaCl и др.
Соединения лития, рубидия и цезия в природе встречаются значительно реже, поэтому их относят к числу редких.
Из щелочноземельных металлов кальций наиболее широко распространён в природе, а радиоактивный радий - менее всего.
Все щелочноземельные металлы обладают высокой химической активностью, поэтому встречаются в природе только в виде соединений.
Основными источниками кальция являются его карбонаты CaCO3 (мел, мрамор, известняк).
В свободном виде простые вещества представляют собой типичные металлы от серого до серебристого цвета.
3. Закрепление изученного материала
1. Щелочноземельные металлы находятся в:
1) I A группе; 2) II А группе; 3) IV А группе 4) VIII А группе
2. Какой из указанных металлов является щелочным:
1) Mg; 2) Zn; 3) Ba; 4) K
3. Степень окисления щелочных металлов:
1) +1; 2) +2; 3) -2; 4) +3
4. Распределение электронов по энергетическим уровням в атоме магния:
1) 2,8,2; 2) 2,8,1; 3) 2,8,8,1; 4) 1,8,8,1
5. Щелочноземельные металлы:
А. Серебристо – белые.
Б. Легко режутся ножом.
В. Неактивные металлы.
1) Все утверждения не верны; 2) Верны А и Б; 3) Верны А и С
6. При взаимодействии с кислородом натрий образует:
1) оксид; 2) пероксид; 3) натрий не реагирует с кислородом.
7. С каким из следующих веществ реагирует кальций?
8. Соли калия окрашивают пламя в:
1) зеленый цвет; 2) красный цвет; 3) желтый цвет; 4) фиолетовый цвет
9. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения (6 баллов):
10. Решите задачу (6 баллов). При взаимодействии натрия массой 10 г с водой выделился водород. Определите объём водорода (н.у.).
Щелочные и щелочноземельные металлы

Наиболее активными среди металлической группы являются щелочные и щелочноземельные металлы. Это мягкие лёгкие металлы, вступающие в реакции с простыми и сложными веществами.
Общее описание
Активные металлы занимают первую и вторую группы периодической таблицы Менделеева. Полный список щелочных и щелочноземельных металлов:
Электронная конфигурация щелочных металлов – ns 1 , щелочноземельных металлов – ns 2 .
Соответственно, постоянная валентность щелочных металлов – I, щелочноземельных – II. За счёт небольшого количества валентных электронов на внешнем энергетическом уровне активные металлы проявляют мощные свойства восстановителя, отдавая внешние электроны в реакциях. Чем больше энергетических уровней, тем меньше связь с внешних электронов с ядром атома. Поэтому металлические свойства возрастают в группах сверху вниз.
Из-за активности металлы I и II групп находятся в природе только в составе горных пород. Чистые металлы выделяют с помощью электролиза, прокаливания, реакции замещения.
Физические свойства
Щелочные металлы имеют серебристо-белый цвет с металлическим блеском. Цезий – серебристо-жёлтый металл. Это наиболее активные и мягкие металлы. Натрий, калий, рубидий, цезий режутся ножом. По мягкости напоминают воск.

Рис. 2. Разрезание натрия ножом.
Щелочноземельные металлы имеют серый цвет. По сравнению со щелочными металлами являются более твёрдыми, плотными веществами. Ножом можно разрезать только стронций. Самый плотный металл – радий (5,5 г/см 3 ).
Наиболее лёгкими металлами являются литий, натрий и калий. Они плавают на поверхности воды.
Химические свойства
Щелочные и щелочноземельные металлы реагируют с простыми веществами и сложными соединениями, образуя соли, оксиды, щёлочи. Основные свойства активных металлов описаны в таблице.
Взаимодействие
Щелочные металлы
Щелочноземельные металлы
Самовоспламеняются на воздухе. Образуют надпероксиды (RO2), кроме лития и натрия. Литий образует оксид при нагревании выше 200°C. Натрий образует смесь пероксида и оксида.
На воздухе быстро образуются защитные оксидные плёнки. При нагревании до 500°С самовоспламеняются.
Реагируют при нагревании с серой, водородом, фосфором:
С азотом реагирует только литий, с углеродом – литий и натрий:
Реагируют при нагревании:
Бурно реагируют с образованием галогенидов:
Образуются щёлочи. Чем ниже металл расположен в группе, тем более активно протекает реакция. Литий взаимодействует спокойно, натрий горит жёлтым пламенем, калий – со вспышкой, цезий и рубидий взрываются.
Менее активно, чем щелочные металлы, реагируют при комнатной температуре:
Со слабыми и разбавленными кислотами реагируют с взрывом. С органическими кислотами образуют соли.
Из всех металлов реагирует только бериллий:
Вступают в реакцию все металлы, кроме бериллия. Замещают менее активные металлы:
2Mg + ZrO2 → Zr + 2MgO

Рис. 3. Реакция калия с водой.
Щелочные и щелочноземельные металлы можно обнаружить с помощью качественной реакции. При горении металлы окрашиваются в определённый цвет. Например, натрий горит жёлтым пламенем, калий – фиолетовым, барий – светло-зелёным, кальций – тёмно-оранжевым.
Что мы узнали?
Щелочные и щелочноземельные – наиболее активные металлы. Это мягкие простые вещества серого или серебристого цвета с небольшой плотностью. Литий, натрий, калий плавают на поверхности воды. Щелочноземельные металлы более твёрдые и плотные, чем щелочные. На воздухе быстро окисляются. Щелочные металлы образуют надпероксиды и пероксиды, оксид образует только литий. Бурно реагируют с водой при комнатной температуре. С неметаллами реагируют при нагревании. Щелочноземельные металлы вступают в реакцию с оксидами, вытесняя менее активные металлы. Со щелочами реагирует только бериллий .
Химические свойства щелочных и щелочноземельных металлов

Химические свойства щелочных и щелочноземельных металлов схожи. На внешнем энергетическом уровне щелочных металлов находится один электрон, щелочноземельных – два. При реакциях металлы легко расстаются с валентными электронами, проявляя свойства сильного восстановителя.
Щелочные
В I группу периодической таблицы входят щелочные металлы:
Они отличаются мягкостью (можно разрезать ножом), низкими температурами плавления и кипения. Это наиболее активные металлы.
Химические свойства щелочных металлов представлены в таблице.
Реакция
Особенности
Уравнение
Быстро окисляются на воздухе. Литий образует оксид при температуре выше 200°C. Натрий образует смесь – 80 % пероксида (R2O2) и 20 % оксида. Остальные металлы образуют надпероксиды (RO2)
Реагирует только литий при комнатной температуре
Реакция проходит бурно
При нагревании. Образуют сульфиды, гидриды, фосфиды, силициды. С углеродом реагируют только литий и натрий, образуя карбиды
Спокойно реагирует только литий. Натрий горит жёлтым пламенем. Калий реагирует со вспышкой. Цезий и рубидий взрываются
С соляной, фосфорной, разбавленной серной кислотами реагируют с взрывом. При реакции с концентрированной серной кислотой выделяется сероводород, с концентрированной азотной кислотой образует оксид азота (I), с разбавленной азотной кислотой – азот
– 2Na + 2HCl → 2NaCl + H2;
Могут реагировать с органическими кислотами и спиртами.
Щелочноземельные
Во II группе таблицы Менделеева находятся щелочноземельные металлы:
- бериллий;
- магний;
- кальций;
- стронций;
- барий;
- радий.
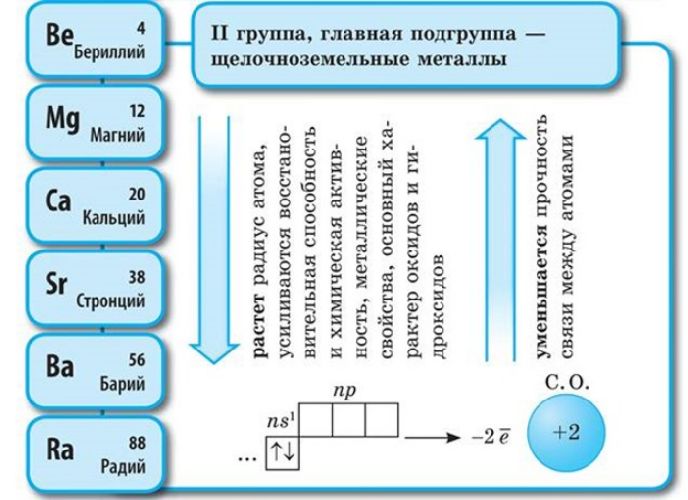
Рис. 2. Щелочноземельные металлы.
В отличие от щелочных металлов они более твёрдые. Ножом можно разрезать только стронций. Наиболее плотный металл – радий (5,5 г/см 3 ).
Бериллий взаимодействует с кислородом только при нагревании до 900°С. С водородом и водой не реагирует при любых условиях. Магний окисляется при температуре 650°С и взаимодействует с водородом под высоким давлением.
В таблице отражены основные химические свойства щелочноземельных металлов.
Образуют оксидные плёнки. При нагревании до 500°С самовоспламеняются
При высокой температуре образуют гидриды
С галогенами и неметаллами
Реагируют при нагревании
При комнатной температуре
Реагируют все металлы с образованием солей
Реагирует только бериллий
Замещают менее активные металлы в оксидах. Исключение – бериллий
Ионы щелочных и щелочноземельных металлов в солях легко обнаружить по изменению цвета пламени. Соли натрия горят жёлтым пламенем, калия – фиолетовым, рубидия – красным, кальция – кирпично-красным, бария – жёлто-зелёным. Соли этих металлов используют для создания фейерверков.
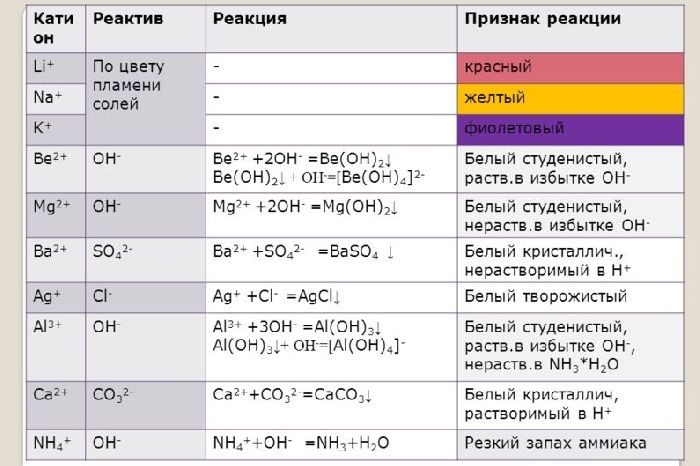
Рис. 3. Качественная реакция.
Щелочные и щелочноземельные металлы – активные элементы периодической таблицы, вступающие в реакции с простыми и сложными веществами. Щелочные металлы более мягкие, бурно реагируют с водой и галогенами, легко окисляются на воздухе, образуя оксиды, пероксиды, надпероксиды, взаимодействуют с кислотами и аммиаком. При нагревании вступают в реакцию с неметаллами. Щелочноземельные металлы реагируют с неметаллами, кислотами, водой. Бериллий не взаимодействует с водородом и водой, но реагирует со щелочами и с кислородом при высокой температуре.
Конспект открытого урока по теме "Щелочные и щелочноземельные металлы. Подготовка к контрольной работе"
план-конспект урока (химия, 9 класс) по теме
Как увлекательно подготовиться к контрольной работе по химии по теме щелочные и щелочноземельные металлы.
| Вложение | Размер |
|---|---|
| подготовка к контрольной работе | 94.2 КБ |
Конспект открытого урока
по химии в 9 классе
Учитель: Инюшкина Т.С.
Тема урока : Таблица Менделеева. Химические свойства щелочных и щелочноземельных металлов.
Тип урока : IV (обобщение и систематизация знаний).
Цель урока : Обобщение и закрепление пройденного материала.
Подготовка к контрольной работе.
- отработка базовых знаний по теме «Таблица Менделеева. Положение щелочных, щелочноземельных металлов в таблице Менделеева и их химические свойства».
Актуализация опорных знаний:
- электронное строение атома,
- количество вещества - моль,
- массовая доля элемента в соединении.
- умение самопроверять и анализировать свои ошибки;
- формирование, навыков самооценки и самоконтроля;
- умение работать во времени.
- воспитание бережного отношения к природе (экологическое воспитание),
- формировать систему нравственного отношения ученик-учитель,
- умение слушать учителя,
- воспитывать высокую работоспособность и организованность.
- создать ситуацию успеха,
- поддерживать атмосферу добра и взаимопонимания.
- ручка, набор цветных ручек, карточки с заданиями, компьютер, видеозаписи химических опытов, таблица Менделеева, таблица растворимости солей, ряд напряжений металлов, Таблица моих успехов.
Этапы и виды работ на уроке
Какие задачи решались в ходе выполнения задания
Настрой ученика на работу, мобилизация внимания.
Подготовка учеников к работе на уроке, восстановление визуального контакта.
Учитель в беседе с учениками определяет тему урока, его цель.
Объясняю, как заполняется «Таблица моих успехов».
Определение темы урока, его цели.
Путешествие № 1 «Д.И.Менделеев»
Предлагаю карточку с ответами.
Работает по Карточке № 1.
1.Сколько периодов в таблице Менделеева?
2.Сколько групп в таблице Менделеева?
3.Укажите заряд ядра атомов следующих элементов:
4.Укажите число электронов в атомах элементов:
Самопроверка по карточке с ответами.
Умение слушать учителя.
Формирование нравственного отношения учитель – ученик.
Работа по карточке № 2. (приложение)
Работа с тестом.
Формирование навыков самоконтроля и самооценки.
VII-VIII. Самостоятельная работа
Показываю видеозапись химического опыта «Горение кальция в кислороде».
Предлагаю на выбор три задачи разной сложности, отводится различное количество времени.
Работа по карточке №3. (приложение) Работа в тетради.
Выбирает и решает задачу.
Формирование навыков самоконтроля и самооценки. Умение работать во времени.
Провожу минуту психологической разгрузки. Читаю стихи.
VIII. Совместная работа
Путешествие № 3 «Космический корабль». Показываю видеозапись химического опыта «Само-воспламенение цезия»
Совместно решаем задачу высокой сложности.
Работа по карточке № 4. ( приложение)
Решает задачу под руководством учителя.
Подводит итог урока
Подводит итого своей работы на уроке. Заполняет Таблицу до конца.
1. Сколько периодов в таблице Менделеева?
2. Сколько групп в таблице Менделеева?
3. Укажите заряд ядра атомов следующих элементов:
4. Укажите число электронов в атомах элементов: а) He, б) O, в) Be.
- Является щелочным металлом
- водород 2) цезий
- алюминий 4) кальций
- Размещение электронов по уровням, соответствующее щелочному металлу
- 2,8,3 2) 2,8,2
- 2 ,8,4 4) 2,8,1
- Радиус щелочного металла возрастает в ряду:
1) натрий – калий – цезий
2) калий – литии – рубидий
3) рубидий – цезий – литий
4) литий – калий – натрий
Задача № 1 – на «4»
Кальций, массой 20 г сожгли в избытке кислорода. Определите массу образовавшегося оксида.
Задача № 2 – на «5»
Определите щелочноземельный металл, если в его оксиде массовая доля кислорода равна 0,2857.
Задача № 3 – на «5+»
Кальций, массой 8 г поместили в воду. Определите: массу образовавшегося гидроксида кальция и объем (н.у.) выделившегося водорода.
Супероксиды щелочных металлов используются в космических кораблях как источник кислорода и уловитель углекислого газа. Какую массу супероксида цезия необходимо запасти для двух марсиан на 10 суток, если каждый марсианин потребляет 22,4 л кислорода в сутки?
Ответы Каточка № 3:
Задача № 1 ответ: 28 г
Задача № 2 ответ: Са
Задача № 3 ответ: 14,8 г, 4,48 л
Ответы Карточка № 1
Таблица моих успехов
по теме «Периодический Закон и Периодическая система элементов Д.И.Менделеева.
Щелочные и щелочноземельные металлы».
ученика(цы) 9 кл. __________________________________________________
Люди похожи на атомы,
Но - как венец творенья
- Они на орбиты наматывают
Не электроны, а - Время.
Время сжимается в массу.
Жаль, синтез не вечно длится,
- Жизни ресурс, как в кассу,
Заложен в ту же Таблицу.
Таит человеко-атом
Такую энергию-силу ,
Что с каждым годичным квантом
- Меняет и статус и символ.
В годик - все Водородики ,
Борики - в детском саду.
В школу пошли - Кислородики .
Хлоры - готовы к труду.
И - ускорение времени
- Паспортизуются Кремнии .
Девушкам в возрасте Серы
Снятся давно кавалеры.
Стали мальчишки Аргонами
- Их помечают погонами.
Лучший Период - четвёртый ,
До тридцати шести:
Можно и Богу и чёрту
Прекрасную чушь нести.
Прут по нему, как на танках,
- Броня и нервы крепки,
Все в двадцать два - Титаны !
Лишь часть в тридцать три - Мышьяки .
В сорок четыре многие
Роются в генеалогии:
В званьи Рутения модно
Слыть хоть чуть-чуть благородным.
И вот юбилейно-звучные
Первые пятьдесят.
Эпитетом не научным
Под золото цифры "косят".
Но прав, как всегда, Менделеев,
- Лишь Олово в том юбилее.
Вот женщины, чуть по сурьм лённые,
- Ещё у них всё "на пять"
- Клеточки предпенсионные
Вдруг начинают считать.
И ждут, когда в возрасте Цезия
Дадут им - для внуков - "пенсию".
А мужики кочевряжатся
И не хотят в Неодимы .
Они в шестьдесят - им кажется
- В реакциях необходимы.
Они ещё - дам обожатели
И должности ждут "на вырост".
(А при лантаноидном сжатии
Возможен кадровый выброс).
Осилив легко, как смолоду,
Азартных алхимиков путь,
- Из Платины сделайте Золото ,
Из Золота сделайте Ртуть !
И выше - тропою не торною
К лучам девяностого Тория .
А там - через звёзды иль тернии
- К нулям виртуального Фермия !
Читайте также:
