Контрольная работа по химии 11 класс металлы с ответами
Обновлено: 19.05.2024
Тесты по химии 11 класс. Тема: "Металлы"
Правильный вариант ответа отмечен знаком +
1. В какой группе находится металл полоний:
2. К четвертой группе относится элемент:
3. Как проходит условная граница между между металлическими и неметаллическими элементами:
4. Металлургический процесс включает в себя:
+ восстановление ионов металла
- окисление ионов неметалла
- восстановление ионов неметалла
5. Пирометаллургией является:
+ процесс получения металлов из их соединений при высокой температуре
- процесс получения неметаллов из их соединений при низкой температуре
- процесс получения неметаллов из их соединений при высокой температуре
6. В пирометаллургии используются:
- как восстановители, так и окислители
7. При алюмотермии используют металл:
8. В гидрометаллургии получают:
+ металлы из растворов их соединений
- неметаллы из растворов их соединений
- воду из растворов их соединений
9. В электрометаллургии используется процесс:
- обработка при предельно высокой температуре
- реакция замещения и соединения
тест 10. При электролизе восстановителем является:
11. Чем определяются физические свойства металлов:
+ типом кристаллической решетки
- количеством протонов, электронов, нейтронов
- расположением в определенной группе или подгруппе
12. Отличием атомов металлов от неметаллов можно назвать:
+ содержат небольшое количество электронов на внешнем уровне, большой радиус и низкая электроотрицательность
- содержат большое количество электронов на внешнем энергетическом уровне, маленький радиус и высокая электроотрицательность
- содержат большое количество электронов на внешнем энергетическом уровне, большой радиус и высокая электроотрицательность
13. Металлической является связь:
+ между ионами металлов
- между ионами неметаллов
- между ионами металла и неметалла
14. Для какого агрегатного состояния не характерна металлическая связь:
- для жидкого состояния
- для твердого состояния
15. Чем обусловлена электропроводность металлов?
+ наличием свободных электронов
- наличием свободных нейтронов
- наличием свободных протонов
16. С повышением температуры электропроводность:
- может как повышаться, так и понижаться
17. Электропроводность увеличивается от:
+ ртути к серебру
- алюминия к цинку
18. Максимальной теплопроводностью обладает:
19. Наиболее пластичным металлом называют:
тест-20. Твердым веществом при нормальных условиях не является:
21. Самым твердым металлом является:
- щелочно – земельные металлы
22. Самым тяжелым металлом является:
23. Самым тугоплавким металлом является:
24. К черным металлам можно отнести:
25. Какие степени окисления имеют металлы:
- как положительные, так и отрицательные
26. Металлы в соединениях проявляют свойства:
- окислительно – восстановительные свойства
27. Какая закономерность уменьшения восстановительных свойств металлов:
+ слева направо, снизу-вверх
- справа налево, сверху вниз
28. На данном изображении представлена:
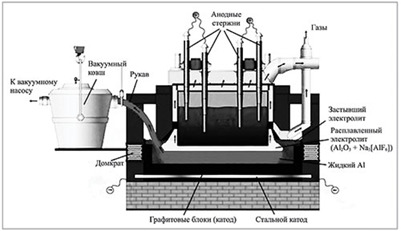
+ схема получения алюминия электролизом
- схема получения железа электролизом
- схема получения гидроксида алюминия электролизом
29. Чем левее находится металл в ряду, тем:
+ больше его восстановительная способность
- меньше его восстановительная способность
- больше его окислительная способность
тест_30. Лантаноиды на внешнем энергетическом уровне содержат по:
31. Сколько примерно имеются металлов в периодической системе Менделеева:
+ более девяти ста
- менее восьми ста
- менее двадцати ста
32. Во сколько раз литий легче осмия:
+ в сорок пять раз
- в шестьдесят раз
- в семьдесят раз
33. Провода высоковольтных изготавливают из:
34. Бронза является сплавом:
- железа и алюминия
- вольфрама и серебра
35. На данном рисунке представлена:
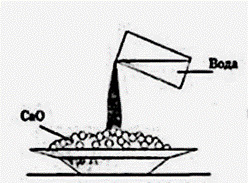
+ реакция гашения извести водой
- реакция соединения калия с хлором
- окисление перманганата калия
36. При взаимодействии с кислородом металлы образуют:
37. При взаимодействии щелочноземельных металлов с водой образуются:
- альдегиды и кетоны
38. Оксидом железа можно назвать:
39. В алюминотермии используется:
тест*40. Взаимодействие металлов с оксидами является реакцией:
Контрольная работа по химии 11 класс
материал по химии (11 класс) на тему
За лето ребенок растерял знания и нахватал плохих оценок? Не беда! Опытные педагоги помогут вспомнить забытое и лучше понять школьную программу. Переходите на сайт и записывайтесь на бесплатный вводный урок с репетитором.
Вводный урок бесплатно, онлайн, 30 минут
Предварительный просмотр:
Муниципальное бюджетное общеобразовательное учреждение
«Средняя общеобразовательная школа № 15 п. Березайка»
Бологовского района Тверской области
по теме «Металлы»
Составил: учитель химии
Часть А Тестовые задания с выбором ответа
1. s-Элементу 4-го периода ПСХЭ соответствует электронная формула:
а) 1s 2 2s 2 2p 6 3s 2 3p 6 3d 3 4s 2 в) 1s 2 2s 2 2p 6 3s 2 3p 6 3d 1 4s 2
б) 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 г) 1s 2 2s 2 2p 6 3s 1
2. Электронная формула иона натрия:
а) 1s 2 2s 2 2p 6 3s 2 б) 1s 2 2s 2 2p 6 в) 1s 2 2s 2 2p 6 3s 1 г) 1s 2 2s 2 2p 5
3. Переменную степень окисления в соединениях проявляет:
а) барий б) цинк в) железо г) рубидий
4 . Простое вещество – марганец – может являться:
а) только восстановителем в) только окислителем
б) и окислителем, и восстановителем
5. Схема превращений: Cr +6 →Cr +3 →Cr 0 представляет собой процессы:
а) восстановления в) окисления
б) окисления (1), восстановления (2) г) восстановления(1), окисления(2)
6. Восстановительные свойства в ряду химических элементов: Cs – Rb – K – Ca:
а ) изменяются периодически б) не изменяются в) ослабевают г) усиливаются
7. Формула вещества Х в уравнении реакции: Cu+2H 2 SO 4 =CuSO 4 +X+2H 2 O:
а) H 2 б) SO 2 в) H 2 S г) SO 3
8. Формулы продуктов электролиза раствора бромида калия на инертных электродах:
а) K, H 2 б) KOH, Br 2 , H 2 в)K, Br 2 г) KOH, H 2
9. Магний взаимодействует с каждым веществом группы:
а) водород, сульфат меди (II) (раствор), этатаналь
б) кислород, уксусная кислота, фосфор
в) оксид углерода (IV), оксид кальция, фенол (расплав)
г) глюкоза, этанол, бром
10. Основные свойства гидроксидов усиливаются в ряду:
а) KOH-NaOH-Be(OH) 2 -LiOH в) Be(OH) 2 -LiOH-NaOH-KOH
б) LiOH-Be(OH) 2 -NaOH-KOH г) KOH-NaOH-Be(OH) 2 -LiOH
Часть Б Задания со свободным ответом
11. Составьте формулы высшего оксида и гидроксида элемента, в ядре которого содержится 56 протонов. Назовите эти вещества, укажите их характер.
12. Составьте уравнения реакций следующих превращений: Al → X → AlCl 3 → Al(NO 3 ) 3 → X → KAlO 2
13. Дополните фразу: «В периоде с уменьшением заряда ядра атома от галогена к щелочному металлу радиус атомов …».
14. Сравните число атомов в 32 г меди и 12 г магния.
15. Рассчитайте объем, количество вещества и массу газа, полученного при взаимодействии 3,5 г лития с водой, взятой в избытке.
1. p-Элементу 4-го периода ПСХЭ соответствует электронная формула:
а) 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 1 в) 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 1
2. Электронная формула иона магния:
а) 1s 2 2s 2 2p 6 3s 2 б) 1s 2 2s 2 2p 6 в) 1s 2 2s 2 2p 6 г) 1s 2 2s 2 2p 5
а) барий б) хром в) кальций г) магний
4 . Простое вещество – железо – может являться:
5. Схема превращений: Cu +2 →Cu 0 →Cu +2 представляет собой процессы:
б) окисления (1), восстановления (2), г) восстановления(1), окисления(2)
6. Восстановительные свойства в ряду химических элементов: Rb – K –Na –Li:
7. Формула вещества Х в уравнении реакции: 2Fe+6H 2 SO 4 =Fe 2 (SO4) 3 +X+6H 2 O:
8. Формулы продуктов электролиза расплава хлорида натрия на инертных электродах:
а) Na, H 2 б) NaOH, Cl 2 , H 2 в) Na, Cl 2 г) NaOH, H 2
9. Алюминий взаимодействует с каждым веществом группы:
а) водород, сульфат меди (II) (раствор), метаналь
б) кислород, муравьиная кислота, сера
в) оксид углерода (IV), оксид бария, фенол (расплав)
г) глюкоза, этанол, хлор
10. Основные свойства гидроксидов ослабевают в ряду:
а) KOH-NaOH-LiOH-Be(OH) 2 в) Be(OH) 2 -LiOH-NaOH-KOH
11. Составьте формулы высшего оксида и гидроксида элемента, в ядре которого содержится 24 протона. Назовите эти вещества, укажите их характер.
12. Составьте уравнения реакций следующих превращений: Be → X → BeCl 2 → Be(NO 3 ) 2 → X → K 2 BeO 2
13. Дополните фразу: «В периоде с увеличением заряда ядра атома от галогена к щелочному металлу радиус атомов …».
14. Сравните число атомов в 108 г серебра и 20 г кальция.
15. Рассчитайте объем, количество вещества и массу газа, полученного при взаимодействии 12 г магния с водой, взятой в избытке.
По теме: методические разработки, презентации и конспекты
контрольная работа по химии 11 класс, по теме:"Предмет органической химии. Предельные углеводороды"
контрольная работа по химии 11 класс, по теме:"Предмет органической химии. Предельные углеводороды".
Контрольная работа по химии : " Классы неорганических веществ"
Контрольная работа по химии: "Классы неорганических веществ".

Тематическое планирование уроков химии, биологии и обществознания. Контрольные работы по химии и биологии.
Календарно - тематическое планирование уроков. Контрольные работы разработаны по вариантам.
Контрольная работа по химии в 9 классе по теме: "Органическая химия"
Данная контрольная работа предназначена для проверки уровня усвоения знаний учащимися за курс «Органическая химия» 9 класс.Задания составлены в форме теста. Тест содержит 16 вопросов с выбором одного .

Контрольная работа по химии для 10 класса (профиль) №1 по темам «Строение и классификация органических соединений», «Химические реакции в органической химии»
Контрольная работа предназначена для обучающихся профильного 10 класса. Включает демоверсию и два варианта заданий. Контрольная работа выявляет уровень знаний по следующим темам:1. Теория химического .

Контрольная работа по химии 9 класс. Тема контрольной работы "Теория электролитической диссоциации".
Контрольная работа по химии 9 класс. Тема контрольной работы "Теория электролитической диссоциации" на два варианта.

Контрольная работа по химии для обучающихся в 9 классе с целью проверки опорных знаний.
Тестовая работа по теме "Металлы" (11 класс)
А) Ca Б) М g В) Sr Г) Fe .
13.Тип связи в простом веществе натрия:
Б) ковалентная неполярная
В) металлическая
Г) ковалентная полярная
14. Наиболее ярко выраженные металлические свойства
проявляет:
А) Mg Б) K В) Al Г) Ca
15. Какую электронную конфигурацию имеет атом наиболее
активного металла?
А) 1 s 2 2 s 2 2 p 11 Б) 1 s 2 2 s 2 2 p 6 3 s 1
В) 1 s 2 2 s 2 Г) 1 s 2 2 s 2 2 p 6 3 s 2 3 p 1
16. Алюмотермия - это
А) восстановление алюминия водородом из его оксида
Б) восстановление металлов из оксидов алюминием
В) шлифовка алюминиевых изделий
Г) получение алюминиевых сплавов
ТЕСТ №2 по теме «Металлы»
1. Какому металлу соответствует электронная формула
1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 10 ?
А) Mo Б) Zn
В) Ba Г) Fe
2. При взаимодействии железа с разбавленной H 2 SO 4 образуется
3.Какой металл не вытеснит водород из разбавленной H 2 SO 4 ?
А) Fe Б) Cr В) Cu Г) Zn
4.В порядке уменьшения восстановительных свойств металлы расположены в ряду:
А ) Al, Zn, Fe Б ) Al, Na, K
В ) Fe, Zn, Mg Г ) Fe, Zn, Al
5.Оксиды CrO и CrO 3 -
А) основные
Б) основные и кислотные
В) кислотные
Г) кислотные и основные
6.К какому типу элементов относится железо?
А) р - элементам
Б) s -элементам
В) d -элементам
Г) f -элементам
7. На d - подуровне максимально может находиться:
А) 2е Б) 6е В)10е Г) 18е
8. Металлический хром может взаимодействовать с:
А) H 2 О Б) HCl (разб.)
В) HNO 3 (конц.) Г) NaOH (конц.)
9. Для металлов не характерно следующее физическое свойство:
А) теплопроводность
Б) металлический блеск
В) электропроводность
Г) хрупкость
10.Установите соответствии между металлом и способом его получения
А) Na 1. алюмотермия
Б) Fe 2. восстановление углеродом
В) Cr 3 . электролиз расплавов солей
11. С точки зрения типа кристаллической решетки «лишнее» простое вещество среди данных
А) алмаз В) железо
Б) хром Г) кобальт
12.Электронная формула иона Fe +2
А) 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 6
Б) 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 0 3 d 10
В) 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 0 3 d 6
Г) 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 10
13. Свойства оксидов металлов побочных подгрупп с уменьшением степени окисления металла изменяются в следующем порядке
А) основные, амфотерные, кислотные
Б) кислотные, амфотерные, основные
В) основные, кислотные, амфотерные
Г) кислотные, основные, амфотерные
14. В схеме превращения
веществами X и Y соответственно являются
В) Fe и HCl
15. В схеме превращения
веществами X 1 , X 2 , X 3 соответственно являются
Металлы. Тесты для 11 класса.
материал для подготовки к егэ (гиа) по химии (11 класс)
Тестовые задания по теме "Металлы" для подготовки к ЕГЭ (11 класс).
| Вложение | Размер |
|---|---|
| testy_metally_11kl.doc | 46 КБ |
Подтяните оценки и знания с репетитором Учи.ру
11 класс. Тема Металлы
А1. В атоме хрома электронная конфигурация валентных электронов: А) 3d 2 4s 2 ; Б) 3s 2 3p 4 ;В) 3d 5 4s 1 ;Г) 4s 2 4p 6
А2.Самый большой радиус имеет атом: А) рубидия; Б) цезия; В) меди; Г) лития
А3. Абсолютно верно утверждение: А) только металлы имеют металлический блеск Б) все металлы - твёрдые вещества; В) атомы металлов и металлы - простые вещества; Г) только металлы электропроводны;.
А4. Вещество с металлической связью – это: А) NaCI; Б) CuSO 4 . 5H 2 O; В) HCI; Г) AI
А5. В порядке усиления металлических свойств элементы расположены в ряду: А) Na, Mg, AI, Si, P; Б) K, Na,Be,Ca, Mg; В) Li, Na, K, Rb, Cs; Г) Ba, Sr,Ca, Mg, AI
А6. Ряд, в котором все вещества реагируют с железом: А) HCI, CO 2 , CO; Б) CI 2 , CuCI 2 , HCI; В) H 2 , O 2 , CaO; Г) SiO 2 , HCI, S.
А7. При взаимодействии калия с водой образуются: А) гидроксид калия и водород; Б) оксид калия и водород; В) гидроксид калия и кислород; Г) только гидроксид калия
А8. Как изменяются свойства гидроксидов, образованных металлами II группы главной подгруппы, при увеличении заряда ядра атомов: А) щёлочи→нерастворимые основания→амфотерный гидроксид; Б) амфотерный гидроксид→нерастворимое основание→щёлочь; В) кислота→амфотерный гидроксид→щёлочь; Г) нерастворимое основание→щёлочь→кислота
А9. Что усиливает коррозию металлических деталей, находящихся в воде: А) добавление в воду ингибитора коррозии; Б) применение для соединения деталей заклёпок из более активного металла; В) применение для соединения деталей заклёпок из менее активного металла; Г) окрашивание деталей
А10. Кальций в промышленности получают: А) электролизом раствора CaCI 2 ; Б) электролизом расплава CaCI 2 ; В) реакцией восстановления; Г) действием более активного металла на водные растворы солей
А11. При электролизе раствора хлорида цинка на катоде происходит: А) восстановление катионов цинка; Б) восстановление воды; В) восстановление катионов цинка и воды; Г) окисление атомов хлора
А12. К микроэлементам относится; А) Fe; Б) Ca; В) K; Г) Mg
В1. Укажите порядковые номера элементов III периода, которые образуют соединения с металлической связью. Ответ________(номера запишите в порядке возрастания и без пробелов между цифрами)
В2. В атоме скандия число полностью заполненных подуровней равно_______(ответ запишите цифрами)
С1. Предложите 3 способа получения гидроксида калия. Ответ подтвердите уравнениями реакций.
С2. При электролизе раствора хлорида меди (II) на аноде выделилось 8,96 л. газа. Какое вещество выделилось на катоде? Найдите его массу.
А1.Химический элемент расположен в IV периоде; I группе А. Распределению электронов в атоме этого элемента соответствует: А) 2,8,8,2; Б) 2,8,18,1; В) 2,8,8,1; Г) 2,8,18,2
А2. В порядке уменьшения атомного радиуса химические элементы расположены в ряду: А) Li, Be, B, C; Б) Be, Mg, Ca, Sr; В) Si, AI, Mg, Na; Г) Li, Na, K, Rb
А3. Какие физические свойства не являются общими для всех металлов: А) электропроводность; Б) теплопроводность; В) твёрдое агрегатное состояние при стандартных условиях; Г) металлический блеск
А4. Кристаллическая решётка вещества железа: А) атомная; Б) молекулярная; В) ионная; Г) металлическая.
А5. Восстановительные свойства элементов усиливаются в ряду: А) K, Na, Li;
Б) Na, Mg, AI; В) Na, Be, Mg; Г) Be, Mg, Ca
А6. Кальций реагирует (по отдельности) со всеми веществами набора: А) Mg, H 2 O, Na 2 CO 3 , CO; Б) H 2 , KOH, CO 2 , H 2 O; В) O 2 , HCI, H 2 O, Br 2 ; Г) Br 2 , CaCO 3 , O 2 , CO
А7. Все металлы какого ряда реагируют с соляной кислотой; А) цинк, железо, кобальт; Б) железо, алюминий, платина; В) никель, хром, золото; Г) олово, магний, ртуть
А8. Гидроксид какого металла обладает наименее основными свойствами: А) лития; Б) калия; В) берилия; Г) кальция.
А9. Какой из компонентов загрязнённого воздуха является наиболее коррозионно-активным по отношению к металлам при повышенной влажности воздуха: А) CO 2 ; Б) SO 2 ; В) N 2 ; Г) CO
А10. Какой восстановитель не используют в металлургическом производстве: А) оксид углерода (II); Б) водород; В) алюминий; Г) нет правильного ответа
А11. При электролизе раствора нитрата серебра на катоде выделяется: А) серебро; Б) водород; В) серебро и водород; Г) кислород и водород
А12. Самый распространённый на Земле переходный элемент: А) Cu; Б) Fe; В) AI; Г) Ti
В1. Запишите порядковый номер элемента, у которого электроны внешнего уровня распределены по орбиталям следующим образом: …3s 2 3p 1
В2. Запишите номер периода, в котором нет элементов, образующих вещества с металлической связью. Ответ___________(запишите цифрами)
С1. Предложите 3 способа получения хлорида алюминия. Ответ подтвердите уравнениями реакций
С2. При электролизе раствора нитрата ртути (II) на катоде выделилось 60,3 г. ртути. Какой газ выделился на аноде? Найдите его объём.
Контрольная работа по теме "металлы". Химия. 11 класс. Углубленный уровень
2). Наиболее характерная степень окисления меди равна +1.
3). Оксид меди ( I ) неустойчив и распадается при комнатной температуре
4). Комплексные соли меди ( I ) устойчивы
5). Не взаимодействует с концентрированной соляной кислотой
2Выберите верные суждения о соединениях цинка?
1). Оксид цинка ZnO - относится к кислотным оксидам.
2). Карбид цинка гидролизуется с образванием метана.
3). Оксид цинка имеет ионную молекулярную решетку
4). Соединения цинка образуют комплексные соединения с водным раствором аммиака
5). Цинк растворяется в водном растворе аммиака
3. Кислотные оксиды образуют:
1). Цинк 2). Хром 3). Алюминий 4). Железо 5) Марганец
4. Не взаимодействует с водой:
1). Цинк 2). Хром 3). Серебро 4) Платина 5). Железо
5. С разбавленным раствором гидроксида натрия взаимодействует:
1). Цинк 2). Хром 3). Медь 4) Бериллий 5). Железо
6. Железо вытесняет металл из раствора соли, формула которой:
7 Водород не образуется при взаимодействии хрома с:
1). Водяным паром 2) раствором азотной кислоты 3). водой
4). Раствором щелочи при t = 600-700 0 C .5) Раствором серной кислоты
8. Концентрированная серная кислота пассивирует каждый из двух металлов:
1). Хром и золото 2). Хром и железо 3). Медь и цинк
4). Железо и медь 5) Алюминий и бериллий
9. Выберите вещества, которые с хромом взаимодействуют:
10. Методом алюмотермии получают:
1). Марганец 2). Цинк 3). Ртуть 4). Хром 5) Натрий
11 Веществами C и D в цепочке превращений являются
1). С u(OH)2 2). CuO 3). Cu2O 4) С uOH 5). Cu
12. Качественной реакцией на ион Fe 3+ служит реакция с соединением:
13. Установите соответствие между исходными веществами и степенью окисления металла, которую он имеет в продукте реакции
ИСХОДНЫЕ ВЕЩЕСТВА СТЕПЕНЬ ОКИСЛЕНИЯ
А). железо и вода (пар) 1). +6
Б). железо и соляная кислота (р-р) 2). +2
В). цинк и вода (пар) 3). +2,+3
Г). марганец и азотная кислота 4). +3
14. Установите соответствие между схемой реакции и пропущенной формулой продукта окислительно-восстановительной реакции.
СХЕМА РЕАКЦИИ ФОРМУЛА ПРОДУКТА РЕАКЦИИ
15. Смесь меди и оксида меди ( II ) массой 2г растворили в концентрированной серной кислоте. При этом образовался газ объёмом 0,56л (н.у.). Вычислите массовую долю оксида меди( II ) в исходной смеси. Ответ: 20%
16. Допишите уравнение реакции, Методом электронного баланса расставьте коэффициенты. Определите окислитель и восстановитель.
17. 25мл 34%-ного раствора соляной кислоты (ρ = 1,16г/мл) добавили при нагревании к оксиду марганца ( IV ) массой 2,61г. Какой объём хлора выделится? Сколько грамм карбоната калия может прореагировать (без нагревания) с выделившимся хлором? Ответ: 0,672л; 4,14г.
18. Щавелевую кислоту нагрели с небольшим количеством концентрированной серной кислоты. Выделившийся газ сначала пропустили над нагретым оксидом меди ( II ), а полученный газ пропустили через раствор гидроксида кальция до тех пор, пока первоначально выпавший осадок не растворился. Напишите уравнения описанных реакций.
19. Нитрат натрия сплавили с оксидом хрома ( III ) в присутствии карбоната натрия. выделившийся при этом газ прореагировал с избытком раствора гидроксида бария с выпадением осадка белого цвета. Осадок растворили в избытке раствора соляной кислоты и в полученный раствор добавили нитрат серебра до прекращения выпадения осадка. Напишите уравнения описанных реакций.
Зачет по теме Металлы. 11 класс. Профильный уровень. Тест.
1. Выберите верные суждения о цинке
1). Цинк растворяется в водном растворе аммиака.
2). Цинк проявляет в соединениях переменную степень окисления.
3) цинк реагирует с азотом
4) цинк можно получить при электролизе раствора хлорида цинка
5) в растворе хлорида цинка среда слабокислая
2. Выберите верные утверждения относительно гидроксида хрома( III )
1). проявляет амфотерные свойства.
2). Растворяется в концентрированной серной и азотной кислотах
3) Растворятся в щелочах, но не растворяется в водном растворе аммиака 4). Кислый раствор перманганата калия окисляет гидроксид хрома ( III ) до хроматов
5). В избытке раствора гидроксида натрия растворяет с образованием хромита
3. В щелочах не растворяется:
1). Цинк 2). Хром 3). Алюминий 4). Железо 5) Бериллий
4. Электролизом раствора хлорида можно получить::
1). Цинк 2). висмут 3). Медь 4). Железо 5) свинец
5. С раствором хлорида олова ( II ) не взаимодействует:
1). Цинк 2). Хром 3). Медь 4). Железо
6. Кислую среду имеет раствор :
7. Водород не образуется при взаимодействии цинка с:
1). Водяным паром 2). Раствором щелочи 3). азотной кислотой 4). Раствором серной кислоты 5) Концентрированной c ерной кислотой
8. С железом взаимодействует:
9. С хлоридом трехвалентного железа взаимодействует?
1). Медь 2). Серебро 3). Свинец 4). Цинк 5) Йод
10. Установите соответствие между металлом и веществом, которое используется для получения металла в промышленности, или способом промышленного получения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
A) железо
Б) алюминий
В) натрий
1) красный железняк
2) электролиз раствора оксида в криолите
3) электролиз раствора поваренной соли
4) электролиз расплава поваренной соли
11. Веществами А и Х в цепочке превращений являются
+HCl +NaOH H 2 O 2 +HCl
1). Fe 2). FeCl 3 3). FeCl 2 4). NaCl
12. У становите соответствие между процессом и используемым при этом катализатором: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
A) гидратация алкинов
Б) синтез аммиака
В) получение серной кислоты
Г) гидрирование непредельных углеводородов
1) губчатое железо
2) пентаоксид ванадия
3) никель, платина
13 . Верны ли следующие утверждения о металлах? Выберите верные
1) Хроматы восстанавливаются в нейтральной среде до Cr ( OH )3
2) Щелочные металлы получают электролизом водных растворов хлоридов
3). Железо в промышленных масштабах получают в виде сплавов с углем
4). Все металлы I-IIIA групп являются р-элементами
5) хром растворяется в растворах щелочей
14. Установите соответствие между исходными веществами и степенью окисления металла, которую он имеет в продукте реакции
А). хром и иод 1) +6
Б). хром и соляная кислота (р-р) 2). +2
В). хлорид ртути ( II ) и ртуть 3). +2,+3
Г). оксид марганца ( IV ) и соляная кислота 4). +3
15. Рассчитайте массовую долю цинка в техническом образце массой 17г, который нужно растворить в соляной кислоте, чтобы получить водород, необходимый для восстановления оксида меди ( II ) массой 20г до металла. Ответ: 95,6%.
17 Кислород, который образуется при разложении 659,7г перманганата калия, содержащего 4,2% бескислородной примеси, использовали для каталитического окисления аммиака. Рассчитайте, какая масса аммиака может вступить в реакцию, и какой объём будет иметь азотосодержащий продукт этой реакции? Ответ: 27,2г; 36л.
18. Нитрат натрия сплавили с оксидом хрома ( III ) в присутствии карбоната натрия. выделившийся при этом газ прореагировал с избытком раствора гидроксида бария с выпадением осадка белого цвета. Осадок растворили в избытке раствора соляной кислоты и в полученный раствор добавили нитрат серебра до прекращения выпадения осадка. Напишите уравнения описанных реакций
19. Оксид железа ( III ) сплавили с содой. Полученный продукт внесли в воду. Выпавший осадок растворили в иодоводородной кислоте. Выделившийся галоген реагирует с железом с образованием соли. Напишите уравнения описанных реакций
1. Выбери в ерные суждения о железе?
1). Железо – это химический элемент в VIIIA группы.
2). Высшая степень окисления железа равна +3.
3) Железо растворяется и в кислотах и в щелочах
4). Железо в промышленных масштабах получают в виде сплава с углеродом
5). Железо пассивируется концентрированными кислотами-окислителями
2. Верны ли следующие суждения о соединениях марганца? Выбери верные
1). Высший оксид марганца относится к кислотным оксидам.
2). Гидроксид марганца ( VII ) проявляет амфотерные свойства.
3). Марганцевая кислота – слабая кислота
4). Марганец может восстанавливать оксиды многих металлов
5). Оксид марганца ( IV ) проявляет только окислительные свойства
3. Кислотный оксид образует химический элемент:
1). Цинк 2). Марганец 3). Алюминий 4). Хром 5) Железо
4. Не взаимодействует с растворами кислот:
1). Ртуть 2). Хром 3). Медь 4). Железо 5) Цинк
5. И с раствором гидроксида натрия, и с раствором серной кислоты взаимодействует:
1). Цинк 2). Хром 3)Бериллий 4). Медь 5). Железо
6. Из предложенного перечня типов реакций выберите два типа реакции, к которым можно отнести взаимодействие щелочных металлов с водой.
1) каталитическая 2) гомогенная 3) необратимая
4) окислительно-восстановительная 5) реакция нейтрализации
7. Водород образуется при взаимодействии цинка с:
1). Холодной водой 2). Раствором щелочи 3). Концентрированной азотной кислотой 4). Концентрированной серной кислотой 5) раствором аммиака
8. Скорость взаимодействия цинка с раствором серной кислоты возрастёт, если
1) измельчить металл 2) увеличить давление 3) понизить температуру реакционной смеси 4) разбавить раствор 5) увеличить концентрацию серной кислоты
9. Из перечня веществ, формулы которых с медью взаимодействует:
10. Установите соответствие между солью металла и окраской пламени:
Читайте также:
