Контрольная работа по химии 9 класс металлы с ответами рудзитис
Обновлено: 13.05.2024
За лето ребенок растерял знания и нахватал плохих оценок? Не беда! Опытные педагоги помогут вспомнить забытое и лучше понять школьную программу. Переходите на сайт и записывайтесь на бесплатный вводный урок с репетитором.
Вводный урок бесплатно, онлайн, 30 минут
Предварительный просмотр:
Контрольная работа «Металлы и их соединения» 1 вариант
Электронная формула атома магния:
1)1s 2 2s 2 2) 1s 2 2s 2 2p 6 3s 2 3) 1s 2 2s 2 2p 6 3s 1 4) 1s 2 2s 2 2p 6 3s 2 3p 2
В каком ряду химические элементы расположены в порядке усиления металлических свойств?
1) Na, Mg, Al 2) Al, Mg, Na 3) Ca, Mg, Be 4) Mg, Be, Ca
Металл, обладающий самой высокой электропроводностью, - это
1) железо 2) медь 3) серебро 4) алюминий
Наиболее энергично взаимодействует с водой:
1) калий 2) натрий 3) кальций 4) магний
Гидроксид цинка взаимодействует с каждым из двух веществ:
1) HCl и CO 2 2) NaOH и H 2 SO 4 3) SiO 2 и KOH 4) NaNO 3 и H 2 SO 4
Методы переработки руд, основанные на восстановлении металлов из оксидов при высоких температурах, называются: 1) гидрометаллургия 2) пирометаллургия 3) электрометаллургия 4) гальваностегия
Установите соответствие между веществами, вступающими в реакцию и продуктами их взаимодействия
РЕАГИРУЮЩИЕ ВЕЩЕСТВА ПРОДУКТЫ РЕАКЦИИ
А) СаO + CO 2 1) Ca(OH) 2
Б) Ca(OH) 2 + SO 2 2) CaCO 3 + H 2 O
В) Ca + H 2 O 3) CaSO 4 + H 2 O
Г) Ca (HCO 3 ) 2 + Ca(OH) 2 4) Ca(OH) 2 + H 2
5) CaSO 3 + H 2 O
С1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: Fe FeCl 3 Fe(OH) 3 Fe 2 O 3 Fe FeCl 2 . Переход 4 рассмотрите в свете ОВР; переходы 2 и 5 - с позиции электролитической диссоциации.
C2. При взаимодействии 12 г технического магния, содержащего 5% примесей, с избытком соляной кислоты, выделилось 10 л водорода (н.у.). Вычислите объемную долю выхода продукта реакции.
Контрольная работа «Металлы и их соединения» 2 вариант
Электронная формула атома алюминия:
1)1s 2 2s 2 2р 1 2) 1s 2 2s 2 2p 6 3s 2 3) 1s 2 2s 2 2p 6 3s 2 3р 1 4) 1s 2 2s 2 2p 6 3s 2 3p 3
В каком ряду химические элементы расположены в порядке увеличения их атомного радиуса?
1) Na, Mg, Al 2) Al, Mg, Na 3) K, Na, Li 4) Mg, Be, Ca
Металл, обладающий самой высокой пластичностью, - это: 1) золото 2) медь 3) серебро 4) алюминий
Не взаимодействует с раствором серной кислоты
1) цинк 2) серебро 3) никель 4) железо
Оксид алюминия взаимодействует с каждым из двух веществ:
1) HCl и O 2 2) КOH и H 2 О 3) HCl и KOH 4) NaNO 3 и H 2 SO 4
В качестве восстановителя при выплавке чугуна в доменных печах используют
1) водород 2) алюминий 3) кокс 4) магний
А) Fe + Cl 2 1) Fe 2 (SO 4 ) 3 + H 2 O
Б) Fe + HCl 2) FeSO 4 + H 2 O
В) Fe 2 O 3 + H 2 SO 4 3) FeCl 3
Г) Fe + CuSO 4 4) FeCl 2 + H 2
6) Fe 2 (SO 4 ) 3 + Cu
С1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: Ca Ca(OH) 2 CaCO 3 Ca(HCO 3 ) 2 CaCl 2 Ca(NO 3 ) 2 . Переход 1 рассмотрите в свете ОВР; переходы 4 и 5 - с позиции электролитической диссоциации.
C2. При взаимодействии 24,15г технического натрия, содержащего 5% примесей, с водой было получено 8,96л водорода (н.у.). Вычислите объемную долю выхода продукта реакции (в %)
Контрольная работа «Металлы и их соединения» 3 вариант
Электронная формула атома железа:
1) 1s 2 2s 2 2p 6 3s 2 3р 6 2) 1s 2 2s 2 2p 6 3s 2 3р 6 4s 2 3d 6 3) 1s 2 2s 2 2p 6 3s 2 3р 6 4s 2 3d 5 4) 1s 2 2s 2 2p 6 3s 2 3р 6 4s 2 3d 10 4p 6
В каком ряду химические элементы расположены в порядке ослабления металлических свойств?
1) Li, K, Rb 2) Al, Mg, K 3) Ca, Mg, Li 4) K, Ca, Be
Самый легкоплавкий металл – это: 1) цезий 2) ртуть 3) алюминий 4) железо
Вытеснит свинец из раствора нитрата свинца (II): 1) медь 2) цинк 3) калий 4) серебро
Гидроксид железа (III) взаимодействует с каждым из двух веществ
1) HCl и CO 2 2) NaOH и H 2 SO 4 3) SiO 2 и KOH 4) KCl и H 2 SO 4
Нельзя получить водородотермией
1) вольфрам 2) медь 3) натрий 4) хром
А) Na + H 2 O 1) Fe(OH) 2 + NaCl
Б) Na 2 O + H 2 O 2) NaOH + H 2
В) NaOH+ SO 3 3) NaOH
Г) NaOH + FeCl 2 4) Fe(OH) 3 + NaCl
5) Na 2 SO 3 + H 2 O
6) Na 2 SO 4 + H 2 O
С1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: Al AlCl 3 Al(OH) 3 Al 2 O 3 KAlO 2 Al(NO 3 ) 3 . Переход 1 рассмотрите в свете ОВР; переходы 2 и 5 - с позиции электролитической диссоциации.
C2. При термическом разложении 20 г известняка, содержащего 10% некарбонатных примесей, было получено 3,23л углекислого газа (н.у.). Вычислите объемную долю выхода продукта реакции (в %)
Контрольная работа «Металлы и их соединения» 4 вариант
Электронная формула атома калия:
1) 1s 2 2s 2 2p 6 3s 1 2) 1s 2 2s 2 2p 6 3s 2 3р 6 4s 2 3) 1s 2 2s 2 2p 6 3s 2 3р 6 4s 1 4) 1s 2 2s 2 2p 6 3s 2 3р 6 4s 2 3d 1
В каком ряду химические элементы расположены в порядке уменьшения их атомного радиуса?
1) Li, K, Rb 2) Al, Mg, K 3) Ca, Mg, Li 4) Be, Ca, K
Самый тугоплавкий металл – это: 1) хром 2) медь 3) вольфрам 4) железо
Не вытеснит медь из раствора сульфата меди(II): 1) железо 2) цинк 3) натрий 4) марганец
Оксид калия взаимодействует с каждым из двух веществ:
1) HCl и CO 2 2) NaOH и H 2 SO 4 3) ВаO и KOH 4) NaNO 3 и H 2 SO 4
Щелочные металлы получают: 1) электролизом растворов солей 2) электролизом расплавов солей
3) восстановлением коксом из оксидов 4) восстановлением водородом из оксидов
Контрольная работа по теме "Металлы" 9 класс
тест по химии (9 класс)
Контрольная работа № 2 по теме «Металлы».
Часть А . Тестовые задания с выбором одного правильного ответа.
- Электронное строение атома кальция:
- 2, 8, 8, 2 2) 2, 8, 2 3) 2, 8, 8 4) 2, 8, 6
- Группа периодической системы химических элементов, в которой все элементы относятся к металлам:
- I 2) II 3) III 4) IV
- Ряд химических элементов, расположенных в порядке увеличения их атомных радиусов:
- K → Na → Li 2) Al → Na → Mg 3) Li → Na → K 4) Na → Mg → Be
- Валентность 3 в соединениях могут проявлять оба элемента:
- Be и Ga 2) B и C 3) Al и Fe 4) Ag и Al
- Вещество, которое может восстановить медь из её оксида, - это:
- Водород 2) азот 3) соляная кислота 4) оксид углерода (IV)
- Железо взаимодействует с каждым из двух веществ:
- соляная кислота и хлор 3) серная кислота и оксид алюминия
- хлорид лития и гидроксид калия 4) сульфат меди (II) и карбонат кальция
- Оба оксида реагируют с растворами кислот и щелочей:
- CuO и CO 2 2) ZnO и P 2 O 5 3) BeO и Al 2 O 3 4) NO и MgO
- Верны ли следующие суждения о свойствах металлов?
А. С водой при обычных условиях реагируют только щелочные металлы.
Б. Металлы в химических реакциях проявляют только восстановительные свойства.
1) верно только А. 2) верно только Б 3) верны оба 4) неверны оба
- Формула вещества Х в цепочке превращений Fe → X → Fe(OH) 3
- FeO 2) Fe 2 O 3 3) FeCl 3 4) FeCl 2
- Реактивом на ион Ва 2+ является ион:
- Cl - 2) SO 4 2- 3) NO 3 - 4) Br -
- В ряду химических элементов Al → Mg → Na
- увеличиваются радиусы атомов химических элементов;
- увеличивается число электронов на внешнем энергетическом уровне;
- увеличиваются заряды ядер атомов;
- усиливаются восстановительные свойства;
- уменьшается число энергетических уровней
- Установите соответствие между исходными веществами и продуктами реакции.
A. Al, NaOH, H 2 O
Б. Fe и H 2 SO 4
2) Fe 2 (SO 4 ) 3 и H 2
4)Na[Al(OH) 4 ] и H 2
5) Ag и Cu(NO 3 ) 2
Часть С . Задания с развёрнутым ответом.
- Дополните генетический ряд железа. запишите уравнения реакций в соответствии со схемой Fe(ОН) 2 → X → Fe 2 O 3 → FeCl 3 .
- Металлическую пластинку прокалили. Полученное вещество черного цвета разделили на две части. Одна часть при нагревании в токе водорода превратилась в исходный металл розового цвета и воду, а растворение другой части в серной кислоте сопровождалось образованием сине-голубого раствора. Определите неизвестный металл и запишите уравнения реакций.
- Число нейтронов и протонов в изотопе 42 Са соответственно равно:
- 20 и 20 2) 22 и 20 3) 20 и 22 4) 20 и 40
- Атом лития отличается от иона лития:
- радиусом частицы 2) зарядом ядра 3) числом протонов 4) числом электронов
- Металл, проявляющий переменную степень окисления в соединениях:
- алюминий 2) барий 3) железо 4) калий
- Ряд химических элементов, расположенных в порядке усиления металлических свойств:
- Ca → Mg → Be 2) Na → Mg → Al 3) Al → Mg → Be 4) Li → Na → K
- Алюминий взаимодействует с каждым из двух веществ:
- сера, концентрированная азотная кислота 3) соляная кислота, оксид железа (III)
- бром, концентрированная серная кислота 4) оксид углерода (IV), азот
- Металл, который не взаимодействует с соляной кислотой:
- Кальций 2) ртуть 3) цинк 4) железо
- Вещества, взаимодействие которых не сопровождается выделением водорода:
- Cu и H 2 SO 4 2) Al и NaOH 3) Ca и H 2 O 4) NaH и H 2 O
- Верны ли следующие суждения о сплавах?
А. Сплав меди с оловом называется латунью.
Б. В состав нержавеющей стали входят железо, никель, хром.
1) верно только А 2) верно только Б 3) верны оба 4) неверны оба
- Формула вещества Х в цепочке превращений Na → X → Na 2 O:
- NaOH 2) Na 2 O 2 3) NaH 4) NaBr
- Реактивом на ион Fe 3+ является:
- OH - 2) Br - 3) SO 4 2- 4) NO 3 -
Контрольная работа по химии 9 класс металлы с ответами рудзитис

Контрольная работа № 2 по химии в 9 классе «Химические реакции в водных растворах» с ответами (3 варианта) для УМК Рудзитис, Фельдман. Автор работы: Т.А.Боровских. Цитаты из пособия использованы в учебных целях. Химия 9 Рудзитис Контрольная работа 2.
Контрольная работа № 2
«Химические реакции в водных растворах»
КР-2. Вариант 1
- Распределите на группы следующие ионы: К + , S 2– , Cu 2+ , NO3 – , F – , Mg 2+ , Al 3+ , SО4 2– , Ва 2+ , Fe 3+ , Сl – , СО3 2– .
- Как называются и чем отличаются друг от друга частицы, обозначенные следующими символами: СO2, СО3 2– ?
- Из предложенного списка: HBr, Br2, CuCl2, NO2, К2O, HNO3, LiOH, K2CO3, MgO, SO2 выпишите формулы ионных соединений.
Какие из них относятся к электролитам?
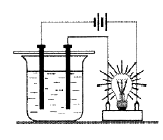
Составьте уравнения их электролитической диссоциации: - Какие из веществ, формулы которых приведены, могли бы содержаться в испытуемом растворе (см. рис.)? Запишите уравнения реакции их диссоциации: КОН, Cu(OH)2, HNO3, AgCl, Na2CO3, Fe2(SO4)3, SiO2.
- Закончите уравнения диссоциации сильных и слабых электролитов:
1) ZnSO4 → _________; 5) ________ → 2K + + SO4 2–
2) НСlO ⇔ _________; 6) ________ → 2К + + SO3 2–
3) Ва(ОН)2 → ________; 7) ________ → Fe 2+ + 2NO3 –
4) Н3РO4 ⇔ ________; 8) ________ → Fe 3+ + 2NO3 – - Определите степень диссоциации кислоты НА, если при растворении 1 моль в 1 л воды на ионы распались 4,214 • 10 23 молекул.
- Составьте молекулярные, полные и сокращённые ионные уравнения возможных реакций:
1) HCl + K2SO3 → _______; 4) Ва(ОН)2 + СO2 → _______
2) Mg(OH)2 + НВr → _______; 5) ВаСl2 + NaNO3 → _______
3) Fe2O3 + НСl → _______; 6) AgNO3 + НСl → _________ - Из предложенного перечня веществ выберите два вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения одной реакции: бромоводород, нитрат серебра(I), нитрат натрия, карбонат натрия.
- Взаимодействие каких веществ может быть описано следующим сокращённым ионным уравнением Н + + ОН – = Н2O? Составьте два возможных молекулярных уравнения.
- Выполните задания, посвящённые качественным реакциям электролитов, гидролизу солей:
1) Как можно обнаружить в растворе карбонат–анион? Приведите сокращённое ионное уравнение реакции
2) В трёх пробирках под номерами 1–3 находятся растворы хлорида меди(II), нитрата меди(II) и сульфата меди(II). Как различить эти вещества? Составьте план эксперимента, заполнив таблицу. Напишите уравнения соответствующих реакций.
3) В трёх пробирках под номерами 1–3 находятся растворы хлоридов натрия и алюминия и карбоната натрия. Как различить эти растворы, имея в своём распоряжении только лакмус? Ответ поясните.
Ответы на задания Варианта 1
№ 1. Катионы — положительно заряженные ионы, 2; 3; 6; 7; 10.
№ 2. Молекула/ион, отсутствием/наличием заряда.
№ 3. 3; 5; 7; 8; 9; уравнение диссоциации можно записать только для солей и щелочей.
№ 4. 1; 3; 5; 6.
№ 5. Слабые электролиты диссоциируют обратимо, а многоосновные — ступенчато.
№ 6. α = N/NA = 4,1214•10 23 /6,02•10 23 = 0,7 (70%).
№ 7. 2Н + + SO3 2– = SO2 + Н2O; Mg(OH)2 + 2Н + = Mg 2+ + 2Н2O; Fe2O3 + 6Н + = 2Fe 3+ + 3Н2O; 2OН – + СO2 = СО3 2– + Н2O; Ag + + Сl – = AgCl.
№ 8. Бромоводород + нитрат серебра(I) →↑; Бромоводород + карбонат натрия →↑
№ 9. Сильная кислота + щёлочь.
№ 10. 1) СO3 2– + 2Н + = CO2↑ + Н2O; 2) + Ba(NO3)2 + AgNO3; 3) лакмус — фиолетовый/красный/синий.
Химия 9 Рудзитис Контрольная работа 2. Вариант 2

- Распределите на группы следующие ионы: Na + , Se 2– , Zn 2+ , NO2 – , Cl – , Mn 2+ , Cr 3+ , SiO3 2– , Sr 2+ , Fe 2+ , I – , HCO3 – .
- Как называются и чем отличаются друг от друга частицы, обозначенные символами: O2, О 2– ?
- Из предложенного списка: I2, AlCl3, F2, Li2O, Н3РO4, Ва(ОН)2, (NH4)2SO4, BaO, SO3, HI выпишите формулы ионных соединений.
Какие из них относятся к электролитам?
Составьте уравнения их электролитической диссоциации. - Какие из веществ, формулы которых приведены, могли бы содержаться в испытуемом растворе (см. рис.)? Запишите уравнения реакции их диссоциации: K2SO3, NaOH, Аl(ОН)3, НСl, BaSO4, Al2(SO4)3, CuO.
- Закончите уравнения диссоциации сильных и слабых электролитов:
1) H2SO3 ⇔ ________; 5) _______ —> 2К + + S 2–
2) К3РO4 —> ________; 6) _______ —> Fe 3+ + 3Сl –
3) HNO2 ⇔ ________; 7) _______ —> 2K + + SO4 2–
4) Са(ОН)2 —> _________; 8) _______ —> 2NH4 + + SO4 2– - Определите степень диссоциации кислоты НА, если при растворении 1 моль в 1 л воды на ионы распались 1,806 • 10 23 молекул.
- Составьте молекулярные, полные и сокращённые ионные уравнения возможных реакций:
1) Са(ОН)2 + N2O5 —> _______; 4) Аl(ОН)3 + HNO3 —> _______
2) НСl + К2СO3 —> _______; 5) Ca(NO3)2 + Na3PO4 —> _______
3) Na2O + H2SO4 —> _______; 6) Na2CO3 + K2SO4 —> _______ - Из предложенного перечня веществ выберите два вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения одной реакции: йодоводород, сульфат цинка, гидроксид калия, ортофосфат натрия.
- Взаимодействие каких веществ может быть описано сокращённым ионным уравнением Ag + + Сl + = AgCl? Составьте два возможных молекулярных уравнения:
- Выполните задания, посвящённые качественным реакциям электролитов, гидролизу солей:
1) Как можно обнаружить в растворе гидроксид–анион?
2) В трёх пробирках под номерами 1–3 находятся растворы сульфата алюминия, нитрата серебра и иодида натрия. Как различить эти вещества? Приведите описание эксперимента по распознаванию этих веществ и уравнения реакций.
3) В трёх пробирках под номерами 1–3 находятся растворы нитратов калия и алюминия и сульфида натрия. Как различить эти растворы, имея в своём распоряжении только лакмус? Ответ поясните.
Ответы на задания Варианта 2
№ 1. Анионы — отрицательно заряженные ионы, 2; 4; 5; 8; 11; 12.
№ 2. Молекула/ион, отсутствием/наличием заряда.
№ 3. 2; 4; 6; 7; 8; уравнение диссоциации можно записать только для солей и щелочей.
№ 4. 1; 2; 4; 6.
№ 5. Слабые электролиты диссоциируют обратимо, а многоосновные— ступенчато. 6. α = N/NA = 1,5•10 23 /6,02•10 23 = 0,3 (30%).
№ 7. 2OН – + N2O5 = 2NO3 – + Н2O; 2Н + + СO3 2– = СO2 + Н2O; Na2O + 2Н + = Na + + Н2O; Аl(ОН)3 + ЗН + = Аl 3+ + ЗН2O; ЗСа 2+ + 2РO4 3– = Са3(РO4)2.
№ 8. Йодоводород + гидроксид калия —> Н2O; сульфат цинка + ортофосфат натрия →↑.
№ 9. Нитрат серебра + соляная кислота или хлорид щелочного металла.
№ 10. 1) фенолфталеин окрасится малиновым; 2)НСl/ВаСl2/AgNO3; 3) лакмус — фиолетовый/красный/синий.
Химия 9 Рудзитис Контрольная работа 2. Вариант 3

- Распределите на группы следующие ионы: NH4 + , SO3 2– , Со 2+ , МnО4 – , F – , Mn 2+ , Со 3+ , РО4 3– , Са 2+ , Fe 3+ , СlO – , СlO3 – .
- Как называются и чем отличаются друг от друга частицы, обозначенные следующими символами: SO3, SO3 2– .
- Из предложенного списка: Br2, FeCl3, N2, К2O, H2SO4, NaOH, Na2SO3, BaO, CO, HBr выпишите формулы ионных соединений.
Какие из них относятся к электролитам?
Составьте уравнения их электролитической диссоциации. - Какие из веществ, формулы которых приведены, могли бы содержаться в испытуемом растворе (см. рис.)? Запишите уравнения реакции их диссоциации: H2SO4, LiOH, Zn(OH)2, NaNO3, CuS, K2CO3, Cr2(SO4)3, Fe2O3.
- Закончите уравнения диссоциации сильных и слабых электролитов:
1) NH4NO3 —> ______; 5) ______ —> Fe 3+ + ЗСl –
2) НОСl —> ______; 6) ______ —> Mg 2+ + 2NO3 –
3) Н2СO3 —> _______; 7) ______ —> 3К + + РO4 3–
4) Ва(ОН)2 —> _______; 8) ______ —> 2Fe 3+ + 3SO4 2– - Определите степень диссоциации кислоты НА, если при растворении 1 моль в 1 л воды на ионы распались 1,204 • 10 23 молекул.
- Составьте молекулярные, полные и сокращённые ионные уравнения возможных реакций:
1) Na2S + ZnCl2 —> ______; 4) Na2S + HBr —> ______
2) НСl + MgCO3 —> ______; 5) SO3 + LiOH —> ______
3) NaCl + K2S —> _______; 6) Fe2O3 + H2SO4 —> ______ - Из предложенного перечня веществ выберите два вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения одной реакции: сульфит натрия, хлорид никеля(II), хлорид калия, гидроксид натрия.
- Взаимодействие каких веществ может быть описано сокращённым ионным уравнением Сu 2+ + 2OН – = Сu(ОН)2? Составьте два возможных молекулярных уравнения:
- Выполните задания, посвящённые качественным реакциям электролитов, гидролизу солей:
1) Как можно обнаружить в растворе сульфат–анион? Приведите сокращённое ионное уравнение реакции.
2) В трёх пробирках под номерами 1–3 находятся растворы сульфита, хлорида и силиката натрия. Приведите описание эксперимента по распознаванию этих веществ и уравнения реакций.
3) В трёх пробирках под номерами 1–3 находятся растворы хлоридов кальция и цинка и фосфата натрия. Как различить эти растворы, имея в своём распоряжении только лакмус? Ответ поясните.
Ответы на задания Варианта 3
№ 1. Катионы — положительно заряженные ионы, 1; 3; 6; 7; 9; 10.
№ 2. Молекула/ион, отсутствием/наличием заряда.
№ 3. 2; 4; 6; 7; 8; уравнение диссоциации можно записать только для солей и щелочей.
№ 4. 1; 2; 4; 6; 7.
№ 5. Слабые электролиты диссоциируют обратимо, а многоосновные— ступенчато.
№ 6. α = N/NA = 1,204•10 23 /6,02•10 23 = 0,2 (20%).
№ 7. S 2– + Zn 2+ = ZnS; 2Н + + MgCO3 = Mg 2+ + CO3 2– + Н2O; S 2– + 2H + = H2S; SO3 + 2OH – = SO3 2– + Н2O; Fe2O3 + 6H + = 2Fe 3+ + 3Н2O.
№ 8. Сульфит натрия + + хлорид никеля (II) →↑; хлорид никеля (II) + гидроксид натрия →↑.
№ 9. Растворимая соль меди + щёлочь.
№ 10. 1) Ва 2+ + SO4 2– = BaSO4; 2) соляная кислота; нитрат серебра; 3) лакмус — фиолетовый/красный/синий.
Вы смотрели: Контрольная работа по химии 9 класс «Химические реакции в водных растворах» с решениями и ответами (3 варианта). Автор работы: Т.А.Боровских. Используется в комплекте с учебником Г. Е. Рудзитиса, Ф. Г. Фельдмана «Химия. 9 класс». Цитаты из пособия использованы в учебных целях. Химия 9 Рудзитис Контрольная работа 2.
Контрольная работа № 7 по химии в 9 классе «Металлы» с ответами для УМК Рудзитис, Фельдман. Автор работы: Т.А.Боровских. Цитаты из пособия использованы в учебных целях. Химия 9 Рудзитис Контрольная работа 7.
Контрольная работа № 7
«Металлы» (9 класс)
КР-7. Вариант 1
- 1) Составьте электронную формулу и схему распределения электронов по орбиталям атомов натрия.
2) Какие степени окисления натрий проявляет в соединениях? Составьте формулы высшего оксида и гидроксида, а также гидрида натрия.
3) Расположите символы химических элементов (Na, Rb, Li, Cs, К) в порядке:
а) возрастания атомного радиуса
б) возрастания восстановительной способности
в) ослабления основных свойств образуемых гидроксидов. - Какой вид химической связи и тип кристаллической решётки у кальция? Используя значки изобразите схему строения кристалла кальция.
- Из перечисленных металлов — натрий, хром, серебро, ртуть — выберите самый
1) электропроводный _______; 2) пластичный ________; 3) хрупкий ________; 4) тяжёлый ________; 5) мягкий ________; 6) твёрдый _______; 7) легкоплавкий ________. - Приведите пример металла, встречающегося в природе только в виде соединений _______________. Как такой металл получают? Приведите соответствующее уравнение реакции.
- Изучите схему, описывающую химические свойства металлов (см. табл. 28 в учебнике). Приведите по одному примеру для каждой группы реакций. Составьте уравнения соответствующих реакций.
- а) Закончите уравнения реакций:
1) МоO3 + H2 →t→ _________; 4) Zn + NaOH + H2O →t→ _________;
2) К + O2 →t→ __________; 5) Сu + HNO3(конц.) →t→ __________;
3) Fe3O4 + Mg →t→ __________; 6) Аl + H2O →t→ ___________.
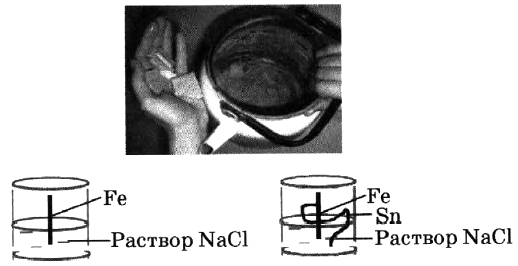
б) Хлорид меди(II) можно получить: 1) взаимодействием гидроксида меди(II) с соляной кислотой; 2) растворением в соляной кислоте предварительно обожжённой на воздухе меди; 3) при горении меди в хлоре. Составьте уравнения реакций, укажите, какие из них окислительно-восстановительные. Определите окислитель и восстановитель. Для реакции ионного обмена составьте сокращённое ионное уравнение. - 1) Рассмотрите рисунок. Поясните причину возникновения накипи на чайнике. Какие процессы происходят при кипячении воды? Составьте уравнение реакции. Что такое жёсткость воды? Что такое временная жёсткость?2) Что такое коррозия металлов? Перед вами рисунок, на котором изображены два стакана. Какие реакции будут происходить там? В каком стакане реакция прошла быстрее? Почему?
- 1) В пробирку с раствором соли X добавили вещество Y. В результате реакции наблюдали образование металла, имеющего в слитке красный цвет. Из предложенного перечня веществ выберите вещества X и Y, которые могут вступать в описанную реакцию: 1) карбонат калия; 2) сульфат меди(II); 3) цинк; 4) калий. Составьте уравнение реакции: _____________________
2) В четырёх пронумерованных пробирках находятся растворы хлоридов магния, железа(II), алюминия и натрия. Как идентифицировать эти вещества? Составьте план эксперимента и уравнения соответствующих реакций.
- Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
1) FeS2 → Fe2O3 → Fe → FeCl2 → Fe(OH)2 → FeSO4
2) Металл красного цвета сожгли в хлоре, а продукт реакции растворили в воде. В полученный раствор добавили щёлочь, выпавший осадок синего цвета отфильтровали и прокалили, при нагревании продукта прокаливания чёрного цвета с коксом был получен исходный металл.
3) Даны вещества: СаСO3, СuО, растворы NaOH, K2SO4, HNO3, H2O2, СаСO3. Используя воду и необходимые вещества только из этого списка, получите в две стадии гидроксид меди(II). Опишите признаки проводимых реакций. Для одной реакции напишите сокращённое ионное уравнение реакции. - Рассчитайте:
1) массу оксида лития, который образуется при сжигании в кислороде 4,2 г лития.
2) массу алюминия, требуемого для получения водорода (н.у.) из соляной кислоты, необходимого для восстановления оксида меди(II), образовавшегося при разложении 63,7 г гидроксида меди(II).
3) массовую долю металлов в смеси алюминия и меди при взаимодействии 10 г смеси с избытком раствора серной кислоты. При этом выделился водород объемом 6,72 л (н. у.).
Указания по решению заданий Варианта 1:
№ 1. 1) 2; 8; 2; 2) +1, Na2O; NaOH; NaH; 3) a) Li, Na, К, Rb, Cs; б) Li, Na, K, Rb, Cs.
№ 2. Металлическая.
№ 3. 3124124.
№ 4. —.
№ 5. —.
№ 6. a) 1) MoO3 + 3H2 → Mo + 3H2O; б) 1) Cu(OH)2 + 2HCl = CuCl2 + 2H2O.
№ 7. 1) B воде растворены гидрокарбонаты кальция и магния. Они неустойчивы к нагреванию;
2) необходимо сравнить активность металлов, в первую очередь разрушается более активный металл.
№ 8. 1) сульфат меди(II) + цинк; 2) У этих солей разное отношение к раствору щёлочи. Соединения железа(+2) легко окисляются кислородом воздуха и меняют цвет.
№ 9. 1) +O2; +СО; +НСl; +NaOH; +H2SO4;
2) Сu + Cl2 = СuCl2; СuCl2 + 2NaOH = Сu(ОН)2 + 2NaCl; Сu(ОН)2 = СuО + H2O; СuО + С = Сu + СО;
3) СuО + HNO3 →; Cu(NO3)2 + NaOH →.
№ 10. 1) 9 г; 2) 11,7 г; 3) 54%.
Контрольная работа в 9 классе по теме "Металлы"
учебно-методический материал по химии (9 класс) на тему
Контрольная работа предназначена для проведения промежуточной аттестации обучающихся в 9 классе по теме "Металлы". Материал сотавлен для обучающихся по учебнику Рудзитиса, Фельдмана.
| Вложение | Размер |
|---|---|
| kr_no4_metally_9_rudzitis_testovaya.doc | 286.5 КБ |
Подтяните оценки и знания с репетитором Учи.ру
А) Al + NaOH + H 2 O 1) Al(NO 3 ) 3 + H 2
Б) Al 2 O 3 + NaOH 2) Al(NO 3 ) 3 + N 2 + H 2 O
В) Al+ HNO 3 3) NaAlO 2
Г) Al 2 (SO 4 ) 3 + KOH 4) NaAlO 2 + H 2
5) NaAlO 2 + H 2 O
6) Al(OH) 3 + K 2 SO 4
С1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: Fe FeCl 2 Fe(OH) 2 Fe(OH) 3 Fe 2 O 3 Fe(NO 3 ) 3 Переход 3 рассмотрите в свете ОВР; переходы 2 и 5 - с позиции электролитической диссоциации.
C2. При взаимодействии 60г технического кальция, содержащего 2% примесей, с водой было получено 30л водорода (н.у.). Вычислите объемную долю выхода продукта реакции (в %)
Контрольная работа «Металлы и их соединения» 5 вариант
Электронная формула атома натрия:
1)1s 2 2s 1 2) 1s 2 2s 2 2p 6 3s 1 3) 1s 2 2s 2 2p 6 3s 2 4) 1s 2 2s 2 2p 6 3s 2 3p 1
Металл, температура плавления которого 660̊ С, - это
Оксид цинка взаимодействует с каждым из двух веществ:
Методы переработки руд, основанные на восстановлении металлов из растворов их солей, называются:
1) гидрометаллургия 2) пирометаллургия 3) электрометаллургия 4) гальваностегия
А) Ва(OH) 2 + CO 2 1) Вa(ClO 4 ) 2 + H 2 O
Б) Вa(OH) 2 + SO 3 2) ВaSO 3 + H 2 O
В) Вa(OH) 2 + Р 2 O 5 3) ВaSO 4 + H 2 O
Г) Вa(OH) 2 + Cl 2 O 7 4) Вa 3 (PO 4 ) 2 + H 2
5) Вa 3 (PO 4 ) 2 + H 2 O
6) ВaCO 3 + H 2 O
С1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: Fe FeCl 2 Fe(OH) 2 FeO Fe FeCl 3 . Переход 4 рассмотрите в свете ОВР; переходы 2 и 5 - с позиции электролитической диссоциации.
C2. Какой объем водорода (н.у.) выделится при действии на 5,4 г алюминия раствора серной кислоты, если выход водорода составляет 95% от теоретически возможного.
Контрольная работа «Металлы и их соединения» 6 вариант
Электронная формула атома лития:
1)1s 2 2s 2 2р 1 2) 1s 2 2s 2 2p 6 3s 1 3) 1s 2 2s 1 4) 1s 2 2s 2 2p 1
1) Na, Mg, Al 2) Li , Na, К 3) K, Na, Li 4) Mg, Be, Ca
Металл, плотность которого 7,8 г/см 3 , - это: 1) железо 2) медь 3) серебро 4) алюминий
Гидроксид алюминия взаимодействует с каждым из двух веществ:
Электролизом расплава боксита в криолите получают
1) барий 2) алюминий 3) калий 4) магний
А) Ca(OH) 2 1) CaO + H 2
Б) Ca(OH) 2 + H 2 S 2) CaO + H 2 O
В ) Ca(OH) 2 + H 2 SO 4 3) CaSO 3 + H 2 O
Г) Ca(OH) 2 + SO 3 4) CaSO 4 + H 2 O
6) CaSO 4 + 2H 2 O
С1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: N a NaOH Na 2 CO 3 NaHCO 3 NaCl Na 2 SO 4 . Переход 1 рассмотрите в свете ОВР; переходы 4 и 5 - с позиции электролитической диссоциации.
C2. Какую массу цинка можно получить при восстановлении 150 г оксида цинка с массовой долей примесей 19%?
Контрольная работа «Металлы и их соединения» 7 вариант
Металл, температура плавления которого 1535 ̊ С, - это
1) цезий 2) ртуть 3) алюминий 4) железо
Вытеснит свинец из раствора нитрата свинца (II): 1) ртуть 2) магний 3) натрий 4) серебро
Оксид железа (III) взаимодействует с каждым из двух веществ
1) железо 2) медь 3) калий 4) магний
Б) Na 2 O + CO 2 2) NaOH + H 2
Г) NaOH + FeCl 3 4) Fe(OH) 3 + NaCl
С1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: Al 2 O 3 AlCl 3 Al(OH) 3 Al 2 O 3 Al Al 2 (SO 4 ) 3 . Переход 5 рассмотрите в свете ОВР; переходы 1и 2 - с позиции электролитической диссоциации.
C2. Вычислите массу оксида хрома (III) с массовой долей примесей 10%, которая необходима для получения 104 г хрома алюмотермическим способом.
Контрольная работа «Металлы и их соединения» 8 вариант
Электронная формула атома кальция:
1) 1s 2 2s 2 2p 6 3s 2 2) 1s 2 2s 2 2p 6 3s 2 3р 6 4s 2 3) 1s 2 2s 2 2p 6 3s 2 3р 6 4s 1 4) 1s 2 2s 2 2p 6 3s 2 3р 6 4s 2 3d 2
Самый твердый металл – это: 1) хром 2) медь 3) вольфрам 4) железо
Не вытеснит медь из раствора сульфата меди(II): 1) железо 2) цинк 3) магний 4) ртуть
Щелочные металлы натрий и калий хранят под слоем: 1) вазелина 2) воды
3) керосина 4) перекиси водорода
А) Fe 2 O 3 + SO 3 1) Fe SO 4
Б) Fe 2 O 3 + H 2 SO 4 2) Fe(NO 3 ) 3 + H 2 O
В) Fe 2 O 3 + HNO 3 3) Fe 2 (SO 4 ) 3
Г) Fe 2 O 3 + N 2 O 5 4) Fe 2 (SO 4 ) 3 + H 2 O
5) Fe(NO 3 ) 2 + H 2 O
С1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: Mg MgCl 2 Mg(OH) 2 MgCO 3 MgO Mg(NO 3 ) 2 Переход 1 рассмотрите в свете ОВР; переходы 2 и 5 - с позиции электролитической диссоциации.
C2. Какую массу железа получат из 480 г оксида железа (III) при восстановлении его оксидом углерода (II), если массовая доля выхода железа составляет 95% от теоретически возможного?
Проверяемые элементы содержания; умения и навыки
Знать положение металлов в Периодической системе химических элементов Д.И. Менделеева. Уметь составлять электронные формулы атомов металлов.
Знать закономерности изменения свойств элементов в периодах и главных подгруппах ПС. Уметь сравнивать свойства элементов.
Знать физические свойства металлов.
Знать общие химические свойства металлов: реакции с неметаллами, кислотами, солями. Оценивать возможность протекания реакции, используя ряд напряжений металлов.
Знать химические свойства соединений щелочных, щелочно-земельных металлов, алюминия и железа.
Знать способы получения металлов.
Знать свойства металлов и их соединений. Уметь определять продукты реакций.
Знать свойства металлов и их соединений. Определять возможность протекания реакций; уметь составлять уравнения химических реакций в молекулярной и ионной формах; уметь определять значения степеней окисления элементов в соединениях, составлять электронные балансы и расставлять коэффициенты в ОВР
Уметь анализировать условие задачи и решать её по известному алгоритму. Уметь рассчитывать массу и количество чистого вещества, если известна массовая доля примесей. Уметь рассчитывать массовую (или объемную долю) выхода продукта в % от теоретически возможного.
Читайте также:
