Коррозия это разрушение металлов вызываемое химическими или электрическими процессами
Обновлено: 04.10.2024
Коррозионная стойкость металла зависит от его природы, характера среды и температуры.
- Благородные металлы не подвергаются коррозии из-за химической инертности.
- Металлы Al, Ti, Zn, Cr, Ni имеют плотные газонепроницаемые оксидные плёнки, которые препятствуют коррозии.
- Металлы с рыхлой оксидной плёнкой – Fe, Cu и другие – коррозионно неустойчивы. Особенно сильно ржавеет железо.
Различают химическую и электрохимическую коррозию.
| Химическая коррозия сопровождается химическими реакциями. Как правило, химическая коррозия металлов происходит при действии на металл сухих газов, её также называют газовой. |
При химической коррозии также возможны процессы:
Fe + 2HCl → FeCl2 + H2
2Fe + 3Cl2 → 2FeCl3
Как правило, такие процессы протекают в аппаратах химических производств.
| Электрохимическая коррозия – это процесс разрушения металла, который сопровождается электрохимическими процессами. Как правило, электрохимическая коррозия протекает в присутствии воды и кислорода, либо в растворах электролитов. |
В таких растворах на поверхности металла возникают процессы переноса электронов от металла к окислителю, которым является либо кислород, либо кислота, содержащаяся в растворе.
При этом электродами являются сам металл (например, железо) и содержащиеся в нем примеси (обычно менее активные металлы, например, олово).
В таком загрязнённом металле идёт перенос электронов от железа к олову, при этом железо (анод) растворяется, т.е. подвергается коррозии:
Fe –2e = Fe 2+
На поверхности олова (катод) идёт процесс восстановления водорода из воды или растворённого кислорода:
2H + + 2e → H2
O2 + 2H2O + 4e → 4OH –
| Например, при контакте железа с оловом в растворе соляной кислоты происходят процессы: |
Анод: Fe –2e → Fe 2+
Катод: 2H + + 2e → H2
Суммарная реакция: Fe + 2H + → H2 + Fe 2+
Если реакция проходит в атмосферных условиях в воде, в ней участвует кислород и происходят процессы:
Анод: Fe –2e → Fe 2+
Катод: O2 + 2H2O + 4e → 4OH –
Суммарная реакция:
Fe 2+ + 2OH – → Fe(OH)2
4Fe(OH)2 + O2+ 2H2O → 4Fe(OH)3
При этом образуется ржавчина.
Методы защиты от коррозии
Защитные покрытия
Защитные покрытия предотвращают контакт поверхности металла с окислителями.
- Катодное покрытие – покрытие менее активным металлом (защищает металл только неповреждённое покрытие).
- Покрытие краской, лаками, смазками.
- Создание на поверхности некоторых металлов прочной оксидной плёнки химическим путём (анодирование алюминия, кипячение железа в фосфорной кислоте).
Создание сплавов, стойких к коррозии
Физические свойства сплавов могут существенно отличаться от свойств чистых металлов. Добавление некоторых металлов может приводить к повышению коррозионной стойкости сплава. Например, нержавеющая сталь, новые сплавы с большой коррозионной устойчивостью.
Изменение состава среды
Коррозия замедляется при добавлении в среду, окружающую металлическую конструкцию, ингибиторов коррозии. Ингибиторы коррозии — это вещества, подавляющие процессы коррозии.
Электрохимические методы защиты
Протекторная защита: при присоединении к металлической конструкции пластинок из более активного металла – протектора. В результате идёт разрушение протектора, а металлическая конструкция при этом не разрушается.
ОГЭ 2021: ФИПИ Вариант 35
Выполните синтаксический анализ предложений текста.
Прочитайте текст.
(1)Коррозия – это разрушение металлов, вызываемое химическими или электрическими процессами. (2)Чтобы защитить металл от разрушения, рекомендуют использование материалов, не подвергающихся коррозии. (3)Например, добавление к стали титана, хрома, никеля значительно увеличивает её антикоррозийные свойства. (4)А для защиты металлов от атмосферной коррозии часто применяют такой способ изоляции: поверхность металлов покрывают лаками, красками, а иногда и слоем другого металла (олова, цинка, никеля, хрома). (5)Однако такой способ защиты металла оказывается довольно дорогим, потому что покрытие надо периодически обновлять.
Выполните пунктуационный анализ.
Расставьте знаки препинания. Укажите цифры, на месте которых должны стоять запятые.
Село Большое Болдино (1) притягивает к себе всех (2) кто неравнодушен к творчеству великого (3) русского писателя А.С. Пушкина. Каждый уголок этого исторического места способен вдохновить любого человека (4) однако (5) больше всего гости Болдинской усадьбы стремятся в знаменитый парк. К каскаду небольших прудов ведут дорожки (6) по которым когда-то прогуливался сам поэт. А возле барского дома растёт старая лиственница (7) посаженная (8) по преданию (9) Пушкиным.
Выполните синтаксический анализ словосочетания.
Замените словосочетание «стеклянная рамка», построенное на основе согласования, синонимичным словосочетанием со связью управление. Напишите получившееся словосочетание.
- РАСЦАРАПАТЬ – на конце приставки перед буквой, обозначающей глухой согласный звук, пишется буква С.
- РАСКЛЕИВШИЙ – написание гласной в суффиксе причастия определяется принадлежностью к спряжению глагола.
- БЕЗЫНИЦИАТИВНЫЙ – после русской приставки, оканчивающейся на согласный, пишется буква Ы.
- НЕСМЫШЛЁНЫЙ – слово не употребляется без НЕ, поэтому пишется слитно.
- (ошибки) ИСПРАВЛЕНЫ – в краткой форме причастия пишется одна буква Н.
Прочтите текст и выполните задания 6–8.
Текст П.С. Романова
(1)Как-то в начале июня зашёл к Поликарповне человек и попросил сдать комнату на лето. (2)Он, не торгуясь, заплатил тридцать рублей.
(3)Звали его Трифоном Петровичем. (4)Он был какой-то уютный, весёлый и простой человек, и хозяйка с первого же дня привыкла к нему, как к своему.
(5)Один раз, походив около бревенчатого домика, Трифон Петрович сказал, потирая руки:
– (6)Дай-ка я поправлю тебе, бабушка, крыльцо.
– (7)Спасибо, родимый, – сказала Поликарповна, – только чуднό мне что-то: пришёл, снял комнату, даже не поторговался, а теперь ты крыльцом моим занимаешься, будто и не чужие мы люди.
– (8)А что ж, Поликарповна, неужто всё только на деньги считать? (9)Я вот тебе поправлю, а ты потом вспомнишь обо мне добрым словом, вот мы, как говорится, и квиты, – сказал он и засмеялся.
– (10)Теперь, милый, такой народ пошёл, что задаром никто рукой не пошевелит. (11)О душе теперь не думают, только для брюха и живут. (12)Да смотрят, как бы что друг у дружки из рук вырвать, как бы выгоду свою не упустить.
– (13)Ну, нам с тобой делить нечего, – отвечал Трифон Петрович, улыбаясь.
– (14)Прямо с тобой душа отошла, – говорила Поликарповна, – а то уж в людей вера пропадать стала.
– (15)Вера в человека – это самая большая вещь, – отзывался Трифон Петрович. – (16)Когда эта вера пропадёт, тогда жить нельзя.
(17)Один раз вернулся Трифон Петрович из города весёлый и сказал:
– (18)Я там в городе всем порассказал, как тут у вас хорошо: теперь хозяйки не отобьются от постояльцев, у меня рука лёгкая.
(19)Начиная с воскресенья в деревню стали приезжать всё новые и новые дачники. (20)Хозяек охватила лихорадка наживы, и цены поднялись втрое, а так как народ всё ехал, то стали уж хапать без всякой совести.
(21)Как-то зашла к Поликарповне соседка. (22)За разговором невзначай поинтересовалась, за сколько та сдаёт жильё, а услышав ответ, удивлённо раскрыла глаза:
– (23)Да ты, бабка, спятила совсем! (24)У меня есть один, он у тебя с руками за сто оторвёт. (25)Теперь по полтораста берут, по двести!
– (26)Как по двести. – спросила едва слышным голосом Поликарповна. (27)У неё почему-то пропал вдруг голос. – (28)Да ведь раньше все дёшево брали…
– (29)Мало что раньше! (30)Тогда народу совсем не было, а теперь от него отбоя нет. (31)Вот что я тебе скажу: из-за чужого человека ты хорошую цену упускаешь, ежели ты его не выставишь, потом ты горько пожалеешь! (32)Ну что, договариваться с новым постояльцем?
(33)Старушка горестно, озабоченно смотрела в сторону, прищурив глаза, потом изменившимся голосом торопливо проговорила:
(По П.С. Романову)*
* Романов Пантелеймон Сергеевич (1884–1938) – русский писатель.
Прозе Романова свойственны лиризм и юмор, мастерство диалога,
ясный, реалистический язык.
- Трифон Петрович сразу, не торгуясь, заплатил Поликарповне триста рублей.
- Поликарповну, как и других хозяек в деревне, охватила жажда наживы, и она решила взять нового постояльца.
- Вера в человека, без которой нельзя жить, – самая большая ценность на этом свете.
- Трифон Петрович рассказал в городе, как хорошо на даче, и люди стали приезжать и снимать жильё.
- Поликарповна выселила Трифона Петровича, потому что он не помогал ей по хозяйству.
- Как-то в начале июня зашёл к Поликарповне человек и попросил сдать комнату на лето.
- У меня есть один, он у тебя с руками за сто оторвёт.
- Хозяек охватила лихорадка наживы, и цены поднялись втрое, а так как народ всё ехал, то стали уж хапать без всякой совести.
- Он был какой-то уютный, весёлый и простой человек, и хозяйка с первого же дня привыкла к нему, как к своему.
- Я вот тебе поправлю, а ты потом вспомнишь обо мне добрым словом, вот мы, как говорится, и квиты, – сказал он и засмеялся.
Выполните лексический анализ.
Замените разговорное слово «чуднó» из предложения 7 стилистически нейтральным синонимом. Напишите этот синоним.
Коррозия металлов

Всякое явление или процесс вокруг нас связан с химией. Скажем, ржавление железа. Хоть раз в жизни вы наверняка задумывались, почему одни металлы ржавеют и разрушаются, а другие — нет. И что такого особенного в нержавеющей стали, что этот процесс ей нипочем? Обо всем это мы и поговорим в сегодняшней статье.
О чем эта статья:
Коротко о главном
Коррозия металлов или ржавление в химии — это явление, которое возникает из-за взаимодействия металлической пластинки с веществами окружающей среды (кислородом воздуха или кислотами, с которыми может реагировать металлическое изделие).
Обычно окисляются металлы, включая железо, которые находятся левее водорода в ряду напряжений.

Чаще всего встречаются химическая и электрохимическая коррозии. Чтобы понять, чем они отличаются друг от друга, давайте сравним их по нескольким критериям в таблице ниже.
Таблица 1. Сравнение химической и электрохимической коррозии металлов
Признаки сравнения
Химическая коррозия
Электрохимическая коррозия
Разрушение металлов в из-за взаимодействия с газами или растворами, которые не проводят электрический ток
Разрушение металла, при котором возникает электрический ток в воде или среде другого электролита
При контакте железа с цинком коррозии подвергается цинк:
Zn 0 - 2e - = Zn 2+ .
Защитить металл от коррозии можно по-разному: покрытием защитными материалами, электрохимическими методами, шлифованием и т. д. Далее — подробно обо всем этом.
Что такое коррозия
Коррозия — это самопроизвольное разрушение элементов, чаще всего металлов, под действием химического или физико-химического влияния окружающей среды.
Иными словами, из-за химического воздействия железо начинает ржаветь. Это весьма сложный процесс, который состоит из несколько этапов. Но суммарное уравнение коррозии выглядит так:
Часто под коррозией понимают химическую реакцию между материалом и средой либо между их компонентами, которая протекает на границе раздела фаз. Обычно это окисление металла. Например:
Некоторые металлы, даже активные, покрываются плотной оксидной пленкой при коррозии. Это одна из их характерных черт. Оксидная пленка не дает окислителям проникнуть в более глубокий слой и поэтому защищает металл от коррозии. Алюминий обычно устойчив при контакте с воздухом и водой, даже горячей. Тем не менее, если поверхность алюминия покрыть ртутью, то образуется амальгама. Она разрушает оксидную пленку, и алюминий начинает быстро превращаться в белые хлопья метагидроксида алюминия:
Коррозии подвергаются и многие малоактивные металлы. Например, поверхность медного изделия покрывается патиной — зеленоватым налетом. Это происходит потому, что на ней образуются смеси основных солей.
Виды коррозии металлов
Химическая коррозия
Химическая коррозия — это процесс разрушения металла, который связан с реакцией между металлом и коррозионной средой.
Химическая коррозия протекает без воздействия электрического тока, и в результате этой реакции металлы окисляются. Этот вид коррозии можно разделить на два подвида:
газовая коррозия — металл корродирует под воздействием различных газов при высоких температурах;
коррозия в жидкостях — неэлектролитах.
Их них более распространенной считают газовую коррозию. Она протекает во время прямого контакта твердого тела с активным газом воздуха. Чаще всего это кислород. В результате на поверхности тела образуется пленка продуктов химической реакции между веществом и газом. Дальше эта пленка мешает контакту корродирующего материала с газом. При высоких температурах газовая коррозия развивается интенсивно. Возникшая при этом пленка называется окалиной, которая со временем становится толще.
Важную роль в процессе коррозии играет состав газовой среды. Но для каждого металла он индивидуален и изменяется с переменой температур.
Электрохимическая коррозия
Электрохимическая коррозия — это разрушение металла, которое протекает при его взаимодействии с окружающей средой электролита.
Этот вид коррозии считают наиболее распространенным. Самым важным происхождением электрохимической коррозии является то, что металл неустойчив в окружающей среде с точки зрения термодинамики. Вот несколько ярких примеров этой реакции: ржавчина в трубопроводе, на обшивке днища морского судна и на различных металлоконструкциях в атмосфере.
В механизме электрохимической коррозии обычно выделяют два направления: гомогенное и гетерогенное. Разберем их подробнее в таблице ниже.
Гомогенный механизм электрохимической коррозии
Гетерогенный механизм электрохимической коррозии
Поверхность металла рассматривается как однородный слой.
У твердых металлов поверхность неоднородна из-за структуры сплава, в котором атомы по-разному расположены в кристаллической решетке.
Растворение металла происходит из-за термодинамической возможности для катодного или анодного процессов.
Неоднородность можно наблюдать при наличии в сплаве каких-либо включений.
Скорость, с которой протекает электрохимическая коррозия, зависит от времени протекания процесса.
В электрохимической коррозии протекает одновременно два процесса на аноде и на катоде, которые зависят друг от друга. Растворение основного металла происходит только на анодах. Анодный процесс заключается в том, что ионы металла отрываются и переходят в раствор:
В результате происходит реакция окисления металла. В данном случае анод заряжается отрицательно.
При катодном процессе избыточные электроны переходят в молекулы или атомы электролита, которые, в свою очередь, восстанавливаются. На катоде идет реакция восстановления. Он носит заряд положительного электрода.
Торможение одного процесса приводит к торможению и другого процесса. Окисление металла может происходить только в анодном процессе.
Как защитить металлы от коррозии
От коррозии можно и нужно защищаться. Чтобы уберечь металлы от этой реакции, их покрывают защитными материалами, обрабатывают электрохимическими методами, шлифованием и т. д. Рассмотрим все эти способы подробнее.
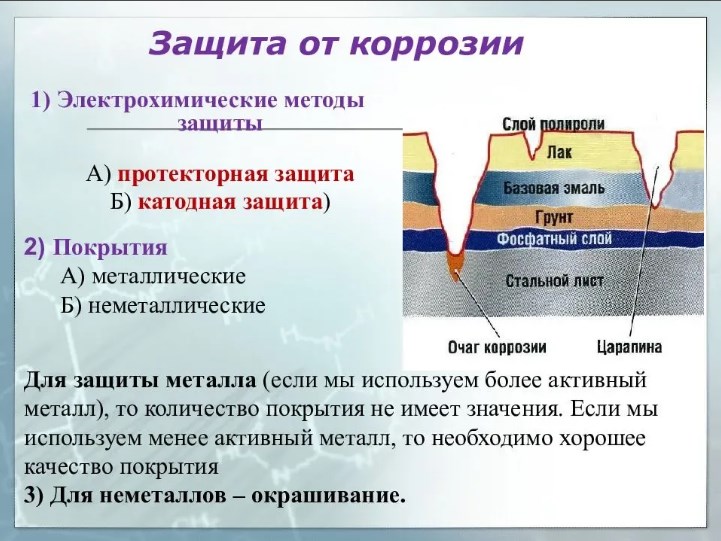
Способ № 1. Защитные покрытия.
Для защиты от коррозии металлические изделия покрывают другим металлом, т. е. производят никелирование, хромирование, цинкование, лужение и т. д. Еще один вариант защиты — покрыть поверхность металла специальными лаками, красками, эмалями.
Способ № 2. Легирование.
Легирование — это введение добавок, которые образуют защитный слой на поверхности металла. Например, при легировании железа хромом и никелем получают нержавеющую сталь.
Способ № 3. Протекторная защита.
Протекторная защита — это способ уберечь металл от коррозии, при котором металлическое изделие соединяют с более активным металлом. Этот второй металл в итоге и разрушается в первую очередь.
Способ № 4. Электрохимическая защита.
Чтобы защитить металлы от электрохимической коррозии, нейтрализуют ток, который возникает при ней. Это делают с помощью постоянного тока, который пропускают в обратном направлении.
Способ № 5. Изменение состава среды путем добавления ингибиторов.
Для защиты от коррозии используют специальные средства, которые ее замедляют — ингибиторы. Они изменяют состояние поверхности металла — образуют труднорастворимые соединения с катионами металла. Защитные слои, образованные ингибиторами, всегда тоньше наносимых покрытий.
Способ № 6. Замена корродирующего металла на другие материалы: керамику и пластмассу.
Способ № 7. Шлифование поверхностей изделия.
Проверьте себя
Что такое коррозия?
Где в повседневной жизни можно встретить ржавление железа и других металлов? Приведите примеры.
Гидроксид железа Fe(OH)3 называют:
Что является причиной возникновения коррозии?
Чем отличаются химический и электрохимический типы коррозии?
Что такое коррозионная среда?
Узнайте все о коррозии металлов и разберитесь в других темах за 9 класс на онлайн-курсах по химии в Skysmart! Наши преподаватели помогут выяснить, где скрываются пробелы в знаниях, и восполнить их. Никаких скучных задач и сухих лекций — только интерактивные упражнения, опыты и теория простым языком. Все это поможет разобраться даже в тех темах, которые не давались в школе. Ждем на бесплатном вводном уроке!
Основы теории коррозии металлов и способы защиты от нее
Коррозия (от позднелатинского corrōsiōn «грызть, жевать») представляет собой постепенно развивающийся процесс поверхностного повреждения металлов, обладающих способностью активно реагировать с кислородом. Один из наглядных примеров этого явления – коррозия металла из-за образования оксида железа Fe2O3 или ржавчины.
- Определение коррозии
- Виды коррозии металлов
- Химическая
- Методы защиты от коррозии
- Металлические покрытия
- Неметаллические покрытия
- Химические покрытия
- Изменение состава технического металла и коррозионной среды
- Электрохимическая защита
Коррозия (от позднелатинского corrōsiōn «грызть, жевать») представляет собой постепенно развивающийся процесс поверхностного повреждения металлов, обладающих способностью активно реагировать с кислородом. Один из наглядных примеров этого явления – коррозия металла из-за образования оксида железа Fe2O3 или ржавчины. Характерно, что два остальных окисла железа – закись FeO и закись-окись Fe3O4 - обладают значительно меньшей корродирующей способностью, причём Fe3O4 при некоторых условиях может даже играть роль твёрдой смазки.
Теория коррозии предполагает, что для начала разрушения металла необходимо наличие четырёх основных компонентов:
Электрического соединения, которое существует между катодом и анодом.
Электролита или любой другой токопроводящей среды, облегчающей направленное перемещение ионов.
Обычное образование ржавчины на стали можно рассматривать как электрическую батарейку. Когда атомы металлов подвергаются воздействию окружающей среды, которая содержит кислород, металл производит электроны. Это действие можно локально ограничить, чтобы создать трещину или микроуглубление. С развитием процесса коррозия распространяется на прилегающую территорию, что приведет к общему ухудшению состояния поверхности. Ограниченная (точечная) коррозия способна вызвать усталость металла – снижение его прочностных характеристик, а имеющиеся коррозионные агенты, например, морская вода, могут привести к прогрессирующему росту трещины.

Теория коррозии утверждает также, что интенсификации поверхностного разрушения металла способствуют микроструктурные изменения, возникающие при повышенных температурах, в частности, при сварке. Это объясняется повышенными значениями энергии активации, из-за чего количество ионов, проводящих электрический ток, лавинообразно возрастает.
Определение коррозии
Коррозия - это постепенное разрушение объектов, обычно металлов, вызванное активной окружающей средой-электролитом и химической реакцией окисления.
Суть коррозионного процесса – наличие постоянно действующей анодной реакции. Она вызывается за счёт растворения металла, который генерирует электроны. Часть энергии активации дополнительно расходуется на другой процесс, называемый катодной реакцией. Эти два процесса уравновешивают произведенные заряды. Зоны, вызывающие эти процессы, могут быть расположены близко или далеко друг от друга, в зависимости от ситуации.
Электроны, генерируемые в процессе, должны потребляться посредством катодной реакции. Ионы водорода и электроны вступают в реакцию с образованием атомарного, а затем и газообразного водорода. Однако водород является сильнейшим восстановителем, поэтому дальнейшую коррозию можно предотвратить, создав на поверхности металла тонкую газовую плёнку. Она служит поляризатором, уменьшающим контакт металла с водой и уменьшающим коррозию. Таким образом, всё, что разрушает барьерную плёнку, увеличивает скорость коррозии.
Основными факторами, определяющими интенсивность процесса, являются:
Уровень возникающих механических и термических напряжений;
Характер протекающих химических реакций.
Коррозия сдерживает внедрение в производство новых металлических материалов и причиняет значительный ущерб экономике.
Классификация всех коррозионных явлений может быть произведена по следующим параметрам:
По степени равномерности. Различают поверхностную коррозию, которая равномерно уменьшает толщину поверхности, и неравномерную коррозию – точечную или язвенную;
По интенсивности воздействия на металл. Например, избирательная коррозия разрушает только определённые структурные составляющие, а контактная воздействует на менее коррозионно стойкие («неблагородные») составляющие пар трения;
При межкристаллитной коррозии разрушение происходит по границам зёрен и распространяется вглубь металла.
Фреттинг-коррозия, когда два контактирующих между собой тела совершают относительно друг друга колебательные движения малой амплитуды (не более 100 мкм).
При одновременном воздействии растягивающих напряжений и агрессивной среды наблюдается коррозионное растрескивание межкристаллитного или транскристаллитного характера, а при наложении знакопеременных напряжений начинается коррозионно-усталостное разрушение. Защита металлов от коррозии, таким образом, предполагает также и одновременное уменьшение износа деталей.

Далее рассматриваются основные явления, которые происходят в повреждающихся зонах при различных видах коррозии.
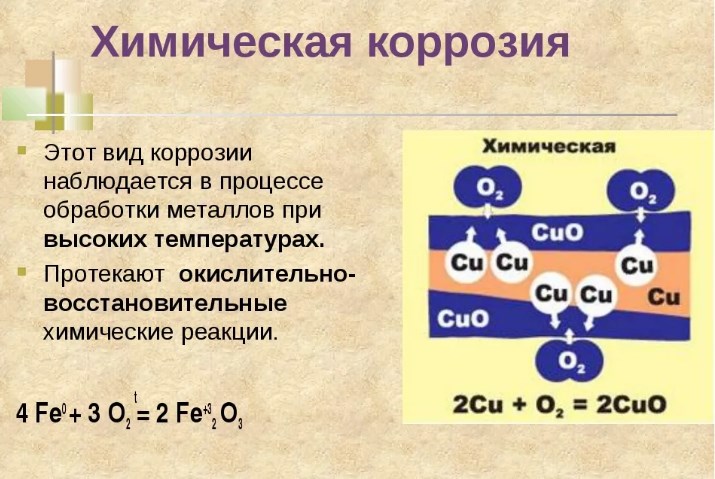
Химическая
Химическая коррозия относится к постепенному разрушению поверхности металла из-за реакции поверхности с веществами во внешней среде. Она происходит в результате окисления металла кислотами с образованием оксидов.
Высокотемпературный вариант заключается в воздействии на металл сухих газов. Все металлы в сухом воздухе покрыты очень тонким (2…10 мкм) слоем оксидов. Этот слой образуется при очень высоких температурах, когда реакция с кислородом воздуха идёт без каких-либо ограничений. При комнатной температуре реакция останавливается, поскольку оксидная плёнка становится слишком тонкой. В случае, например, с алюминием, такая плёнка, состоящая из оксида Al2O3, эффективно защищает поверхность алюминиевой посуды, поскольку коррозионная стойкость чистого алюминия невысока.
Химическая коррозия начинается в месте, где металл находится под давлением и изолирован от циркуляции воздуха. Это побуждает ионы металлов растворяться во влажной среде, что в конечном итоге ускоряет реакцию между ними и водой. В результате реакции образуются водные оксиды (известные при взаимодействии с железом как ржавчина) и свободные ионы.
Электрохимическая
Для моделирования процесса необходимо рассмотреть железную пластину, покрытую любым электропроводящим покрытием, например, оксидной окалиной, которая образовалась во время высокотемпературной обработки. При погружении пластины в раствор хлорида натрия, обнаруживается, что, если повредить целостность окалины, в этом месте ржавление железа пойдёт значительно быстрее. Электрохимическая коррозия наиболее достоверно объясняет ржавление железа в аэробных условиях.
Теория электрохимической коррозии предполагает наличие дополнительных химических реакций:
Fe → Fe ++ + 2e−, - анодная реакция;
2e− + O + H2O → 2OH− - катодная реакция.
Когда ионы металла растворяются, их заряд уравновешивается ионами хлорида, которые мигрируют в область атаки, притягиваясь образующимися ионами положительного заряда. Хлорид железа растворяется в воде, но это не создаёт препятствий для дальнейшей коррозии, поскольку раствор хлорида железа вследствие гидролиза очень кислый. По мере того, как ионы Fe ++ удаляются из этого места, они сталкиваются с гидроксильными ионами, которые либо присутствуют в воде естественным образом, либо образуются в результате катодной реакции. Результатом является образование и осаждение гидроксида железа Fe (OH)2. Далее, в присутствии растворённого кислорода, он быстро окисляется до оксигидроксида железа FeOOH.
Таким образом, при электрохимической коррозии происходят три реакции, причём в трёх разных местах. Анодная происходит в зонах потери металла, катодная – там, где растворённый в воде кислород может принимать электроны, а сама твёрдая окалина формируется в местах механических повреждений на поверхности изделия.
В последнее время выделяют ещё один вид коррозии – механохимическую, которая происходит в результате динамического взаимодействия контактирующих элементов окружающей среды в условиях высоких контактных давлений.
Ржавчина и другие коррозионные проявления могут приводить к проблемам с безопасностью, нарушать целостность производственного оборудования и расходных материалов. Даже плановое техническое обслуживание по удалению и устранению ржавчины увеличивает эксплуатационные затрат. Отработано ряд способов, используя которые, можно минимизировать коррозию.
Металлические покрытия
Эти методы предотвращения коррозии заключаются в погружении стали в расплав металла, электрический потенциал которого меньше, чем железа (чем больше разница, тем эффективнее покрытие).
Практическое применение находят гальванические покрытия цинком или оловом, а также диффузионные покрытия никелем, хромом, кремнием или алюминием. По сравнению с другими методами защиты от коррозии гальванизация известна более низкими начальными затратами, устойчивостью и универсальностью.
Поскольку расход металла-протектора довольно велик, преимущество получают технологии, отличающиеся экономичностью используемых компонентов и прочностью создаваемых покрытий. Первым в этом списке находится цинкование. Железо в стали вступает в реакцию с цинком, образуя прочное покрытие из сплава, которое служит защитой.
Неметаллические покрытия
Один из самых простых способов предотвратить коррозию - использовать защитные покрытия из неметаллов - краски, пластика, воска или порошка. Порошки, включая эпоксидную смолу, нейлон и уретан, наносятся на металлическую поверхность и нагреваются до стадии расплавления, образуя тонкую плёнку.
Краска действует как покрытие, защищающее металлическую поверхность от электрохимического заряда, который исходит от коррозионно опасных соединений. Обычно используют комбинацию различных слоёв краски, которые выполняют разные функции. Грунтовка действует как ингибитор, промежуточный слой увеличивает общую толщину краски, а финишный слой обеспечивает устойчивость к факторам окружающей среды.
Химические покрытия
Относятся к методам временной антикоррозионной защиты стали, например, во время пластического деформирования при повышенных температурах. Наибольшее распространение получили технологии фосфатирования и оксалатирования.
При фосфатировании поверхность покрывают сплошным слоем фосфатных солей железа и марганца, а при оксалатировании – водорастворимыми солями щавелевой кислоты. Фосфатирование используется для обработки нелегированных сталей, оксалатирование – легированных. Покрытие прочно сцепляется с поверхностью, способствуя снижению трения и уменьшению износа инструмента. После окончания штамповки покрытие удаляют.
Изменение состава технического металла и коррозионной среды
Заключается в специальном легировании стали элементами, повышающими её коррозионную стойкость. Если это возможно, то в механическую систему, которая работает в условиях повышенной температуры и влажности, вводят смазку, содержащую противокоррозионные компоненты (восстановители).
Элементом, который положительно влияет на коррозионную стойкость стали, является хром. Для реализации этого эффекта сталь должна содержать не менее 13% хрома. Каждые дополнительные 5% хрома обеспечивают еще лучшую коррозионную стойкость.

Никель - второй важный элемент для улучшения коррозионной стойкости стали, причём добавка никеля приводит также к стабилизации аустенита. Третьим важным элементом повышения коррозионной стойкости является молибден. Однако его добавки повышают коррозионную стойкость только нержавеющих сталей с достаточным содержанием хрома и никеля.
Электрохимическая защита
Процесс коррозии, которая возникает при контакте двух разных металлов, находящихся в электролите, можно остановить использованием системы катодной защиты. Для реализации метода активные центры на поверхности металла необходимо преобразовать в пассивные путем предоставления электронов из другого источника (обычно используют аноды, прикрепленные к поверхности). Металлы, используемые для анодов - алюминий, магний или цинк.
Катодная защита очень эффективна в бытовой технике, однако аноды необходимо часто проверять, что увеличивает расходы на техническое обслуживание.
Коррозия металлов Коррозия металлов, разрушение металлов вследствие химического или электрохимического взаимодействия их с внешней (коррозионной) средой. В результате К. ежегодно теряется от 1 до 1,5% всего металла, накопленного и эксплуатируемого человечеством. В денежном выражении прямые потери от К. (на воспроизводство и замену вышедшего из строя оборудования) составили, по примерной оценке, в США за 1955 около 5,5 млрд. долларов, во Франции за 1959 около 250 млрд. франков. В СССР в конце 60-х гг. они были не ниже 5≈6 млрд. рублей в год. Трудно учесть более высокие косвенные потери от простоев и снижения производительности оборудования, подвергшегося К., от нарушения нормального хода технологических процессов, от аварий, обусловленных снижением прочности металлических конструкций, и т. п. В народном хозяйстве всё шире применяются всевозможные средства и методы борьбы с К. (см. Антикоррозионная защита ) .
═ Причина К.: термодинамическая неустойчивость системы, состоящей из металла и компонентов окружающей (коррозионной) среды. Мерой термодинамической неустойчивости является свободная энергия, освобождаемая при взаимодействии металла с этими компонентами. Но свободная энергия сама по себе ещё не определяет скорость коррозионного процесса, т. е. величину, наиболее важную для оценки коррозионной стойкости металла. В ряде случаев адсорбционные или фазовые слои (плёнки), возникающие на поверхности металла в результате начавшегося коррозионного процесса (см. Пассивирование металлов ) , образуют настолько плотный и непроницаемый барьер, что К. прекращается или очень сильно тормозится. Поэтому в условиях эксплуатации металл, обладающий большим сродством к кислороду, может оказаться не менее, а более стойким (так, свободная энергия образования окисла у Cr или Al выше, чем у Fe, а по стойкости они часто превосходят Fe).
═ Коррозионные процессы классифицируют: а) по виду (геометрическому характеру) коррозионных разрушений на поверхности или в объёме металла, б) по механизму реакций взаимодействия металла со средой (химическая и электрохимическая К.), в) по типу коррозионной среды, г) по характеру дополнительных воздействий, которым подвергается металл одновременно с действием коррозионной среды.
═ Виды коррозионных разрушений. К., захватившая всю поверхность металла, называется сплошной. Её делят на равномерную и неравномерную в зависимости от того, одинакова ли глубина коррозионного разрушения на разных участках. При местной К. поражения локальны и оставляют практически незатронутой значительную (иногда подавляющую) часть поверхности. В зависимости от степени локализации различают коррозионные пятна, язвы и точки (питтинг). Точечные поражения могут дать начало подповерхностной коррозии. распространяющейся в стороны под очень тонким (например, наклёпанным) слоем металла, который затем вздувается пузырями или шелушится. Наиболее опасные виды местной К. ≈ межкристаллитная (интеркристаллитная), которая, не разрушая зёрен металла, продвигается вглубь по их менее стойким границам, и транскристаллитная, рассекающая металл трещиной прямо через зёрна. Почти не оставляя видимых следов на поверхности, эти поражения могут приводить к полной потере прочности и разрушению детали или конструкции. Близка к ним по характеру ножевая К., словно ножом разрезающая металл вдоль сварного шва при эксплуатации некоторых сплавов в особо агрессивных растворах. Иногда специально выделяют поверхностную нитевидную К., развивающуюся, например, под неметаллическими покрытиями, и послойную К., идущую преимущественно в направлении пластической деформации. Специфична избирательная К., при которой в сплаве могут избирательно растворяться даже отдельные компоненты твёрдых растворов (например, обесцинкование латуней).
═ Химическая и электрохимическая К. К. является химической, если после разрыва металлической связи атомы металла непосредственно соединяются химической связью с теми атомами или группами атомов, которые входят в состав окислителей, отнимающих валентные электроны металла. Химическая К. возможна в любой коррозионной среде, однако чаще всего она наблюдается в тех случаях, когда коррозионная среда не является электролитом (газовая К., К. в неэлектропроводных органических жидкостях). Скорость её чаще всего определяется диффузией частиц металла и окислителя через поверхностную плёнку продуктов К. (высокотемпературное окисление большинства металлов газами), иногда ≈ растворением или испарением этой плёнки (высокотемпературное окисление W или Mo), её растрескиванием (окисление Nb при высоких температурах) и изредка ≈ конвективной доставкой окислителя из внешней среды (при очень малых его концентрациях).
═ К. является электрохимической, если при выходе из металлической решётки образующийся катион вступает в связь не с окислителем, а с другими компонентами коррозионной среды; окислителю же передаются электроны, освобождающиеся при образовании катиона. Такой процесс возможен в тех случаях, когда в окружающей среде существуют два типа реагентов, из которых одни (сольватирующие или комплексообразующие) способны соединяться устойчивыми связями с катионом металла без участия его валентных электронов, а другие (окислители) могут присоединять валентные электроны металла, не удерживая около себя катионы. Подобными свойствами обладают растворы или расплавы электролитов, где сольватированные катионы сохраняют значительную подвижность. Т. о., при электрохимической К. удаление атома из металлической решётки (что составляет суть любого коррозионного процесса) осуществляется в результате двух независимых, но сопряжённых, связанных между собой электрическим балансом, электрохимических процессов: анодного ≈ переход сольватируемых катионов металла в раствор, и катодного ≈ связывание окислителем освобождающихся электронов. Отсюда следует, что процесс электрохимической К. можно замедлить не только путём непосредственного торможения анодного процесса, но также воздействуя на скорость катодного. Наиболее распространены два катодных процесса: разряд водородных ионов (2 е + 2H + = H 2 ) и восстановление растворённого кислорода (4 e +O 2 +4H + = 2H 2 O или 4 e +O 2 +2H 2 O = 4ОН - ), которые часто называют соответственно водородной и кислородной деполяризацией.
═ Анодный и катодный процессы с той или иной вероятностью и в той или иной последовательности протекают в любых точках металлической поверхности, где катионы и электроны могут взаимодействовать с компонентами коррозионной среды. Если поверхность однородна, то катодные и анодные процессы равновероятны по всей её площади; в таком идеальном случае К. называют гомогенно-электрохимической (отмечая таким образом отсутствие какой-либо неоднородности в распределении вероятности электрохимических процессов в любой точке поверхности, что, конечно, не исключает термодинамической гетерогенности взаимодействующих фаз). В действительности на металлических поверхностях существуют участки с различными условиями доставки реагирующих компонентов, с разным энергетическим состоянием атомов или с различными примесями. На таких участках возможно более энергичное протекание либо анодного, либо катодного процессов, и К. становится гетерогенно-электрохимической.
═ Проводимость металла очень высока, и при возникновении избыточного заряда электроны практически мгновенно перераспределяются, так что плотность заряда и электрического потенциал металла меняются одновременно по всей его поверхности независимо от того, в каких её точках электроны освободились после ухода катионов, а в каких захватываются окислителем. В частности, это означает, что от мест, где преимущественно осуществляется анодная реакция, электроны перемещаются в металле к местам протекания катодной. Соответственно раствор вблизи анодных участков принимает избыточный положительный заряд растворившихся катионов, а вблизи катодных заряжается отрицательно в результате захвата электронов растворённым окислителем. В растворе эти заряды не перераспределяются так легко, как в металле. Поэтому с повышением скорости процесса потенциал раствора в непосредственной близости от анодных участков становится всё более положительным, что затрудняет дальнейший выход из металла положительно заряженных катионов, а вблизи катодных участков ≈ более отрицательным, что затрудняет катодный процесс. Иначе это можно представить, как вызванное протеканием тока омическое падение напряжения между прианодным и прикатодным слоями раствора, с учётом которого потенциал металла по отношению к прианодному слою оказывается несколько более отрицательным, а по отношению к прикатодному ≈ более положительным, чем по отношению к объёму раствора. В случаях, когда такое омическое падение напряжения велико (очень высокая плотность тока, низкая электрическая проводимость раствора, большое взаимное удаление катодных и анодных участков), коррозионную систему удобнее представить в виде системы короткозамкнутых микро- или макрогальванических элементов. В остальных случаях при определении средней по площади скорости растворения металла современная теория наряду с такой моделью позволяет также представлять электрохимически гетерогенную поверхность как квазигомогенную. Тогда ей приписывают удельные анодные и катодные характеристики, равные интегрально усреднённым по площади значениям одноимённых характеристик моделируемой гетерогенной поверхности, и графически изображают их на коррозионной диаграмме в виде анодных и катодных поляризационных кривых. Эти кривые показывают, как влияет электродный потенциал на усреднённые по площади и выраженные в единицах (или логарифмах) плотности тока скорости выхода катионов и электронов с данной поверхности в данный электролит. Диаграмма может быть очень сложной, т. к. в реальных системах на форму кривых могут влиять многие факторы, в том числе диффузия окислителя или переходящих в раствор катионов, пассивация металла и различные нарушения пассивного состояния (см. Пассивирование металлов ) . На рисунке дана схематическая коррозионная диаграмма для простейшего гипотетического случая, когда ни один из перечисленных факторов не оказывает влияния.
═ Анодный и катодный процессы, как было отмечено выше, связаны электрическим балансом. Электроны, оставляемые уходящими катионами, сообщают металлу отрицательный заряд, который затрудняет выход катионов в раствор, но одновременно ускоряет катодный процесс. Последний, в свою очередь, способствуя уменьшению отрицательного заряда металла, самозатормаживается, но облегчает протекание анодной реакции. Т. о. происходит саморегулирование заряда металлической поверхности, являющееся одним из важных элементов механизма установления стационарного потенциала К. ( j ст ), при котором катодная ( К ) и анодная ( А ) поляризационные кривые пересекаются (точка S ). Хотя скорость электрохимической К. и зависит от потенциала, однако связь эта далеко неоднозначна, что можно видеть на следующем примере. Если при неизменных анодных характеристиках (кривая А ) на поверхности металла появляются дополнительные активные катоды, то вызванное ими облегчение катодного процесса (описываемого теперь кривой К' ) может привести к ускорению растворения металла (до тех пор, пока не будет достигнута плотность тока i* ст ) со сдвигом потенциала в положительном направлении (до j* ст ). Наоборот, при неизменных катодных характеристиках (кривая К ) и появлении дополнительных анодных участков (что соответствует протеканию процесса, описываемого кривой А' ) К. ускоряется (до i** ст ) со сдвигом потенциала в отрицательную сторону (до j** ст ). Однако при пропорциональном облегчении обоих процессов (кривые A' и К' ) значительное ускорение К. (до i*** ст ) возможно без изменения потенциала. Более сложные случаи наблюдаются при пассивации, а также нарушениях пассивного состояния.
═ К. в различных средах, влияние дополнительных факторов (воздействий). Некоторые коррозионные среды и вызываемые ими разрушения столь характерны, что по названию этих сред классифицируются и протекающие в них коррозионные процессы. Так, выделяют газовую К., т. е. химическую К. под действием горячих газов (при температуре много выше точки росы). Характерны некоторые случаи электрохимической К. (преимущественно с катодным восстановлением кислорода) в природных средах: атмосферная ≈ в чистом или загрязнённом воздухе при влажности, достаточной для образования на поверхности металла плёнки электролита (особенно в присутствии агрессивных газов, например СО 2 , Cl 2 , или аэрозолей кислот, солей и т. п.); морская ≈ под действием морской воды и подземная ≈ в грунтах и почвах.
═ К. под напряжением развивается в зоне действия растягивающих или изгибающих механических нагрузок, а также остаточных деформаций или термических напряжений и, как правило, ведёт к транскристаллитному коррозионному растрескиванию, которому подвержены, например, стальные тросы и пружины в атмосферных условиях, углеродистые и нержавеющие стали в паросиловых установках, высокопрочные титановые сплавы в морской воде и т. д. При знакопеременных нагрузках может проявляться коррозионная усталость , выражающаяся в более или менее резком понижении предела усталости металла в присутствии коррозионной среды. Коррозионная эрозия (или К. при трении) представляет собой ускоренный износ металла при одновременном воздействии взаимно усиливающих друг друга коррозионных и абразивных факторов (трение скольжения, поток абразивных частиц и т. п.). Родственная ей кавитационная К. возникает при кавитационных режимах обтекания металла агрессивной средой, когда непрерывное возникновение и «захлопывание» мелких вакуумных пузырьков создаёт поток разрушающих микрогидравлических ударов, воздействующих на поверхность металла. Близкой разновидностью можно считать и фреттинг-К., наблюдаемую в местах контакта плотно сжатых или катящихся одна по другой деталей, если в результате вибраций между их поверхностями возникают микроскопические смещения сдвига.
═ Утечка электрического тока через границу металла с агрессивной средой вызывает в зависимости от характера и направления утечки дополнительные анодные и катодные реакции, могущие прямо или косвенно вести к ускоренному местному или общему разрушению металла (К. блуждающим током). Сходные разрушения, локализуемые вблизи контакта, может вызвать соприкосновение в электролите двух разнородных металлов, образующих замкнутый гальванический элемент, ≈ контактная К. В узких зазорах между деталями, а также под отставшим покрытием или наростом, куда проникает электролит, но затруднён доступ кислорода, необходимого для пассивации металла, может развиваться щелевая К., при которой растворение металла в основном происходит в щели, а катодные реакции частично или полностью протекают рядом с ней на открытой поверхности.
═ Принято выделять также биологическую К., идущую под влиянием продуктов жизнедеятельности бактерий и др. организмов, и радиационную К. ≈ при воздействии радиоактивного излучения.
═ Количественная оценка К. Скорость общей К. оценивают по убыли металла с единицы площади ( К ) , например в г/м 2 × ч, или по скорости проникновения К., т. е. по одностороннему уменьшению толщины нетронутого металла ( П ), например в мм/год. При равномерной К. П = 8,75 К/r , где r ≈ плотность металла в г/см 3 . При неравномерной и местной К. оценивается максимальное проникновение. По ГОСТу 13819≈68 установлена 10-балльная шкала общей коррозионной стойкости (см. табл.). В особых случаях К. может оцениваться и по др. показателям (потеря механической прочности и пластичности, рост электрического сопротивления, уменьшение отражательной способности и т. д.), которые выбираются в соответствии с видом К. и назначением изделия или конструкции.
═ 10-балльная шкала для оценки общей коррозионной стойкости металлов
Читайте также:
